-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Stanovenie flavonoidov v prírodnom materiáli metódou HPLC
Determination of flavonoids in natural materials with HPLC
The paper reviews recent developments in the determination of flavonoids with HPLC. Flavonoids are a group of polyphenolic compounds commonly found in plants. Sample preparation is a very important step in the analytical procedure. The basic concept of a sample preparation method is to convert a real matrix into a sample in a format that is suitable for analysis by separation or analytical technique. In the present paper, attention was focused on the applications of molecularly imprinted polymers, especially on their utilization as selective sorbents in solid-phase extraction in the determination of flavonoids.
Key words:
flavonoids • hydrolysis • high performance liquid chromatography • molecularly imprinted polymers
Autoři: Jarmila Krňanová; Jozef Lehotay; Jozef Čižmárik
Vyšlo v časopise: Čes. slov. Farm., 2015; 64, 119-125
Kategorie: Přehledy a odborná sdělení
Souhrn
Práca sumarizuje doterajší vývoj pri stanovení flavonoidov metódou HPLC. Flavonoidy sú skupinou polyfenolických zlúčenín bežne sa vyskytujúcich v rastlinách. Úprava vzorky je dôležitým krokom v ich analytickej chémii. Cieľom úpravy vzorky je previesť matricu do takej formy, ktorá je vhodná na samotnú analýzu, či už ide o chromatografiu, alebo inú analytickú metódu. Práca sa zaoberá aj polymérmi s odtlačkami molekúl, najmä ich využitie ako sorbentov pri extrakcii na tuhej fáze pri stanovení flavonoidov.
Kľúčové slová:
flavonoidy • hydrolýza • vysokoúčinná kvapalinova chromatografia • polyméry s molekulovými odtlačkamiÚvod
V ostatnom čase sa vo väčšej miere venuje pozornosť názoru, že zvýšená konzumácia zeleniny a ovocia môže znižovať riziko vzniku niektorých foriem rakoviny alebo kardiovaskulárnych ochorení. Predpokladá sa, že je to vďaka vysokému obsahu antioxidantov, ktoré majú schopnosť eliminovať pôsobenie reaktívnych foriem kyslíka a ďalších radikálov vznikajúcich v tkanivách. Medzi účinné prírodné antioxidanty, ktoré sú súčasťou našej potravy, patrí β-karotén, vitamín C, vitamín E a veľká skupina látok označovaných súhrne ako polyfenoly. Výrazné miesto medzi týmito látkami zastávajú aj flavonoidy. Flavonoidy sú skupinou polyfenolických zlúčenín bežne sa vyskytujúcich v rastlinách, kde sú často zodpovedné za ich základné fyziologické funkcie ako napr. farba, opelenie, ochrana pred UV žiarením, ochrana pred patogénmi a predátormi. Hlavným zdrojom flavonoidov pre ľudský organizmus je potrava rastlinného pôvodu. Flavonoidy sa nachádzajú v zelenine, ovocí, orechoch, semenách, korení, kvetoch a sú bežné konzumované ako súčasť ľudskej diéty. Odhady denného príjmu flavonoidov potravou sú rôzne a pohybujú sa od 50 mg až do 1 g, pričom kvercetín a kemferol patria medzi dva najviac sa vyskytujúce flavonoidy.
Antioxidanty
Antioxidant je látka, ktorá chráni naše telo pred procesom zvaným oxidácia. Kyslík je pre telo veľmi dôležitý, je to však silne nestály a reaktívny prvok. Reaguje s tukmi napríklad v masle, oxiduje ich a vyvoláva ich žltnutie. Podobný proces sa odohráva v tele. Ako starneme, objavuje sa viac kyslíku a naše telo určitým spôsobom oxiduje (lipoperoxidácia a pod.). Látky, ktoré bránia oxidačnému procesu alebo ho spomaľujú sa nazývajú antioxidanty. Rôzne antioxidanty nás chránia pred rôznym typom voľných radikálov, v rôznych častiach buniek a v rôznych častiach tela. Antioxidanty si navzájom pomáhajú – antioxidačný synergizmus – súčet je väčší ako jeho časti1).
Antioxidanty sa dajú rozdeliť na dve skupiny:
- prírodné: v prírode alebo v danej potravine sa prirodzene vyskytujú
- syntetické: vytvorené bez patričného relevantného výskytu v prírode
Niektoré zdroje antioxidantov v potravinách rastlinného pôvodu sú uvedené v tabuľke 12).
Tab. 1. Príklady antioxidantov nachádzajúcich sa v potravinách rastlinného pôvodu 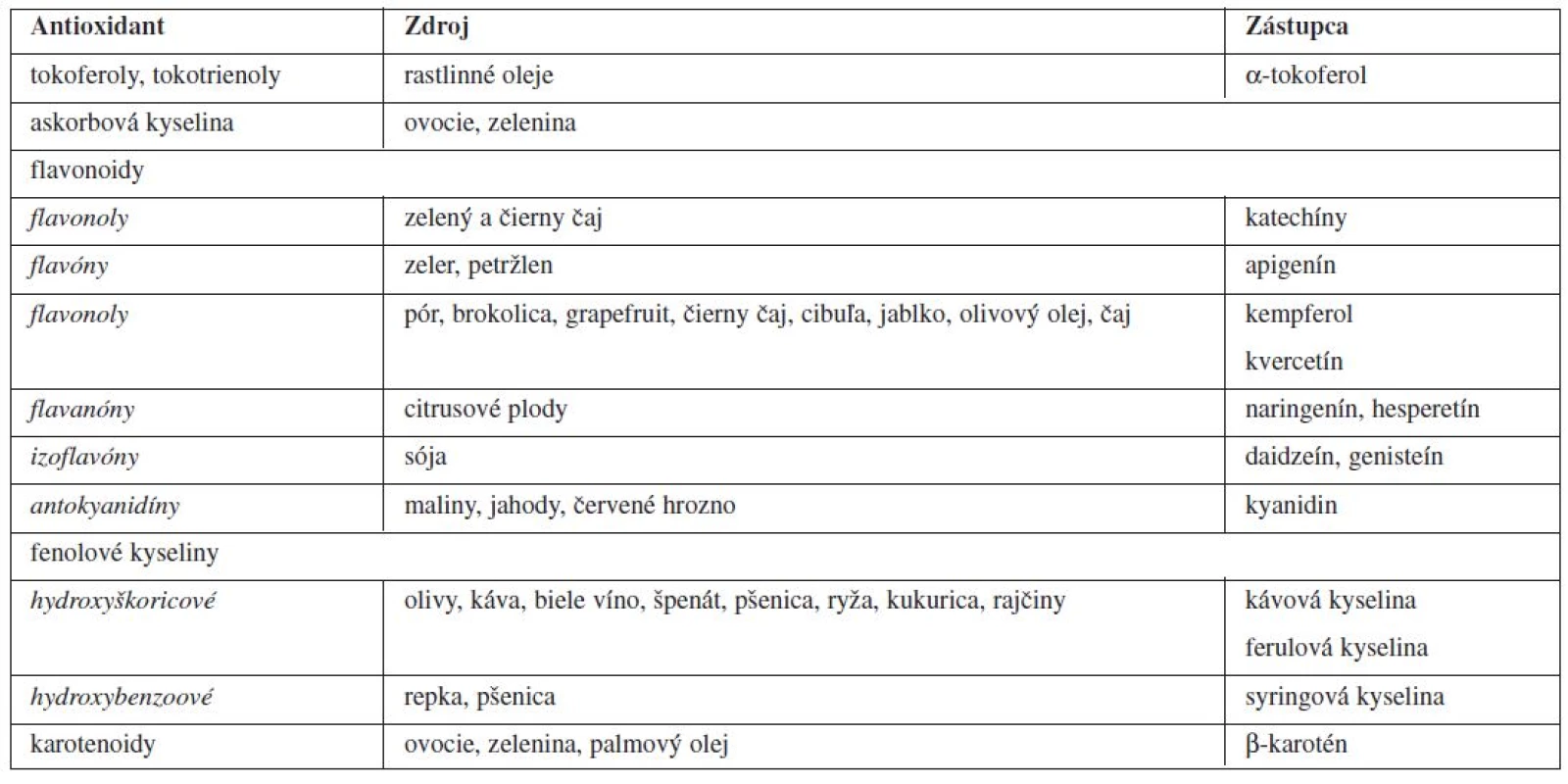
Flavonoidy
Základná štruktúra flavonoidov je znázornená vo vzorci na obrázku 13, 4).
Obr. 1. Chemická štruktúra flavonoidov 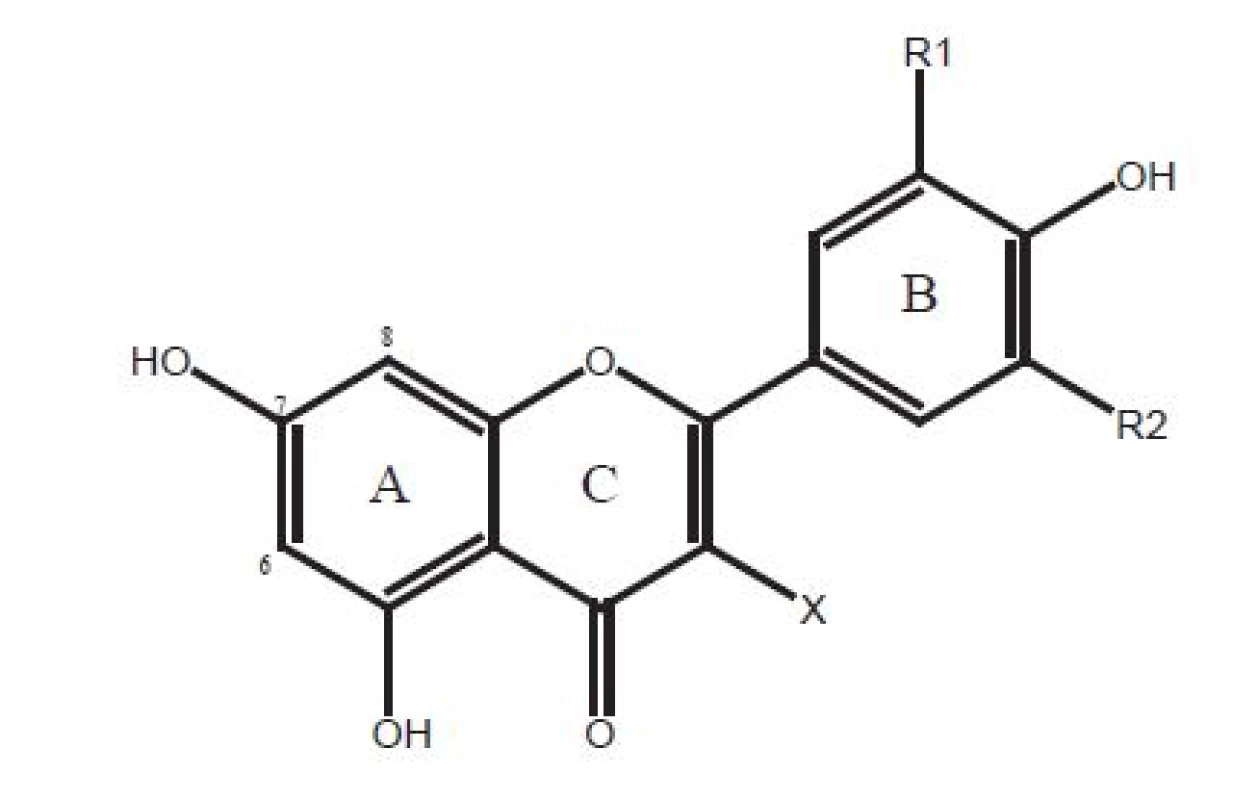
X = O-gly, R1 = OH, R2 = OH alebo –OCH3 Odhadovaný príjem flavonoidov vo výžive človeka je v rozmedzí niekoľkých desiatok až stovky gramov za deň, v závislosti od výživových zvyklostí. Bolo napríklad dokázané, že japonská populácia má vyšší príjem flavonoidov, čo je pripísané konzumácii zeleného čaju. Medzi hlavné skupiny flavonoidov vo výžive človeka patria flavanoly, flavanóny, flavóny, flavonoly, proantokyanidíny, kyanidíny a izoflavonoidy.
Významný obsah polyfenolických látok bol preukázaný aj v olivovom oleji. Sú to napríklad hydroxytyrazol, oleuropein a jeho aglykón a niektoré fenolové kyseliny (kávová, vanilová, syringová, protokatechová). Ich obsah sa uvádza až 1 g/kg oleja, závisí však na odrode, podmienkach pestovania a spôsobe spracovania. Prítomnosť týchto látok je pripisovaná nízka frekvencia výskytu kardiovaskulárnych ochorení a niektorých druhov rakoviny u obyvateľov v oblasti Stredomoria3–7).
Veľká časť flavonoidov je glykozylovaná. Naviazaný cukor býva napríklad glukóza, ramnóza, menej často galaktóza, arabinóza, xylóza, glukurónová kyselina a ďalšie cukry. Zvyčajne je naviazaná jedna cukorná jednotka, ale môžu byť aj dve, tri či viac. Cukry môžu byť ďalej substituované napr. malonylovou skupinou8).
Niektoré flavonoidy boli skúmané z hľadiska ochrany zdravia človeka. Živočíchy flavonoidy netvoria, môžu ich však prijať v rastlinnej strave. Pôsobením črevných baktérií sú flavonoidy uvoľnené zo štruktúr rozmanitých glykozidov, ktorých sú súčasťou v rastlinnom organizme, a spolu s ostatnými zložkami potravy sú vstrebané a prevažne vo forme konjugátov sú potom vylúčené močom. Zhruba jedna desatina je vylúčená ako čisté (nekonjugované) flavonoidy. Flavonoidy majú veľa chemických vlastností, vďaka nim môžu na rôznych úrovniach zasahovať do dejov v organizme konzumenta6).
Analytické stanovenie flavonoidov
Polyfenolové látky majú významné prospešné vlastnosti pre zdravie. Vďaka ich biologickým a farmakologickým účinkom ako napríklad protizápalový, antioxidačný, antimutagénny, protirakovinový a pod. sú predmetom záujmu. Priaznivý vplyv rastlinných polyfenolov na ľudské zdravie podnietil záujem o štúdium biologickej dostupnosti týchto látok9).
Metódy stanovenia polyfenolových látok sa dajú rozdeliť na nešpecifické, ako sú spektrofotometrické metódy, ktoré zisťujú prítomnosť celej skupiny látok, a metódy založené na separácii jednotlivých zlúčenín, ako sú chromatografické metódy.
HPLC (High-Performance Liquid Chromatography) je metódou a technikou pre separáciu látok, ktorá bola navrhnutá pre kvalitatívnu i kvantitatívnu analýzu flavonoidov v ovocí, nápojoch, brusnicový džús, mede, propolise a hlavne v rôznom rastlinnom materiáli (napr. extrakty chmeľu, cibule, špenátu, grécke aromatické rastliny a iné) s použitím rôznych detekcií10–15)..
Na analýzu fenolových zlúčenín sa využíva izokratická aj gradientová elúcia. Výber vhodnej metódy závisí od počtu a typu analytov a pôvodu použitej matrice. Acetonitril a metanol sú najbežnejšími používanými organickými rozpúšťadlami. Voľba kolón v kvapalinovej chromatografii závisí od použitej techniky úpravy vzoriek, pretože surové rastlinné extrakty by mohli znížiť životnosť týchto kolón alebo ich úplne poškodiť16).
Absorpčné maximá jednoduchých polyfenolov sa pohybujú v rozmedzí 220–320 nm, avšak ich absorpcia je značne ovplyvnená povahou rozpúšťadla a jeho pH16).
Flavonoidy majú charakteristické fyzikálne a chemické vlastnosti. Patrí sem aj absorpcia ultrafialového žiarenia (UV), čo robí ich UV spektrum veľmi charakteristické. Pre svoju aromatickosť sú polyfenolové zlúčeniny vo všeobecnosti detegované použitím UV/VIS detekciou, PDA (photodiode array) a UV-fluorescenčných detektorov17).
Iné metódy využívané na detekciu takýchto látok zahrňujú elektrochemické coulometrické stanovenia, MS – hmotnostnú spektrometriu a NMR detekciu. Kombinácia HPLC techniky a voltampérometrie sa úspešne využíva na detekciu, identifikáciu a kvantifikáciu flavonoidov a fenolových kyselín vo víne18–23).
Extrakcia a hydrolýza flavonoidov
Existuje mnoho typov matríc obsahujúcich flavonoidy a ďalšie fenolové látky ako napríklad rastliny, z kvapalných vzoriek biologické tekutiny a nápoje. Pevné vzorky je potrebné najskôr zhomogenizovať. Homogenizáciou je možné perforovať plazmatické membrány buniek za účelom uvoľnenia bunkového obsahu do prostredia. K tomu sa používajú rôzne metódy, najčastejšie rozbitie buniek ultrazvukom, použitie mierneho detergentu na perforáciu plazmatickej membrány, alebo rozbitie buniek dobre tesniacim rotačným piestom v hrubostennej nádobe. Nasleduje izolácia analytu pomocou extrakcie vhodným rozpúšťadlom, prípadne prečistenie a zakoncentrovanie vzorky extrakciou tuhou fázou (SPE). Kvapalné vzorky sa zvyčajne najskôr filtrujú, prípadné ďalšie nečistoty sa oddelia na vysokofrekvenčnej centrifúge24).
Na extrakciu sa vyberá rozpúšťadlo podľa typu flavonoidu. Dôležité je zobrať do úvahy aj polaritu. Menej polárne flavonoidy (napr. izoflavóny, flavanóny, metylované flavóny a flavonoly) sú extrahované s chloroformom, dichlórmetánom, dietyléterom alebo etylacetátom, zatiaľ čo glykozidy flavonoidov a viac polárne aglykóny sú extrahované s alkoholmi alebo zmesami alkohol – voda. Glykozidy sú viac rozpustné vo vode a preto sú vhodné vodné roztoky alkoholov. Sušený rastlinný materiál môže byť tiež extrahovaný v Soxhletovom prístroji, najskôr s hexánom, napr. odstrániť tuky a potom s etylacetátom alebo etanolom. Tento spôsob nie je vhodný pre zložky citlivé na teplo. Prvý krok, napríklad s dichlórmetánom vyextrahuje aglykóny flavonoidov a menej polárny materiál. Ďalší krok s alkoholom vyextrahuje glykozidy flavonoidov a polárne zložky. Rozpustnosť flavanónov závisí od pH roztokov obsahujúcich vodu. Flavan-3-oly (katechíny, proantokyanidíny a taníny) môžu byť často extrahované priamo vodou. Zloženie extraktu závisí od použitého rozpúšťadla – voda, metanol, etanol, acetón alebo etylacetát. Napríklad metanol je najlepšie rozpúšťadlo pre katechíny a 70% acetón pre prokyanidíny. Antokyaníny sú extrahované so studeným okysleným metanolom. Bežne používanou kyselinou je kyselina octová (asi 7%) alebo trifluóroctová kyselina (TFA, asi 3%). Použitie minerálnej kyseliny môže viesť k strate pripojených acylových skupín. Extrakcia sa väčšinou vykonáva vytrepávaním alebo inými metódami, ktoré zvýšia účinnosť a rýchlosť extrakcie17).
Flavonoidy a veľká skupina rastlinných polyfenolov sú v rastlinných tkanivách prítomné v relatívnych vysokých koncentráciách, tiež ako konjugáty cukrov alebo aglykóny. Stanovenie glykozidov flavonoidov v rastlinnom materiáli je náročné kvôli ich veľkému počtu, a pretože komerčne dostupných je iba niekoľko glykozidov flavonoidov, kvantitatívna analýza je často nepraktická. Na odstránenie cukornej zložky z glykozidov flavonoidov sa používa kyslá, zásaditá a enzýmová hydrolýza a výsledné aglykóny sú identifikované a kvantifikované10, 12–14, 17, 25, 26).
V roku 1992 Hertog et al. optimalizovali podmienky kyslej hydrolýzy na uvoľnenie piatich majoritných aglykónov flavonoidov, vyskytujúcich sa v ovocí a zelenine – kvercetínu, kempferolu, myricetínu, luteolínu a apigenínu z rodičovských glykozidov. Systematicky sledovali vplyv koncentrácie kyselín, reakčný čas a koncentráciu metanolu na glukozidy flavonolov a glykozidy flavónov27).
Podmienky hydrolýzy, ktorých výsledkom je rozpad glykozidov, môžu byť príliš kyslé pre ostatné fenolové zložky nachádzajúce sa v danom rastlinnom materiáli. Preto sa študovala efektivita rozdielnych podmienok hydrolýzy a rozdielne antioxidanty na čistých glykozidoch a aglykónoch flavonoidov. Na základe výsledkov so štandardmi sa navrhli vhodné podmienky hydrolýzy. Bolo dôležité určiť aj vhodné podmienky hydrolýzy pre analýzu flavonoidov a fenolových zložiek osobitne pre každý rastlinný materiál. V prípade, kedy sa vyžadovala veľmi vysoká presnosť, sa museli použiť rozdielne podmienky hydrolýzy pre rôzne zložky toho istého rastlinného materiálu. Zvyčajne kyslá hydrolýza glykozidov flavonoidov vyžaduje relatívne vysoké koncentrácie (1–2 mol/l) minerálnych kyselín pod refluxom12, 28, 29).
V tabuľke 2 sú uvedené príklady extrakcie a hydrolýzy flavonoidov.
Tab. 2. Podmienky extrakcie a hydrolýzy flavonoidov v prírodných matriciach 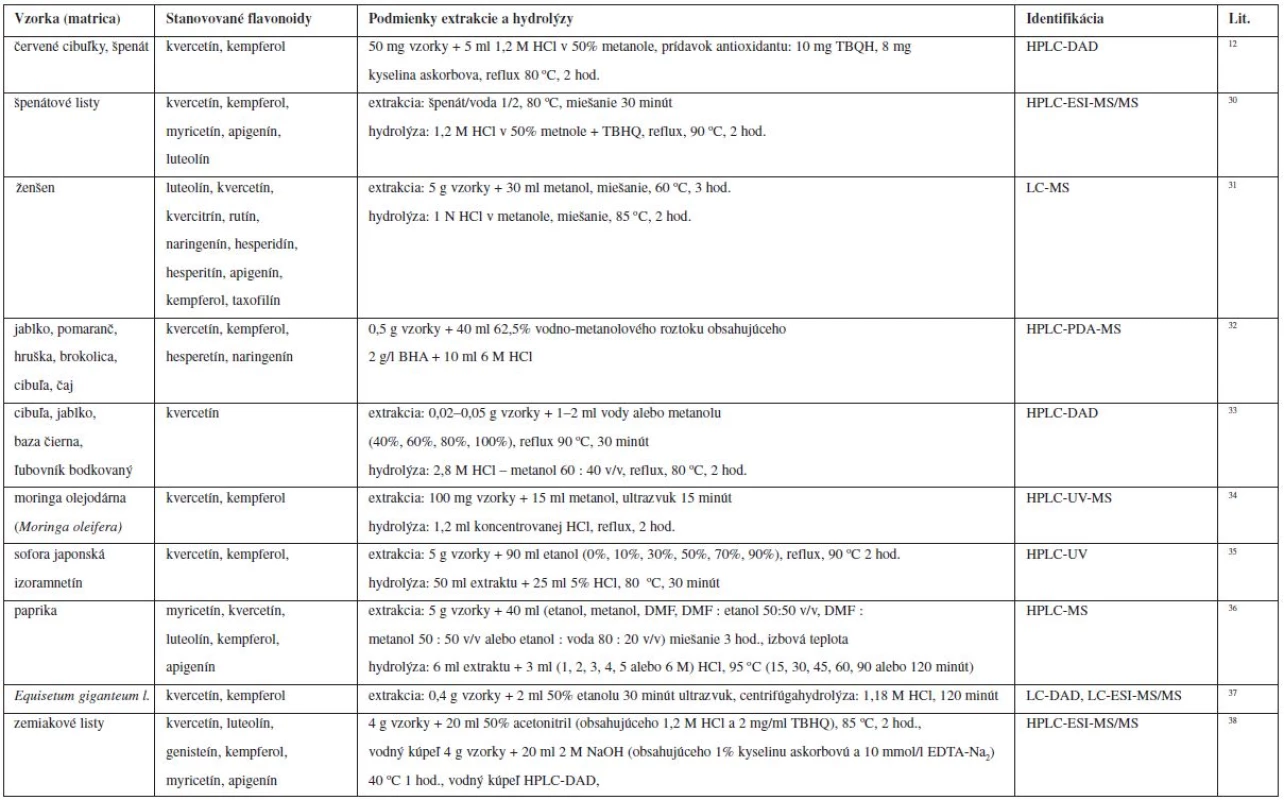
HCl – kyselina chrolovodíková, TBQH – terc-butylhydrochinón, BHA – butylhydroxianizol, DMF – dimetylformamid, EDTA-Na2 – disodná sol etylén diamín tetra-octovej kyseliny Polyméry s odtlačkami molekúl
MIP (molecularly imprinted polymer) – polyméry s odtlačkami molekúl sú syntetické materiály s umelo vytvorenými interakčnými miestami schopnými prednostne viazať sledovaný analyt (templát) v prítomnosti iných štruktúrne podobných zlúčenín. Získavajú sa polymerizáciou funkčného a zosieťovacieho monoméru okolo molekuly templátu, to vedie ku vzniku vysoko zosieťovanej trojrozmernej siete polyméru. Monoméry sa volia s ohľadom na ich schopnosť interagovať s funkčnými skupinami molekuly templátu. Po procese polymerizácie sa templát odstráni z polyméru a vo vzniknutom polymére zostávajú kavity, ktoré sú veľkosťou, tvarom a voľnými funkčnými skupinami komplementárne molekule templátu39, 40).
Polyméry s odtlačkami molekúl môžu byť pripravované tromi rôznymi spôsobmi kovalentným, nekovalentným a semi-kovalentným spôsobom41, 42).
Polymerizačná zmes zvyčajne obsahuje porogén, templát, funkčný monomér, zosieťovacie činidlo a iniciátor. Molekula templátu musí obsahovať funkčné skupiny, ktoré budú dostatočne interagovať s funkčnými molekulami monoméru a vytvoria stabilný komplex. Kyselina metakrylová a TFMAA (trifluórmetakrylová kyselina) sú bežne používané ako monoméry pre templáty obsahujúce základné skupiny. Pre analyty s kyslými funkčnými skupinami sú vhodné monoméry s bázickými vlastnosťami, ktoré sa dajú využiť k príprave stacionárnych fáz v HPLC, ako sú napr. 2-VP (2-vinylpyridín), 4-VP (4-vinylpyridín) alebo akrylamid42, 43).
Imprintované polyméry,ktoré sa dajú využiť pre prípravu stacionarných fáz v HPLC, v porovnaní s biomolekulami (receptory, enzýmy) majú niekoľko výhod, ale tiež majú aj niekoľko vlastností, ktoré by bolo potrebné zlepšiť alebo úplne odstrániť41, 44 ).
Zloženie niektorých imprintovaných polymérov je uvedené v tabuľke 3.
Tab. 3. Zloženie imprintovaných polymérov flavonidov 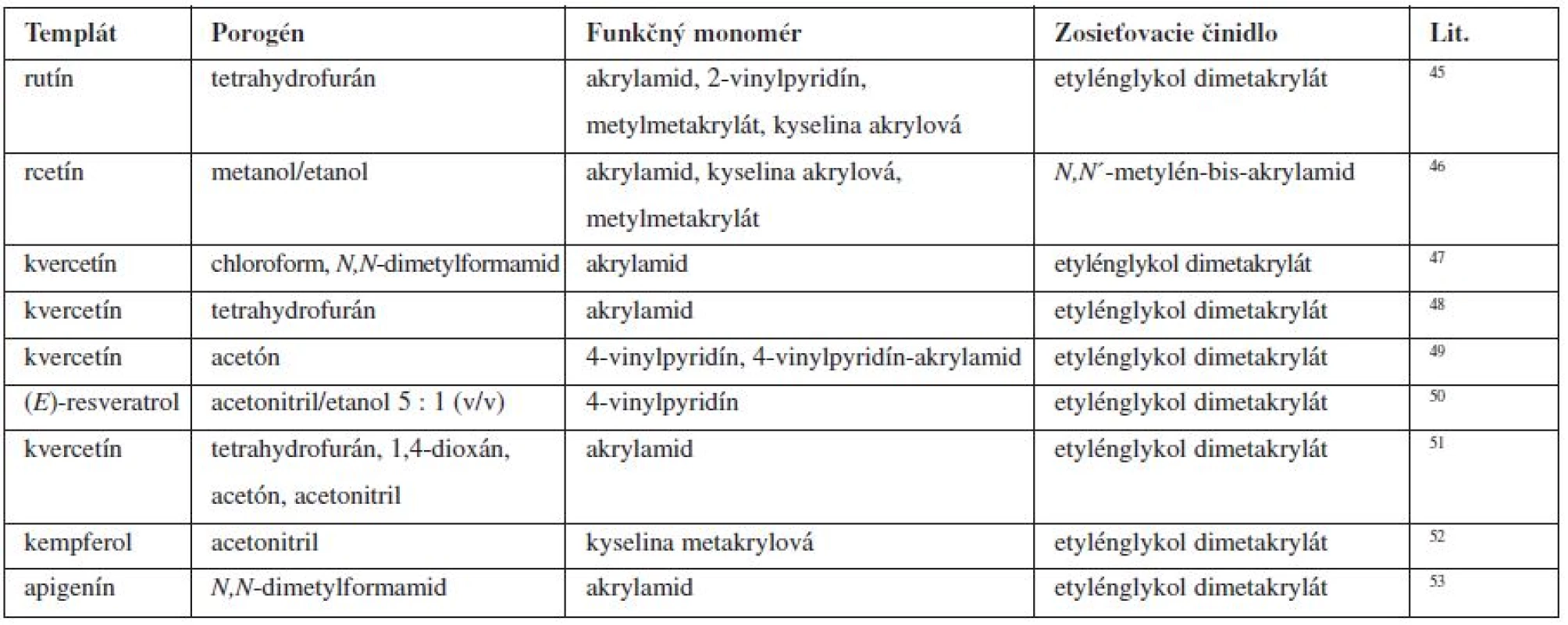
Záver
Flavonoidy sú prírodné látky vyskytujúce sa v ľudskej potrave. Nakoľko sa preukázala ich antioxidačná aktivita, majú veľký význam pre ľudský organizmus. Vďaka zlepšujúcej sa prístrojovej technike je možné získať stále presnejšie výsledky analýz z rôznych vzoriek a medze detekcie klesajú až po femtogramy. Avšak ak sa použije nevhodná metóda úpravy vzorky, aj dobrý analytický postup môže viesť k chybným výsledkom.
Cieľom úpravy vzorky je previesť matricu do takej formy, ktorá je vhodná na samotnú analýzu (chromatografia alebo iná analytická metóda). Úprava vzorky je dôležitým krokom v analytickej chémii. Je potrebná kvôli extrakcii, izolácii a skoncentrovaniu sledovaných analytov z matríc a odstráneniu látok, ktoré by mohli komplikovať analýzu alebo poškodiť analytický systém. Pri analytických metódach je dôležitá selektivita k analytom. Polyméry s odtlačkami molekúl sa prejavujú vysokou selektivitou. Pripravujú sa priamo na daný typ analytu. Využívajú sa v rôznych analytických metódach.
Stret záujmov: žiadny.
Došlo 20. októbra 2014
Prijaté 25. júna 2015
J. Krňanová • prof. Ing. J. Lehotay, DrSc.
Univerzita sv. Cyrila a Metoda
Fakulta prírodných vied
nám. J. Herdu 2, 917 01 Trnava, SR
e-mail: jozef.lehotay@ucm.sk
J. Čižmárik
Farmaceutická fakulta UK
Odbojárov 10, 832 32 Bratislava, SR
Zdroje
1. Ďuračková Z. Voľné radikály a antioxidanty v medicíne (I), (Definícia, rozdelenie a biologický význam voľných radikálov a antioxidantov). Bratislava: Slovak Academic Press 1988.
2. Harborne J. B. The Flavonoids. London: Chapman and Hall 1994.
3. Kühnau J. The Flavonoids. A class of semi-essential food components: Their role in human nutrition. World Rev Nutr Diet. 1976; 24, 117–120.
4. Mojžiš J., Mojžišová G. Flavonoidy a ich biologické účinky. Košice: Vienala 2001.
5. Bielicka-Daszkiewicz K., Voelkel A. Theoretical and experimental methods of determination of the breakthrough volume of SPE sorbents. Talanta 2009; 80, 614–621.
6. Stevenson D. Molecular imprinted polymers for solid-phase extraction. Trends Anal. Chem. 1999; 18, 154–158.
7. Winkel-Schirley B. Flavonoid biosynthesis. A colorful model for genetics, biochemistry, cell biology, and biotechnology. Plant Physiology 2001; 26, 485–493.
8. Ďuračková Z., Bergendi Ľ., Čársky J. Voľné radikály a antoixidanty v medicíne, (II).( Význam voľných radikálov v etiológii niektorých ochorení). Bratislava: Slovak Academic Press 1999.
9. Häkkinen S. Flavonols and Phenolic Acids in Berries and Berry Products. Kuopio: University of Kuopio 2000.
10. Crozier A., Jensen E., Lean M. E. J., Mcdonald M. S. Quantitative analysis of flavonoids by reversed-phase high performance liquid chromatography. J. Chromatogr. A 1997; 761, 315–321.
11. Segawa S., Yasui K., Takata Y., Kurihara T., Kaneda H., Watari J. Flavonoid Glycosides Extracted from Hop (Humulus lupulus L.) as Inhibitors of Chemical Mediator Release from Human Basophilic KU812 Cells. Biosci. Biotechnol. Biochem. 2006; 70, 2990–2997.
12. Nuutila A.M., Kammiovirta K., Oksman-Caldentey K. M. Comparison of methods for the hydrolysis of flavonoids and phenolic acids from onion and spinach for HPLC analysis. Food Chem. 2002; 76, 519–526.
13. Hao CH., Yuegang Z., Yiwei D. Separation and determination of flavonoids and other phenolic compounds in cranberry juice by high-performance liquid chromatography. J. Chromatogr. A 2001; 913, 387–395.
14. Proestos C., Boziaris I. S., Nychas G. J. E., Komaitis M. Analysis of flavonoids and phenolic acids in Greek aromatic plants: investigation of their antioxidant capacity and antimicrobial activity. Food Chem. 2006; 95, 664–671.
15. Biesaga M., Pyrzynska K. Liquid Chromatography/Tandem Mass Spectrometry Studies of the Phenolic Compounds in Honey. J. Chromatogr. A 2009; 1216, 6620–6626.
16. Stalikas C. D. Extraction, separation, and detection methods for phenolic acids and flavonoids. J. Sep. Sci. 2007; 30, 3268–3295.
17. Andersen Ø. M., Markham, K. R. Flavonoids: chemistry, biochemistry and applications. New York: CRC Press 2006.
18. Nardini M., Ghiselli A. Determination of free and bound phenolic acids in beer. Food Chem. 2004; 84, 137–143.
19. Liu J. J., Li S. P., Wang Y. T. Optimization for quantitative determination of four flavonoids in epimedium by capillary zone electrophoresis coupled with diode array detection using central composite design. J. Chromatogr. A 2006; 1103, 344–349.
20. Careri M., Elviri L., Mangia A., Musci M. Spectrophotometric and coulometric detection in the high-performance liquid chromatography of flavonoids and optimization of sample treatment for the determination of quercetin in orange juice. J. Chromatogr. A 2000; 881, 449–460.
21. De Rijke E., Out P., Niessen W. M. A., Ariese F., Gooijer C., Brinkman U. A. Th. Analytical separation and detection methods for flavonoids. J. Chromatogr. A 2006; 1112, 31–63.
22. Magalhães P. J., Guido, L. F., Cruz, J. M., Barros A. A. Analysis of xanthohumol and isoxanthohumol in different hop products by liquid chromatography-diode array detection-electrospray ionization tandem mass spectrometry. J. Chromatogr. A 2007; 1150, 295–301.
23. Aguilar-Sánchez R., Áhuatl-García F., Dávila-Jiménez M. M., Elizalde-González M. P., Guevara-Villa M. R. G. Chromatographic and electrochemical determination of quercetin and kaempferol in phytopharmaceuticals. J. Pharm. Biomed. Anal. 2005; 38, 239–249.
24. Careri M., Mangia A., Musci M. Overview of the applications of liquid chromatography - mass spectrometry interfacing systems in food analysis: naturally occurring substances in food. J. Chromatogr. A 1998; 794, 263–297.
25. Abad-Garcia B., Berrueta L. A., Lopéz Márquez D. M., Crespo-Ferrer I., Gallo B., Vicente F. Optimization and validation of a methodology based on solvent extraction and liquid chromatography for the simultaneous determination of several polyphenolic families in fruit juices. J. Chromatogr. A 2007; 1154, 87–96.
26. Olszewska M. Separation of quercetin, sexangularetin, kaempferol and isorhamnetin for simultaneous HPLC determination of flavonoid aglycones in inforescences, leaves and fruits of three Sorbus species. J. Pharm. Biomed. Anal. 2008; 48, 629–635.
27. Hertog M. G. L., Hollman P. C. H., Venema D. P. Optimization of a quantitative HPLC determination of potentially anticarcinogenic flavonoids in vegetables and fruits. J. Agric. Food. Chem. 1992; 40, 1591–1598.
28. Mcdonald M. S., Hughes M., Burns J., Lean M. E. J., Matthews D., Crozier A. Survey of free and conjugated myricetin and quercetin content of red wines of different geographical origin. J. Agric. Food. Chem. 1998; 46, 368–375.
29. Komes D., Belśćak-Cvitanović A., Horžić D., Rusak G., Likić S., Berendika M. Phenolic composition and antioxidant properties of some traditionally used medical plants affected by the extraction time and hydrolysis. Phytochem. Anal. 2010; 22, 172–180.
30. Denhkharghanian M., Adenier H., Vijayalakschmi M. A. Study of flavonoids in aqueous spinach exctract using positive electrospray ionisation tanden quadrupole mass spectrometry. Food Chem. 2010; 121, 863–870.
31. Kao T. H., Huang S. C., Inbaraj S., Chen B. H. Determination of flavonoids and saponins in Gynostemma pentaphyluum (Thunb.) Makino by liquid chromatography – mass spectrometry. Anal. Chim. Acta. 2008; 626, 200–211.
32. Justesen U., Knuthsen P., Leth T. Quantitative analysis of flavonols, flavones, and flavanones in fruits, vegetables and beverages by high-performance liquid chromatography with photo-diode array and mass spectrometric detection. J. Chromatogr. A 1998; 799, 101–110.
33. Wach A., Pyrzyńska K., Biesaga M. Quercetin content in some food and herbal samples. Food Chem. 2007; 100, 699–704.
34. Coppin J. P., Xu Y., Chen H., Pan M-H., Ho CH-T., Juliani R., Simon J., Wu Q. Determination of flavonoids by LC/MS and anti-inflammatory activity in Moringa oleifera. J. Functional Foods 2013; 5, 1892–1899.
35. Xu Q., Schen Y., Wang H., Zhang N., Xu S., Zhang L. Application of response surface methology to optimise extraction of flavonoids from fructus sophorae. Food Chem. 2013; 138, 2122–2129.
36. Bae H., Jayaprakasha G. H., Jifon J., Patil B. S. Extraction efficiency and validation of an HPLC method for flavonoids analyis in peppers. Food Chem. 2012; 130, 751–758.
37. Francescato L. N., Debendetti L. S., Schwanz T. G., Bassani V. L., Henriques A. T. Identification of phenolic compounds in Equisetum giganteum by LC-ESI-MS/MS and new appproach to total flavonid quantification. Talanta 2013; 105, 192–203.
38. Luo Ch., Wang X., Gao G., Eang L., Li Y., Sun Ch. Identification and quantification of free, conjugate and total phenolic compounds in leaves of 20 sweet potato cultivars by HPLC-DAD and HPLC-ESI-MS/MS. Food. Chem. 2013; 141, 2697–2706.
39. Tamayo F. G., Turiel E., Martín-Esteban A. Molecularly imprinted polymers for solid–phase extraction and spolid – phase microextraction: Recent developments and future trends. J. Chromatogr. A 2007; 1152, 32–40.
40. He Ch., Long Y., Pan J., Li K., Liu F. Application of molecularly imprinted polymers to solid–phase extraction of analytes from real samples. J. Biochem. Bioph. Methods. 2007; 70, 133–150.
41. Denderz N., Lehotay J., Čižmárik J. Molecularly imprinted polymers. Čes. slov. Farm. 2012; 61, 79–86.
42. Lachová M., Lehotay J., Skačáni I., Čižmárik J. Application of molecularly imprinted polymers in analytical and pharmaceutical chemistry. Čes. slov. Farm. 2007; 56, 159–164.
43. Karim K., Breton F., Rouillon R., Piletska E. V., Guerreiro A., Chinanela I., Piletsky S. A. How to fine effective functional monomers for effective molecularly imprinted polymers? Adv. Drug Delivery Rev. 2005; 57, 1795–1808.
44. Mahony J. O., Nolan K., Smyth M. R., Mizaikoff B. Moleculary imprinted polymers – potential and challenges in analytical chemistry. Anal. Chim. Acta 2005; 534, 31–39.
45. Zeng H., Wang Y., Liu X., Kong J., Nie Ch. Preparation of molecular imprinted polymers using bi-functional monomer and bi-crossingr fo solid-phase extraction of rutin. Talanta 2012; 93, 172–181.
46. Chen Z., Wang M., Fu Y., Yu H., Di D. Preparation of quercetin molecularly imprinted polymers. Des. Monomers Polym. 2012; 15, 93–111.
47. Yu L., Yun Y. Zhang W., Wang L. Preparation, recognition characteristics and properties for quercetin molecularly imprinted polymers. Desalin. Water Treat. 2011; 34, 309–314.
48. Xie J., Zhu L., Luo H., Zhou L., Li Ch., Xu X. Direct extraction of specific pharmacophoric flavonoids from gingko leaves using a molecularly imprinted polymer for quercetin. J. Chromatogr. A 2001; 934, 1–11.
49. Mahony J. O., Molinelli A., Nolan K., Smyth M.R., Mizaikoff B. Anatomy of a successful imprint: Analysing the recognition mechanisms of a molecularly imprited polymer for quercetin. Biosens. Bioelectron. 2006; 21, 1383–1392.
50. Schwarz L. J., Danylic B., Harris S. J., Boysen R. I., Hearn M. T. W. Preparation of molecularly imprited polymers for the selective recognition of the bioactive polyphenol, (E)-resveratrol. J. Chromatogr. A 2011; 1218, 2189–2195.
51. Song X., Li J., Wang J., Chen L. Quercetin molecularly imprinted polymers: Preparation, recognition characteristics and properties as sorbent for solid-phase extraction. Talanta 2009; 80, 694–702.
52. Zhang Z., Yun Y., Li Ch. Preparation and adsorption performance of molecularly imprinted polymers for kaempferol. Desalin. Water Treat. 2013; 51, 3914–3919.
53. Li L., Chen X. Preparation and spectral characterization of apigenin moleculrly imprinted polymer. Acta Pharm. Sinica 2009; 44, 868–872.
Štítky
Farmacie Farmakologie
Článek vyšel v časopiseČeská a slovenská farmacie
Nejčtenější tento týden
2015 Číslo 4- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
- Přerušovaný půst může mít významná zdravotní rizika
-
Všechny články tohoto čísla
- Stanovenie flavonoidov v prírodnom materiáli metódou HPLC
-
Účinnost fytoterapie v podpůrné léčbě diabetes mellitus typu 2
III. Momordika (Momordica charantia) - Legislativní aspekty vývoje zdravotních prostředků
- Influence of Ganoderma lucidum (Curt.: Fr.) P. Karst. on T-cell-mediated immunity in normal and immunosuppressed mice line CBA/Ca
-
Štúdium lokálnych anestetík: Časť 206*
Micelizácie vybraných kvartérnych amóniových solí odvodených od heptakaínu - Preskripce humánních léčivých přípravků na veterinárních lékařských předpisech
- Úvod do všeobecnej a klinicky aplikovanej biochémie.
- Praktická apiterapia.
- Česká a slovenská farmacie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Preskripce humánních léčivých přípravků na veterinárních lékařských předpisech
- Stanovenie flavonoidov v prírodnom materiáli metódou HPLC
-
Účinnost fytoterapie v podpůrné léčbě diabetes mellitus typu 2
III. Momordika (Momordica charantia) - Legislativní aspekty vývoje zdravotních prostředků
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



