-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaSeparácia enantiomérov aminokyselín metódou vysokoúčinnej kvapalinovej chromatografie
Separation of amino acid enantiomers by high performance liquid chromatography
Enantiomeric forms of the target analytes can be separated using chiral stationary phases based on cyclodextrins, macrocyclic polyethers and antibiotics, and derivatized polysaccharides and cyclofructans. The polar-organic, reverse-phase and normal-phase separation system of the mobile phase can be used for chromatographic separation of racemic mixtures of amino acids, depending on the type of the chiral stationary phase. In addition to the direct method of separation, the possibility of derivatization with a chiral derivatization agent is used. The conventional detection techniques, circular dichroism and laser polarimetry detection can be used to detect amino acids after HPLC separation.
Keywords:
amino acids, enantiomers, chiral separations, high performance liquid chromatography
Autoři: Jakub Moravčík; Katarína Hroboňová
Působiště autorů: Slovenská technická univerzita v Bratislave
Vyšlo v časopise: Čes. slov. Farm., 2014; 63, 4-12
Kategorie: Přehledy a odborná sdělení
Souhrn
Témou práce je separácia enantiomérov aminokyselín metódou vysokoúčinnej kvapalinovej chromatografie. Enantiomérne formy cieľovej skupiny analytov je možné separovať použitím chirálnych stacionárnych fáz na základe cyklodextrínov, makrocyklických polyéterov a antibiotík, polysacharidov a derivatizovaných cyklofruktánov. Pre chromatografickú separáciu racemických zmesí aminokyselín, v závislosti od typu chirálnej stacionárnej fázy, možno využiť polárno-organický, reverzno-fázový aj konvenčný separačný systém. Popri priamom spôsobe separácie sa využíva aj možnosť derivatizácie chirálnym derivatizačným činidlom. V prípade HPLC analýzy sa využívajú bežné detekčné techniky, ako aj detekcia na základe cirkulárneho dichroizmu a laserovej polarimetrie.
Kľúčové slová:
aminokyseliny, enantioméry, chirálne separácie, vysokoúčinná kvapalinová chromatografiaÚvod
Chiralitu možno považovať za základnú vlastnosť živej hmoty, a preto stereoselektívne pôsobenie opticky aktívnych zlúčenín je súčasťou intenzívnych vedeckých výskumov už viac ako polstoročie. Najväčší význam odlišného správania sa enantiomérov sa pozoruje u farmaceutík. V posledných rokoch je ďalšou oblasťou, v ktorej sa chiralita dostáva do veľkej pozornosti priemysel agrochemikálií. Napriek tomu, že zámena chirálnych zložiek potravín nemá také negatívne následky ako v prípade liečiv, v mnohých aplikáciách sa využíva stanovenie enantiomérneho zastúpenia jednotlivých komponentov prítomných v rôznych výrobkoch určených na konzumáciu.
Chromatografické metódy slúžia nielen na separáciu enantiomérov, a teda na kontrolu procesu ich výroby, ale využívajú sa aj pri štúdiu interakcie optických izomérov s inými chirálnymi alebo nechirálnymi molekulami. Okrem toho sa aplikujú aj pri kvalitatívnej a kvantitatívnej analýze opticky aktívnych látok v rozmanitých matriciach.
Predkladaná práca sa zaoberá možnosťami separácie enantiomérov aminokyselín. V súvislosti s optickou aktivitou proteínogénnych aminokyselín je v práci spracovaný aktuálny prehľad poznatkov z oblasti ich chirálnych separácií metódou vysokoúčinnej kvapalinovej chromatografie. Pozornosť je venovaná aj cyklofruktánom, ktoré predstavujú potenciálne chirálne selektory pri enantioseparáciách látok obsahujúcich -NH2 skupinu.
Aminokyseliny
Aminokyseliny predstavujú jednu z najdôležitejších skupín biologicky aktívnych látok. Tieto zlúčeniny sú základnými stavebnými zložkami peptidov a proteínov. V živých organizmoch sa uplatňujú pri biosyntéze rôznych neproteínových látok obsahujúcich dusík, prípadne vznikajú v reakciách bazálneho metabolizmu. V prírode môžu byť prítomné aj vo voľnej forme. Zastúpenie aminokyselín v jednotlivých živých jedincoch závisí od konkrétneho rastlinného alebo živočíšneho druhu.
Z chemického hľadiska sú aminokyseliny organické zlúčeniny, ktorých štruktúra sa vyznačuje prítomnosťou aspoň jednej primárnej aminoskupiny (-NH2) a súčasne jednej karboxylovej skupiny (-COOH). V tomto prípade hovoríme o neutrálnych aminokyselinách. Niektoré aminokyseliny môžu obsahovať jednu -NH2 skupinu a dve -COOH skupiny (kyslé aminokyseliny) a niektoré naopak dve -NH2 skupiny a jednu -COOH skupinu (zásadité aminokyseliny). Ak sú -NH2 skupina a -COOH skupina viazané na tom istom atóme uhlíka, ide o tzv. αα-aminokyseliny. Spomedzi všetkých typov aminokyselín sú práve tieto aminokyseliny najvýznamnejšie, pretože tvoria základ proteínov1).
Biologický význam aminokyselín
Mnohé z proteínogénnych aminokyselín sú syntetizované v telách rastlín, živočíchov alebo človeka. Ako príklad možno uviesť kyselinu glutámovú, ktorá vzniká reakciou kyseliny 2-oxoglutárovej (jeden z produktov Krebsovho cyklu) s amónnymi katiónmi. Kyselina glutámová následne slúži ako prekurzor iných aminokyselín, napr. glutamínu alebo prolínu. Tento typ aminokyselín označujeme pojmom neesenciálne aminokyseliny. Organizmus ich dokáže produkovať, ak má k dispozícii adekvátne množstvo dusíka. Neesenciálnymi aminokyselinami okrem kyseliny glutámovej, glutamínu a prolínu sú alanín, kyselina asparágová a asparagín, cysteín, glycín, selenocysteín, serín a tyrozín.
Niektoré aminokyseliny však živé organizmy nedokážu syntetizovať, a preto ich musia prijímať v potrave. Tieto aminokyseliny nazývame esenciálnymi aminokyselinami. Pre ich štruktúru je charakteristická prítomnosť rozvetveného reťazca, aromatického alebo heterocyklického substituenta. Obsah esenciálnych aminokyselín predstavuje dôležitý faktor, ktorý určuje biologickú hodnotu bielkovín.
D-aminokyseliny môžu byť vhodnými ukazovateľmi podmienok spracovania, prípadne skladovanie biologických vzoriek. Aminokyseliny prítomné v peptidoch a bielkovinách vplyvom pH, teploty a koncentrácie môžu racemizovať, pričom rýchlostné konštanty racemizácie sa výrazne líšia1).
Separácia enantiomérov aminokyselín
Základné princípy a význam chirálnych separácií aminokyselín
Enantioméry aminokyselín a iných organických zlúčenín chirálneho charakteru vykazujú v biologických systémoch odlišnú fyziologickú aktivitu. Z tohto dôvodu sa v súčasnosti intenzívne študuje problematika chirálnych separácií nielen aminokyselín, ale aj ostatných opticky aktívnych zlúčenín. Enantioseparácie sa realizujú popri kapilárnej elektroforéze a enzymatických metódach prevažne chromatografickými metódami (HPLC, TLC, GC). Inštrumentálne analytické metódy sa používajú na kontrolu priebehu asymetrickej syntézy, na určenie enantiomérneho prebytku, pri príprave analógov aminokyselín a ďalších látok, ktoré je potrebné syntetizovať iba v jednej enantiomérnej forme2).
Chirálne separácie aminokyselín majú nenahraditeľné postavenie v oblasti farmaceutickej chémie už viac ako 20 rokov. Chromatografickú separáciu ich optických izomérov možno uskutočniť priamym a nepriamym spôsobom. Nepriama separácia vyžaduje chemickú derivatizáciu enantiomérov, na ktorú slúžia chirálne derivatizačné činidlá. Výsledkom tohto procesu je vznik stabilných diastereoizomérov, ktoré možno deliť na základe ich rozdielnych fyzikálnych vlastností v nechirálnom separačnom systéme (nechirálna stacionárna fáza a nechirálna mobilná fáza). Priame techniky chirálnej chromatografie sú charakteristické tým, že deleniu optických izomérov nepredchádza proces derivatizácie. Používa sa chirálna stacionárna fáza (CSF), ktorú tvorí chirálny selektor viazaný na nosiči. Druhou možnosťou je prídavok chirálneho selektora do pôvodne nechirálnej mobilnej fázy za vzniku chirálnej mobilnej fázy (CMF)2, 3).
Nepriamy spôsob separácie enantiomérov aminokyselín sa využíva len ojedinele. Dôvodom je predĺženie času analýzy a tiež riziko racemizácie v priebehu derivatizačného procesu.
Priama technika enantioseparácií aminokyselín bola pôvodne vyvinutá pre plynovú chromatografiu. Boli ňou separované optické izoméry skupiny esterov N-trifluoroacetyl-D,L-aminokyselín na kolóne s CSF na báze laurylesteru N-trifluoroacetyl-L-izoleucínu. Predpokladá sa, že k chirálnemu rozlíšeniu dochádza v dôsledku vzniku vodíkovej väzby medzi atómami dusíka -NH2 skupín a atómami kyslíka -CHO skupín. Postupne sa začali vyrábať rozličné chirálne selektory na báze derivátov aminokyselín a neskôr aj amidové a diamidové CSF. Ich nevýhodou bola nižšia teplotná stabilita, ktorá spôsobovala obmedzený rozsah pracovnej teploty chromatografickej kolóny (asi do 80 °C)4).
V kvapalinovej chromatografii boli enantioméry aminokyselín prvýkrát separované v roku 1971 metódou výmeny ligandov (Ligand Exchange Chromatography, LEC), ktorá je založená na princípe ligandovej výmeny. Pri tomto spôsobe enantioseparácií sa tvorili koordinačné komplexy, ktoré pozostávali z centrálneho iónu prechodného kovu a minimálne z dvoch chirálnych bifunkčných ligandov (chirálny selektor a separovaný enantiomér). K separácii optických izomérov dochádzalo, ak boli konštanty stability komplexov dostatočne odlišné. Ďalšou nevyhnutnou podmienkou boli aspoň dve funkčné skupiny v molekulách enantiomérov, ktoré môžu poskytovať centrálnemu kovu elektrónový pár. Prvá chromatografická kolóna použitá na chirálne separácie metódou LEC bola pripravená chemickým naviazaním L-prolínu na polystyrén-divinylbenzénový nosič. Síran meďnatý sa použil ako aditívum do mobilnej fázy. Neskôr sa ako nosič začal využívať silikagél, čím sa výrazne zvýšila účinnosť kolóny5).
Z veľkého počtu elektroforetických metód možno pri enantioseparáciách aminokyselín pripísať nesmierny význam kapilárnej elektroforéze s ligandovou výmenou (Ligand Exchange Capillary Electrophoresis, LECE). Táto technika je v porovnaní s ostatnými separačnými metódami charakteristická krátkymi časmi analýzy. Výhodou sú aj nízke hodnoty koncentrácie chirálneho selektora (rádovo 10-4 mol.l-1). LECE metóda nevyužíva stacionárnu fázu, a teda separácia enantiomérnych foriem je proces prebiehajúci výhradne v roztoku. Podstatou separačného deja je vznik ternárnych diastereoizomérnych komplexov medzi komplexom kov-chirálny ligand a separovanými optickými izomérmi. Ako chirálne ligandy sa často využívajú aj aminokyseliny, napr. L-prolín. Nevyhnutným predpokladom pri elektroforetických chirálnych separáciách je prítomnosť vhodných funkčných skupín v štruktúre enantiomérov pri tvorbe ternárnych komplexov. Kapilárna elektroforéza založená na tomto princípe je vhodnou experimentálnou technikou pri štúdiu interakcií a mechanizmov enantioseparácií6).
Ďalšiu možnosť pri separáciách optických izomérov mnohých látok predstavujú enantioselektívne polymérne membrány, ktorých základ tvorí neselektívny porézny nosič pokrytý tenkou vrstvou polyméru schopného rozlišovať enantiomérne formy. Pri tomto spôsobe enantioseparácií sa musí zabezpečiť dostatočná plocha špecifického povrchu polyméru, minimálny odpor proti prestupu molekúl analytu a tiež dobrá mechanická odolnosť membrány. Mechanizmus separácie v tomto prípade zahŕňa enantiošpecifické interakcie medzi jednotlivými enantiomérmi a vrstvou polymérnej matrice. V súčasnosti používané chirálne membrány sú najčastejšie na báze derivátov polyacetylénu, polyakrylu a polymérov syntetizovaných z α-aminokyselín alebo zo sacharidov. Veľký záujem o tento typ stacionárnych fáz súvisí najmä so separáciou racemických zmesí aminokyselín7).
Enantioselektívne membrány pre chirálne separácie môžu byť založené aj na polyméroch s odtlačkami molekúl (Molecularly Imprinted Polymers, MIP). Postup ich prípravy je rovnaký ako v prípade MIP sorbentov slúžiacich na selektívnu sorpciu analytov zo vzoriek so zložitou matricou pri HPLC analýzach. V prvom kroku dochádza ku vzniku komplexu medzi cieľovým analytom a vhodným funkčným monomérom. V priebehu polymerizácie v prítomnosti sieťovacieho činidla sa geometrické usporiadanie vytvoreného komplexu „odtlačí“ do matrice polyméru. Následne sa analyt z polyméru vyextrahuje a vzniknutý sorbent obsahuje kavity, ktorých tvar a funkčné skupiny sú komplementárne k analyzovanej látke. Mechanizmus chirálnych separácií realizovaných MIP membránami zahŕňa transport molekúl enantioméru cez mikropóry prítomné v štruktúre polyméru a tiež ich selektívny transport cez kavity špecifické pre daný analyt7).
Nepriame separácie enantiomérov aminokyselín metódou HPLC
Neustály vývoj nových typov chirálnych stacionárnych fáz zapríčinil, že nepriame techniky enantioseparácie sa už neuplatňujú v takej miere ako v počiatočnom období. V mnohých aplikáciách sa však tento spôsob separácie optických izomérov ešte stále využíva. Jedným z dôvodov je široká ponuka komerčne dostupných chirálnych derivatizačných činidiel. Okrem toho derivatizácia väčšinou pozostáva z chemických reakcií, ktoré sa vyznačujú relatívne jednoduchým priebehom8).
Aminokyseliny, biogénne amíny a rozsiahla skupina terapeutík majú vo svojej štruktúre minimálne jednu -NH2 skupinu, ktorú možno substituovať prostredníctvom rozličných derivatizačných reakcií. Vzniknuté deriváty týchto látok sú najčastejšie na báze amidov, karbamátov, karbamidov a tiokarbamidov. Amidy a karbamáty sa zvyčajne pripravujú reakciou zlúčenín obsahujúcich -NH2 skupinu s derivatizačnými činidlami typu acylchloridov a chloroformátov. Iné reagenty vhodné na syntézu amidov sú napríklad N-sukcinimidyl ester alebo reagenty typu aktivovaných esterov. Reakciou aminokyselín s izokyanátmi vznikajú stabilné karbamidy a tiokarbamidy. Prehľad niektorých chirálnych derivatizačných činidiel používaných pri separácii optických izomérov aminokyselín je uvedený v tabuľke 19).
Tab. 1. Chirálne derivatizačné činidlá používané pri nepriamych HPLC enantioseparáciách aminokyselín 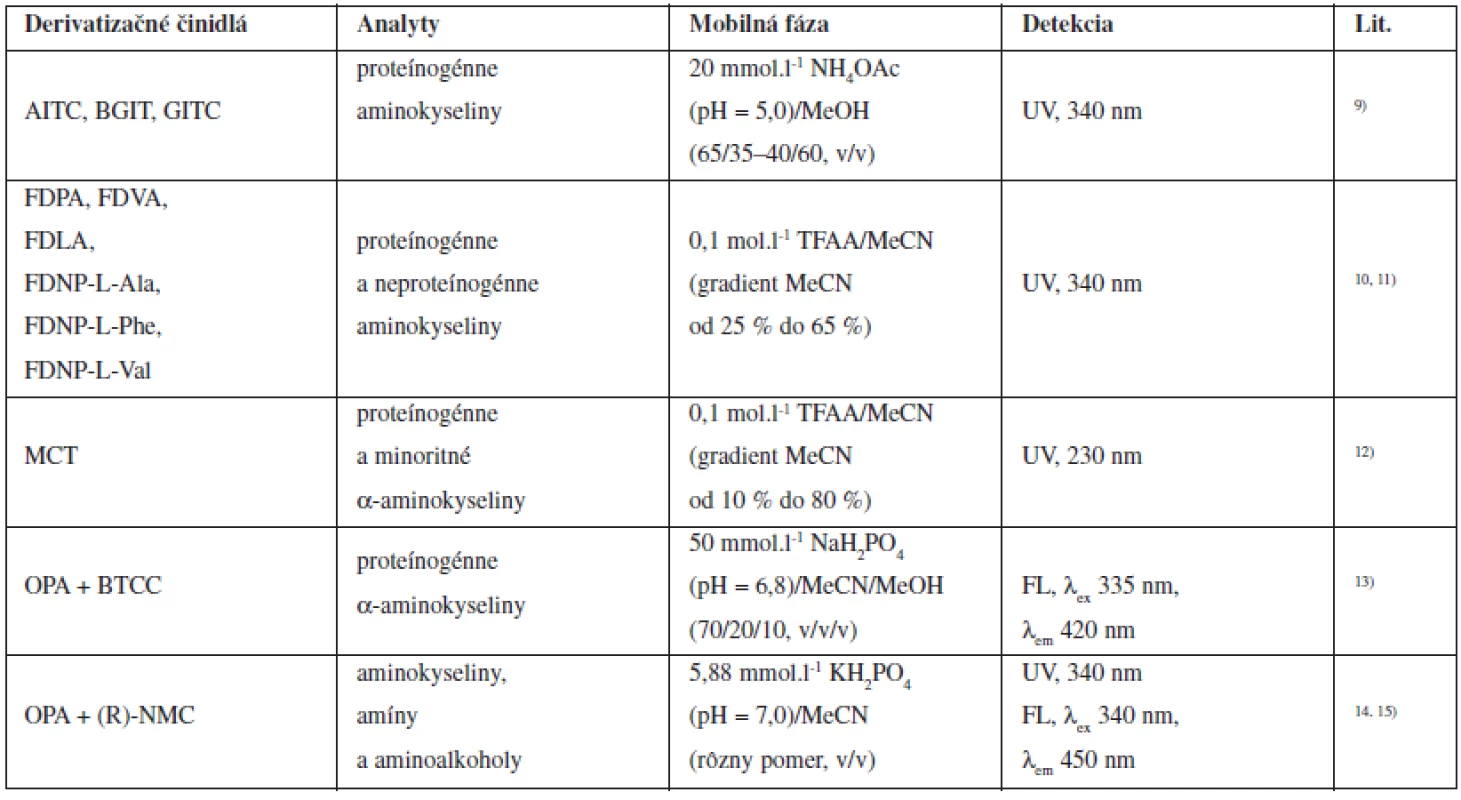
AITC: 2,3,4-tri-O-acetyl-α-D arabinopyranozyl izotiokyanát, BGIT: 2,3,4,6 tetra-O-benzoyl-β-D-glukopyranozyl izotiokyanát, GITC: 2,3,4,6-tetra- O-acetyl-β-D-glukopyranozyl izotiokyanát, FDPA: amid N-(5-fluoro-2,4-dinitrofenyl)-L fenylalanínu, FDVA: amid N-(5-fluoro 2,4-dinitrofenyl)- L-valínu, FDLA: amid N-(5-fluoro 2,4-dinitrofenyl)-L-leucínu, FDNP-L-Ala: 1-fluoro-2,4-dinitrofenyl-5-L-alanín, FDNP-L-Phe: 1-fluoro- 2,4-dinitrofenyl-5-L-fenylalanín, FDNP-L-Val: 1-fluoro-2,4-dinitrofenyl-5-L-valín, MCT: monochloro-s- triazín, OPA: o-ftalaldehyd, BTCC: etylester N-(terc-butyltiokarbamoyl)-L cysteínu, (R)-NMC: N-(R)-mandenyl-L-cysteín, TFAA: kyselina trifluoroctová, NH4OAc: octan amónny, MeOH: metanol, MeCN: acetonitril Priame separácie enantiomérov aminokyselín metódou HPLC
Pri priamych chirálnych HPLC separáciách aminokyselín sa rovnako ako pri nepriamom spôsobe pred samotným separačným procesom pristupuje k derivatizácii, a to hlavne z dôvodu zvýšenia separačnej účinnosti a zavedenie fluorofóru, prípadne chromofóru do molekúl analytov, a tým rozšírenia možnosti využitia spektrofotometrickej a fluorescenčnej detekcie. V prevažnej väčšine publikácií sa uvádza využitie CSF, kým prídavok chirálneho selektora do mobilnej fázy má oveľa menší počet aplikácií v oblasti delenia enantiomérov16).
Po uskutočnení prvého úspešného rozlíšenia optických izomérov aminokyselín v kvapalinovej chromatografii metódou LEC v roku 1971 sa začali vo veľkej miere používať chirálne komplexy prechodných kovov s vhodnými ligandami. Slúžili ako aditívum do mobilnej fázy. Ako príklad možno uviesť komplex D-penicilínu s Cu2+, ktorý sa ukázal ako vhodný chirálny selektor pri enantioseparáciách menej známych ββ-aminokyselín, ako sú napríklad kyselina morfolín-3-karboxylová, kyselina piperazín-2-karboxylová a kyselina piperidín-2-karboxylová17).
Jednými z najefektívnejších chirálnych selektorov sú cyklodextríny (CD). Tieto cyklické oligosacharidy sú známe od roku 1891, kedy boli prvýkrát izolované ako produkty degradácie škrobu. Vznikajú jeho enzymatickou hydrolýzou spôsobenou rôznymi druhmi baktérií, a to hlavne Bacillus circulans, Bacillus macerans a Klebsiella oxytoca. Medzi tzv. natívne cyklodextríny zaraďujeme α-CD, β-CD a γ-CD. V ich molekulách sú D-glukopyranózové jednotky (6–8) navzájom pospájané α-(1→4)-glykozidovou väzbou. Pri použití CD CSF v reverzno-fázovom (RP) systéme (použitie vodných a vodno-organických mobilných fáz) je mechanizmus separácie založený na tvorbe inklúznych komplexov riadený hydrofóbnymi interakciami medzi separovanými analytmi a chirálnym CD selektorom. Hydrofóbna časť separovanej molekuly penetruje do CD dutiny, čím vytláča molekuly rozpúšťadla. Komplex je stabilizovaný vo vnútri dutiny Van der Waalsovými interakciami, prípadne ďalšími hydrofilnými interakciami (vodíkové väzby, dipól-dipól interakcie) s hydroxylovými skupinami CD skeletu. Pre aromatické zlúčeniny sú dominantné π-π interakcie. Inklúzia do dutiny súvisí aj s veľkosťou molekuly. Pri polárno-organickom (PO) a konvenčnom (NP) usporiadaní fáz pre CD a CD-derivatizované CSF je vnútro dutiny blokované molekulami rozpúšťadiel mobilných fáz, a tým nedostupné pre tvorbu inklúznych komplexov s molekulami analytov. V týchto rozpúšťadlách sú podporované hydrofilné interakcie a analyty s hydrofilnými skupinami interagujú s polárnym povrchom CD skeletu. Enantioselektivita môže byť ovplyvnená veľkosťou týchto polárnych interakcií (vodíkové väzby, dipól-dipól interakcie)18).
Crown-étery sú makrocyklické polyétery, ktoré predstavujú významnú skupinu syntetických chirálnych selektorov. Ich využitie pri separáciách opticky aktívnych látok súvisí nielen s chirálnym charakterom, ale tiež so schopnosťou týchto zlúčenín tvoriť stabilné komplexy s katiónmi kovov a so substituovanými amóniovými iónmi. Crown-éterový selektor, ktorý je kovalentnou väzbou viazaný na silikagélový nosič, dokáže prednostne interagovať s jedným z optických izomérov látok s primárnou -NH2 skupinou, ako sú napríklad estery D,L-aminokyselín19).
Z tejto skupiny CSF sa v prípade aminokyselín vo veľkej miere aplikuje kyselina (+)-(18-crown-6)-2,3,11,12-tetrakarboxylová. Táto kyselina sa ukázala ako vhodný chirálny selektor pri separácii enantiomérov β-aminokyselín, racemátov proteínogénnych D,L-aminokyselín a tiež arylderivátov β-aminokyselín. V odbornej literatúre je opísaný vplyv metanolu ako jednej zo zložiek mobilnej fázy a tiež prídavku kyseliny na hodnoty chromatografického rozlíšenia optických izomérov. Okrem toho bol navrhnutý mechanizmus chirálneho rozpoznávania. Predpokladá sa, že koncentrácia metanolu a prídavok danej kyseliny majú výrazný vplyv na rovnováhu protonizovanej formy analytu distribuovaného medzi stacionárnu a mobilnú fázu20, 21).
Makrocyklické antibiotiká sú veľmi efektívne CSF, pretože poskytujú rozličné interakcie, napr. inklúzia analytu do hydrofóbnej časti selektora, tvorba π-π komplexov, dipólové interakcie, vodíkové mostíky, elektrostatické interakcie alebo van der Waalsove sily. Povaha interakcií pri separáciách enantiomérov pomocou stacionárnych fáz tvorených týmito zlúčeninami je určovaná stérickými efektami a zložením mobilnej fázy22). Jedným z najpoužívanejších glykopeptidových antibiotík, ktoré je vhodné aj na prípravu stacionárnych fáz v chirálnej chromatografii, je teikoplanín. V jeho molekule sa nachádzajú 4 kavity a 20 centier chirality. Okrem teikoplanínových stacionárnych fáz sa zo skupiny makrocyklických antibiotík pri separáciách enantiomérov uplatňujú aj teikoplanín aglykón (TAG), ristocetín A a vankomycín. Vankomycín obsahuje 3 kavity a 18 stereogénnych centier. Ristocetín A má rovnaký počet kavít ako teikoplanín a až 38 chirálnych centier23).
Priamy spôsob chromatografického delenia enantiomérov aminokyselín možno realizovať aj pomocou polysacharidových chirálnych stacionárnych fáz. Z tejto skupiny chirálnych selektorov sa najviac využívajú celulóza a amylóza tris-(3,5-dimetylfenylkarbamát) naviazané na silikagéli. HPLC kolóny tohto typu sú komerčne dostupné pod názvami Chiralcel OD-H (celulóza tris-(3,5 - -dimetylfenylkarbamát)) a Chiralpak AD-H (amylóza tris-(3,5-dimetylfenylkarbamát))24).
V súčasnosti sú mnohé vedecké štúdie orientované na vývoj a testovanie cyklofruktánových CSF. Vďaka výraznej enantioselektivite a možnosti použitia pre rozsiahlu skupinu racemických zlúčenín sú derivatizované cyklofruktány neustále predmetom intenzívnych výskumov25). Cyklofruktány možno zaradiť medzi makrocyklické oligosacharidy. Základ ich štruktúry najčastejšie tvorí šesť, sedem alebo osem D-fruktofuranózových jednotiek, ktoré sú navzájom pospájané β-(2→1) glykozidovou väzbou. Každá molekula sacharidu má štyri stereogénne centrá a pozostáva z jednej primárnej hydroxylovej skupiny a dvoch sekundárnych hydroxylových skupín. Tieto funkčné skupiny zabezpečujú hydrofilný charakter cyklofruktánov. Práve z tohto dôvodu sa nederivatizované cyklofruktány začali aplikovať ako stacionárne fázy v kvapalinovej chromatografii hydrofilných interakcií HILIC (Hydrophilic Interaction Liquid Chromatography), ktorá sa na rozdiel od kvapalinovej chromatografie na obrátených fázach (RP LC) používa pri separácii aminokyselín, cukrov, nukleotidov, peptidov a iných polárnych látok. Pri tejto chromatografickej metóde sa medzi analytom a hydrofilnou stacionárnou fázou uplatňujú rôzne typy interakcií, napríklad coulombické interakcie, dipól-dipólové interakcie alebo vodíkové väzby25). Spomedzi týchto oligosacharidov sa CSF najčastejšie pripravujú z cyklofruktánov tvorených šiestimi monosacharidovými jednotkami (CF6), pretože tento typ cyklofruktánu je dostupný v čistej forme a jeho štruktúra je dobre definovaná. Natívne cyklofruktány vykazujú pri HPLC enantioseparáciách limitovanú enantioselektivitu, a preto sa pristupuje k derivatizácii hydroxylových skupín alifatickými alebo aromatickými substituentmi. Derivatizované cyklofruktány sú vhodnými chirálnymi selektormi s výraznou schopnosťou rozlišovať enantioméry veľkého počtu zlúčenín. V odborných štúdiách týkajúcich sa HPLC chirálnych separácií látok obsahujúcich -NH2 skupinu (aminoalkoholy, aminokyseliny a ich amidy alebo estery) sa ako CSF testujú najmä chirálne selektory na báze derivatizovaného CF6, a to IP-CF6 (izopropylkarbamát cyklofruktánu 6) a RN-CF6 (R-naftyletylkarbamát cyklofruktánu 6)26).
Prehľad chirálnych stacionárnych fáz a zložiek mobilných fáz použitých pri separácii aminokyselín je uvedený v tabuľke 2.
Tab. 2. Chirálne stacionárne fázy používané pri priamych HPLC enantioseparáciách aminokyselín 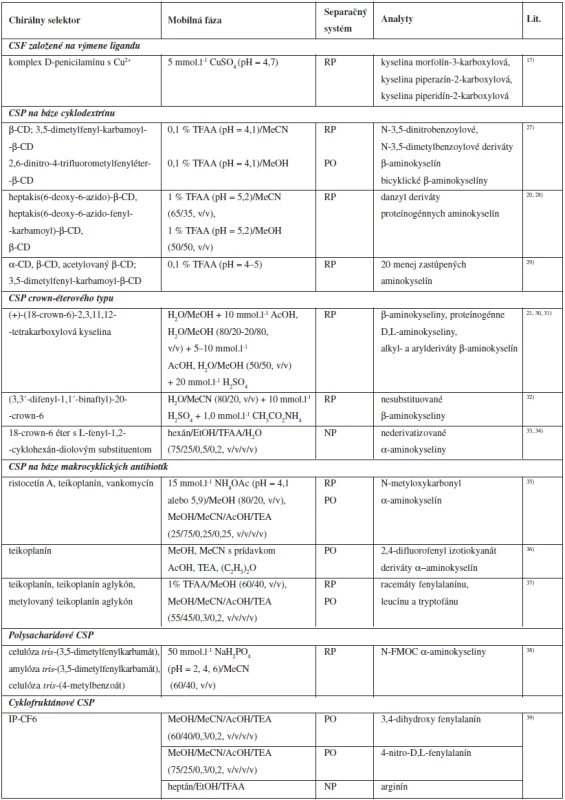
CD: cyklodextrín, TFAA: kyselina trifluoroctová, MeOH: metanol, EtOH: etanol, MeCN: acetonitril, AcOH: kyselina octová, NH4OAc: octan amónny, TEA: trietylamín, N-FMOC: N-fluorenylmetoxykarbonyl, RP: systém s obrátenými fázami (reversed-phase), PO: polárno-organický separačný systém (polar-organic mode), NP: systém s konvenčným usporiadaním fáz (normal-phase mode) Možnosti detekcie aminokyselín po HPLC separácií
Detekcia aminokyselín môže byť založená na rozličných princípoch. V prípade HPLC analýzy sa využívajú mnohé detekčné techniky, z ktorých najvýznamnejšie sú: spektrofotometrická detekcia, refraktometrická detekcia, fluorescenčná detekcia, elektrochemická detekcia na princípe pulznej ampérometrie, detekcia rozptylu žiarenia s odparovaním mobilnej fázy, chemiluminiscenčná detekcia špecifická pre dusík a detekcia na princípe hmotnostnej spektrometrie.
Selektivita spektrofotometrickej detekcie (UV-VIS) pre nederivatizované aminokyseliny je nízka, pretože prevažná väčšina týchto zlúčenín neobsahuje vo svojej štruktúre chromofór, prípadne obsahuje chromofóry schopné absorbovať UV žiarenie iba pri krátkych vlnových dĺžkach (210 nm). V oblasti krátkych vlnových dĺžok absorbujú UV žiarenie okrem aminokyselín mnohé organické látky, a preto je často potrebné zvoliť vhodnejší typ detekcie alebo použiť proces derivatizácie. Predkolónová derivatizácia sa môže použiť pri HPLC separácii aminokyselín v systéme s obráteným usporiadaním fáz. Pre ionexovú chromatografiu je vhodná pokolónová derivatizácia s ninhydrínom39).
Refraktometrická detekcia (RID) pre aminokyseliny sa rovnako ako spektrofotometrická detekcia vyznačuje svojou nízkou citlivosťou a selektivitou, pretože hodnotu indexu lomu možno určiť nielen pre tieto látky, ale aj pre všetky ostatné analyty prítomné v danej vzorke. Tento typ detektora má obmedzené aplikačné možnosti, pretože nie je kompatibilný s gradientovou elúciou a je veľmi citlivý na teplotné zmeny40).
Fluorescenčnú detekciu (FLD) možno použiť v prípade on-line derivatizácie aminokyselín napr. s o-ftalaldehydom (OPA), pričom vlnová dĺžka excitačného žiarenia je 330 nm a vlnová dĺžka emisného žiarenia je 455 nm. Ďalšími vhodnými derivatizačnými činidlami pre detekciu aminokyselín touto technikou sú fenylizotiokyanát (PITC) a 6-aminochinolyl-N-hydroxysukcinimidyl karbamát (AQC), v prípade ktorého sú vlnové dĺžky excitačného a emisného žiarenia 250 nm a 395 nm41).
Pulzná ampérometria (PAD) je typ elektrochemickej detekcie využívaný na detekciu nederivatizovaných aminokyselín po ich HPLC separácii. Hlavnou výhodou je schopnosť citlivejšie detegovať aminokyseliny v porovnaní so spektrofotometrickou detekciou. Pracovnou elektródou je najčastejšie zlatá vláknová mikroelektróda a ako referenčná elektróda slúži tuhá elektróda z paládia42).
Detektor založený na kontinuálnom meraní rozptylu žiarenia po odparení mobilnej fázy (ELSD) je vhodnou možnosťou detekcie aminokyselín, keďže je schopný poskytnúť odozvu pre látky neobsahujúce chromofór alebo fluorofór. Ďalšou výhodou ELSD je kompatibilita s oveľa rozsiahlejšou skupinou organických rozpúšťadiel ako pri UV-VIS alebo refraktometrickej detekcii43).
Chemiluminiscenčná detekcia špecifická pre dusík (CLND) pracuje na princípe rozprášenia eluentu obsahujúceho stanovované látky so zmesou kyslíka a argónu, prípadne hélia. Následne dochádza k pyrolýze pri teplote 1050 °C a v dôsledku prítomnosti kyslíka vznikajú zo zložiek mobilnej fázy príslušné oxidy (oxid uhličitý a iné). Všetky zlúčeniny obsahujúce dusík sú týmto spôsobom prevedené na oxid dusný, z ktorého sa reakciou s ozónom generuje oxid dusičitý v excitovanom stave. Pri návrate oxidu dusičitého do základného stavu sa vyžiari kvantum energie, ktoré je detegované pomocou fotonásobiča. Najväčší aplikačný potenciál tejto detekčnej metódy je spojený s analýzou peptidov a s rôznymi oblasťami kombinatoriálnej chémie. Pri analýze nederivatizovaných aminokyselín sa osvedčila metóda IP-RP HPLC (Ion-Pair Reversed Phase High Performance Liquid Chromatography) v kombinácii s touto detekciou. V prípade iných typov kvapalinovej chromatografie je nekompatibilita s CLND zapríčinená tým, že mobilné fázy obsahujú neprchavé tlmivé roztoky alebo organické rozpúšťadlá na báze dusíka44).
Spojenie kvapalinovej chromatografie s hmotnostnou spektrometriou (MS) ako detekčnou technikou predstavuje vhodnú metódu pri analýze voľných nederivatizovaných aminokyselín v zložitých matriciach. Stanovenie koncentrácie jednotlivých proteínogénnych aminokyselín v krvnej plazme sa v minulosti realizovalo metódou vysokoúčinnej ionexovej chromatografie s pokolónovou derivatizáciou s ninhydrínom, prípadne sa na kvantitatívnu analýzu týchto látok v biologických vzorkách využívala plynová chromatografia s hmotnostnou spektrometriou. Nevýhody uvedených techník sú najmä náročná príprava vzorky (extrakcia na tuhom sorbente) a dlhé časy analýz. V poslednom období sa pri IP-RP-HPLC analýze aminokyselín na detekciu používa hmotnostná spektrometria s preletovým analyzátorom (Time of Flight Mass Spectrometry, TOF-MS) a na tvorbu iónov ionizácia elektrosprejom (Electrospray Ionization, ESI). Preletový analyzátor v porovnaní s vysokorozlišovacím kvadrupólom sa v tomto prípade vyznačuje výrazne vyšším rozlíšením jednotlivých iónov aminokyselín. Použitím ión-párového činidla, napríklad kyseliny tridekafluórheptánovej, možno ovplyvniť separáciu týchto analytov (na C18 kolóne), pričom sa eliminuje potreba predkolónovej alebo pokolónovej derivatizácie. Metóda IP-RP-HPLC/ESI-TOF-MS je vhodnou alternatívou k tandémovej hmotnostnej spektrometrii použiteľnou pri analýze klinických vzoriek45).
Pri separácii optických izomérov aminokyselín možno okrem vyššie spomenutých typov detekcie použiť aj detekciu na princípe cirkulárneho dichroizmu a detekciu na princípe laserovej polarimetrie.
Cirkulárny dichroizmus (CD) je jednou z chiroptických metód, ktoré sú analógiou absorpčnej spektroskopie a merania indexu lomu. Podstatou cirkulárneho dichroizmu je odlišná absorpcia pravotočivo a ľavotočivo kruhovo polarizovaného žiarenia enantiomérnymi formami. Detekcia sa kombinuje s HPLC separáciou enantiomérov proteínogénnych αα-aminokyselín, pre ktoré sa osvedčil chirálny selektor crown-éterového typu46, 47).
Laserová polarimetria (ALP) sa v poslednom období zaraďuje medzi najefektívnejšie detekčné techniky v chirálnej HPLC. Okrem určenia elučného poradia enantiomérov je ideálnym nástrojom na monitorovanie zmien optickej aktivity v priebehu chemických reakcií. Jednou z najdôležitejších aplikácií laserovej polarimetrie je detekcia konformačných zmien peptidov a proteínov. V porovnaní s UV a CD detekciou má polarimetria využívajúca laserovú diódu niekoľko výhod. Stanovované analyty nemusia obsahovať vo svojej štruktúre chromofór48).
Porovnanie vybraných typov detekcie z hľadiska dosiahnuteľných medzí detekcie pre nederivatizované aminokyseliny je zhrnuté v tabuľke 3. UV detektor nie je vhodný pre detekciu všetkých aminokyselín z dôvodu neprítomnosti chromofóru v molekule analytu, prípadne kvôli iným interferenciám. Ďalším kritériom výberu vhodného typu detekcie je aj kompatibilita s použitou mobilnou fázou, prípadne izokratickou/gradientovou elúciou. Napr. pre ELSD, CLND a MS detektory sú vhodné prchavé mobilné fázy, pre UV detekciu sa volia zložky mobilnej fázy s dostatočnou priepustnosťou pri nízkych UV vlnových dĺžkach a pre CD detektor sa na dosiahnutie maximálnej citlivosti volia mobilné fázy s nízkou vodivosťou.
Tab. 3. Porovnanie rozsahov LOD nederivatizovaných aminokyselín pre vybrané typy detektorov použivaných pri HPLC separáciích 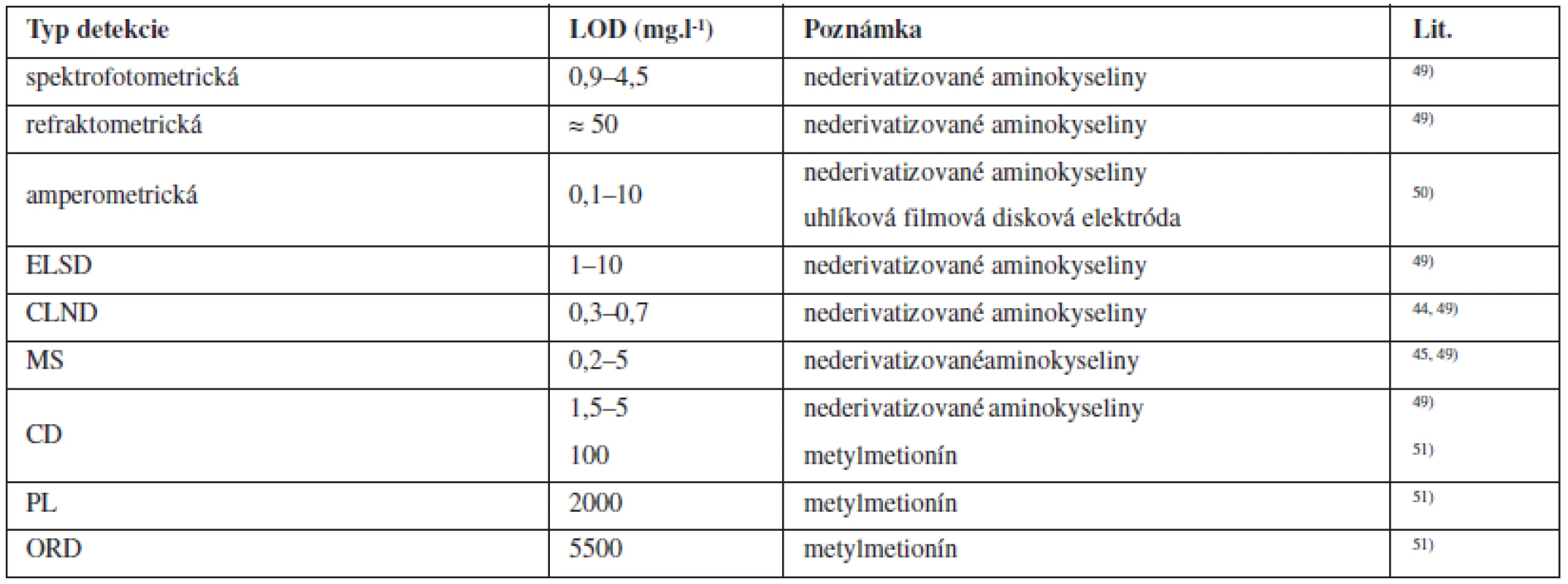
ELSD: detekcia založená na kontinuálnom meraní rozptylu žiarenia po odparení mobilnej fázy, CLND: chemiluminiscenčná detekcia špecifická pre dusík, MS: hmotnostná spektrometria, CD: cirkulárny dichroizmus, PL: polarimetrická detekcia, ORD: optická rotačná disperzia Záver
Aminokyseliny patria medzi jednu z najdôležitejších skupín biologicky aktívnych látok. Tieto zlúčeniny sú základnými stavebnými zložkami peptidov a proteínov. V živých organizmoch sa uplatňujú pri biosyntéze rôznych neproteínových látok obsahujúcich dusík, prípadne vznikajú v reakciách bazálneho metabolizmu.
Príspevok je zameraný na separáciu enantiomérov aminokyselín metódou vysokoúčinnej kvapalinovej chromatografie. Ťažiskom práce je prehľad možností separácie enantiomérov cieľovej skupiny analytov použitím chirálnych stacionárnych fáz. Pre chromatografickú separáciu racemických zmesí aminokyselín, v závislosti od typu chirálnej stacionárnej fázy, možno využiť polárno-organický, reverzno-fázový aj konvenčný separačný systém mobilnej fázy. Popri priamom spôsobe separácie sa využíva aj možnosť derivatizácie chirálnym derivatizačným činidlom. V prípade HPLC analýzy sa využívajú bežné detekčné techniky, ako aj detekcia na základe cirkulárneho dichroizmu a laserovej polarimetrie. Najčastejšie využívanými chirálnymi selektormi sú predovšetkým cyklodextríny a makrocyklické antibiotiká.
Práca vznikla za podpory grantu č. 1/0499/14 Vedeckej grantovej agentúry Ministerstva školstva Slovenskej republiky a Slovenskej akadémie vied.
Stret záujmov: žiadny.
Došlo 6. prosince 2013
Přijato 18. prosince 2013
J. Moravčík • doc. Ing. Katarína Hroboňová, PhD. (∗)
Slovenská technická univerzita v Bratislave
Ústav analytickej chémie
Fakulta chemickej a potravinárskej technológie
Radlinského 9, 812 37 Bratislava, Slovenská republika
e-mail: katarina.hrobonova@stuba.sk
Zdroje
1. Škárka B.; Ferenčík M. Biochémia. Bratislava: Alfa 1992.
2. Ilisz I., Aranyi A., Pataj Z., Péter A. Recent advances in the direct and indirect liquid chromatographic enantioseparation of amino acids and related compounds. A review. J. Pharm. Biomed. Anal. 2012; 69, 28–41.
3. Lehotay J. Separačné metódy v analytickej chémii, 1. vyd. Bratislava: Nakladateľstvo STU 2009.
4. Štulík K. Analytické separační metody, 1. vyd. Praha: Karolinium 2004.
5. Davankon V. A., Rogozhin S. V. Ligand chromatography as a novel method for the investigation of mixed complex: stereoselective effects in α-amino acids copper(II) cpmplexes. J. Chromatogr. 1971; 60, 280–283.
6. Contino A., Maccarrone G., Remelli M. Exploiting thermodynamic data to optimize the enantioseparation of underivatized amino acids in ligand exchange capillary electrophoresis. Anal. Bioanal. Chem. 2013; 405, 951–959.
7. Subramanian G. Chiral separation techniques. A practical approach, 2nd Edition. Weinheim: Wiley-VCH 2000.
8. Molovenau C. S., David V. Essentials in modern HPLC separations. 2nd Edition. USA: Elsevier 2013; 550.
9. Guillarme D., Bonvin G., Badoud F., Schappler J., Rudaz S., Veuthey J. L. Fast chiral separation of drugs using columns packed with sub-2 μμm particles and ultra high pressure. Chirality 2010; 22, 320–330.
10. Bhushan R., Tanwar S. Indirect resolution of enantiomers of certain D,L-amino acids by liquid chromatography via diastereomer formation with Marfey’s reagent and its leucine variant. Proc. Nat. Acad. Sci. 2009; 79, 241–251.
11. Bhushan R., Kumar V. Analysis of multicomponent mixture and simultaneous enantioresolution of proteinogenic and non-proteinogenic amino acids by reversed-phase high performance liquid chromatography using chiral variants of Sanger’s reagent. Anal. Biomed. Chem. 2009; 394, 1697–1705.
12. Bhushan R., Kumar V. Indirect enantioseparation of α-amino acids by reversed-phase liquid chromatography using new chiral derivatizing reagents synthesized from s-triazine chloride. J. Chromatogr. A 2008; 1201, 35–42.
13. Nimuta N., Fujiwara T., Watanabe A., Sekine M., Furuchi T., Yohda M., Yamagishi A., Oshima T., Homma H. A novel chiral thiol reagent for automated precolumn derivatization and high performance liquid chromatographic enantioseparation of amino acids and its application to the aspartate racemase assay. Anal. Biochem. 2003; 315, 262–269.
14. Guranda D. T., Kudryavtsev P. A., Khimiuk A. Y., Svedas V. K. Efficient enantiomeric analysis of primary amines and amino alcohols by high performance liquid chromatography with precolumn derivatization using novel chiral SH-reagent N-(R)-mandenyl-(S)-cysteine. J. Chromatogr. A 2005; 1095, 89–93.
15. Chernobrovkin M. G., Shapovalova E. N., Guranda D. T., Kudryavtsev P. A., Svedas V. K., Shpigun O. A. Chiral high performance liquid chromatography analysis of αα-amino acid mixtures using a novel chiral SH-reagent N-(R)-mandenyl-L-cysteine and traditional enantiomeric thiols for precolumn derivatization. J. Chromatogr. A 2007; 1175, 89–95.
16. Francotte E., Lindner W. Chirality in drug research. 1st Edition. Weinheim: Wiley-VCH 2006; 351.
17. Ilisz I., Tourwe D., Armstrong D. W., Peter A. High-performance liquid chromatographic enantioseparation of unusual secondary amino acids on a D-penicillamine – based chiral ligand-exchange column. Chirality 2006; 18, 539–543.
18. Lämmerhofer M. Chiral recognition by enantioselective liquid chromatography: mechanisms and modern chiral stationary phases. J. Chromatogr. A 2009; 1217, 814–856.
19. Choi H. J., Hyun M. H. Liquid chromatographic chiral separations by crown ether – based chiral stationary phases. J. Liq. Chromatogr. Rel. Technol. 2007; 30, 853–875.
20. Hyun M. H., Choi H. J., Kang B. S., Tan G., Cho Y. J. Preparation of a new chiral stationary phase based on (2S, 3S)-O,O´-bis-(10-undecenoyl)-N,N´-bis-(3,5-dinitrobenzoyl)-2,3-diamino-1,4-butandiol and its application for the liquid chromatographic resolution of enantiomers. Bull. Kor. Chem. Soc. 2006; 27, 1775–1779.
21. Chen J. J., Zhang D. T., Shen B. C., Zhang X. J., Xu B. J., Xu X. Z. Enantioseparation of D,L-αα-amino acids on crown ether chiral stationary phases. Chin. J. Anal. Chem. 2006; 34, 1535–1540.
22. Ilisz I., Berkecz R., Peter A. HPLC separation of amino acid enantiomers and small peptides on macrocyclic antibiotic – based chiral stationary phases. A review. J. Sep. Sci. 2006; 29, 1305–1321.
23. Ilisz I., Berkecz R., Peter A. Retention mechanism of high performance liquid chromatographic enantioseparation on macrocyclic glycopeptide – based chiral stationary phases. J. Chromatogr. A 2009; 1216, 1845–1860.
24. Winkler M., Klempier N. Enantioseparation of nonproteinogenic amino acids. Anal. Biomed. Chem. 2009; 393, 1789–1796.
25. Qiu H., Loukotkova L., Tesařova E., Bosakova Z., Armstrong D. W. Cyclofructan 6 based stationary phases for hydrophilic interaction liquid chromatography. J. Chromatogr. A 2011; 1218, 270–279.
26. Sun P., Armstrong D. W. Effective enantiomeric separations of racemic primary amines by the isopropyl carbamate – cyclofructan 6 chiral stationary phase. J. Chromatogr. A 2010; 1217, 4904–4918.
27. Ilisz I., Berkecz R., Forro E., Fülöp F., Armstrong D. W., Peter A. The role of π-acidic and π-basic chiral stationary phases in the high performance liquid chromatographic enantioseparation of unusual βα-amino acids. Chirality 2009; 21, 339–348.
28. Wang Y., Ong T. T., Li L. S., Tan T. T. Y. Enantioseparation of a novel “clickchemistry“ derived native ββ-cyclodextrin chiral stationary phase for high performance liquid chromatography. J. Chromatogr. A 2009; 1216, 2388–2393.
29. Remsburg J. W., Armstrong D. W., Peter A., Toth G. LC enantiomeric separation of unusual amino acids using cyclodextrin – based stationary phases. J. Liq. Chromatogr. Rel. Technol. 2008; 31, 219–230.
30. Wang Y., Young D. J., Tan T. T. Y. Click preparation of hindered cyclodextrin chiral stationary phases and their efficient resolution in high performance liquid chromatography. J. Chromatogr. A 2010; 1217, 7878–7883.
31. Berkecz R., Sztojkov-Ivanov A., Ilisz I., Forro E., Fülöp F., Hyun M. H., Peter A. High performance liquid chromatographic enantioseparation of ββ-amino acid stereoisomers on a (+)-(18-crown-6)-2,3,11,12-tetracarboxylic acid – based chiral stationary phase. J. Chromatogr. A 2006; 1125, 138–143.
32. Choi H. J., Ha H. J., Han S. C., Hyun M. H. Liquid chromatographic resolution of ββ-amino acids on CSPs based on optically active (3,3´-diphenyl-1,1´-binaphtyl)-20-crown-6. Anal. Chim. Acta 2008; 619, 122–128.
33. Hirose K., Jin Y. Z., Nakamura T., Nishioka R., Ueshige T., Tobe Y. Preparation and evaluation of a chiral stationary phase covalently bound with chiral pseudo-18-crown-6 ether having 1-phenyl-1,2-cyclohexanediol as a chiral unit. J. Chromatogr. A 2005; 1078, 35–41.
34. Hirose K., Jin Y. Z., Nakamura T., Nishioka R., Ueshige T., Tobe Y. Chiral stationary phase covalently bound with a chiral pseudo-18-crown-6 ether for enantiomeric separation of amino compounds using a normal mobile phase. Chirality 2005; 17, 142–148.
35. Boesten J. M. M., Berkheij M., Schoemaker H. E., Hiemstra H., Duchateau A. L. L. Enantioselective high performance liquid chromatographic separation of N-methyloxycarbonyl unsaturated amino acids on macrocyclic glycopeptide stationary phases. J. Chromatogr. A 2006; 1108, 26–30.
36. Chen S. The enantioseparation of amino acids on a teicoplanin chiral stationary phase using non – aqueous mobile phases after pre-column derivatization with sulfur-containing reagents: the considerations of mobile phase composition and analyte structure variation on resolution enhancement. Biomed. Chromatogr. 2006; 20, 718–728.
37. Xiao T. L., Tesařová E., Anderson J. L., Egger M., Armstrong D. W. Evaluation and comparison of a methylated teicoplanin aglycone to teicoplanin aglycon and natural teicoplanin chiral stationary phases. J. Sep. Sci. 2006; 29, 429–445.
38. Lee K. A., Yeo S., Kim K. H., Lee W., Kang J. S. Enantioseparation of N-fluorenylmethoxycarbonyl α-amino acids on polysacharide – derived chiral stationary phases by reverse mode liquid chromatography. J. Pharm. Biomed. Anal. 2008; 46, 914–919.
39. Agrafiotou P., Sotiropoulos S., Pappa-Louisi A. Direct RP-HPLC determination of underivatized amino acids with online dual UV absorbance, fluorescence, and multiple electrochemical detection. J. Sep. Sci. 2009; 32, 949–954.
40. Barrett C. G. Elmore T. D. Amino acids and peptides. 1st Edition. USA, Cambridge: University Press 1998.
41. Šlechtová T., Kalíková K., Tesařová E. Stanovení enantiomerů theaninu pomocí HPLC, porovnání metod detekce. Chem. Listy 2013; 107, 228–232.
42. Siangproh W., Leesutthipornchai W., Dungchai W., Chailapakul O. Electrochemical detection for flow-based system. A Review. J. Flow Injection Anal. 2009; 26, 5–25.
43. Lucena R., Cardenas S., Valcarcel M. Evaporative light scattering detection: trends in its analytical uses. Anal. Bioanal. Chem. 2007; 388, 1663–1672.
44. Petritis K., Elfakir C., Dreux M. HPLC-CLND for the analysis of underivatized amino acids. LC-GC Europe 2001; 14, 389–395.
45. Armastong M., Jonscher K., Reisdorph N. A. Analysis of 25 underivatized amino acids in human plasma using ion-pairing reversed-phase liquid chromatography/time-of-flight-mass spectrometry. Rapid Commun. Mass Spectrom. 2007; 21, 2717–2726.
46. Ranjbar B., Gill P. Circular dichroism techniques. Biomolecular and nanostructural analyses. A Review. Chem. Biol. Drug Des. 2009; 74, 101–120.
47. Görög S. Identification and determination of impurities in drugs. 1st Edition. The Netherlands: Elsevier 2000; 772.
48. Ng K., Edkins T. J., Bobbitt D. R. Direct specific rotation measurements of amino acids, dipeptides, and tripeptides by laser-based polarimetry. Chirality 1999; 11, 187–194.
49. Petritis K, Elfakir C, Dreux M. A comparative study of commercial liquid chromatographic detectors for the analysis of underivatized amino acids. J. Chromatogr. A 2002; 961, 9–21.
50. Sato K, Jin JY, Takeuchi T, Miwa T, Takekoshi Y, Kanno S, Kawase S. Indirect amperometric detection of underivatized amino acids in microcolumn liquid chromatography with carbon film based ring-disk electrodes. Analyst 2000; 125, 1041–1043.
51. Kott L., Holzheuer W. B., Wong and M. M., Webster G. K. An evaluation of four commercial HPLC chiral detectors: A comparison of three polarimeters and a circular dichroism detector. J. Pharm. Biomed. Anal. 2007; 43, 57–65.
Štítky
Farmacie Farmakologie
Článek Nové knihy
Článek vyšel v časopiseČeská a slovenská farmacie
Nejčtenější tento týden
2014 Číslo 1- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
-
Kam směřuje vývoj nových antituberkulotik?
Část 2 – Hodnocení in vitro - Produkce flavonoidů a isoflavonoidů v suspenzní kultuře jetele lučního elicitované kyselinou jasmonovou
-
Štúdium lokálnych anestetík: Časť 204*
Determinácia kritických micelových koncentrácií vybraných m-alkoxysubstituovaných pyrolidínoetylesterov kyseliny fenylkarbámovej využitím pyrénu ako sondy - Inhibícia 12/15 lipoxygenázy kurkumínom a extraktom z Curcuma longa L.
- Časopis Česká a slovenská farmacie vstupuje do roku 2014
- Identifikácia a riešenie farmakoterapeutických problémov z pohľadu verejného lekárnika
- Separácia enantiomérov aminokyselín metódou vysokoúčinnej kvapalinovej chromatografie
- Globalizácia a jej dopady v lekárenstve SR
- Docent RNDr. Pavel Komárek, PhD. jubiluje
- 42. konference Syntéza a analýza léčiv byla opět úspěšná
- Nové knihy
-
Kam směřuje vývoj nových antituberkulotik?
- Česká a slovenská farmacie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Separácia enantiomérov aminokyselín metódou vysokoúčinnej kvapalinovej chromatografie
- Identifikácia a riešenie farmakoterapeutických problémov z pohľadu verejného lekárnika
- Globalizácia a jej dopady v lekárenstve SR
- Docent RNDr. Pavel Komárek, PhD. jubiluje
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



