-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Modulácia leukotriénovej cesty – potenciálne ciele
Modulation of leukotriene pathway – potential targets
Leukotrienes (LT), namely cysteinyl LT and LTB4, are potent lipid mediators taking part in the signal pathways of many inflammatory processes. The arachidonic acid transformation into leukotrienes can be signed as the leukotriene pathway. The key enzyme is 5-lipoxygenase, a dioxygenase containing a nonheme-bound ferric central ion, which in the catalytic complex with 5-lipoxygenase activating protein forms 5-hydroperoxyeicosatetraenoic acid. In the next steps this process involves leukotriene A4-hydrolase or leukotriene C4-synthase. According to the progress in recent years in the area of X-ray structural analysis and revealed 3D structure of these biocatalysts, especially their active sites, the development of new drugs markedly accelerated. This complicated enzymatically controlled process offers several possibilities of modulation and presents new approaches to the treatment of typical inflammatory diseases as well as in the therapy of atherosclerosis and cancer.
Keywords:
leukotrienes, 5-lipoxygenase, modulation, leukotriene pathway
Autoři: Peter Hoffman; Lýdia Bezáková
Působiště autorů: Univerzita Komenského v Bratislave, Farmaceutická fakulta, Katedra bunkovej a molekulárnej biológie liečiv
Vyšlo v časopise: Čes. slov. Farm., 2012; 61, 101-106
Kategorie: Přehledy a odborná sdělení
Souhrn
Leukotriény (LT), zahŕňajúce cysteinyl LT a LTB4, sú významné lipidové mediátory zúčastňujúce sa signalizácie v mnohých zápalových procesoch. Proces premeny kyseliny arachidónovej na leukotriény môžeme označovať ako leukotriénovú cestu. Kľúčovým enzýmom je 5-lipoxygenáza – dioxygenáza s nehémovo viazaným centrálnym iónom železa, ktorý v katalytickom komplexe s membránovým 5-lipoxygenázu aktivujúcim proteínom tvorí 5-hydroperoxyeikozatetraénovú kyselinu. V ďalších krokoch sa zapájajú leukotrién A4-hydroláza alebo leukotrién C4-syntáza. Vďaka pokroku z posledných rokov v oblasti röntgenovej štruktúrnej analýzy a odhalenia 3D štruktúry biokatalyzátorov, najmä ich aktívnych centier, sa vývoj nových liečiv výrazne urýchlil. Tento zložitý enzymaticky kontrolovaný proces ponúka viacero možností modulácie a predstavuje tak nové prístupy nielen k liečbe typických zápalových ochorení, ale aj v terapii aterosklerózy a nádorových ochorení.
Kľúčové slová:
leukotriény, 5-lipoxygenáza, modulácia, leukotriénová cestaLeukotriény
Leukotriény sú bioaktívne lipidové mediátory tvorené v metabolickej ceste 5-lipoxygenázy (5-LOX). Sú tvorené a uvoľňované z aktivovaných leukocytov kaskádou enzymaticky kontrolovaných reakcií, ich účinky sú sprostredkované špecifickými GPCR receptormi. Zmes cysteinyl-leukotriénov (LTC4, LTD4 a LTE4) bola po štyri desaťročia označovaná ako SRS-A – pomaly pôsobiace mediátory anafylaxie.
Kyselina arachidónová (AA), ktorá je v bunke esterovo viazaná na membránové fosfolipidy, je po uvoľnení prostredníctvom cPLA2 metabolizovaná 5-LOX. Táto solubilná dioxygenáza aduje molekulárny kyslík na nenasýtenú väzbu v pozícii C5 za tvorby 5 HpETE, ktorá je ďalej premieňaná 5-LOX na nestabilný epoxid LTA4 (obr. 1) 1). Osud LTA4 závisí na type bunky a prítomnosti metabolizujúcich enzýmov: LTA4-hydrolázy za tvorby LTB4, alebo LTC4-syntázy za tvorby LTC4. Uvoľnením LTC4 do extracelulárneho prostredia a pôsobením γ-glutamyl transpeptidázy vedie k vzniku LTD4, ktorý je metabolizovaný dipeptidázou na LTE4. Alternatívne môže byť de novo syntetizovaný LTA4 transportovaný do susedných buniek, ktoré ho nie sú schopné produkovať samostatne, ale exprimujú LTA4-hydrolázu alebo LTC4-syntázu, resp. MAPEG.
Obr. 1. Schéma biosyntézy leukotriénov Aktiváciou bunky exprimujúcej 5-LOX dochádza v prvom kroku k uvoľneniu kyseliny arachidónovej prostredníctvom cPLA2. 5-LOX v spolupráci s FLAP oxygenuje AA za vzniku hydroperoxidu (5-HpETE), ktorý môže byť redukovaný glutatión peroxidázou na 5-HETE alebo ďalším pôsobením 5-LOX/FLAP vzniká leukotriénový epoxid LTA<sub>4</sub>. Ten podľahne hydrolytickému štiepeniu katalyzovanému LTA<sub>4</sub>-hydrolázou za vzniku LTB<sub>4</sub>. Alternatívne LTA<sub>4</sub> konjuguje s glutatiónom za vzniku cysteinyl leukotriénov (LTC<sub>4</sub>, LTD<sub>4</sub>, LTE<sub>4</sub>), reakcia je katalyzovaná leukotrién C4 syntázou. Vznikajúce leukotriény pôsobia na cieľové bunky prostredníctvom príslušných receptorov: LTB4 cez LTB<sub>4</sub> receptory, cysteinyl leukotriény cez cys-LT receptory (upravené podľa <sup>1</sup>). 
Štúdie zaoberajúce sa LTA4 v rámci ľudských neutrofilov preukázali, že viac než 50% vytvoreného leukotriénu sa uvoľňuje a zúčastňuje sa medzibunkového metabolizmu2, 3). Napríklad erytrocyty, ktoré exprimujú LTA4-hydrolázu ale nie 5-LOX, preukázali schopnosť premeny LTA4 na LTB44). Endotelové bunky a krvné doštičky, ktoré exprimujú LTC4-syntázu, ale nemajú 5-LOX, dokážu spracovať LTA4 vytvorené neutrofilmi na LTC45). Podobne bola preukázaná transcelulárna biosyntéza aj pre alveolárne makrofágy6).
Receptory leukotriénov
Cysteinyl-leukotriény (cys-LT), tiež označované ako peptidyl-leukotriény (p-LT), LTC4, LTD4 a LTE4 sú prozápalové mediátory pôsobiace prostredníctvom GPCR receptorov – Cys-LT1 a Cys-LT2 (pôvodne označovaný ako LTC4 receptor).
Väčšina efektov cys-LT v patofyziológii astmy je sprostredkovaných Cys-LT1 receptorom, ktorý sa vyskytuje v ľudských prieduškách, periférnych cirkulujúcich leukocytoch, v bunkách hladkých svalov pľúc, intersticiálnych makrofágoch a slezine. Cys-LT2 je exprimovaný hlavne v srdci, dreni nadobličiek, pľúcach a periférnych cirkulujúcich leukocytoch7). Cys-LT2 zohráva dôležitú úlohu v kardiovaskulárnom systéme, je hlavným receptorom v predsieňach a komorách a aj v koronárnych artériách, kde Cys-LT1 receptor je minimálne exprimovaný8).
Aktivita leukotriénu B4 je sprostredkovaná dvoma podtriedami BLT receptorov. BLT1 receptor je špecifický a vysoko afinitný pre LTB4, nachádza sa prednostne na povrchu polymorfonukleárnych leukocytov9) a niektorých ďalších tkanivách10), ale tiež v aterosklerotických plátoch krčnej tepny, endotelových bunkách a hladkých svalov ciev11). LTB4 prostredníctvom tohto vysoko afinitného receptora sprostredkúva chemotaxiu, spája sa s aterogenézou, bronchiálnou astmou, glomerulonefritídou, artritídou a chronickými zápalovými črevnými ochoreniami12).
BLT2 je ubikvitárny, nízko-afinitný receptor (vykazuje 20-násobne nižšiu afinitu než BLT1) s výskytom v pečeni, črevách, slezine, obličkách, endotelových bunkách aj neutrofiloch13). Fyziologické a patologické úlohy BLT2 sú stále takmer neznáme.
Enzýmy zapojené v biosyntéze leukotriénov
5-lipoxygenáza
Najvýznamnejšou a najviac preskúmanou polohovo špecifickou izoformou lipoxygenáz je 5-LOX. Premieňa AA na 5-hydroperoxyeikozatetraénovú kyselinu (5 HpETE), ktorá je redukovaná na príslušný hydroxid (HETE) alebo na leukotriény. Enzymatická aktivita je vysoko regulovaná prostredníctvom viacerých procesov signalizácie (najmä fosforylácie) a membránového 5 LOX aktivujúceho proteínu (FLAP). V súčasnosti používané modulátory 5-LOX metabolizujúcej dráhy sa využívajú v liečbe astmy a alergickej rinitídy, no potenciálne nové modulátory pôsobiace na úrovni tvorby leukotriénov, prípadne ich účinku (receptorov), ponúkajú výrazne pestrejšie možnosti využitia: v kardiovaskulárnych ochoreniach (stavy po infarkte myokardu, ochorenia koronárnych artérií, ateroskleróza), pri liečbe reumatoidnej artritídy a osteoartritídy, ale aj niektorých druhov rakovinového bujnenia.
5-lipoxygenázu aktivijúci proteín (FLAP)
Objav tohto 18 kDa integrálneho membránového proteínu sa spája s koncom osemdesiatych rokov a syntézou indolovej zlúčeniny označenej ako MK-886, ktorá inhibovala syntézu leukotriénov in vitro aj in vivo bez ovplyvnenia 5-LOX, fosfolipáz alebo iných neselektívnych mechanizmov v produkcii leukotriénov14). Keďže tento proteín bol nevyhnutný pre bunkovú aktivitu 5 LOX, bol nazvaný proteín aktivujúci 5-lipoxygenázu (five-lipoxygenase activating protein; FLAP).
FLAP je nevyhnutným pre premenu endogénneho substrátu (AA) prostredníctvom 5-LOX. Stimuluje tiež utilizáciu exogénne pridanej kyseliny arachidónovej a výrazne (približne 190-násobne) stimuluje aj spracovanie ďalšieho exogénneho substrátu – 12(S)-HETE. Pridaním exogénnej kyseliny arachidónovej dochádza k stimulácii 5-LOX aj v neprítomnosti FLAP, čo znižuje účinnosť blokátorov FLAP15).
LTA4-hydroláza
LTA4-hydroláza (LTA4-H) je 69 kDa zinok obsahujúci enzým (EC 3.3.2.6) lokalizovaný v cytozole a tvorený 610 AK. Bol objavený prostredníctvom jeho epoxid-hydrolázovej aktivity, súčasne je členom M1 rodiny zinok obsahujúcich aminopeptidáz. Zabezpečuje premenu leukotriénu A4 na chemotakticky aktívny LTB4.
Hoci je najvyššia expresia enzýmu v neutrofiloch, LTA4-H je ubikvitárne distribuovaná v cicavčích tkanivách, dokonca aj v bunkách, ktoré nevykazujú 5-LOX aktivitu. Príkladom môžu byť erytrocyty, kde syntéza LTB4 závisí na transporte LTA4 z iných buniek exprimujúcich 5-LOX (najčastejšie polymorfonukleárne leukocyty)16). Gén kódujúci LTA4-H má viac než 35 kbp s 19 exónmi a je lokalizovaný na chromozóme 12q22 (LTA4H). V neutrofiloch je mRNA enzýmu up-regulovaná prostredníctvom IL-4 a IL 1317).
LTC4-syntáza
LTC4-syntáza (LTC4-S) je 18 kDa integrálny membránový proteín, člen veľkej rodiny MAPEG enzýmov, tvorený 150 AK. Enzým pracuje ako mikrozomálna glutatión-S-transferáza, ktorá katalyzuje konjugáciu epoxidového leukotriénu A4 s glutatiónom za tvorby LTC4.
LTC4-S je exprimovaná najmä v mastocytoch a makrofágoch, vysoké množstvá boli preukázané aj v eozinofiloch18). Aj v prípade tvorby LTC4 je pomerne výrazná transcelulárna tvorba v bunkách neexprimujúcich 5 LOX: endotelové bunky, bunky hladkých svalov ciev, krvné doštičky2).
Inhibítory a antagonisty LOX dráhy
Pokroky v objasnení vzniku leukotriénov a molekulárnej fyziológie ich účinku urýchlili vývoj v oblasti liečby zápalových ochorení typu astmy a ďalších kardiovaskulárnych a iných ochorení. Ovplyvnenie leukotriénovej signalizačnej dráhy sa zameriava na viaceré oblasti: inhibíciu aktivity 5-LOX (prípadne duálnou inhibíciou COX/5-LOX), blokovaním aktivity FLAP, LTA4-H alebo LTC4-S a antagonizmom Cys-LT receptorov.
Redoxné inhibítory 5-LOX
Lipoxygenázy a príbuzné enzýmy v metabolizme AA sú náchylné k inhibícii zlúčeninami s nízkym redoxným potenciálom (obr. 2). Takéto redoxné inhibítory sú slabo selektívne pre LOX podobne ako pre COX. Výsledkom interakcií s inými biologickými redoxnými systémami a ďalšími oxygenázami je aj vznik toxického methemoglobínu. Navyše, napriek značnej aktivite in vitro sú často iba slabými alebo neúčinnými inhibítormi in vivo pri perorálnom podávaní19), prípadne vykazujú toxické účinky vrátane genotoxicity. Vzhľadom na lipofilnú podstatu substrátu sú aj tieto inhibítory vo všeobecnosti malými lipofilnými molekulam typu fenolov (nordihydroguajaretová kyselina), chinónov, dihydrochinónov, kumarínov (eskuletín) alebo flavonoidov (cirsiliol).
Obr. 2. Štruktúry redoxných inhibítorov 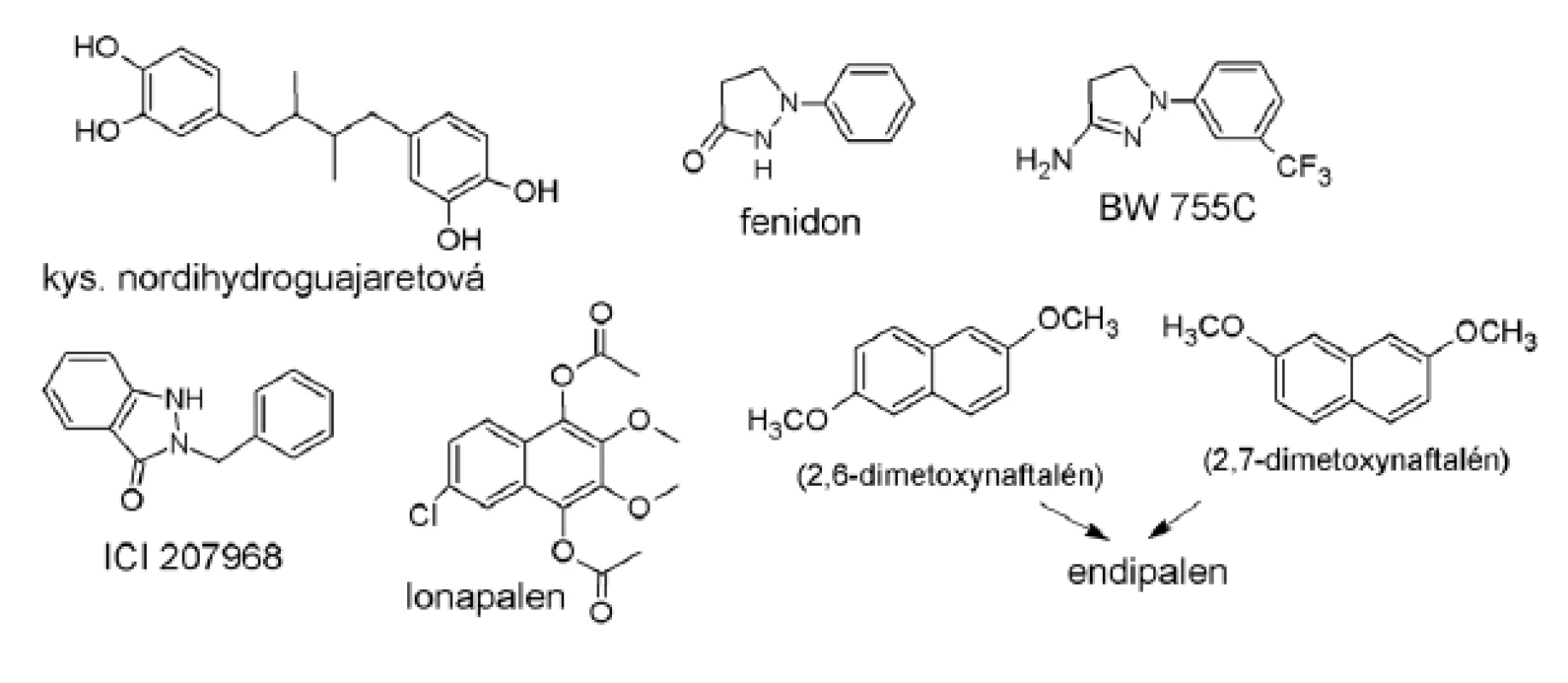
Okrem prírodných zlúčenín zaujímavé inhibičné účinky dosiahli deriváty pyrazolínu fenidón a BW 755C (časť Duálne inhibítory COX/5 LOX) a indazolínový derivát ICI 207968. Posledne menovaná zlúčenina vykazovala vysokú selektivitu pre 5-LOX s výraznými in vivo účinkami20).
Redoxné inhibítory práve z uvedených dôvodov nedosiahli uvedenie do terapeutickej praxe a boli sklamaním. Skupina redoxných inhibítorov nebola ďalej rozvíjaná s výnimkou lonapalenu a endipalenu, ktoré vykazujú efektivitu v liečbe psoriázy a nachádzajú sa v tretej fáze klinických štúdií21).
Nádeje sa vkladajú najmä do prírodných aromatických zlúčenín, najmä flavonoidov a ich derivátov, ktorých pôvod a redoxná schopnosť predurčuje ich terapeutické využitie. Navyše, mnohým flavonoidom sa pripisujú významné antioxidačné vlastnosti, pričom ich dlhodobé užívanie je historicky overené a bezpečné.
Chelátory železa
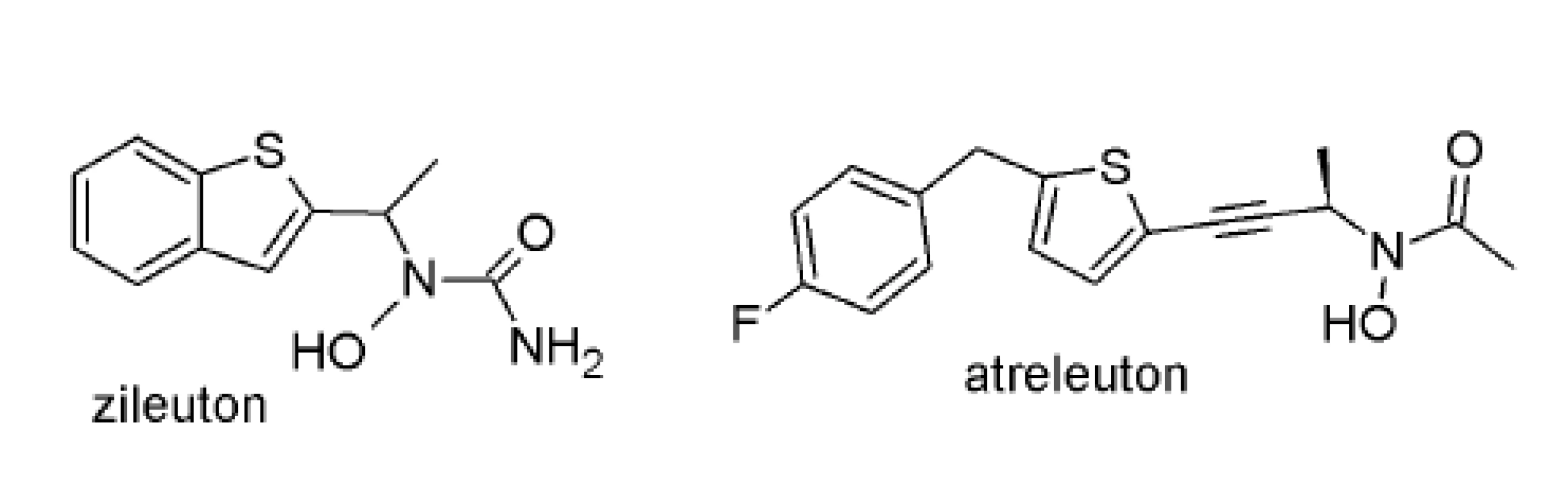
Najväčšie úspechy pri hľadaní netoxických neredoxných inhibítorov 5-LOX (obr. 3) predstavujú hydroxámové kyseliny a ich deriváty (Zileuton; ABT-761). Tieto zlúčeniny boli syntetizované s predpokladom chelatovať centrálny ión železa. Zileuton preukázal účinnosť v liečbe chronickej astmy najmä bronchodilatačným, protizápalovým a steroidy-šetriacim účinkom22). Náročnosť dávkovania (4-krát denne) a hepatotoxický účinok viedol k jeho stiahnutiu z terapeutickej praxe.
Druhú generáciu predstavuje atreleuton (s eliminačným polčasom 15-18 h), v súčasnosti v klinickom skúšaní pre využitie v liečbe aterosklerózy23).
FLAP inhibítory
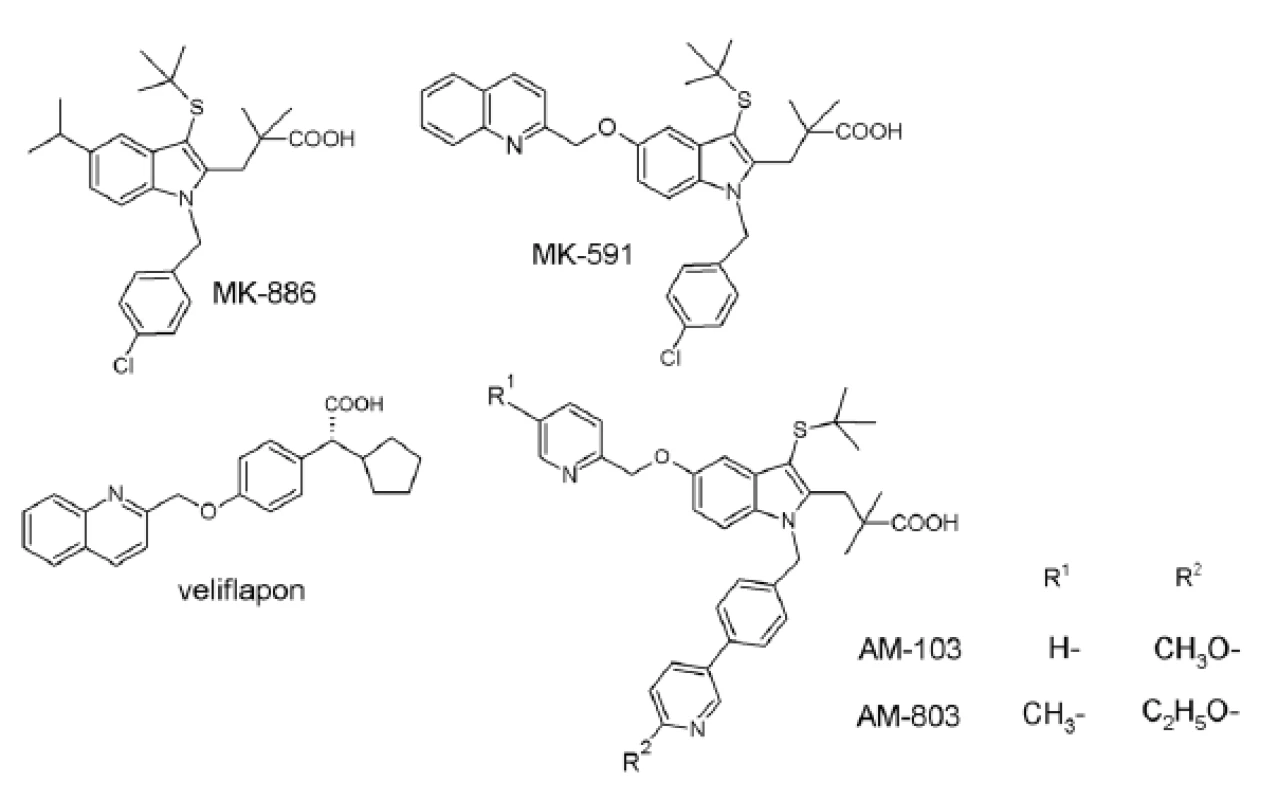
Mechanizmus účinku FLAP-u bol objavený až na základe testovania inhibítorov biosyntézy LT: indolového derivátu indometacínu (MK-886) a chinolín-indolového derivátu MK-59114). V súčasnosti sa využívajú vo výskume FLAP-u nakoľko nedosahovali účinnosť porovnateľnú s Cys-LT inhibítormi24).
Ďalší FLAP antagonista, veliflapon (chinolínový derivát), je v súčasnosti testovaný v súvislosti s kardiovaskulárnymi ochoreniami25). Na základe objasnenia 3D štruktúry FLAP-u sa vytvorili možnosti pre cielenú syntézu špecifických inhibítorov, čo vyústilo do objavu AM 10326) a AM-80324), ktoré sa v súčasnosti nachádzajú v druhej fáze klinických štúdií pre liečbu astmy (obr. 4).
Inhibítory LTA4-hydrolázy
Inhibítory LTA4-H sú buď analógmi LTA4, alebo inhibítormi dipeptidázovej aktivity enzýmu. Interakciu s LTA4-H preukázali kaptopril (ACE inhibítor), bestatín (inhibítor aminopeptidáz) a niektoré chelátory zinku (centrálny ión LTA4-H)27). Fázu 2 klinického výskumu zatiaľ dosiahol iba DG-051 (obr. 5) indikovaný u pacientov s anamnézou infarktu myokardu alebo ochoreniami koronárnych artérií (najmä aterosklerózou)28). DG-051 bol syntetizovaný na základe štruktúrnej analýzy LTA4-H.
Obr. 5. Zástupcovia inhibítorov LTA<sub>4</sub>-hydrolázy a antagonistov BLT receptorov 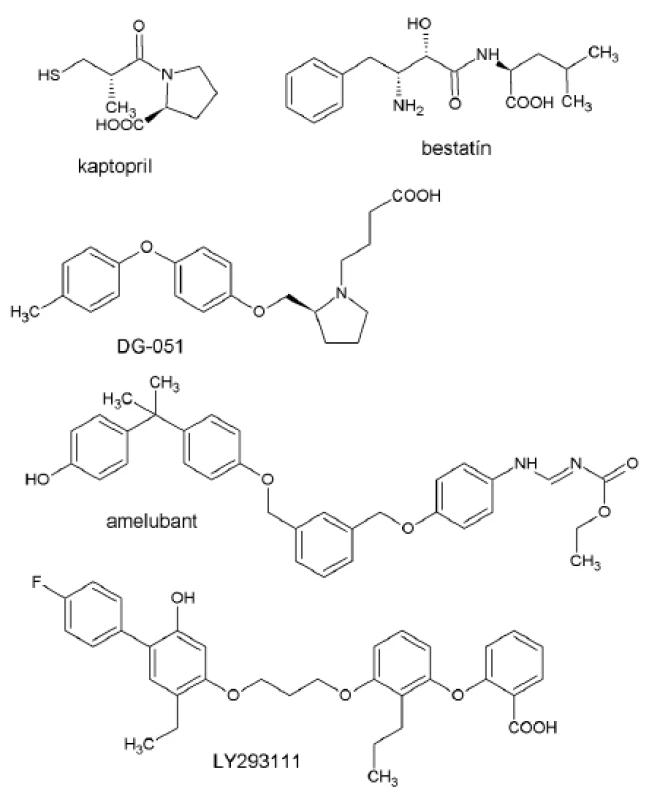
Antagonisty BLT receptorov
K liečbe zápalových ochorení sa v súčasnosti pristupuje aj ďalším mechanizmom, inhibíciou infiltrácie leukocytov do tkanív (napr. kĺbov, kože) sprostredkovanej leukotriénom B4 a jeho receptormi (BLT1 a BLT2). Výsledky z posledných rokov priniesli niekoľko zaujímavých zlúčenín.
Amelubant (obr. 5) je prodrug forma pre orálne dávkovanie so zanedbateľnou väzbou na BLT receptory, po metabolizovaní esterázami však poskytuje dva aktívne metabolity s antagonizmom voči obom BLT receptorom29). Amelubant inhibuje expresiu Mac-1 (CD11b/CD18) v neutrofiloch, u pacientov s reumatoidnou artritídou však nepreukázal výraznú efektivitu30). Potenciál tohto liečiva je stále v liečbe COPD a cystickej fibrózy31).
Najvážnejším kandidátom nového liečiva je LY293111, v súčasnosti v druhej fáze klinických štúdií, ktoré vykazuje antagonizmus voči BLT receptorom a agonizmus pre PPAR-γ. V kombinácii s gemcitabínom vykazuje zaujímavé protirakovinové účinky pri adenokarcinóme pankreasu32).
Antagonisty Cys-LT receptorov
Šesť rokov pred definovaním štruktúry leukotriénov bol objavený prvý Cys-LT antagonista, derivát acetofenónu FPL55712 (obr. 6), pôvodne vyvinutý ako antagonista SRS-A33). Napriek tomu, že nevykazoval vysokú špecificitu, stal sa základom výskumu vedúceho k súčasným vysoko selektívnym a účinným liečivám.
Obr. 6. Antagonisty Cys–LT receptorov 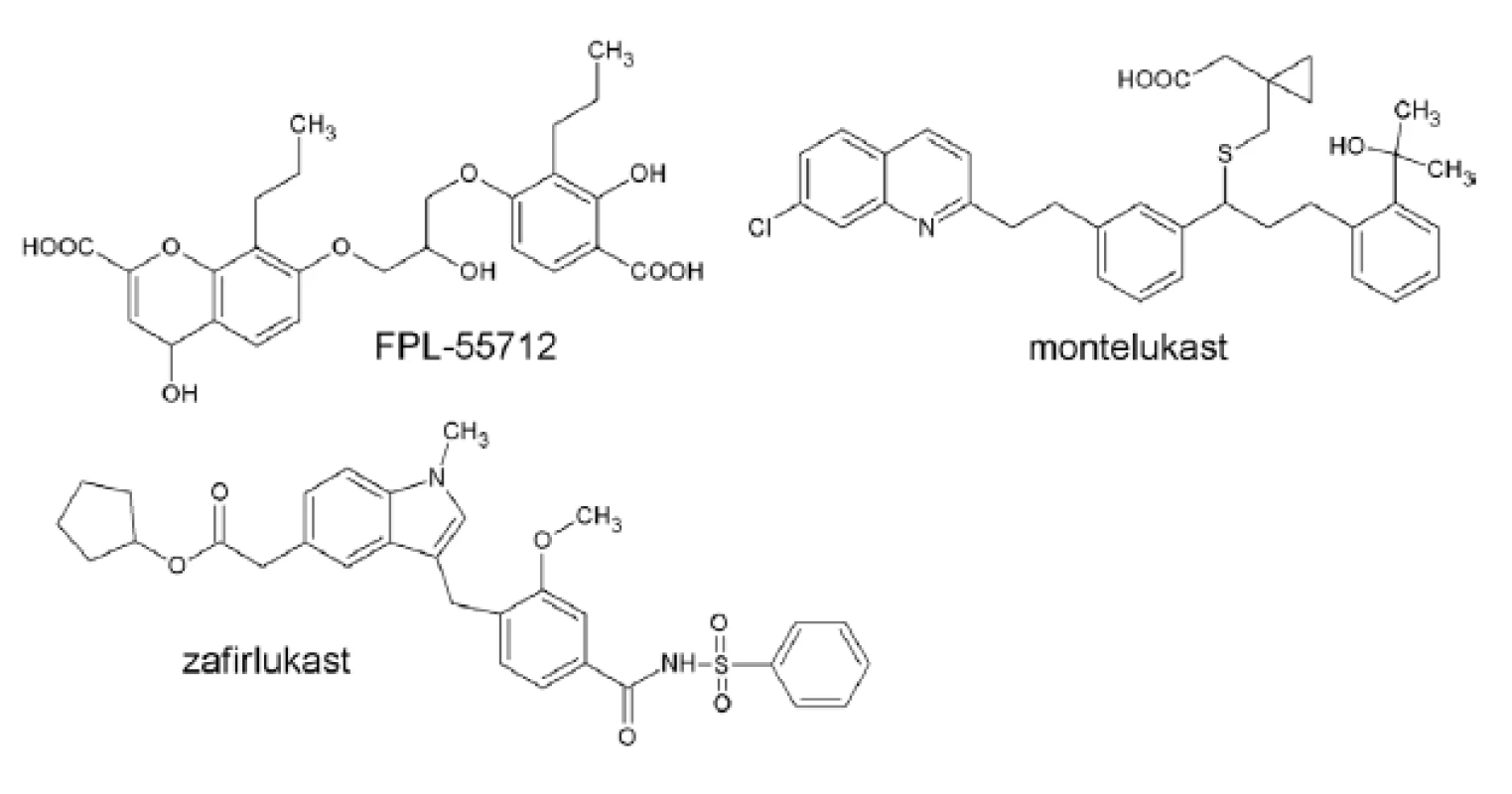
Zatiaľ najvýznamnejšími liečivami ovplyvňujúcimi leukotriénovú cestu, pôsobiace prostredníctvom selektívnej inhibície cys-LT1 receptora, sú montelukast (Singulair®, Merck & Co, NJ, USA), zafirlukast (Accolate®, AstraZeneca, Londýn, UK) a pranlukast (Onon®, Ono Pharmaceutical, Osaka, Japonsko), používané v liečbe bronchiálnej astmy a alergickej rinitídy. Výhodou týchto liečiv oproti bežnej liečbe astmy je zníženie potreby záchranných antiastmatík typu ß2-agonistov a kortikosteroidov. Práve nežiaduce účinky inhalačných kortikosteroidov, najmä u detí, viedli k zavedeniu montelukastu do terapeutickej praxe pre deti od 2. roku života.
Duálne inhibítory COX/5-LOX
Liečivá schopné inhibovať tak cyklooxygenázy (COX 1 a COX-2), ako aj 5-LOX boli navrhnuté za účelom zachovať aktivitu NSAIDs a súčasne vynechať ich hlavné nežiadúce účinky: redukciu tvorby gastroprotektívnych prostaglandínov a súčasné zvýšenie hladín prozápalových leukotriénov, ktoré prispievajú k patogenéze NSAID-indukovaného poškodenia mukózy žalúdočnej sliznice34). Posun bol zaznamenaný aj na základe sklamania zo selektívnych COX-2 inhibítorov (coxibov), ktorým sa po uvedení do terapeutickej praxe preukázala zvýšená incidencia kardiovaskulárnych komplikácií: infarktu myokardu a náhlej cievnej mozgovej príhody35).
Na základe 3D štruktúry enzýmu je v rámci súčasných poznatkov modelovania pomerne jednoduché navrhnúť liečivo selektívne sa viažuce na enzým. Navrhnúť liečivo, ktoré by inhibovalo súčasne dva odlišné enzýmy bez výraznej štrukturálnej podobnosti, je oveľa ťažšia úloha.
Tebufelon a darbufelon sú reprezentantmi skupiny di-terc-butylfenolov (obr. 7). Fenolová funkčná skupina im dodáva antioxidačné vlastnosti zodpovedné za protizápalové schopnosti a nízky ulcerogénny potenciál34). Darbufelon sa nachádza v tretej fáze klinického skúšania ako nové perorálne aktívne liečivo pre reumatoidnú artritídu36).
Obr. 7. Duálne inhibítory COX/5-LOX 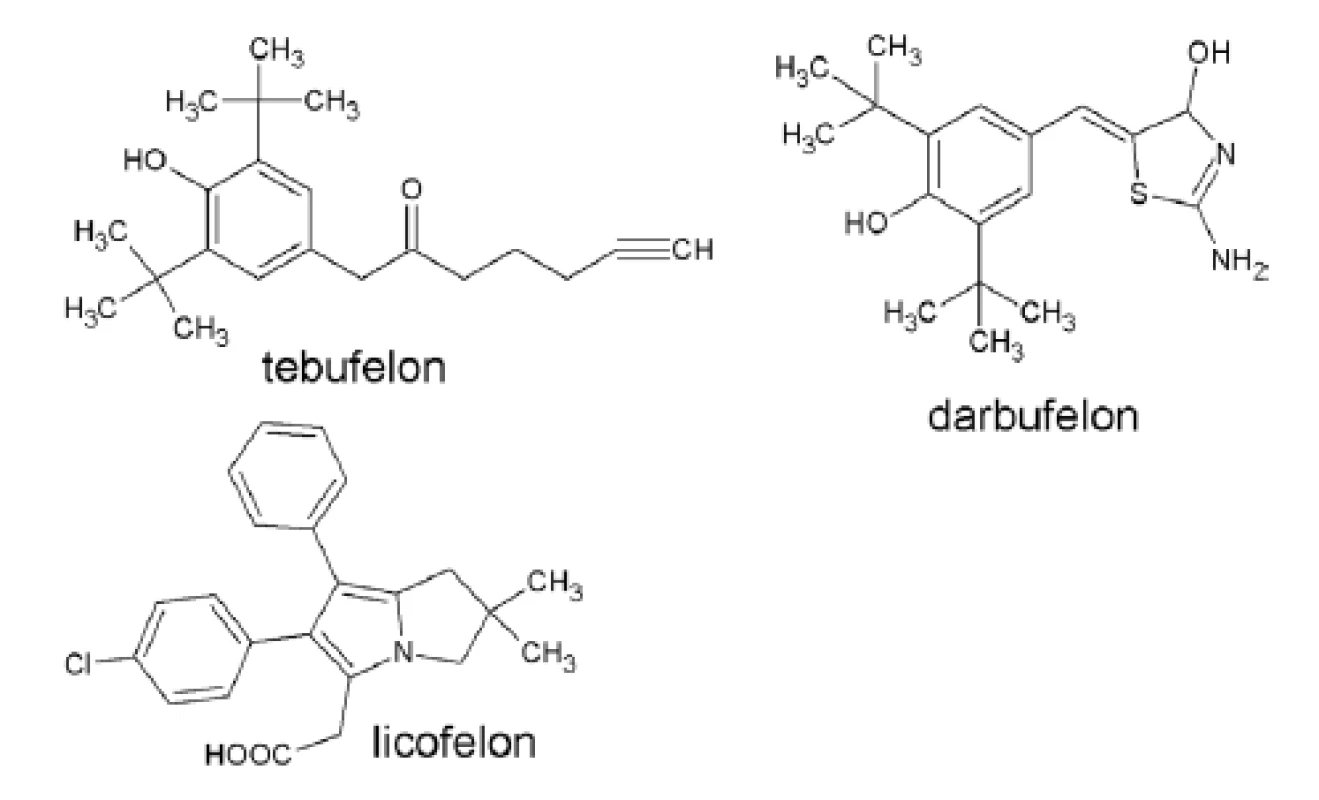
K duálnym COX/LOX inhibítorom zaraďujeme aj pyrazolínové deriváty fenidon a BW 755C pôsobiace ako redoxné inhibítory. Tieto malé lipofilné aromatické zlúčeniny sa používajú v rastlinných modeloch pri odhaľovaní významu lipoxygenáz v raste a obranných systémoch rastlín v odpovedi na environmentálny stres (pri napadnutí patogénmi)37).
V tretej fáze klinických štúdií pre liečbu osteoartritídy sa nachádza pyrolizínový derivát licofelon38). Na viacerých zvieracích modeloch preukázal protizápalový, analgetický a protiastmatický účinok bez poškodenia mukózy GIT39). V porovnaní s naproxénom (NSAID) vykazuje rovnakú efektívnosť redukcie symptómov osteoartritídy (najmä bolesti), výrazne však redukuje zmenšovanie objemu chrupky v kĺboch.
Záver
Hoci progres v tejto oblasti postúpil o veľký krok vpred, všetky signalizačné cesty leukotriénovej cesty tak vo fyziologických, ako aj patologických procesoch dosiaľ neboli objavené. Súčasne treba pripomenúť, že k derivátom kyseliny arachidónovej patria aj mnohé významné eikozanoidy (prostaglandíny, tromboxány a iné), preto aj ovplyvnenie leukotriénovej cesty vyvolá zmeny v ich tvorbe a aktivite ďalších enzýmov. Nové možnosti sa otvárajú aj v modulácii ďalších polohovo špecifických lipoxygenáz, ktorých produkty boli preukázané aj v mnohých fyziologických procesoch.
Zoznam skratiek
- AA – kyselina arachidónová
- BLT – receptor LTB4
- COPD – chronická obštruktívna pľúcna choroba
- COX – cyklooxygenáza
- cPLA2 – cytozolová fosfolipáza A2
- FLAP – proteín aktivujúci 5-lipoxygenázu
- GPCR – s G-proteínom spriahnuté receptory
- HETE – hydroxyeikozatetraénová kyselina
- HpETE – hydroperoxyeikozatetraénová kyselina
- IL – interleukín
- LOX – lipoxygenáza
- LT – leukotrién
- MAPEG – s membránou asociované proteíny v metabolizme eikozanoidov a glutatiónu
- mRNA – mediátorová ribonukleová kyselina
- NSAID – nesteroidné antiflogistiká
- PPAR – receptory aktivujúce proliferáciu peroxizómov
Konflikt záujmov: žiadny.
Došlo 4. apríla 2012 / Přijato 9. mája 2012
PharmDr. Peter Hoffman, L. Bezáková
Univerzita Komenského v Bratislave, Farmaceutická fakulta, Katedra bunkovej a molekulárnej biológie liečiv
Kalinčiakova 8, 832 32 Bratislava, Slovenská republika
e-mail: hoffman@fpharm.uniba.sk
Zdroje
1. Steinhilber, D., Fischer, A. S., Metzner, J., Steinbrink, S. D., Roos, J., Ruthardt, M., Maier, T. J.: 5-lipoxygenase: underappreciated role of a pro-inflammatory enzyme in tumorigenesis. Front Pharmacol. 2010; 1, doi: 10.3389//fphar.2010.00143
2. Folco G., Murphy R. C.: Eicosanoid transcellular biosynthesis: from cell-cell interactions to in vivo tissue responses. Pharmacol Rev 2006; 58, 1–14.
3. Sala A., Bolla M., Zarini S., Muller-Peddinghaus R., Folco G.: Release of leukotriene A4 versus leukotriene B4 from human polymorphonuclear leukocytes. J Biol Chem 1996; 271, 17944–17948.
4. McGee J. E., Fitzpatrick , F. A.: Erythrocyte-neutrophil interactions: formation of leukotriene B4 by transcellular biosynthesis. Proc Natl Acad Sci, 1986; 83, 1349–1353.
5. Maclouf J. A., Murphy R. C.: Transcellular metabolism of neutrophil-derived leukotriene A4 by human platelets: a potential cellular source of leukotriene C4. J Biol Chem, 1988; 263, 174–181.
6. Grimminger F., Sibelius U., Seeger W.: Amplification of LTB4 generation in AM–PMN cocultures: transcellular 5-lipoxygenase metabolism. Am J Physiol, 1991; 261, L195 – L203.
7. Montuschi P., Sala A., Dahlén S. E., Folco G.: Pharmacological modulation of the leukotriene pathway in allergic airway disease. Drug Discov Today, 2007; 12, 404–412.
8. Kamohara M., Takasaki J., Matsumoto M., Matsumoto S. I., Saito T., Soga T., Matsushime H., Furuichi K.: Functional characterization of cysteinyl leukotriene CysLT2 receptor on human coronary artery smooth muscle cells. Biochem Biophys Res Commun, 2001; 287, 1088–1092.
9. Toda A., Yokomizo T., Shimizu T.: Leukotriene B4 receptors. Prostag Oth Lipid M, 2002; 68-69, 575–585.
10. Yokomizo T., Kato K., Hagiya H, Izumi T, Shimizu T.: A pilot study examining the role of zileuton in atopic dermatitis. Ann Allergy Asthma Immunol, 1997; 83, 620–624.
11. Bäck M., Bu D. X., Bränström R. Sheikine Y., Yan Z. Q., Hansson G. K.: Leukotriene B4 signaling through NF-kappaB-dependent BLT1 receptors on vascular smooth muscle cells in atherosclerosis and intimal hyperplasia. Proc Natl Acad Sci USA, 2005; 102, 17501-17506.
12. Werz O., Steinhilber D.: Therapeutic options for 5–lipoxygenase inhibitors. Pharmacol Therapeut, 2006; 112, 701–718.
13. Khanapure S. P., Garvey D. S., Janero D. R., Letts L. G.: Eicosanoids in inflammation: biosynthesis, pharmacology, and therapeutic frontiers. Curr Top Med Chem, 2007; 7, 311–340.
14. Gillard J., Ford-Hutchinson A. W., Chan C., Charleson S., Denis D., Foster A., Fortin R., Leger S., McFarlane C. S., Morton H. et al.: L–663,536 (MK–886) (3–[1-(4-chlorobenzyl)-3-t-butyl-thio-5–isopropylindol-2-yl]-2,2-dimethylpropanoic acid), a novel, orally active leukotriene biosynthesis inhibitor. Can J Physiol Pharmacol, 1989; 67, 456–464.
15. Radmark O., Samuelsson B.: Regulation of the activity of 5–lipoxygenase, a key enzyme in leukotriene biosynthesis. Biochem Biophys Res Commun, 2010; 396, 105–110.
16. Bäck, M.: Inhibitors of the 5–lipoxygenase pathway in atherosclerosis. Curr Pharm Design, 2009; 15, 3116–3132.
17. Zaitsu M., Hamasaki Y., Matsuo M., Kukita A., Tsuji K., Miyazaki M., Hayasaki R., Muro E., Yamamoto S., Kobayashi I., Ichimaru T., Kohashi O., Miyazaki S.: New induction of leukotriene A4 hydrolase by interleukin-4 and interleukin–13 in human polymorphonuclear leukocytes. Blood, 2000; 96, 601–609.
18. Sampson A. P.: Leukotriene C4 synthase: the engine of aspirin intolerance? Clin Exp Allergy, 2011; 41, 1050–1053.
19. Young R. N.: Inhibitors of 5-lipoxygenase: a therapeutic potencial yet to be fully realized? Eur J Med Chem, 1999; 34, 671–685.
20. Bruneau P., Delvare C., Edwards M. P., McMillan R. M.: Indazolines, a new series of redox-active 5-lipoxygenase inhibitors with built-in selectivity and oral activity. J Med Chem, 1991; 34, 1028–1036.
21. Black A. K., Camp R. D. R., Derm F. F., Mallet A. I., Cunningham F. M., Hofbauer M., Greaves M. W.: Pharmacologic and clinical effects of lonapalene (RS-43179), a 5-lipoxygenase inhibitor, in psoriasis. J Invest Dermatol, 1990; 95, 50–54.
22. Liu M. C., Dube L. M., Lancaster J.: Acute and chronic effects of a 5-lipoxygenase inhibitor in asthma: a 6-month randomized multicenter trial. J Allergy Clin Immunol, 1996; 98, 859–871.
23. Tardif J. C., L’Allier P. L., Ibrahim R., Gregoire J. C., Nozza A., Cossette M., Kouz S., Lavoie M. A., Paquin J., Brotz T. M., Taub R., Pressacco J.: Treatment with 5-lipoxygenase inhibitor VIA-2291 (Atreleuton) in patients with recent acute coronary syndrome. Circulation, 2010; 3, 298–307.
24. Sampson A. P.: FLAP inhibitors for treatment of inflammatory diseases. Curr Opin Investig Drugs, 2009; 10, 1163–1172.
25. Hakonarson H., Thorvaldsson S., Helgadottir A., Gudbjartsson D., Zink F., Andresdottir M. et al.: Effects of a 5-lipoxygenase-activating protein inhibitor on biomarkers associated with risk of myocardial infarction: a randomized trial. JAMA, 2005; 293, 2245–2256.
26. Bain G., King C. D., Rewolinski M., Schaab K., Santini A. M., Shapiro D., Moran M., Rooij S. W., Roffel A. F., Schulenga-Hut P., Milne G. L. et al.: Pharmacodynamics and pharmacokinetics of AM103, a novel inhibitor of 5-lipoxygenase-activating protein (FLAP). Clin Pharmacol Ther, 2010; 87, 437–444.
27. Penning T. D.: Inhibitors of leukotriene A4 (LTA4) hydrolase as potential anti-inflammatory agents. Curr Pharm Design, 2001; 7, 163–179.
28. Sandanayaka V., Mamat B., Bhagat N., Bedell L., Halldorsdottir G., Sigthorsdottir H., Andrésson P., Kiselyov A., Gurney M., Singh J.: Discovery of novel leukotriene A4 hydrolase inhibitors based on piperidine and piperazine scaffolds. Bioorg Med Chem Lett, 20, 2010; 20, 2851–2854.
29. Diaz-Gonzalez F., Alten R. H. E., Bensen W. G., Bown J. P., Sibley J. T., Dougados M., Bombardieri S., Durez P., Ortiz P., de-Miquel G., Staab A. et al.: Clinical trial of a leukotriene B4 receptor antagonist, BIIL 284, in patients with rheumatoid arthritis. Ann Rheum Dis, 2007; 66, 628–632.
30. Alten R., Gromnica-Ihle E., Pohl C., Emmerich J., Steffgen J., Roscher R., Sigmund R., Schmolke B., Steinmann G.: Inhibition of leukotriene B4-induced CD11B/CD18 (Mac–1) expression by BIIL 284, a new long acting LTB4 receptor antagonist, in patients with rheumatoid arthritis. Ann Rheum Dis, 2004; 63, 170–176.
31. Hicks A., Monkarsh S. P., Hoffman A. F., Goodnow R. Jr.: Leukotriene B4 receptor antagonists as therapeutics for inflammatory disease: preclinical and clinical developments. Expert Opin Investig Drugs, 2007; 16, 1909–1920.
32. Saif M. W., Oettle H., Vervenne W. L., Thomas J. P., Spitzer G., Visseren–Grul C., Enas N., Richards D. A.: Randomized double-blind phase II trial comparing gemcitabine plus LY293111 versus gemcitabine plus placebo in advanced adenocarcinoma of the pancreas. Cancer J, 2009; 15, 339–343.
33. Augstein J., Farmer J. B., Lee T. B., Sheard P., Tattersall M. L.: Selective inhibitor of slow reacting substrate of anaphylaxis. Nat New Biol, 1973; 245, 215–217.
34. Charlier C., Michaux C.: Dual inhzibition of cyclooxygenase-2 (COX-2) and 5-lipoxygenase (5-LOX) as a new strategy to provide safer non-steroidal anti-inflammatory drugs. Eur J Med Chem, 2003; 38, 645–659.
35. Furberg C. D., Psaty B. M., Fitzgerald G. A.: Parecoxib, valdecoxib, and cardiovascular risk. Circulation, 2005; 111, 249.
36. Bannwarth B.: Is licofelone, a dual inhibitor of cyclo-oxygenase and 5-lipoxygenase, a promising alternative in anti-inflammatory therapy? Fund Clin Pharmacol, 2004; 18, 125–130.
37. Peng J., van Loon J. J. A., Zheng S., Dicke M.: Herbivore-induced volatiles of cabbage (Brassica oleracea) prime defence in neighbouring intact plants. Plant Biol, 2011; 13, 276–284.
38. Raynauld J. P., Martel-Pelletier J., Bias P., Laufer S., Haraoui B., Choquette D., Bealieu A. D., Abram F., Dorais M., Vignon E., Pelletier J. P.: Protective effects of licofelone, a 5-lipoxygenase and cyclo-oxygenase inhibitor, versus naproxen on cartilage loss in knee osteoarthritis: a first multicentre clinical trial using quantitative MRI. Ann Rheum Dis, 2009; 68, 938–947.
39. Rotondo S., Dell’Elba G., Krauze-Brzósko K., Manarini S., Martelli N., Pecce R., Evangelista V., Cerletti C.: Licofelone, a dual lipoxygenase-cyclooxygenase inhibitor, downregulates polymorphonuclear leukocyte and platelet function. Eur J Pharmacol, 2002; 453, 131–139.
Štítky
Farmacie Farmakologie
Článek vyšel v časopiseČeská a slovenská farmacie
Nejčtenější tento týden
2012 Číslo 3- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
- Přerušovaný půst může mít významná zdravotní rizika
-
Všechny články tohoto čísla
- Pod ochranou sv. Dymphny – LIV. sympozium z historie farmacie a veterinární medicíny
- Modulácia leukotriénovej cesty – potenciálne ciele
- Mikrobiálne sekundárne metabolity ako inhibítory farmaceuticky významných oxidoreduktáz a transferáz
- Fenotypizace enzymů podílejících se na metabolismu léčiv
- SOLUTIO 2011
- Vysoce účinné potenciální antimykobakteriální látky proti Mycobacterium avium
-
Štúdium lokálnych anestetík – časť 197*
Vplyv xylitolu na farmaceutickú dostupnosť lidokaínu a tokové vlastnosti hydrogélov - Prof. RNDr. J. Čižmárik, PhD. – doctor honoris causa
- Doc. RNDr. Ingrid Tumová, CSc., jubiluje
- Životné jubileum docenta RNDr. Jozefa Sokolíka, CSc.
- Polyméry s molekulovými odtlačkami
- Extruze tavenin
- Inhibítory gamma-sekretázy v terapii Alzheimerovej choroby
- Česká a slovenská farmacie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Fenotypizace enzymů podílejících se na metabolismu léčiv
- Extruze tavenin
- Modulácia leukotriénovej cesty – potenciálne ciele
- Doc. RNDr. Ingrid Tumová, CSc., jubiluje
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání