-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Monitoring povrchové kontaminace cytotoxickými léčivy v nemocničních lékárnách České republiky
Monitoring of surface cytotoxic drugs in the environment of hospital pharmacies in the Czech Republic
The study aimed to determine the contamination with antineoplastic (cytotoxic) drugs in 15 hospital pharmacies in the Czech Republic and to investigate the relationship between the level of contamination and the work load (number of preparations per week reported by the given pharmacy staff). For this purpose, surface contamination of the most exposed locations within the preparation and storage areas was monitored. Monitored surfaces were wiped with a nonwoven swab moistened with acetate buffer (0.02 M, pH = 4). Wipers were then extracted in the same solution and analysed for cyclophosphamide and platinum contents by high-performance liquid chromatography with mass spectrometry (HPLC-MS) and inductively coupled plasma mass spectrometry (ICP-MS), respectively. From the total of 119 collected samples, 70 samples (59%) were positive for at least one of the analytes and 43 samples (36%) were positive for both compounds studied. In general, the levels of contamination were higher in the preparation rooms than in the storage areas. Furthermore, it was shown that contamination is more frequent in those pharmacies where high numbers of preparations are routinely processed. Nevertheless, individual levels of contamination seem to be influenced also by the staff dedication and spatial organization of working areas.
Key words:
antineoplastic agents – contamination – cyclophosphamide – platinum – pharmacy
Autoři: P. Odráška 1,2; L. Gorná 1; L. Doležalová 1; M. Oravec 2; J. Kuta 2; L. Bláha 1,2
Působiště autorů: Masarykův onkologický ústav Brno 1; Masarykova univerzita Brno, Přírodovědecká fakulta, RECETOX (Výzkumné centrum pro chemii životního prostředí a ekotoxikologii) 2
Vyšlo v časopise: Čes. slov. Farm., 2009; 58, 225-229
Kategorie: Původní práce
Souhrn
Cílem práce bylo zjistit úroveň kontaminace 15 českých a moravských nemocničních lékáren cytotoxickými léčivy a prostudovat souvislosti s intenzitou práce charakterizovanou průměrným počtem vykonaných příprav za týden. Tohoto cíle bylo dosaženo stanovením povrchové kontaminace nejčastěji exponovaného vybavení prostor, které jsou v lékárnách určeny pro přípravu a uskladnění cytotoxických léčiv. Odběr vzorků byl realizován pomocí stěrové metody využívající netkané textilie a acetátového pufru jako desorpčního a extrakčního roztoku (0,02 M, pH = 4). Získané extrakty byly analyzovány na přítomnost cyklofosfamidu a platiny metodami HPLC/MSMS (vysokoúčinné kapalinové chromatografie s tandemovou hmotnostní spektrometrií) a ICP/MS (hmotnostní spektrometrií s indukčně vázaným plazmatem). Z celkového počtu 119 odebraných vzorků bylo 70 vzorků (59 %) pozitivních alespoň na jeden analyt a 43 vzorků (36 %) bylo pozitivních na přítomnost obou sledovaných analytů. Při porovnání obou studovaných pracovních prostorů (skladu léčiv, přípravny) byla více zatíženým prostorem vždy přípravna cytotoxických léčiv, ve které se soustřeďuje intenzivní manipulace s nejvíce koncentrovanými léčivými přípravky. Dále bylo potvrzeno, že vyšší provozní vytížení zařízení (intenzita provozu, množství připravených léčiv k aplikaci) vede k nárůstu kontaminace pracovního prostředí, i když svoji roli hraje také zkušenost a uvědomělost personálu a stavební a prostorové dispozice a organizace pracoviště.
Klíčová slova:
cytostatika – kontaminace – cyklofosfamid – platina – lékárnaÚvod
Proces přípravy cytotoxických léčiv (CL) doznal během svého klinického využití mnohých změn, které se pozitivně projevily jak na kvalitě připravovaného léčiva, tak i na bezpečnosti práce a ochraně zdraví pracovníků nakládajících s nebezpečnými protinádorovými léčivy. Nicméně problematika kontaminace pracovního prostředí a expozice zdravotnického personálu je stále aktuální 1–3). Dle soudobého mínění je za současných podmínek v rámci profesní expozice CL nejvýznamnější dermální příjem těchto látek, ke kterému dochází v důsledku kontaktu pracovníků s kontaminovanými objekty (resp. jejich povrchem) 4–7). Dosavadní studie ukazují, že tuto cestu expozice pracovníků nelze vyloučit na žádném pracovišti bez ohledu na to, jak sofistikovaně je provoz organizován a jakou techniku mají tato pracoviště k dispozici.
Pro studium a sledování kontaminace pracovního prostředí CL byla vyvinuta řada metod. S ohledem na obecně nízké/stopové koncentrace, které jsou pro oblast profesní expozice CL charakteristické, jsou až na výjimky monitorovací aktivity podmíněny technicky velmi vyspělou a nákladnou instrumentací. Z nejčastěji používaných analytických technik lze jmenovat hmotnostní spektrometrii (MS) ve spojení s vysoce účinnou kapalinovou chromatografií (HPLC), které se užívá například pro stanovení cyklofosfamidu, ifosfamidu, doxorubicinu 8–10), nebo s plynovou chromatografií (GC) v případě stanovení cyklofosfamidu, ifosfamidu a fluorouracilu 11, 12). Další citlivou metodou analýzy cytostatik s obsahem platiny je hmotnostní spektrometrie s indukčně vázaným plazmatem, případně polarografie 13,14).
Cílem této studie bylo porovnat kontaminaci různých pracovních ploch (deska pracovního stolu, podlaha, madlo lednice, telefon, kliky materiálových propustí (MP)) ve většině nemocničních lékáren na území České republiky, které připravují CL v souladu s požadavky Státního ústavu pro kontrolu léčiv. Studie byla realizována v období listopad až prosinec 2008. V rámci studie byla monitorována kontaminace v devíti moravských a šesti českých lékárnách zajišťujících přípravu CL.
POKUSNÁ ČÁST
Předmět monitoringu
Této studie se účastnilo celkem 15 nemocničních lékáren; přehled jednotlivých pracovišť udává obrázek 1. Vzorky byly odebírány z prostor sloužících pro uskladnění a přípravu CL. V rámci skladovacích prostor byla obvykle vzorkována plocha stolu, na kterém se přejímají CL od dodavatelů, podlaha před tímto stolem, skladovací police, madlo lednice a sluchátko telefonu. V čistých (aseptických) prostorách přípravny CL byla vzorkována podlaha pod výstupní komorou izolátoru, dveře materiálové propusti spojující přípravnu CL se zbytkem lékárny a plocha stolu sloužícího pro balení připravených CL. Ohledně posledně jmenované plochy nutno dodat, že balení připravených CL často neprobíhá přímo v aseptické přípravně nýbrž až v přilehlé místnosti po výstupu CL z přípravny. Samotné vzorkování bylo prováděno autory studie, kteří osobně daná pracoviště navštívili a ve spolupráci s místními pracovníky vzorky odebrali. Všechny lékárny byly vybaveny aseptickou přípravnou CL s izolátorem, jak to vyžaduje vyhláška č. 84/2008 Sb., kterou se stanoví správná lékárenská praxe.
Obr. 1. Přehled nemocničních lékáren České republiky začleněných do studie 1 – Fakultní nemocnice Na Bulovce v Praze, 2 – Fakultní nemocnice Motol v Praze, 3 – Fakultní Thomayerova nemocnice s poliklinikou v Praze, 4 – Všeobecná fakultní nemocnice v Praze, 5 – Krajská nemocnice Liberec, 6 – Sdružené zdravotnické zařízení Krnov, 7 – Slezská nemocnice v Opavě, 8 – Fakultní nemocnice Ostrava, 9 – Mendelova lékárna Nový Jičín, 10 – Fakultní nemocnice Brno, 11 – Fakultní nemocnice u sv. Anny, 12 – Masarykův onkologický ústav, 13 – Nemocnice T. G. Masaryka Hodonín, 14 – Nemocnice Znojmo, 15 – Nemocnice Jihlava 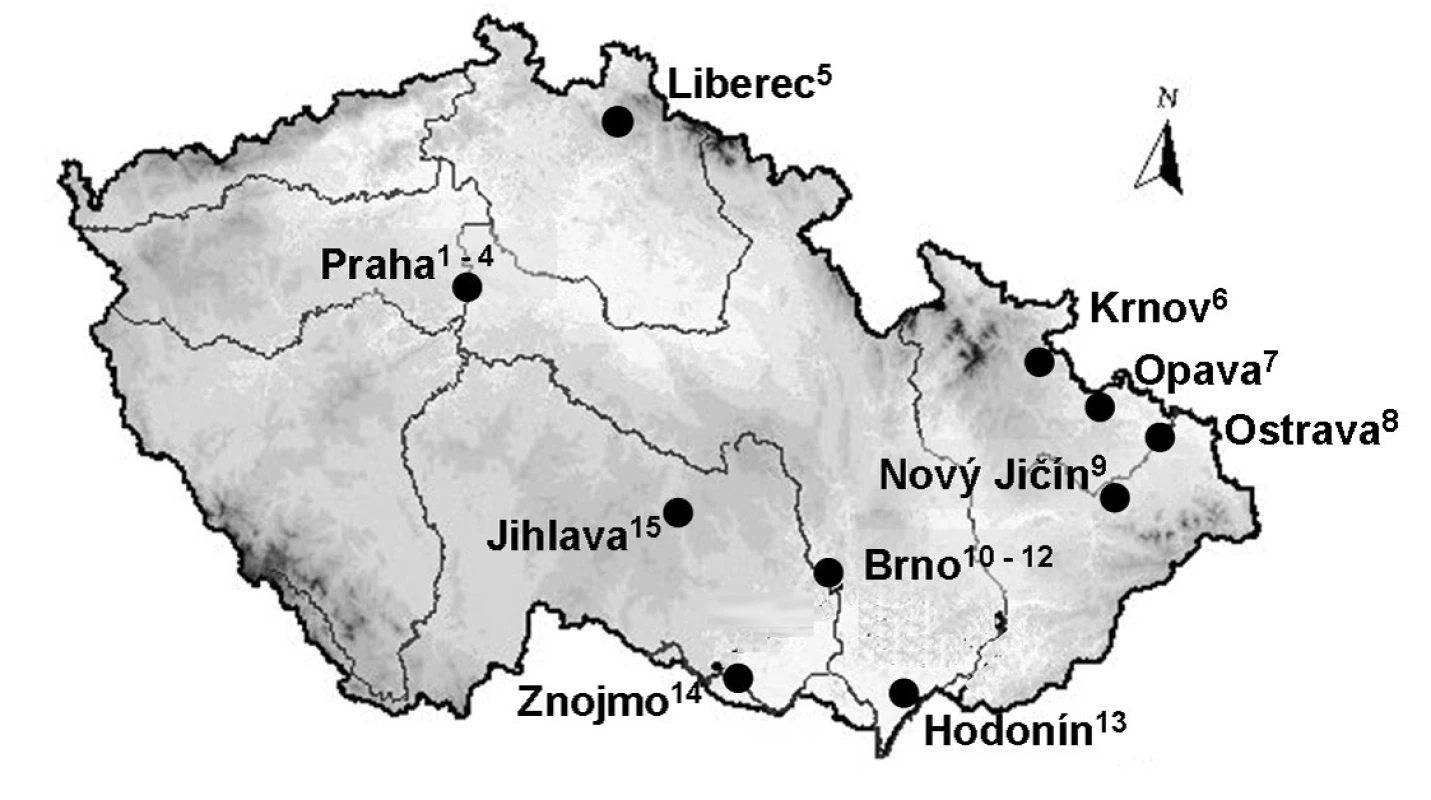
Odběr a příprava vzorku
Pro stěry ploch byla využita metodika využitá v rozsáhlé studii v Německu 2) tak, aby bylo dosaženo srovnatelných výsledků. Stěr byl z vybrané plochy odebrán pomocí stěrky z netkané textilie (Mesoft, 7,5 × 7,5 cm) navlhčené 0,75 ml 20 mM acetátového pufru (pH = 4). Použitá stěrka byla extrahována na ultrazvukové lázni v udaném acetátovém pufru přidaném ke vzorku do konečného objemu 25 ml (doba extrakce = 30 minut). Získaný extrakt byl centrifugován (10 minut, 20 tis. × g) a podroben kvantitativní analýze na přítomnost cyklofosfamidu a platiny (informující o množství cytotoxických léčiv s obsahem tohoto prvku, zejména cisplatiny, karboplatiny a oxaliplatiny).
Stanovení cyklofosfamidu
Pro stanovení cyklofosfamidu v připraveném extraktu byl využit kapalinový chromatograf (Agilent HP1200 HPLC System) v tandemu s hmotnostním detektorem (Agilent 6410 TripleQuad). Analýzy probíhaly v režimu gradientové eluce na koloně ZORBAX SB-18 (2,1 × 30 mm, 3,5 μm) temperované na teplotu 30 °C a za použití mobilní fáze připravené z acetátového pufru (0,02 M, pH = 4) a acetonitrilu. V průběhu každé analýzy (t = 6 min) bylo zastoupení acetonitrilu v mobilní fázi lineárně zvyšováno z původních 10 na 25 %. Hmotnostní detekce byla založena na sledování iontového přechodu 261 → 140 (m/z). Limity detekce a kvantifikace této metody činí 2,5 a 8 ng cyklofosfamidu/stěr. Výtěžnost a opakovatelnost metody je shrnuta v tabulce 1.
Tab. 1. Parametry opakovatelnosti a výtěžnosti analytických metod pro cyklofosfamid (HPLC/MS) a cisplatinu (ICP/MS) 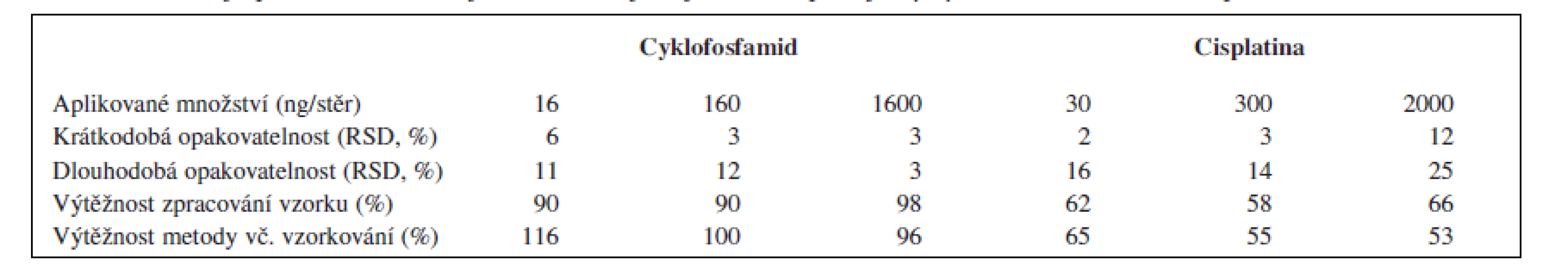
RSD – relativní směrodatná odchylka Stanovení platinových léčiv
Stanovení platinových komplexů se zakládá na kvantifikaci celkového množství platiny ve vzorku metodou hmotnostní spektrometrie s indukčně vázaným plazmatem (Agilent ICP-MS System 7500ce). Vzhledem k neselektivnímu charakteru této metody jsou získané výsledky prezentovány ve formě sumárních množství prvkové platiny na vzorek. Připravené extrakty byly před samotnou analýzou naředěny 1% HCl v poměru 1 : 14. K detekci se využívá sledování izotopů Pt 194 a 195. Limity detekce a kvantifikace této metody činí 0,3 a 1 ng platiny/stěr. Výtěžnost a opakovatelnost této metody byla charakterizována pro nejčastěji používané platinové léčivo (cisplatinu) a je shrnuta v tabulce 1.
VÝSLEDKY
Hodnocení výtěžnosti a opakovatelnosti metody prokázalo její velmi dobrou použitelnost pro stanovení cyklofosfamidu (tab. 1). U platiny jsou hodnocené parametry méně uspokojivé (opakovatelnost do 25 %, výtěžnost 50–60 %), nicméně stále přijatelné. Na zjištěných výsledcích se patrně nejvíce projevilo složení extrakčního roztoku, které více vyhovuje prvnímu z obou analytů. Omezenou výtěžnost metody pro platinová cytostatika však do velké míry kompenzuje vysoká citlivost použité analytické metody (limit detekce 0,3 ng Pt/stěr).
V rámci provedené studie bylo odebráno celkem 119 vzorků. Z tohoto množství bylo 70 vzorků (59 %) pozitivních alespoň na jeden analyt a 43 vzorků (36 %) pozitivních na přítomnost obou sledovaných analytů. Sumarizace dat popisující množství cyklofosfamidu a platiny nalezených na povrchu jednotlivých objektů je uvedena v tabulce 2 a 3.
Tab. 2. Kontaminace monitorovaných ploch a objektů v pracovním prostředí nemocničních lékáren České republiky cyklofosfamidem<sup>1</sup> 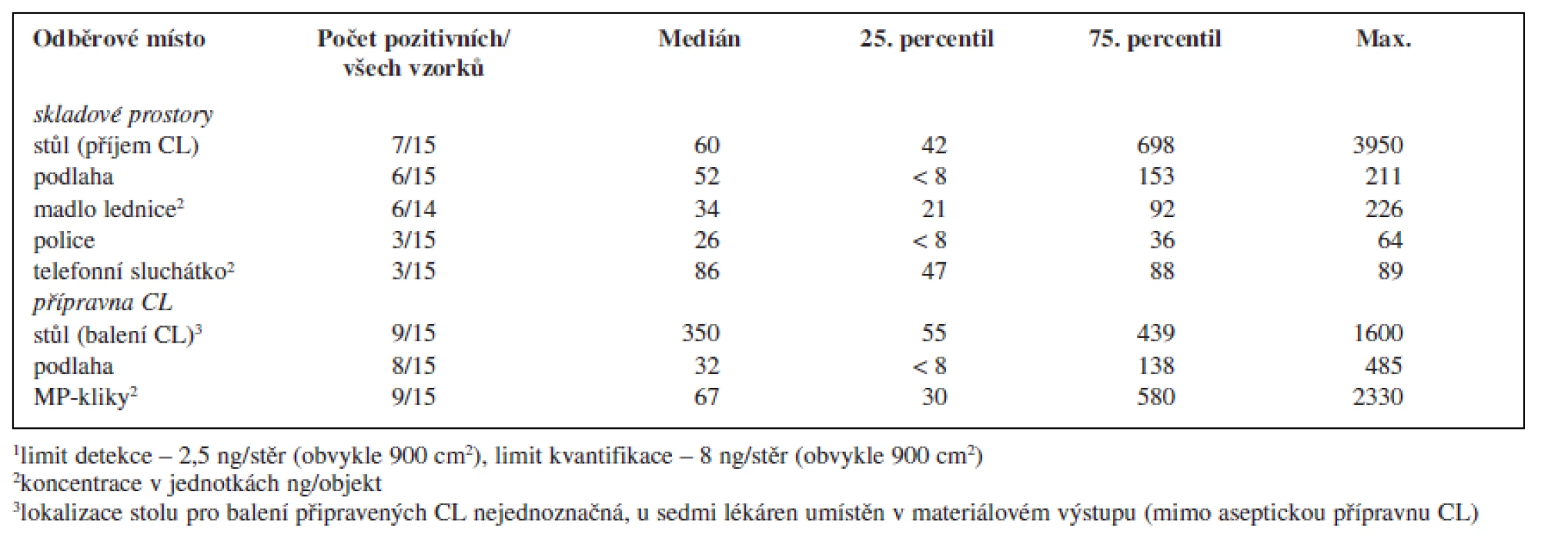
Tab. 3. Kontaminace monitorovaných ploch a objektů v pracovním prostředí nemocničních lékáren České republiky platinovými cytostatiky<sup>1</sup> 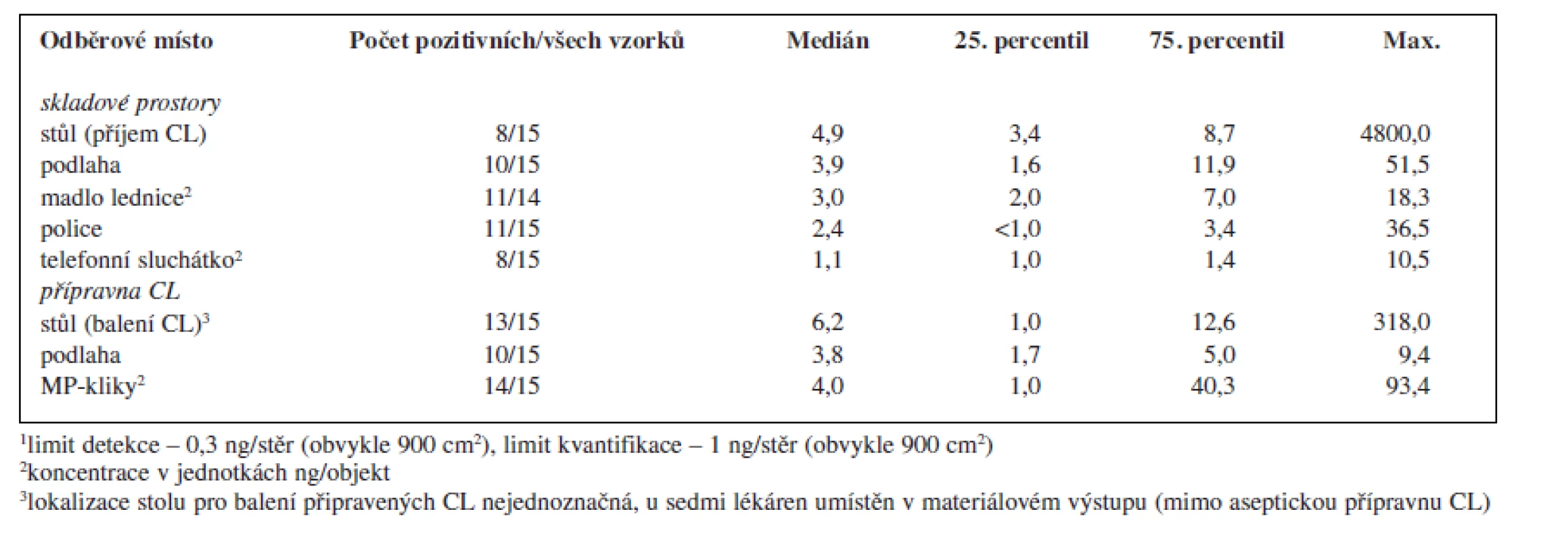
Na obrázku 2 je znázorněna souvislost mezi intenzitou provozu (průměrný počet všech chemoterapií připravených lékárnou za běžný týden – údaj deklarovaný vedoucími jednotlivých lékáren) a celkovou kontaminací cyklofosfamidem a platinou. Vzhledem k rozsahu naměřených koncentrací (přes tři řády) je tato celková kontaminace pracoviště vyjádřena číslem udávajícím umístění daného pracoviště v žebříčku, který srovnává výsledky všech zúčastněných pracovišť (jde o průměrnou hodnotu všech umístění, kterých dané pracoviště dosáhlo pro jednotlivá sledovaná místa/objekty; 1 – nejnižší, 15 – nejvyšší koncentrace, N = 15 zúčastněných lékáren).
Obr. 2A,B. Souvislost mezi intenzitou provozu (počet příprav všech CL za týden) a úrovní kontaminace cyklofosfamidem (A) a platinovými CL (B) Kontaminace pracoviště je reprezentována průměrným umístěním daného pracoviště v žebříčku sestaveném podle pořadí kontaminace; 1 – průměrná nejnižší kontaminace, 15 – průměrná nejvyšší kontaminace. Přímka naznačuje hranici minimální kontaminace dané pracovním vytížením. 
DISKUSE
Porovnáme-li oba studované pracovní prostory, byla kontaminací častěji a více zatížená přípravna CL, ve které se soustřeďuje intenzivní manipulace s nejvíce koncentrovanými léčivými přípravky. Koncentrace v přípravně CL řádově dosahovaly až několika μg CL/vzorek (plocha 30 × 30 cm) a v porovnání se skladovacími prostory byly tyto hodnoty zpravidla o jeden řád vyšší. K nejvíce kontaminovaným povrchům patřily kliky materiálových propustí spojující přípravnu CL s okolními prostory lékárny a povrch stolu určeného pro balení (zatavování) připravených CL do ochranné fólie. Tato skutečnost může představovat problém především pro ta pracoviště, která tento stůl mají umístěný v prostoru mimo vlastní přípravnu, kde zpravidla nebývají kladeny takové nároky na bezpečnost práce a ochranu zaměstnanců před expozicí CL. V rámci prostor mimo přípravnu CL byla vysoká kontaminace zjištěna na stole sloužícím k přejímání zásilek CL od dodavatelů a k jejich vybalování (tab. 2).
Velké rozdíly byly nalezeny i mezi jednotlivými pracovišti. V souladu s dohodou uzavřenou s účastníky studie řešitelé studie konkrétní hodnoty vztahující se ke konkrétním pracovištím neposkytují. Obecně však lze konstatovat, že kontaminace pracoviště do určité míry souvisí s intenzitou provozu (obr. 2A,B). Zejména u výsledků pro cyklofosfamid (obr. 2A) je zřetelně vidět, že zatímco u málo vytížených lékáren je možné kontaminaci držet pod limity detekce použitých analytických metod, u více vytížených lékáren existuje určitá minimální kontaminace, která se s narůstajícím počtem připravovaných dávek postupně zvyšuje (přímka na obrázcích 2A,B).
K vlivu intenzity provozu se také často přirozeně připojují i další faktory, které tuto „bazální“ kontaminaci mohou zvyšovat. Nejčastěji jde o dodržování hygieny práce, zkušenost a uvědomělost personálu a také stavební/prostorové dispozice pracoviště a organizace provozu. Tyto aspekty mohou zvyšovat kontaminaci především u menších lékáren, které se poté úrovní kontaminace blíží (či občas i předčí) i největším lékárnám.
V porovnání se světovou literaturou jsou námi nalezené výsledky z České republiky dobře srovnatelné například s nálezy studií provedených v Německu 11), v USA a Kanadě 15), či ve Švédsku 16). Řádově shodné hodnoty povrchové kontaminace nalezli též Vandenbrouck a Robays v Belgii 17). Hlavní přínos posledně jmenované studie spočívá v paralelní realizaci tzv. biomonitoringu (tj. sledování exkrece cyklofosfamidu v moči zaměstnanců monitorované lékárny). U čtyř ze šesti sledovaných farmaceutických asistentů a lékárníků byly odebrané vzorky pozitivní s kumulativní exkrecí 0,11–17,75 μg cyklofosfamidu za 24 hodin. Na základě informací o exkreci/příjmu cyklofosfamidu zdravotnickými pracovníky a s využitím metodiky pro hodnocení zdravotních rizik dle P. J. M. Sessinka 18) bylo výsledné riziko vzestupu pravděpodobnosti vzniku nádorových onemocnění (leukémie a nádory močového měchýře) odhadnuto na 240–39 000 případů/milion exponovaných pracovníků (dle konkrétních hodnot exkrece).
Za mezní akceptovatelné riziko se přitom obecně uvažuje hranice 100 případů/milion osob a jeden toxikant 19). Z toho plyne, že při současné úrovni kontaminace může u některých pracovníků dojít až k 400násobnému zvýšení rizika vzniku nádorů nad přijatelnou míru rizika. K Vandenbrouckeově studii 17) je však nutno kriticky dodat, že uvedená maximální exkrece 17,7 μg cyklofosfamidu/24 hodin je mezi ostatními literárními údaji velmi vysokou a zcela ojedinělou hodnotou. Publikované hodnoty exkrece cyklofosfamidu zpravidla nepřesahují hodnotu 1 μg/24 hodin 18, 20, 21). Avšak i tyto hodnoty jsou stále násobně vyšší (10–20×) než hodnoty odpovídající tolerovatelnému riziku 19).
Závěrem lze konstatovat, že kontaminace pracovního prostředí CL byla potvrzena u všech z 15 navštívených nemocničních lékáren. Naše studie prokázala detekovatelné hladiny obou analytů na různých pracovištích v hladinách dosahujících až několika mikrogramů/stěr (cca 900 cm2) a tyto hladiny kontaminace jsou srovnatelné s údaji ve světové odborné literatuře. Relativně lepší situace byla prokázána u lékáren s nízkým pracovním zatížením (menší počty připravovaných CL) a potažmo i časovým stresem (dostatek času, který umožňuje pečlivý přístup k jednotlivým přípravám).
Vzhledem ke skutečnosti, že cytotoxická léčiva nelze v současné době nahradit méně nebezpečnými přípravky, je celosvětovým trendem snaha postupně snižovat profesní expozici (a potažmo i kontaminaci pracovního prostředí) na co nejnižší úroveň. Cílem našeho kolektivu je pak podpořit tuto snahu prováděním systematického monitoringu, který kromě informačního významu přinese i zpětnou vazbu na prováděná nápravná opatření.
Z hlediska prevence profesní expozice CL lze doporučit důsledné používání všech osobních ochranných prostředků (zejména chemoprotektivních rukavic a pracovních oděvů s dlouhými rukávy). Důležitým faktorem je také striktní oddělení prostor vyhrazených pro manipulaci s CL od prostor sloužících pro kancelářské a provozní účely.
Studie vznikla s podporou projektu Národního programu výzkumu II - CYTO (2B06171) „Výzkum profesní zátěže zdravotnických pracovníků nakládajících s cytotoxickými léčivy v chronických prahových a podprahových expozicích“. Autoři vyjadřují své díky doc. RNDr. Zdeňku Šimkovi, CSc. a Mgr. Jiřímu Machátovi, Ph.D. za cenné připomínky a pomoc při zavádění metod analýz cytotoxických léčiv a všem partnerům z nemocničních lékáren České republiky, kteří se zapojili do realizace monitorovací studie.
Došlo 9. září 2009 / Přijato 20. října 2009
Adresa pro korespondenci:
Mgr. Pavel Odráška
Oddělení laboratorní medicíny, Masarykův onkologický ústav
Žlutý kopec 7, 656 53 Brno
e-mail: odraska@mou.cz
Zdroje
1. Hedmer, M., Tinnerberg, H., Axmon, A., Jonsson, B. A. G.: Int. Arch. Occup. Environ. Health, 2008; 81, 899–911.
2. Heinemann, A., Hadtstein, C.: ASUpraxis, 2009; 44, 37–39.
3. Wieringa, A., van Staveren, M. C., van der Aart-van der Beek, A., Visser, T.: Europ. J. Hosp. Pharm., 2008; 14, 94–95.
4. Kromhout, H., Hoek, F., Uitterhoeve, R., Huijbers, R., Overmars, R. F., Anzion, R., Vermeulen, R.: Ann Occup Hyg, 2000; 44, 551–560.
5. McDevitt, J. J., Lees, P. S. J., McDiarmid, M. A.: J. Occup. Environ. Med., 1993; 35, 57–60.
6. Sessink, P. J. M., Timmersmans, J. L., Anzion, R. B. M., Bos, R. P.: J. Occup. Environ. Med., 1994; 36, 79–83.
7. Sessink, P. J. M., Vandekerkhof, M. C. A., Anzion, R. B. M., Noordhoek, J., Bos, R. P.: Arch. Environ. Health, 1994; 49, 165–169.
8. DiFrancesco, R., Griggs, J. J., Donnelly, J., Di Cenzo, R.: J. Chromatogr. B, 2007; 852, 545–553.
9. Hedmer, M., Jonsson, B. A. G., Nygren, O.: J. Environ. Mon., 2004; 6, 979–984.
10. Minoia, C., Turci, R., Sottani, C., Schiavi, A., Perbellini, L., Angeleri, S., Draicchio, F., Apostoli, P.: Rapid Commun. Mass Spectrom., 1998; 12, 1485–1493.
11. Schmaus, G., Schierl, R., Funck, S.: Am. J. Health. Syst. Pharm., 2002; 59, 956–961.
12. Sessink, P. J. M., Scholtes, M. M., Anzion, R. B. M., Bos, R. P.: J. Chromatogr. Biomed. Appl., 1993; 616, 333–337.
13. Nygren, O., Gustavsson, B., Strom, L., Eriksson, R., Jarneborn, L., Friberg, A.: J. Environ. Mon., 2002; 4, 739–742.
14. Turci, R., Sottani, C., Ronchi, A., Minoia, C.: Toxicol. Lett., 2002; 134, 57–64.
15. Connor, T. H., Anderson, R. W., Sessink, P. J. M., Broadfield, L., Power, L. A.: Am. J. Health. Syst. Pharm., 1999; 56, 1427–1432.
16. Hedmer, M., Georgiadi, A., Bremberg, E. R. M., Jonsson, B. A. G.: Ann. Occup. Hyg., 2005; 49, 629–637.
17. Vandenbroucke, J., Robays, H.: J. Oncol. Pharm. Pract., 2001; 6, 146–152.
18. Sessink, P. J. M., Kroese, E. D., Vankranen, H. J., Bos, R. P.: Int. Arch. Occup. Environ. Health, 1995; 67, 317–323.
19. Čupr, P., Koptíková, J., Šantroch, J., Bartoš, T., Bednářová, Z., Mužík, J., Holoubek, I., Dušek, L.: Klin. onkol., 2007; 20, 190–196.
20. Hirst, M., Mills, D., Tse, S., Levin, L., White, D.: The Lancet, 1984; 323, 186–188.
21. Sessink, P. J. M., Boer, K. A., Scheefhals, A. P. H., Anzion, R. B. M., Bos, R. P.: Int. Arch. Occup. Environ. Health, 1992; 64, 105–112.
Štítky
Farmacie Farmakologie
Článek Pandemic (H1N1) 2009Článek Srovnání ledvinné akumulace [DOTA0, 1-Nal3]-oktreotidu značeného vybranými kovovými radionuklidyČlánek OpravaČlánek AUTORSKÝ REJSTŘÍKČlánek VĚCNÝ REJSTŘÍK
Článek vyšel v časopiseČeská a slovenská farmacie
Nejčtenější tento týden
2009 Číslo 5-6- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Metody přípravy mikročástic ve farmaceutické technologii
- Pandemic (H1N1) 2009
- Hypolipidemický účinek obsahových látek amarantu
- Antimykobakteriálna aktivita nových derivátov arylkarbonyloxyaminopropanolov
- Srovnání ledvinné akumulace [DOTA0, 1-Nal3]-oktreotidu značeného vybranými kovovými radionuklidy
- Adhezivita větvených plastifikovaných oligoesterů
- Vliv technologie přípravy na uvolňování theofylinu z pelet s chitosanem
- Monitoring povrchové kontaminace cytotoxickými léčivy v nemocničních lékárnách České republiky
- Příspěvek k vývoji reklamy ve farmacii I
- Příspěvek k dějinám lékáren Milosrdných bratří na území dnešního Slovenska v prvních desetiletích 20. století
- Sledování vybraných jakostních parametrů parenterální výživy AIO – pilotní studie
- Oprava
- K životnému jubileu doc. RNDr. Zuzany Vitkovej, PhD.
- XXV. lékárnické dny Litoměřice, 3.–5. října
- AUTORSKÝ REJSTŘÍK
- VĚCNÝ REJSTŘÍK
- Česká a slovenská farmacie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Metody přípravy mikročástic ve farmaceutické technologii
- Příspěvek k vývoji reklamy ve farmacii I
- Sledování vybraných jakostních parametrů parenterální výživy AIO – pilotní studie
- Hypolipidemický účinek obsahových látek amarantu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



