-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Prenatální diagnostika kardiálního postižení u lupus neonatorum
Prenatal diagnosis of cardiac manifestation associated with lupus neonatorum?
Transplacentar transfer of maternal anti-Ro and/or anti-La autoantibodies may result in cardiac disease such as heart block and cardiomyopathy. Complete congenital heart block is a rare but devastating condition of cardiac Neonatal Lupus and may result in heart failure and foetal death. Complete atrioventricular block is considered to be irreversible. It seems that maternal anti-Ro levels ant presence of anti-Ro52 component predict fetuses at high risk of immune-mediated cardiac complications. Maternally administered corticosteroids may limit the progression of the 1st or the 2nd atrioventricular block. However, the transition from normal sinus rhythm to the third-degree atrioventricular rhythm may be rapid (< 24 hours). Dexamethasone given during pregnancy may achieve normalization of prolonged atrioventricular conduction time interval and averts the progression to complete heart block, often used in combination with intravenous immunoglobulin administration. In fetuses with complete AV block, the effect of steroid treatment on outcome is not proven. Hydroxychloroquine treatment during preganancy has been associated with a decreased recurrence of cardiac Neonatal Lupus.
Keywords:
prenatal diagnosis – echocardiography – fetus – neonatal lupus – atrioventricular block
Autoři: V. Tomek; J. Gilík; J. Kovanda; K. Fiala; M. Jičínský
Působiště autorů: Dětské kardiocentrum 2. LF UK a FN Motol, Praha
Vyšlo v časopise: Čes. Revmatol., 27, 2019, No. 3, p. 136-143.
Kategorie: Přehledový článek
Souhrn
Transplacentární přenos mateřských autoprotilátek anti-Ro a anti-La může vést k onemocnění srdce zahrnující atrioventrikulární blokádu a kardiomyopatii. Kompletní atrioventrikulární blokáda plodu je závažným projevem kardiálního postižení u lupus neonatorum, které může vést k rozvoji srdečního selhání a až k intrauterinnímu úmrtí plodu.
Diagnostika atrioventrikulární blokády 1. až 3. stupně je pomocí ultrazvukového vyšetření poměrně snadná. Možnosti terapeutického ovlivnění kompletní atrioventrikulární blokády jsou v prenatálním období dosud výrazně limitované. Konverze úplné formy atrioventrikulární blokády na sinusový rytmus není možná. Léčba plodů s již vzniklou kompletní blokádou pomocí glukokortikoidů (dexamethason) nepřináší prokazatelný pozitivní efekt pro plod ani pro novorozence. Nejlepší možností zábrany vzniku atrioventrikulární blokády je preventivní léčba vyžadující sledování a správnou stratifikaci vysoce rizikové skupiny těhotných, zřejmě dle přítomnosti a výše titru anti-Ro52 kDa. Atrioventrikulární blokádu 1. stupně lze stanovit echokardiografickým měřením plodů rizikových těhotných. K rozvoji atrioventrikulární blokády ale může dojít velmi rychle, a to i v průběhu několika hodin. Preventivní podání glukokortikoidů s transplacentárním přenosem může zabránit rozvoji kompletní formy, často v kombinaci s imunoglobuliny. Hydroxychlorochin je slibným lékem v prevenci kardiálního postižení u lupus neonatorum..
Klíčová slova:
prenatální diagnóza – echokardiografie – plod – lupus neonatorum – atrioventrikulární blok
ÚVOD
Transplacentární přenos mateřských autoprotilátek anti-Ro a anti-La může vést k onemocnění srdce zahrnující atrioventrikulární (AV) blokádu a kardiomyopatii. Kompletní AV blokáda (AVB) plodu je závažným projevem kardiálního postižení u lupus neonatorum, které může vést k rozvoji srdečního selhání a až k intrauterinnímu úmrtí plodu (1). Anti-Ro a anti-La jsou autoprotilátky proti extrahovaným nukleárním antigenům a jsou přítomné u pacientů se systémovým onemocněním (systémový lupus erythematodes – SLE, Sjögrenův syndrom a další). Tyto mateřské protilátky přestupují placentou do oběhu plodu a vyvolávají zánět v oblasti AV uzlu vedoucí k postupnému vývoji AV blokády. K té dochází typicky mezi 20. až 24. gestačním týdnem. O proběhlém zánětu v oblasti AV uzlu svědčí fibrotická přestavba uzlu u kongenitálního AVB 3. stupně (2). V kombinaci s hydropsem a nízkou komorovou frekvencí (pod 55/min) představuje vysoké riziko intrauterinního úmrtí nebo předčasného porodu (3). Ve zvláště nepříznivých případech může dojít až k progresi autoimunitně navozeného zánětu v endokardiální fibroelastózu (4, 5) a dilatační kardiomyopatii (6). Kompletní AVB se vyskytuje v 1–2 % plodů matek se séropozitivou anti-Ro, anti-La, což odpovídá incidenci 1/15 000 až 1/20 000 živě narozených dětí (7). Rizikem pro možný vývoj lupus neonatorum u plodu není jen samotná přítomnost autoprotilátek v krvi matky, ale vysoký titr anti-Ro autoprotilátek (8). Autoprotilátky anti-Ro 52 kDa mají (na rozdíl od anti-Ro 60 kDa) dominantní roli při vzniku AV blokády (9, 10).
Kompletní atrioventrikulární (AV) blokáda vede k bradykardii plodu. Srdeční frekvence při kompletní formě blokády se pohybují od 45 do 70/min. Lidský plod toleruje nízké srdeční frekvence lépe než vyšší, ale i tak může vést k srdečnímu selhání (obr. 1). Kumulativní neonatální a prenatální úmrtnost se udává mezi 10–30 % u plodů s AV blokádou (3). Hlavními rizikovými faktory úmrtí jsou: hydrops plodu, snížená funkce levé komory a nízké gestační stáří plodu v okamžiku diagnózy (3, 11, 12).
Obr. 1. Rozsáhlý hydrops u plodu s kompletní formou atrioventrikulární blokády ve 26. gestačním týdnu při tepové frekvenci 54/min
PP – pravá pleura, LP – levá pleura, P – perikard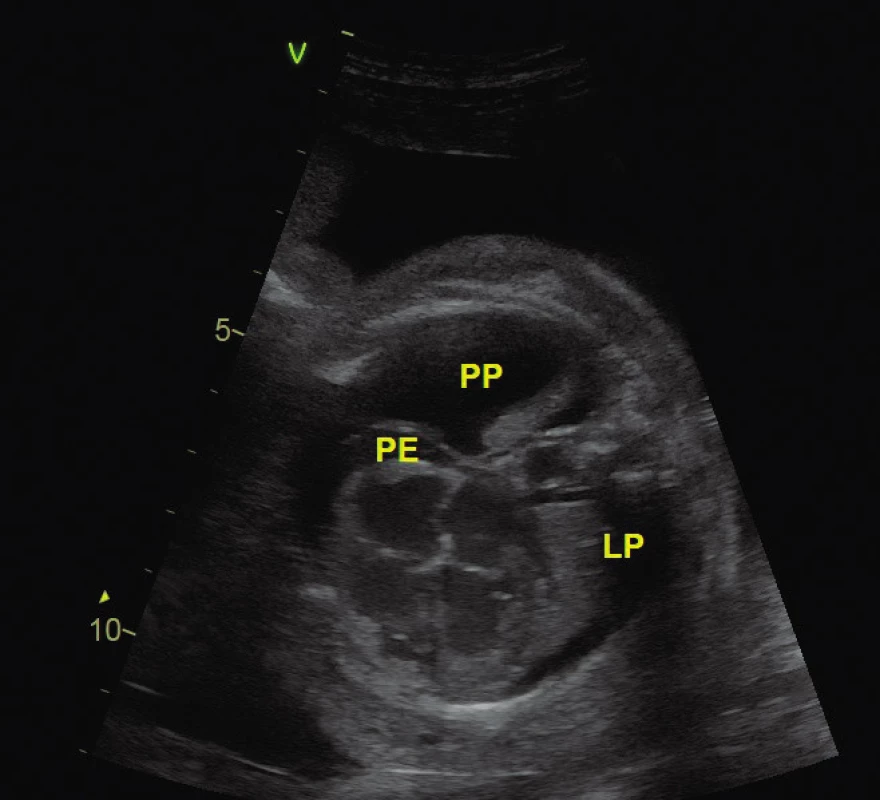
DIAGNOSTIKA ATRIOVENTRIKULÁRNÍ BLOKÁDY
Atrioventrikulární blokáda se vyznačuje bradykardií plodu a vzniká na základě poruchy vedení vzruchu. Ta může být způsobena buď změněnou funkcí iontových kanálů, nebo snížením počtu buněk převodního systému na podkladě fibrotizace a degenerativních změn. K poruše vedení vzruchů může dojít na úrovni atrioventrikulárního uzlu (suprahisálně), v oblasti Hisova svazku (intrahisálně) nebo infrahisálně až ve větvení na Purkyňova vlákna. Dle míry zachování AV převodu rozlišujeme tři stupně AV blokády (AVB):
- stupeň se zachovalým převodem poměrem převodu mezi síněmi a komorami 1 : 1, ale s prodloužením AV převodu (obr. 2)
- stupeň, kdy některé síňové kontrakce nejsou převedeny na komory. Rozlišujeme dva typy AVB 2. stupně:
- Wenckebachův typ, při kterém dochází k postupnému prodlužování PQ intervalu vedoucího až k výpadu AV převodu
- Mobitz II, kdy je výpadek převodu ze síní na komory náhlý (obr. 3, 4)
- stupeň je rovněž nazýván jako kompletní AV blokáda a je definován jako úplná disociace akce síní a komor. Výsledná tepová frekvence plodu je dána pouze frekvencí komor.
Obr. 2. Atrioventrikulární blokáda 1. stupně. Pulzní dopplerovské vyšetření simultánně registruje vtok a výtok z levé komory, prokazuje prodloužený mechanický atrioventrikulární interval 150 msec mezi kontrakcí síně (A) a kontrakcí komory (V).
E – fáze rychlého plnění komory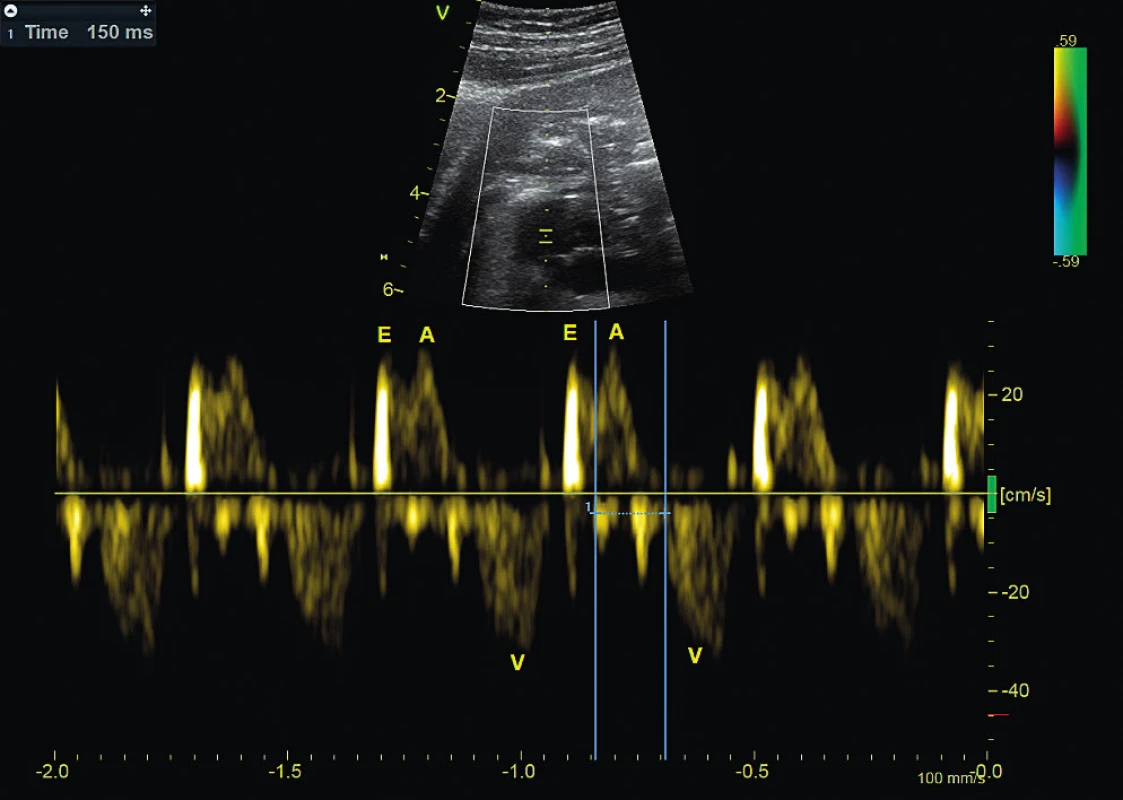
Obr. 3. Atrioventrikulární blokáda 2. stupně typu Mobitz II. Na komory (V) se převádí pouze každý druhý stah síní (A); pulzní dopplerovské vyšetření při simultánním zobrazení vtoku a výtoku levé komory
E – fáze rychlého plnění komory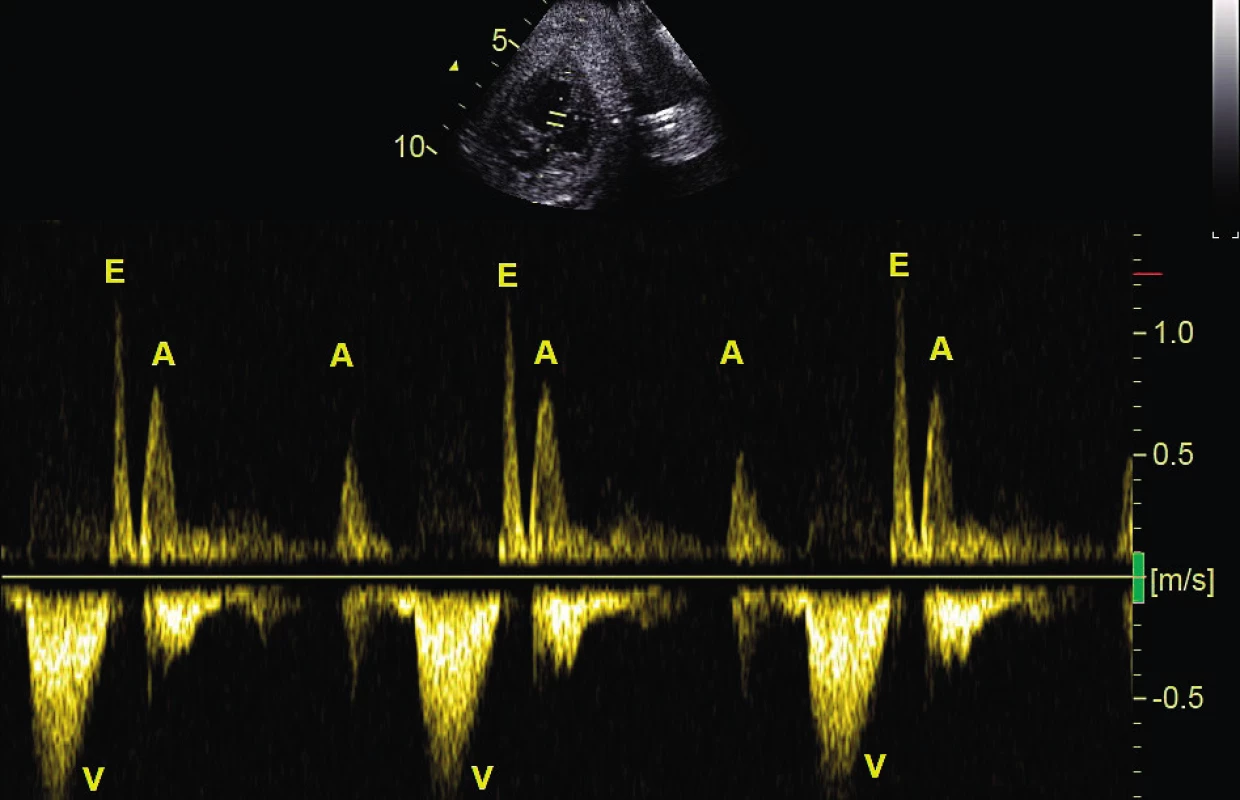
Obr. 4. Atrioventrikulární blokáda 2. stupně typu Mobitz II zachycena pomocí Mmode. Na komory (V) se převádí pouze každý druhý stah síní (A).
RA – pravá síň, LV – levá komora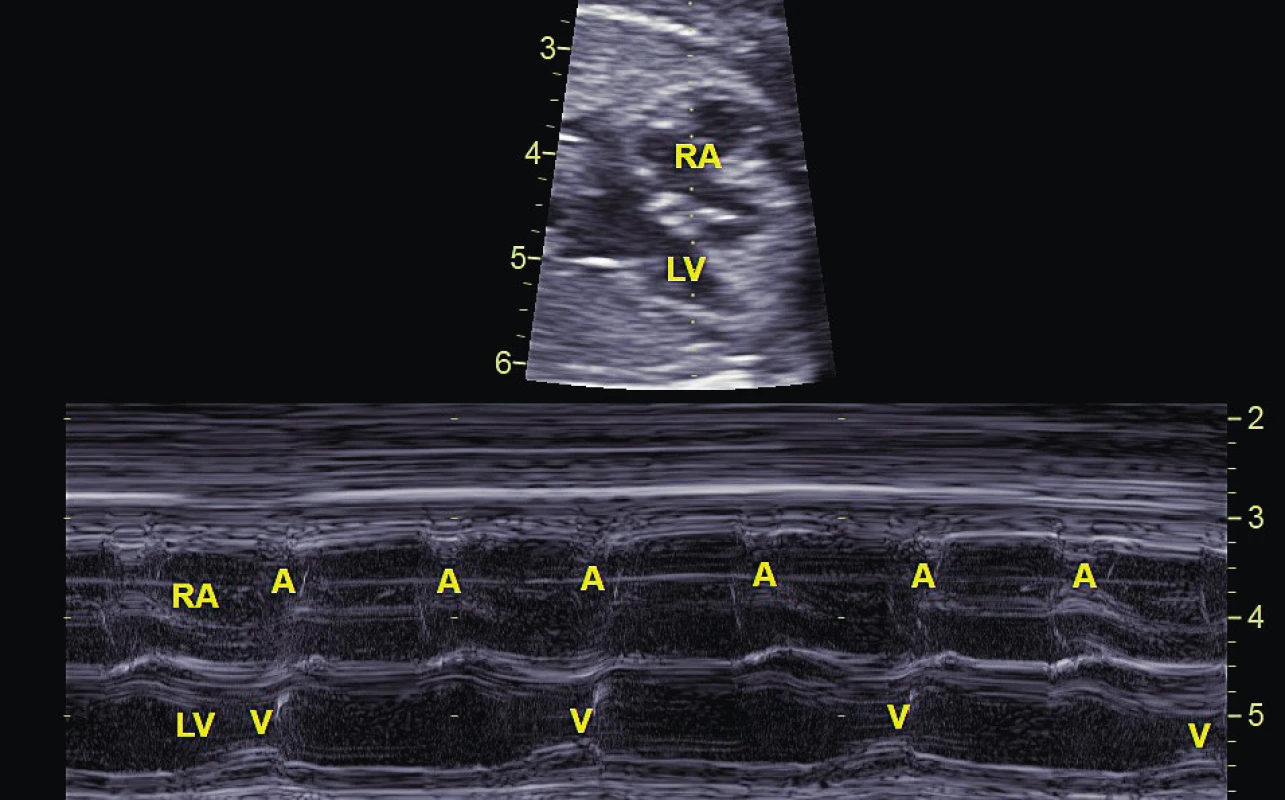
Diagnostika AV bloku spočívá v echokardiografickém vyšetření. Již ve 2D obraze je patrná pomalá frekvence komor při normálním sinusovém rytmu síní. Diagnózu lze ověřit dopplerovským vyšetřením nebo M-způsobem, kdy je možné simultánně registrovat kontrakci síní a komor (obr. 5).
Obr. 5. Kompletní atrioventrikulární blokáda u plodu registrovaná na úrovni levé komory (LV) a pravé síně (RA), echokardiografie M-způsob zobrazení detekující kontrakci síní (A) a komor (V). Pravidelný sinusový rytmus o frekvenci 120 tepů/min není převáděn na komory, které mají svoji vlastní aktivitu 62 tepů/min. 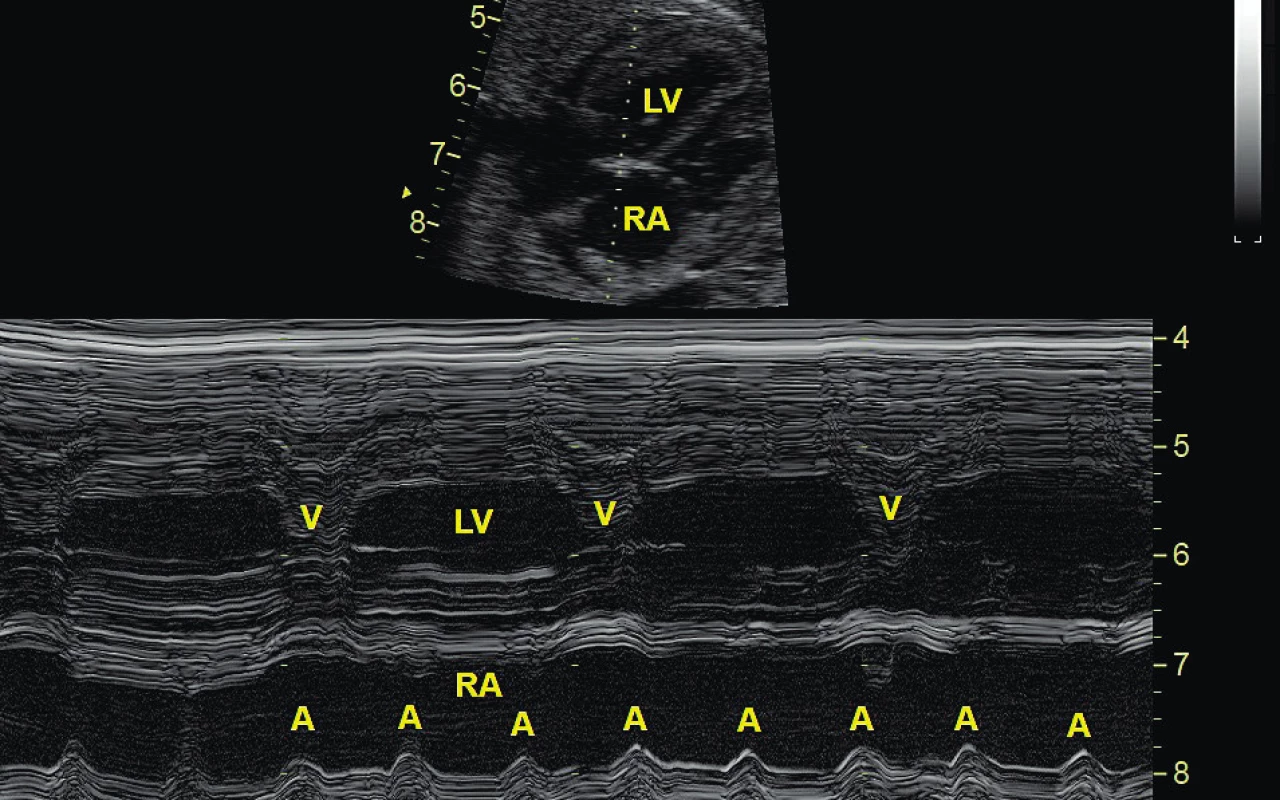
MOŽNOSTI LÉČBY KARDIÁLNÍHO POSTIŽENÍ LUPUS NEONATORUM U PLODU
Elektrická stimulace srdce
V postnatální léčbě AV blokády dominuje nefarmakologický přístup – elektrická stimulace srdce. Její princip spočívá v tvorbě nadprahových elektrických impulzů vedoucích k opakovanému dráždění (stimulaci) myokardu, odkud se srdeční vzruch šíří na ostatní tkáň. Trvalá kardiostimulace je v dnešní době vyzkoušenou a plně funkční metodou, která při správném nastavení stimulačního režimu a správně zvoleném umístění stimulačních elektrod umožňuje téměř fyziologickou aktivaci srdečního svalu. Nastavení kardiostimulátoru zabezpečí nejen správnou sekvenci aktivace síní a komor, ale zachová i vhodné synchronní šíření impulzu v obou komorách, včetně možnosti tzv. biventrikulární stimulace (stimulace obou komor s nastavitelným interventrikulárním intervalem). Moderní stimulační systém dokáže adekvátně frekvenčně reagovat na metabolické změny organizmu i pomocí metabolických senzorů (mechanické vibrace při fyzické zátěži, změně pH či saturace kyslíku v centrální žíle, tlaku v pravé komoře, délce repolarizace a řadě dalších parametrů) a zabezpečit srdeční výdej dle potřeb organizmu.
Prenatálně je elektrická stimulace srdce nemožná. Nutnost implantace stimulačních elektrod (intravaskulárně nebo epikardiálně) s použitím pacemakeru, by teoreticky byla optimální léčebnou metodou, ale je v současné době technicky nepředstavitelná. Jedinou možností je tedy pokus o farmakologické ovlivnění této závažné bradyarytmie.
Glukokortikoidy
Teoretický podklad léčby spočívá jednak v zabránění probíhajícího zánětu a fibrotizace atrioventrikulárního uzlu při prokázaném přenosu autoprotilátek od matky a zvýšení tepové frekvence plodu tak, aby se zlepšil srdeční výdej (13, 14). Podání fluoridovaných glukokortikoidů (dexamethason v dávce 4–8 mg/den) může zabránit progresi v AV blokádu 3. stupně, která je považována za ireverzibilní poškození. Byla prokázána úspěšná konverze AV blokády 2. stupně na sinusový rytmus (15). Konverze úplné AV blokády na sinusový rytmus nebyla prokazatelně dokumentována. Smysl aplikace glukokortikoidů (dexamethason 2–4 mg/den) při již kompletní AV blokádě byl spatřován v imunomodulačním efektu steroidní léčby a zabránění rozvoje autoimunitního zánětu myokardu a jeho další progresi v dilatační kardiomyopatii (14). Léčba glukokortikoidy ale musí být jasně indikována pro řadu nepříznivých důsledků pro plod, zejména pro vývoj mozku (16, 17). Předpoklad efektu transplacentární steroidní léčby se opíral především o práci Jaeggiho (18), který popsal pozitivní vliv dexamethasonu na osud plodu. Problémem této studie je však srovnání dvou rozdílných časových období – staršího bez kortikoterapie a mladšího s plody léčenými steroidy. Lze oprávněně namítnout, že mortalita novorozenců byla ovlivněna obecným zlepšením kvality péče a znevýhodnila historicky starší neléčené plody. V rámci multicentrické retrospektivní studie jsme neprokázali žádný rozdíl mezi léčenou a neléčenou skupinou plodů s již vzniklou kompletní AV blokádou (12). Naopak, těhotenství u léčených plodů bylo častěji ukončeno porodem sekcí a plody měly i nižší hmotnost, zřejmě v důsledku nižšího gestačního stáří. Ze sledovaných 175 plodů intrauterinně zemřelo deset a dalších 12 postnatálně (celková úmrtnost 13 %). Hlavním rizikovým faktorem mortality bylo gestační stáří plodu < 20 týdnů, frekvence komor < 50 tepů/min a snížená funkce levé komory. Při znalosti nežádoucích účinků glukokortikoidů na lidský plod, jejich neefektivní podávání při již vzniklé ireverzibilní AV blokádě, by mělo být podávání kortikoidů limitováno pouze na případy AV blokády 1. a 2. stupně.
Betamimetika
Osud těhotenství by mohlo zlepšit při poklesu srdeční frekvence podání β-sympatomimetik – terbutalinu nebo salbutamolu (13). Jejich použití pro zvýšení tepové frekvence plodu má opodstatnění ve zjištění, že nízké tepové frekvence < 55/min jsou spojeny s vysokým rizikem kardiální dekompenzace při nízkém srdečním výdeji. Jejich pozitivní efekt byl opakovaně prokázán. Ani tato léčba ale nedokáže vždy zajistit úpravu či prevenci srdečního selhání. Navíc často dochází po iniciálním zvýšení tepové frekvence k jeho opakovanému poklesu. Betamimetika mohou být v těhotenství špatně tolerována a výskyt palpitací, anxiozity či bolestí hlavy je častý.
Imunoabsorpce
Další možnou léčbou je extrakorporální imunoadsorpce. Cílem je selektivní odstranění imunoglobulinů G. Tato metoda byla úspěšně využita dosud jen na malých souborech a při kombinované léčbě (19). Její efekt je navíc pouze dočasný, při již vzniklé kompletní blokádě její benefit prokázán nebyl. Větší soubory efekt v zábraně vzniku kompletní AV blokády nijak neprokázaly (20).
Imunoglobuliny
Ani podávání imunoglobulinů matce nemá jednoznačně pozitivní efekt na osud plodů postižených neonatálním lupusem (21, 22). Role imunoglobulinů byla u plodu prokázána v ovlivnění kardiomyopatie, resp. „karditidy“, na obdobném mechanismu, jako je tomu při léčbě postnatální myokarditidy (21). AV blokádu imunoglobuliny ovlivnit nedokážou (23).
I když nedojde k úmrtí plodu, má novorozenec s kompletním AV blokem vysoké riziko implantace kardiostimulátoru (24) se všemi negativními důsledky (sternotomie s našitím epikardiálních elektrod, opakované výměny generátoru pacemakeru, riziko vývoje dilatační kardiomyopatie na podkladě proběhlé myokariditidy nebo indukované pacemakerem).
PREVENTIVNÍ LÉČBA
Úvahy o prevenci AV blokády se opírají o dokumentovanou konverzi neúplné formy blokády na sinusový rytmus (15). Aplikace kortikoidů matce může zvrátit progresi AV bloku 1. a 2. stupně ke kompletní formě, která je již ireverzibilní. Regrese kompletní AV blokády není spolehlivě prokázaná. Logicky správnou cestou by byla detekce plodů s AVB 1. stupně, kdy je prodloužený, ale stále zachovalý přenos vzruchu ze síní na komory. Vysoký výskyt (až 33 %) plodů s prodlouženým PQ intervalem séropozitivních matek byl dokumentován v jediném souboru (26), v dalších studiích nebyl potvrzen (27, 28). Z těchto studií navíc vyplývá, že fetální prodloužení PQ intervalu nepredikuje progresivní AV blokádu, a doklady o postupném rozvoji blokády jsou stále pouze předmětem ojedinělých kazuistik.
Na základě zkušeností a literárních údajů o zvýšeném riziku kompletní AV blokády u dalšího plodu (3, 6) jsme se rozhodli pro preventivní podávání transplacentárních glukokortikoidů u těhotných, které již v předchozí graviditě měly záchyt této arytmie. Postupovali jsme dle doporučení o léčebné dávce dexamethasonu (18). Tento postup jsme použili dosud celkem u 12 těhotných. Doufali jsme, že preventivní podání dexamethasonu jednoznačně zabrání vzniku AV blokády – již proto, že podobné léčebné schéma prokazatelně zastavilo rozvoj již probíhající nemoci (15, 26). Negativní zkušeností však bylo, že u 2/12 těhotných došlo k rychlé progresi AV bloku 3. stupně navzdory terapeutickým dávkám transplacentárně pronikajících gulokortikoidů. To poukazuje jednak na zjevně velikou agresivitu autoprotilátek, namířených proti AV uzlu, ale i na skutečnosti, že efektivita protizánětlivého účinku kortikoidů je značně omezená.
Nejlepší možnou prevencí kardiální postižení u lupus neonatorum plodu je zjevně efektivní léčba těhotné se systémovým onemocněním (29). Velmi slibným lékem v prevenci postižení plodu je hydroxychlorochin (Plaquenil), jak naznačily již pokusy na in vitro modelech. Limitované studie prokazují, že právě podávání léku používaného při léčbě malárie může snížit riziko vzniku AV blokády u plodu (30, 31).
DISPENZARIZACE TĚHOTNÉ
Bylo prokázáno, že hlavním rizikovým faktorem při vzniku AV blokády plodu je výše titru anti-Ro autoprotilátek, zejména anti-Ro 52 kDa. Jejich střední či významné zvýšení bylo signifikatně spojeno s vyšším rizikem AV blokády, nezávisle na titru anti-La autoprotilátek (8). Je tedy zřejmé, že právě tyto těhotné by měly být zvláště pečlivě sledovány.
Řada kazuistik a vlastní zkušenost ale jasně demonstrují, že k rozvoji kompletní AV blokády může dojít velmi rychle i za < 24 hodin (32). Z tohoto pohledu je frekvence sledování těhotných značně diskutabilní. Možným přístupem je domácí monitoring. Při něm si těhotná sama pomocí dopplerovského přístroje minimálně 2krát denně monitoruje srdeční frekvenci plodu. Při její nepravidelnosti či frekvenci mimo fyziologický limit je těhotná neprodleně vyšetřena a při průkazu AV blokády 1. nebo 2. stupně zahájena léčba kortikoidy a imunoglobuliny. Výsledky jsou velmi slibné, ale ani tak nedošlo k zábraně vzniku kompletní AV blokády u všech plodů (33).
VLASTNÍ ZKUŠENOSTI
V Dětském kardiocentru bylo v období 2001–2016 vyšetřeno a sledováno celkem 24 plodů s kompletní AV blokádou. Průměrná tepová frekvence v okamžiku diagnózy byla 58 ± 9,4 tepů/min. Diagnóza byla stanovena mezi 19. a 32. týdnem (medián 21 týdnů). Anti-Ro autoprotilátky byly přítomny u 18 z nich (75 %). Známky srdečního selhání byly přítomny u 15 z 24 plodů s AVB 3. stupně. Jedno těhotenství bylo ukončeno na základě přání rodičů a dva plody odumřely při rozsáhlém hydropsu. Dvacet jedna plodů bylo řádně porozeno v termínu, 15 vyžadovalo implantaci kardiostimulátoru v různém věku (1 den – 2 roky, medián 2 týdny).
V uvedeném období bylo vyšetřeno celkem 127 dalších těhotných, které byly poslány k vyšetření s pozitivními autoprotilátkami (dle posledního vyšetření). AV blokáda 1. stupně byla diagnostikována u deseti z nich, 6/10 bylo léčeno dexamethasonem, k dalšímu rozvoji AV blokády nedošlo. Kompletní AV blokáda se rozvinula u tří těhotných, pouze u jednoho plodu byl zjištěn při iniciálním vyšetření AV blok 1. stupně. Dva z nich byly vzhledem k AV blokádě u předchozího plodu preventivně neúspěšně léčeny dexamethasonem.
ZÁVĚR
Kardiální postižení u lupus neonatorum plodů je vzácné, ale může vést při kompletní AV blokádě k intrauterinnímu srdečnímu selhání a úmrtí. Léčba kompletní AV blokády u plodu neexistuje. Při prevenci je důležitá stratifikace rizika těhotných, kde důležitou roli hraje výše titru anti-Ro52 autoprotilátek. Ani preventivní podání kortikoidů a/nebo imunoglobulinů nemusí zastavit rozvoj lupus neonatorum u plodu. Podávání hydroxychlorochinu v těhotenství může významně snížit riziko vzniku atrioventrikulárního bloku u plodu.
Podpořeno MZ ČR – RVO, FN v Motole 00064203.
Konflikt zájmů: žádný.
adresa pro korespondenci:
MUDr. Viktor Tomek, Ph.D.
Dětské kardiocentrum 2. LF UK a FN Motol
V Úvalu 84, 150 08 Praha 5
e-mail: viktor.tomek@fnmotol.cz
Zdroje
1. Hubsher O, Batista N, Rivero S, et al. Clinical and serological identification of 2 forms of complete heart block in children. J Rheumatol 1995; 22 : 1352–1355.
2. Ho YS, Esscher E, Anderson RH, et al. Anatomy of congenital complete heart block and relation to maternal anti-Ro antibodies. Am J Cardiol 1986; 58 : 291–294.
3. Buyon JP, Hiebert R, Copel J, et al. Autoimmune-associated congenital heart block: demographics, mortality, morbidity and recurrence rates obtained from the national lupus registry. J Am Coll Cardiol 1998; 31 : 1658–1666.
4. Nield LE, Silverman ED, Smallhorn JF, et al. Endocardial fibroelastosis associated with maternal anti-Ro and anti-La antibodies in the absence of atrioventricular block. J Am Coll Cardiol 2002; 40(4): 796–802.
5. Lynne EN, Silverman ED, Taylor GP, et al. Maternal anti-Ro and anti-La antibody-associated endocardial fibroeastosis. Circulation 2002; 105 : 843–848.
6. Mofors J, Eliasson H, Ambrosi A, et al. Comorbidity and long-term outcome in patients with congenital heart block and their siblings exposed to Roo/SSA autoantibodies in utero. Ann Rheum Dis 2019; 75 : 595–703.
7. van Bergen AH, Cuneo BF, Davis N. Prospective echocardiographic evaluation of atrioventricular conduction in fetuses with maternal Sjogren’s antibodies. Am J Obstet Gynecol 2004; 191 : 1014–1018.
8. Jaeggi E, Laskin C, Hamilton R, et al. The importance of the level of maternal anti-Ro/SSA antibodies as a prognostic marker of the development of cardiac neonatal lupus erythmematosus. J Am Coll Cardiol 2010; 24 : 2778–2784.
9. Salomonsson S, Dzikaite V, Zeffer E, et al. A population-based investigation of the autoantibody profile in mothers of children with atrioventricular block. Scand J Immunol 2011; 74 : 511–517.
10. Anami A, Fukushima K, Takasaki Y, et al. The predictive value of anti-SS-A antibodies titration in pregnant women with fetal congenital heart block. Mod Rheumatol 2013; 23 : 653–658.
11. Berg C, Geipel A, Kohl T, et al. Atrioventricular block detected in fetal life: associated anomalies and potential prognostic markers. Ultrasound Obstet Gynecol 2005; 26 : 4–15.
12. Eliasson H, Sonesson SE, Sharland G, et al. Isolated atrioventricular block in the fetus: A retrospective, multinational, multicenter study of 175 patients. Circulation 2011; 124 (18): 1919–1926.
13. Custodeat-Chalumeau N, Amoura Z, Le Thi Hong D, Piette JC. Questions about dexamethason use for the prevention of anti-SSA related congenital heart block. Ann Rheum Dis 2003; 62 : 1010–1012.
14. Schmidt KG, Ulmer HE, Silverman NH, et al. Perinatal outcome of fetal complete atrioventricular block: a multicenter experience. J Am Coll Cardiol 1991; 17 : 1360–1366.
15. Mevorach D, Elchalal U, Rein AJ. Prevention of complete heart block in children of mothers with anti-SSA/Ro and anit-SSB/La autoantibodies: detection and treatment of first degree atrioventricular block. Curr Opin Rheumatol 2009; 21(5): 478–482.
16. Lee BH, Stoll BJ, McDonald SA, Higgins RD. National Institute of Child Health and Human Development Neonatal Research Network. Neurodevelopmental outcomes of extremely low birth weight infants exposed prenatally to dexamethasone versus betamethasone. Pediatrics 2008; 121(2): 289–296.
17. Rademaker KJ, de Vries WB. Long-term effects of neonatal hydrocortisone treatment for chronic lung disease on the developing brain and heart. Semin Fetal Neonatal Med 2009; 14(3): 171–177.
18. Jaeggi ET, Fouron JC, Silverman ED, et al. Transplacental fetal treatment improves the outcome of prenatally diagnosed complete atrioventricular block without structural heart disease. Circulation 2004; 110 : 1542–1548.
19. Hickstein H, Kulz T, Claus R, et al. Autoimunne-associated congenital heart block: treatment of the mother with immunoadsorption. Ther Apher Dial 2005; 9 : 148–153.
20. Makino S, Yonemoto H, Itoh S, Takeda S. Effect of steroid administration and plasmapheresis to prevent fetal congenital heart block in patients with systemic lupus erythematosus and/or Sjogren’s syndrome. Acta Obstetricia et Gynecologica 2007; 86 : 1145–1146.
21. Samuelsson A, Towers TL, Ravetch JV. Anti-inflammatory activity of IVIG mediated through the inhibitory Fc receptor. Science 2001; 291 : 484–486.
22. Friedman DM, Llanos C, Izmirly PM, et al. Evaluation of fetuses in a study of intravenous immunoglobulin as preventive therapy for congenital heart block: Results of a multicenter, prospective, open-label clinical trial. Arthritis Rheum 2010; 62 : 1138–1146.
23. Pisoni CN, Brucato A, Ruffatti A, et al. Failure of intravenous immunoglobulin to prevent congenital heart block: Findings of a multicenter, prospective, observational study. Arthritis Rheum 2010; 62 : 1147–1152.
24. Lopes LM, Tavares GM, Damiano AP, et al. Perinatal outcome of fetal atrioventricular block: one-hundred-sixteen cases from a singleton institution. Circulation 2008; 118 : 1268–1275.
25. Jaeggi ET, Silverman ED, Yoo SJ, Kingdom J. Is immune-mediated complete fetal atrioventricular block reversible by transplacental dexamethasone therapy? Ultrasound Obstet Gynecol 2004; 23(6): 602–605.
26. Sonesson SE, Salomonsson S, Jacobsson LA, et al. Signs of first-degree heart block occur in one-third of fetuse of pregnant women anti-SSA/Ro 52-kd antibodies. Arthirits Rheum 2004; 50 : 1253–1261.
27. Tomek V, Janoušek J, Reich O, et al. Atrioventricular conduction time in foetuses assesed by Doppler echocardiography. Physiol Res 2011; 60 : 611–616.
28. Gardiner HM, Belmar C, Pasquini L, et al. Fetal ECG: a novel predictor of atrioventricular block in anti-Ro positive pregnancies. Heart 2007; 93(11): 1454–1460.
29. Saxena A, Izmirly PM, Mendez B, et al. Prevention and treatment in utero of autoimmune associated congenital heart block. Cardiol Rev 2014; 22(6): 263–267.
30. Izmirly PM, Custodeat-Chalumeau N, Pisoni CN, et al. Maternal use of of hydroxychloroquine is associated with a reduced risk of recurrent anti-SSA/Ro-antibody-associated cardiac manifestation of neonatal lupus. Circulation 2012; 125 : 76–82.
31. Levy RA, Vilela VS, Cataldo MJ, et al. Hydroxychloroquine in lupus pregnancy: A double-blind placebo controlled study. Lupus 2001; 10 : 401–404.
32. Cuneo BF, Ambrose SE, Tworetsky WT. Detection and succesful treatment of emergent anti-SSA-mediated fetal atrioventricular block. Am J Obstet Gynecol 2016; 215 : 527–528.
33. Cuneo BF, Sonesson SE, Levasseur S, et al. Home monitoring for fetal heart rhtyhm during anti-Ro pregnancies. J Am Coll Cardiol 2018; 72(16): 1940–1951.
Štítky
Dermatologie Dětská revmatologie Revmatologie
Článek vyšel v časopiseČeská revmatologie
Nejčtenější tento týden
2019 Číslo 3- Kterým pacientům se SLE nasadit biologickou léčbu?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Vnímanie bolesti u mužov a žien s reumatoidnou artritídou
- Chronická rekurentní multifokální osteomyelitida (CRMO) v dětském věku – přehled a vlastní výsledky
- Novinky v diagnostice a léčbě granulomatózy s polyangiitidou
- Prenatální diagnostika kardiálního postižení u lupus neonatorum
- Steroidní myopatie
- Kongres EULAR 2019
- Odborné události
- Česká revmatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Chronická rekurentní multifokální osteomyelitida (CRMO) v dětském věku – přehled a vlastní výsledky
- Novinky v diagnostice a léčbě granulomatózy s polyangiitidou
- Steroidní myopatie
- Prenatální diagnostika kardiálního postižení u lupus neonatorum
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



