-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Poruchy funkce štítné žlázy v těhotenství
Disorders of the thyroid gland in pregnancy
Functional disorder of the thyroid gland affects individuals of all ages. Incidence and nature of the disease is influenced by supplying iodine, genetic and immunological factors and other external effects. Increased function occurs in 1–2% of the adult population, reduced function in the younger population diagnosed in about 5%, in women aged over 50 years we have beenat 10–15%. The incidence of thyroid diseases is higher in women than in men (5–8 : 1) and significantly increases with age. Approximately as common as overt forms of thyroid disease are their subclinical forms. Thyroid disease, especially asymptomatic reduction of function for direct examination is diagnosed up to 5% of pregnant women. Untreated decreased thyroid function of mothers may have significant negative impact on the course of pregnancy, as well as on fetal development, especially in the psychomotoric area. Women with the presence of antithyroid antibodies are at risk of pregnancy deepening malfunctions and/or postpartum thyroiditis. Czech Endocrinological Society currently pursuing a systematic screening of other risk population groups, including notably the pregnant and nursing women, women in old age and ill with some other disease or treatment with certain drugs.
Keywords:
hypothyroidism – pregnancy – thyrotropin – free thyroxine – triiodothyronine – antithyroidantibodies
Autoři: A. Skřivánek 1; M. Lubušký 2,3; M. Studničková 2
; I. Holusková 4; M. Procházka 2
Působiště autorů: G-Centrum Olomouc, vedoucí MUDr. A. Skřivánek 1; Porodnicko-gynekologická klinika FN a LF UP, Olomouc, přednosta prof. MUDr. R. Pilka, Ph. D. 2; Ústav lékařské genetiky a fetální medicíny FN a LF UP, Olomouc, přednosta prof. MUDr. J. Šantavý, CSc. 3; Transfuzní oddělení FN a LF UP, Olomouc, primářka MUDr. D. Galuszková, MBA, Ph. D. 4
Vyšlo v časopise: Ceska Gynekol 2013; 78(1): 99-106
Souhrn
Funkční porucha štítné žlázy postihuje jedince všech věkových skupin. Výskyt i charakter onemocnění je ovlivňován zásobením jodem, genetickými a imunologickými faktory a dalšími zevními vlivy. Zvýšená funkce se vyskytuje u 1–2 % dospělé populace, snížená funkce se u mladší populace diagnostikuje asi u 5 %, u žen ve věku nad 50 let již u 10–15 %. Výskyt tyreopatií je vyšší u žen než u mužů (5–8 : 1) a významně stoupá s věkem. Přibližně stejně časté jako manifestní tyreopatie jsou jejich subklinické formy. Onemocnění štítné žlázy, především asymptomatické snížení funkce, je při cíleném vyšetření diagnostikováno až u 5 % těhotných žen. Neléčená snížená funkce štítné žlázy matky může mít výrazně negativní dopad jak na průběh těhotenství, tak i na vývoj plodu, především v psychomotorické oblasti. Ženy s přítomností antityreoidálních protilátek jsou ohroženy v těhotenství prohloubením funkční poruchy a/nebo poporodní tyroiditidou. Česká endokrinologická společnost v současné době usiluje o zavedení systematického screeningu v dalších rizikových skupinách obyvatel, kam patří především těhotné a kojící ženy, ženy ve vyšším věku a nemocní s některými dalšími chorobami či léčení určitými léky.
Klíčová slova:
hypotyreóza – těhotenství – tyreotropin – volný tyroxin – trijodtyronin, antityreoidální protilátkyPATOFYZIOLOGIE PORUCH ŠTÍTNÉ ŽLÁZY
Štítná žláza produkuje hormony tyroxin (T4) a trijodtyronin (T3). Jejich syntéza je závislá na vychytávání jodu z krve. Ten je do buňky transportován pomocí tzv. jodidové pumpy. V buňce poté dochází k oxidaci jodu za pomoci enzymu peroxidázy. Při organifikaci jodu se jod naváže na bílkovinu tyreoglobulin. Na molekulu tyrosinu se váže jeden nebo dva atomy jodu a vzniká monojodtyrosin nebo dijodtyrosin. Jejich kondenzací pak vzniká tyroxin a trijodtyronin. Trijodtyronin může vzniknout i dejodací tyroxinu.
Hormony T3 a T4 se po sekreci do krve rychle vážou na vazebné proteiny, a to globulin vázající tyroxin (TBG), prealbumin vázající tyroxin (TBPA) a albumin. Produkce a sekrece T3 a T4 je regulována adenohypofyzárním tyreotropním hormonem (TSH), ten pak hypothalamickým tyreoliberinem (TRH).
Hlavním účinkem T3 a T4 je účinek metabolický (kalorigenní), v časných fázích vývoje navíc diferenciační a růstový. Hormony štítné žlázy zvyšují celkový metabolismus, spotřebu kyslíku a tvorbu tepla ve tkáních. Působí termoregulačně, zvyšují katabolismus lipidů a zrychlují resorpci sacharidů z gastrointestinálního traktu [39].
Hypotyreóza
Mezi příčiny snížené funkce štítné žlázy patří snížený přívod jodu potravou, omezený příjem jodu buňkami štítné žlázy, nedostatek peroxidázy, poruchy tvorby tyreoglobulinu, defekt v zabudování jodu, defekt v kondenzaci tyrosinových zbytků, neschopnost uvolňovat z tyreoglobulinu tyroxin, resp. trijodtyronin nebo necitlivost cílových orgánů v důsledku receptorových defektů. Častou příčinou jsou i zánětlivá poškození štítné žlázy, méně často vzniká hypotyreóza jako důsledek nedostatku TSH nebo TRH.
Nedostatek hormonů štítné žlázy má za následek pokles metabolismu a produkce tepla, s čímž souvisí i intolerance chladu. Pokles lipolýzy vede k hyperlipidémii a hypercholesterolémii s rozvojem aterosklerózy, pokles glykogenolýzy a glukoneogeneze pak ke hypoglykémii. Kůže takto postižených jedinců je studená a suchá, vzniká hyperkeratóza. Snížená stimulace svaloviny gastrointestinálního traktu má za následek zácpu, nechutenství a gastroezofageální reflux. Objevují se i účinky na kardio-vaskulární systém, jako je bradykardie, snížený srdeční výdej nebo pokles systolického krevního tlaku. Klesá neuromuskulární dráživost, rozvíjí se hyporeflexie, únava, somnolence, poruchy paměti, deprese, v krajních případech až kóma. Tyto projevy jsou u dospělého jedince reverzibilní. Na rozdíl od plodu, kdy nedostatek hormonů štítné žlázy může způsobit ireverzibilní poškození mozku a zpomalení růstu kostí. Vzniká tak typický obraz kretenismu.
Hypertyreóza
Nejvýznamnější příčinou hypertyreózy je Basedowova choroba, dále pak tumory produkující hormony štítné žlázy, záněty žlázy nebo zvýšená produkce TSH.
Projevy zvýšené produkce hormonů štítné žlázy jsou v podstatě opakem symptomů při hypoty-reóze. Zvyšuje se bazální metabolismus a tělesná teplota, vzniká intolerance tepla. Zvyšuje se citlivost cílových orgánů na katecholaminy, zvyšuje se srdeční výdej a tepová frekvence, často se vyskytují palpitace nebo fibrilace síní, stoupá krevní tlak. Následkem lipolýzy dochází k hypolipidémii a hypocholesterolémii, pacienti hubnou. Poruchy metabolismu glukózy vedou k poruchám glukózové tolerance, popřípadě k rozvoji diabetu. Ubývá kostní i svalové hmoty, kůže je teplá a vlhká. Stimulace střevní peristaltiky vede k průjmům, zvýšená neuromuskulární dráždivost k hyperreflexii, třesu, svalové slabosti, nervozitě a nespavosti. Mezi symptomy Basedowovy nemoci patří i exoftalmus.
Symptomy hypo - i hypertyreózy přehledně shrnuje tabulka 1.
Tab. 1. Symptomy hypotyreózy a hypertyreózy 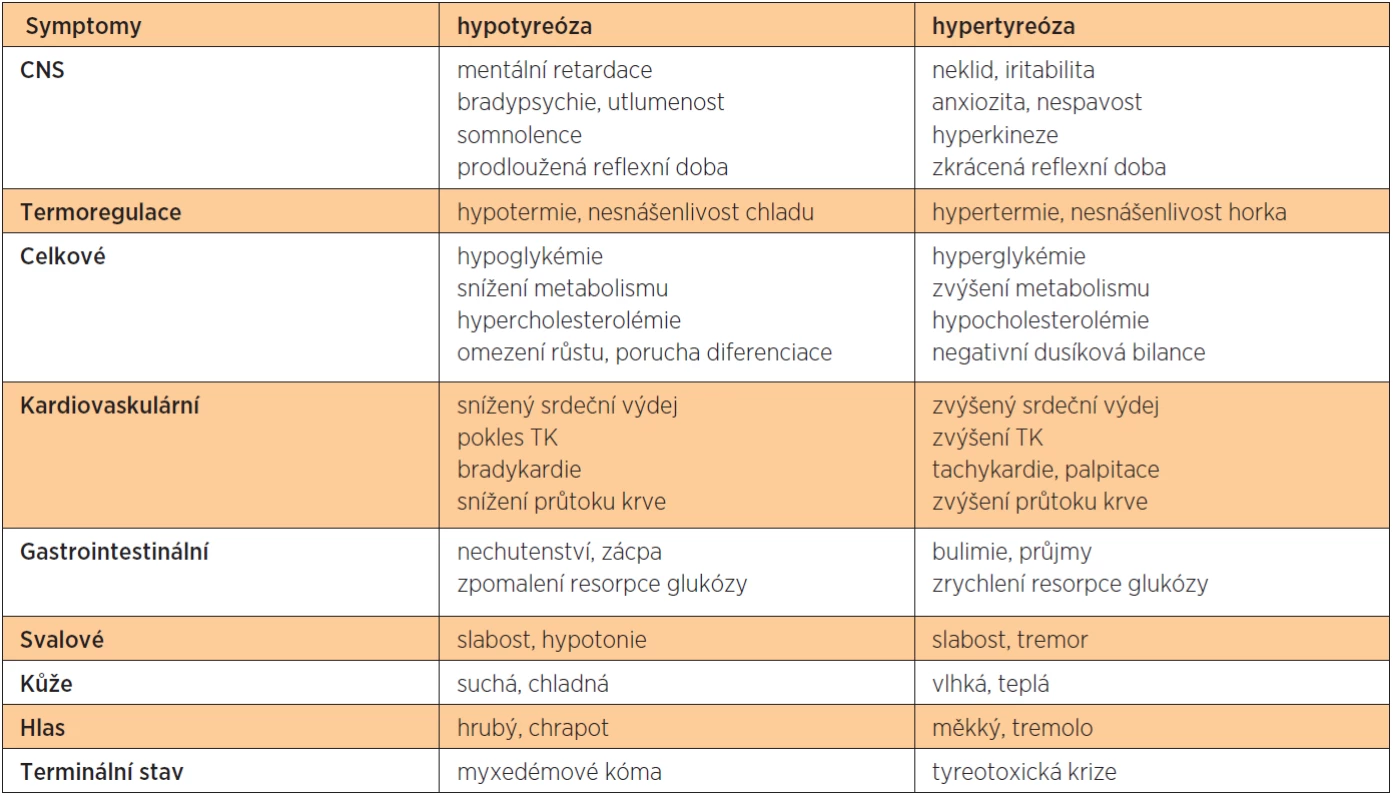
FYZIOLOGIE TYREOIDÁLNÍCH HORMONŮ BĚHEM EMBRYONÁLNÍHO A FETÁLNÍHO VÝVOJE
Do doby vlastní tyreoidální sekrece na konci prvního trimestru gravidity je embryo zcela závislé na dodávce T4 od matky. Od druhého trimestru tvoří štítná žláza plodu již významné množství hormonů a matka se podílí na zásobení plodu T4 „jen“ asi 17 %. Dostatečné množství T4 je zajištěno převážně vlastní syntézou ve štítné žláze plodu, avšak mateřský T4 je i v této době nezbytný pro správný další vývoj plodu, především jeho CNS. Nezbytnou podmínkou pro dostatečnou syntézu T4 plodu je po celou dobu gravidity dostatečný přísun jodu, jehož jediným zdrojem je matka [10].
TYREOIDÁLNÍ HORMONY V CIRKULACI MATKY
Fyziologii tyreoidální osy a tyreoidálních hormonů v těhotenství ovlivňuje lidský choriový gonadotropin (hCG). Jeho koncentrace plynule stoupá v prvním trimestru těhotenství a vrcholu dosahuje kolem 11. gestačního týdne, ve 4. a 5. měsíci gravidity pak postupně klesá. V této době se hCG spoluúčastní regulace syntézy tyreoidálních hormonů štítnou žlázou matky. Děje se to na základě TSH-like efektu molekuly hCG na receptorech pro TSH. Tento efekt je způsoben identickou alfa podjednotkou molekuly hCG a molekuly TSH. Zvýšení koncentrace hCG podle některých autorů může způsobit fyziologický vzestup koncentrací mateřského volného T4 a volného T3, které se vracejí do původních hodnot ve druhé polovině gravidity [10].
Velmi častou příčinou nedostatečného vzestupu tvorby T4 v prvním trimestru je také relativní nedostatek jodu v potravě matky v době zvýšených nároků. Tomu je nutno předcházet suplementací jodu v jakékoli formě (změna jídelníčku, těhotenské potravinové doplňky, tablety s jodem) tak, aby celkový příjem byl nejméně 250 µg elementárního jodu denně [17].
Vysoké koncentrace hCG bývají spojovány s hyperemesis gravidarum a jeho excesivní vzestup může velmi vzácně vyvolat i přechodnou hypertyreózu. V důsledku synergického působení hCG a TSH na TSH-receptoru dochází k přechodnému poklesu sérových koncentrací mateřského TSH. Navíc v přítomnosti relativního jodového deficitu je vzniklá hypotyroxinémie kompenzována zvýšenou dejodací T4 na T3 a preferenční sekrecí T3. Sérové koncentrace T3 tak zůstávají normální nebo mohou i kompenzatorně stoupat, to však pak brání principem zpětné vazby elevaci TSH a rozvoji (subklinické) hypotyreózy [22]. Hodnoty TSH tak mohou být v první polovině gravidity falešně nízké a ukazuje se, že současné normy pro populaci nebudou bezvýhradně přijatelné pro jednotlivé fáze gravidity.
PORUCHY FUNKCE ŠTÍTNÉ ŽLÁZY A TĚHOTENSTVÍ
Výraznější funkční poruchy štítné žlázy mají jasné klinické projevy a přivedou postiženou ženu k lékaři. Většina žen s lehkou poruchou funkce štítné žlázy (podstatně častěji s hypotyreózou než hypertyreózou) nebo žen ohrožených poruchou tyreoidální funkce je asymptomatická, a tudíž uniká pozornosti. Jejich počet je však nezanedbatelný a může tvořit až 5 % žen ve fertilním věku. Všechny tyto ženy by měly být identifikovány a podle potřeby léčeny [19].
Ženy s funkční poruchou štítné žlázy (častěji hypotyreózou) mívají anovulační cykly a obtížněji otěhotní. Během gravidity mají zvýšenou incidenci spontánních abortů, předčasných porodů, abrupce placenty, krvácení a bývají častěji indikovány k císařskému řezu [19].
Pokud je těhotenství diagnostikováno v průběhu léčby tyreostatiky, je nutné indikaci k ukončení těhotenství posuzovat individuálně ve spolupráci s endokrinologem a genetikem, a totéž platí pro závažné formy neléčené hypotyreózy.
Hypertyreóza
Hyperfunkce je v těhotenství vzácná, spíše jde o relaps, vzácněji o první vzplanutí. Pokud je diagnóza potvrzena, je indikována léčba Propycilem, který méně prochází placentou než Carbimazol. Ve 2. trimestru může nastat zklidnění choroby. V určitých situacích (potřeba vysokých dávek tyreostatika, růst strumy) je na rozhraní 2.–3. trimestru indikována tyreoidektomie.
Hypotyreóza
Závažný nedostatek tyreoidálních hormonů vede k ireverzibilním změnám plodu: především k poruše diferenciace nervových buněk, nedostatečnému vývoji CNS s následnou mentální retardací, ale i k dalším somatickým defektům (srdeční vady a poruchy vývoje skeletu). Mírnější deficit může vést k poruchám koncentrace, syndromu hyperaktivity nebo neurologickým deficitům. Jak již bylo řečeno, plod je do 14. až 16. týdne těhotenství závislý na tyreoidálních hormonech matky. Vlastní syntéza tyreoidálních hormonů plodem začíná ve 12. – 14. gestačním týdnu, avšak i potom musí být trvale doplňována tyroxinem matky [19, 22].
Subklinická hypotyreóza
Asymptomatická hypotyreóza je v graviditě dia-gnostikována při cíleném screeningu u 2–5 % žen. Vzhledem k závažnosti důsledků nedostatků T-hormonů na psychomotorický vývoj dítěte je doporučeno provádět screening funkčních poruch (FP) před zamýšlenou koncepcí nebo alespoň v časné fázi gravidity u všech žen, zejména pak u žen se zvýšeným rizikem. Vyšetření by mělo zahrnovat stanovení TSH, FT4 a TPOAb. Patologie kteréhokoliv ukazatele má být bezodkladně konzultována s endokrinologem. Hypotyreóza (i subklinická) musí být léčena okamžitě, podle závažnosti, a pokud zdravotní stav dovolí, plnou dávkou tyroxinu s cílem dosáhnout TSH mezi 1–2 mIU /l a FT4 v horní polovině normálního pásma. Je-li již těhotná žena v léčbě, bývá nutné zvýšit dosavadní substituci asi o 30 %. S ohledem na závažnost důsledků FP pro průběh gravidity i pro plod patří péče o těhotné ženy s tyreopatií do péče endokrinologa [38].
Poporodní tyreoiditida
Nejen gravidita, ale i poporodní období může být komplikováno nepoznanou tyreopatií. Gravidita je obdobím imunotolerance. Po porodu se však dostaví tzv. rebound fenomén, kdy se mohou aktivovat autoimunitní choroby. To je podkladem vzniku i poporodní tyroiditidy. Pokud se v důsledku zánětu uvolní hormony do oběhu, vznikne fáze hyperfunkce, po které může následovat buď hypofunkce, nebo úzdrava s normalizací funkce, anebo se plíživě rozvine hypotyreóza. Výskyt se uvádí u 2–7–15 % žen po porodu a vyvíjí se častěji u žen s vysokým titrem protilátek [26], a to až u poloviny dosud asymptomatických žen [18].
DŮSLEDKY MANIFESTNÍ I SUBKLINICKÉ HYPOTYREÓZY MATKY V TĚHOTENSTVÍ
Koncem 90. let minulého století bylo publikováno několik sdělení, která jednoznačně upozornila na skutečnost, že děti matek s neléčenou subklinickou či manifestní hypotyreózou v těhotenství mají v 7–9 letech statisticky významně nižší IQ než kontrolní skupina, tj. děti hypotyreózních matek léčených substitucí a matek bez tyreopatií [9, 21, 30, 33]. Rovněž další studie prokázaly negativní korelaci mezi TSH těhotných matek a IQ jejich potomků [12]. Některé studie navíc ukázaly, že i hypotyroxinémie matky během prvního trimestru (bez ohledu na TSH) má negativní vliv na neuropsychický vývoj dítěte [30]. Děti matek s volným T4 ve 12. týdnu gravidity pod 10. percentilem měly nižší skóre psychomotorického vývoje než děti matek s vyšším volným T4 [22]. V roce 2004 Vermiglio et al. ukázali, že 70 % dětí matek trpících hypotyroxinémií jakékoliv etiologie během prvního trimestru gravidity je postiženo různými poruchami psychického vývoje, jako jsou poruchy pozornosti či hyperaktivita [42].
Z pohledu dnešních vědomostí jsou závažná i starší zjištění, že děti matek s pozitivními protilátkami proti tyreoidální peroxidáze měly v předškolním věku nižší IQ oproti dětem matek s protilátkami negativními [31] a že samotná pozitivita těchto protilátek (bez poruchy tyreoidální funkce) je spojena s vyšším rizikem spontánních potratů [6]. Riziko závažného postižení vývoje CNS z důvodu subklinické hypotyreózy matky je podle některých autorů odhadováno až na 1 : 1000, což je 3–4krát více než u vrozené hypotyreózy [21].
Snížená funkce štítné žlázy matky může vést i ke gynekologicko-porodnickým komplikacím. U žen s hypotyreózou nejen manifestní, ale i subklinickou, je prokázána jak snížená fertilita, tak komplikace v průběhu gravidity. Vyskytuje se vyšší procento případů intrauterinního odumření plodu, spontánních potratů, předčasných porodů a preeklampsie [32]. V analýze z roku 2005 bylo u žen se subklinickou hypotyreózou třikrát vyšší riziko abrupce placenty a dvakrát vyšší riziko předčasného porodu [5]. Naopak izolovaná hypotyroxinémie matky neměla na průběh těhotenství a porodu negativní vliv [4].
Zvýšené riziko spontánních potratů a předčasných porodů bylo popsáno u eutyreózních žen se zvýšeným titrem protilátek TPOAb, a toto riziko klesalo při podávání levotyroxinu [25]. Tato studie je dosud jedinou dokončenou intervenční studií, která prokázala pozitivní vliv léčby levotyroxinem u těhotných žen se subklinickou hypotyreózou nebo eutyreózních s izolovanou pozitivitou tyreoidálních protilátek.
DIAGNOSTIKA PORUCH ŠTÍTNÉ ŽLÁZY V TĚHOTENSTVÍ
Klinická symptomatologie
Těhotenství významně ovlivňuje klinické příznaky. Tyreoidální symptomatologie může být těhotenstvím zastřena (únava, obstipace, otoky), ale i imitována (úbytek hmotnosti při zvracení, tachykardie). U hypotyreózy může chybět struma, zvláště při atrofické formě. Ženy však mohou vnímat tlak v oblasti tyreoidey jako důsledek zvýšených nároků na syntézu tyreoidálních hormonů ve žláze postižené chronickým zánětem. Obtíže v 1. trimestru se mohou ve 2. trimestru spontánně upravit. Subklinická porucha typickou symptomatologii nemá.
Hodnocení laboratorních výsledků
Organismus těhotné ženy reaguje na zvýšenou koncentraci estrogenů větší produkcí vazebných transportních bílkovin (thyroxine binding globulin – TBG) a vytvoří rovnováhu tak, aby koncentrace volného T4 (FT4) zůstala ve fyziologickém pásmu. Volné frakce nejsou zvýšením TBG ovlivněny. Zvyšuje se hladina celkového T4 a celkového T3, proto v těhotenství vyšetřujeme výhradně FT4 a podle potřeby volný T3 (FT3). Normy FT4 a FT3 se u těhotných neliší od norem pro ostatní populaci.
TSH může být v těhotenství ovlivněn zvýšenou koncentrací hCG – může se mírně snižovat, protože hCG a TSH mají společnou alfa podjednotku [19]. Díky podobné stavbě s TSH je v počátku gravidity hCG schopno aktivovat štítnou žlázu navázáním na TSH-receptor; tento jev se nazývá spillover syndrom [29]. Proto se v posledních letech vedou diskuse o nutnosti určení hraničních hodnot vyšetřovaných hormonů speciálně pro těhotné ženy.
Pozitivita či zvýšené hodnoty protilátek proti peroxidáze (TPOAb) jsou markerem autoimunity a v průběhu let se většinou nemění. Vysoký titr upozorňuje na etiologii autoimunitního onemocnění. Vytipuje osoby rizikové pro možný rozvoj dystyreózy v graviditě nebo po porodu [19].
Česká endokrinologická společnost doporučuje vyšetření všech žen před zamýšlenou koncepcí a nejpozději v začátcích gravidity, a to využitím tří ukazatelů: koncentrace THS, FT4 a TPOAb. Při odchylce v kterémkoli parametru by měl být ihned konzultován endokrinolog tak, aby byla léčba zahájena ještě v prvních týdnech gravidity [19]. Endokrinologové by měli neprodleně řešit patologické nálezy, protože právě v prvních týdnech gravidity je vývoj plodu nejvíce závislý na optimálním zásobení tyreoidálními hormony. Je-li žena pro hypotyreózu již léčena, je obvykle nutné zvýšit substituční dávku co nejdříve [2].
VÝZNAM SCREENINGU PORUCH FUNKCE ŠTÍTNÉ ŽLÁZY PREKONCEPČNĚ A NA ZAČÁTKU TĚHOTENSTVÍ
Včasná diagnóza a léčba tyreopatií v těhotenství představují účinnou prevenci jak porodnických komplikací, tak možného negativního dopadu tyreoidální dysfunkce na správný vývoj plodu. Vzhledem k relativně vysoké prevalenci tyreopatií u těhotných žen se odborné společnosti většiny světadílů opakovaně shodly na oprávněnosti zavedení systematického screeningu žen v časné fázi těhotenství nebo ještě před plánovanou koncepcí. Přesto nebylo dosud dosaženo všeobecného konsenzu, zda má být screening cílený jen na rizikové skupiny žen, vyjmenované v tabulce 2 [1, 10], nebo má být celoplošný [15, 22, 40]. Skutečností je, že pokud by byl screening cílený jen na ženy rizikové, pak 1/3 žen s manifestní či subklinickou hypotyreózou nebude diagnostikována [40]. Z tohoto důvodu se autoři článku přiklánějí k názoru, že screening by měl být v podmínkách České republiky realizován celoplošně [10]. K ideálnímu posouzení aktuálního stavu i rizika komplikací je nutné vyšetřovat nejen sérové koncentrace TSH, ale i volného T4 a TPOAb. Každý z ukazatelů v graviditě podává pouze část informací. Z fyziologie tyreoidální osy a z citovaných prací je zřejmé, že současné normy TSH pro populaci nebudou bezvýhradně přijatelné pro jednotlivé fáze gravidity. V recentních doporučeních [1] se jako jedna z možností navrhuje přijmout tzv. „trimestr-specifické“ normální rozmezí TSH např. podle Panesara et al.: 0,03–2,3 mIU.l-1 pro 1. trimestr, 0,03–3,1 mIU.l-1 pro 2. trimestr a 0,13 až 3,5 mIU.l-1 pro 3. trimestr gravidity [27]. Opakovaně se zdůrazňuje, že k přesnému posouzení tyreoidální funkce v graviditě je nezbytné zohlednit i sérové koncentrace volného T4, protože některé studie ukázaly, že i izolovaná hypotyroxinémie matky (bez ohledu na TSH) má negativní vliv na psychomotorický vývoj narozených dětí [18, 23, 30, 42].
Tab. 2. Rizikové skupiny žen vhodné ke screeningu poruch funkce štítné žlázy 
Vyšetření protilátek proti tyreoidální peroxidáze (TPOAb) podá informaci o etiologii funkční poruchy a odhalí ženy se zvýšeným rizikem rozvoje tyreopatie, které mohou být sice eufunkční, ale v graviditě nebo po porodu je porucha funkce může ohrozit. Izolovaná pozitivita TPOAb je navíc spojená se zvýšeným rizikem spontánních potratů a předčasných porodů [25].
S přihlédnutím k těmto skutečnostem a k zavedeným preventivním screeningovým programům v těhotenství, realizovaným gynekology, se v současnosti v České republice jako nejracionálnější jeví vyšetření TSH, volného T4, eventuálně TPOAb z krve u žen plánujících graviditu nebo co nejdříve po potvrzení těhotenství. Optimální je provést odběr u ošetřujícího gynekologa, popřípadě u praktického lékaře ihned po zjištění gravidity. Do preventivního programu musí být praktičtí lékaři zapojeni – mohou ženy na význam screeningu nejen upozornit, ale u plánované gravidity screening realizovat. Provázanost informací o výsledku vyšetření a konzultace s endokrinologem by neměly být v době internetu problémem. Velmi důležité je zlepšit informovanost žen ve fertilním věku o významu správné funkce štítné žlázy v těhotenství.
V případě pozitivního screeningu musí následovat bez prodlení stanovení etiologie a významnosti funkční poruchy a rozhodnutí o dalším postupu. Vzhledem ke složitosti hodnocení laboratorních nálezů v graviditě je však nezbytné, aby léčbu určil lékař plně orientovaný v problematice. Platí konsenzus, že podle výsledků by mělo být upravováno dávkování substituční léčby tak, aby TSH nebylo vyšší než 2,5 mIU.l-1 [1], resp. volný T4 byl v horním pásmu normy příslušné laboratoře. Někteří autoři se domnívají, že podobně jako u TSH, tak ani u volného T4 nebude možné u těhotných žen použít normy pro běžnou populaci [1, 34]. Vypracování norem patrně bude ještě předmětem diskusí – jednou z možností je vypracovat pro TSH i volný T4 v každé laboratoři vlastní normy pro jednotlivé fáze gravidity.
ZÁVĚR
O tom, že porucha funkce štítné žlázy ženy v graviditě může mít nepříznivý vliv na průběh těhotenství a vývoj plodu, jsou nezvratné důkazy. Efektivnost screeningu vrozené hypotyreózy stanovením TSH v suché kapce krve (který je dosud jediným celoplošným screeningem tyreopatií u nás) je nezpochybnitelná. Naproti tomu screening tyreopatií u těhotných žen, který prokazuje záchyt 2–4 % funkčních tyreopatií a 5–10 % žen s rizikem funkční tyreopatie, není dosud v České republice systematicky prováděn (ať už celoplošný, či cílený na rizikové skupiny). Porucha funkce štítné žlázy v graviditě probíhá převážně asymptomaticky, nebo jsou obtíže připisovány těhotenství. Vyšetření TSH, volného T4 a TPOAb u žen plánujících graviditu, nebo co nejdříve po potvrzení těhotenství (u ošetřujícího gynekologa, popřípadě u praktického lékaře) zachytí nejen ženy s již funkčním onemocněním, ale i ženy se zvýšeným rizikem onemocnění v graviditě nebo po porodu. Realizace a funkčnost tohoto preventivního programu mohou být zajištěny jen tehdy, budou-li o důležitosti screeningu tyreopatií v těhotenství informováni nejen praktický lékař a ošetřující gynekolog, ale i ženy plánující těhotenství.
Podpořeno grantem IGA MZ ČR NT 11004-3/2010, NT 12225-4/2011.
MUDr. Aleš Skřivánek
G-CENTRUM Olomouc s.r.o.
Horní nám. 8
772 00 Olomouc
e-mail: skrivanek@g-centrum.cz
Zdroje
1. Abalovich, M., Nobuyuki, A., Barbour, LA., et al. Clinical Practice Guideline. Management of thyroid dysfunction during pregnancy and postpartum: an endocrine society clinical practice guideline. J Endocrinol Metab, 2007, 92(8 Suppl), S1–S47.
2. Alexander, EK., Marquesee, E., Lawrence, J., et al. Timing and magnitude of increases levothyroxine requirements during pregnancy in women with hypothyroidism. N Eng J Med, 2004, 351, p. 241–249.
3. Borovský, M., Lattáková, M. Štítna žľaza z pohľadu gynekológa. (The thyroid from the gynecologist’s point of view.) Prakt Gyn, 2007, 11, 4, s. 61–163.
4. Casey, BM., Dashe, JS., Spong, CY., et al. Perinatal significance of isolated maternal hypothyroxinemia identified in the first half of pregnancy. Obstet Gynecol, 2007, 109, p. 1129–1135.
5. Casey, BM., Dashe, JS., Wells, CE., et al. Subclinical hypothyroidism and pregnancy outcome. Obstet Gynecol, 2005, 105, p. 239–245.
6. Glinoer, D., Solo, M., Bourdoux, P., et al. Pregnancy in patients with mild thyroid abnormalities: Maternal and neonatal repercusions. J Clin Endocrinol Metab, 1991, 73, p. 421–427.
7. Glinoer, D. Miscarriage in women with positive anti-TPO Antibodies: Is thyroxine the answer? J Clin Endocrinol Metabol, 2006, 91, 7, p. 2500–2502.
8. Haddow, JE,, McClain, MR., Lambert-Messerlian, G., et al. First and second trimester evaluation of risk for Fetal Aneuploidy Research Consortium: Variability in thyroid-stimulating hormone suppression by human chorionic [corrected] gonadotropin during early pregnancy. J Clin Endocrinol Metabol, 2008, 93, 9, p. 3341–3347.
9. Haddow, JE., Palomaki, GE., Allan, WC., et al. Maternal thyroid deficiency during pregnancy and subsequent neuropsychological development of the child. N Eng J Med, 1999, 341, p. 549–555.
10. Jiskra, J., Límanová, Z., Potluková, E., Antošová, M. Význam screeningu tyreopatií u těhotných žen: patofyziologický podklad a praktické aspekty. (The importance of screening for thyroid dysfunction during pregnancy: pathophysiological background and practical implications.) Čas Lék čes, 2007, 146, 11, s. 827–833.
11. Kalvachová, B., Zamrazil, V. Štítná žláza v gynekologii a porodnictví – nové poznatky a praktické postupy. (Thyroid gland in gynecology and obstetrics. A new knowledge and practical approach.) Gynekolog, 2003, 12, 3, s. 104–108.
12. Klein, RZ., Sargent, JD., Larsen, PR., et al. Relation of severity of maternal hypothyroidism to cognitive development of offspring. J Med Screen, 2001, 8, p. 18–20.
13. Kořenek, A. Screening poruch štítné žlázy v graviditě a po porodu. (Screening of disturbances of thyroid gland during pregnancy and postpartum.) Prakt Gyn, 2009, 13, 3, s. 137–140.
14. Lazarus, JH. Thyroid disease in pregnancy and childhood. Minerva Endocrinol, 2005, 30, 2, p. 71–87.
15. Lazarus, JH., Premawardhana, LD. Screening for thyroid disease in pregnancy. J Clin Pathol, 2005, 58, 5, p. 449–452.
16. Lazarus, JH. Thyroid disorders associated with pregnancy: ethiology, diagnosis, and management. Treat Endocrinol, 2005, 4, 1, p. 31–41.
17. Liebert, MA. Iodine supplementation for pregnancy and lactation – US and Canada: recommendation of the American Thyroid Association. Thyroid, 2006, 16, p. 949–951.
18. Límanová, Z., Laňková, J., Zamrazil, V. Funkce štítné žlázy a těhotenství. Doporučený postup pro praktické lékaře „Funkční poruchy štítné žlázy“. 2008, s. 6.
19. Límanová, Z., Potluková, E. Význam preventivního vyšetření funkce štítné žlázy v graviditě. (Importance of active screening for thyroid disorders in pregnant women.) Čes Gynek, 2007, 11, 3, s. 120–124.
20. Límanová, Z., et al. Štítná žláza. Praha: Galén, 2006, 371 s.
21. Mitchell, ML., Klein, RZ. The sequelae of untreated maternal hypothyroidism. Eur J Endocrinol, 2004, 151, p. U45–U48.
22. Morreale de Escobar, G., Escobar, F. Maternal thyroid hormones early in pregnancy and fetal brain develompment. Best Pract Res Clin Endocrinol Metab, 2004, 18, p. 225–248.
23. Morreale de Escobar, G., Obregon, MJ., Escobar del Rey, F.Is neuropsychological development related to maternal hypothyroidism, or to maternal hypothyroxinaemia? J Clin Endocrinol Metab, 2000, 85, p. 3975–3987.
24. Negro, R., Formoso, G., Mangieri, T., et al. Levothyroxine treatment in euthyroid pregnant women with autoimmune thyroid disease: effects on obstetrical complications. J Clin Endocrinol Metab, 2006, 91, p. 2587–2591.
25. Negro, R., Formoso, G., Mangieri, T., et al. Euthyroid women with autoimmune thyroid disease undergoing the assistant reproduction technologies. The role of autoimmunity and thyroid function. J Clin Endocrinol Metabol, 2006, 91, p, 2587–2591.
26. Nohr, SB., Jorgensen, A., Pedersen, KM., et al. Postpartum thyroid dysfunction in pregnant thyroid peroxidase antibody-postitive women living in an area with mild to moderate iodine deficiency: is iodine supplementation safe? J Clin Endocrin Metab, 2000, 85, 9, p. 3191–3198.
27. Panesar, NS., Li, CY., Rogers, MS. Reference intervals for thyroid hormones in pregnant Chinese women. Ann Clin Biochem, 2001, 38, p. 329–332.
28. Pop, VJ., Kuijpens, JL., van Baar, AL., et al. Low maternal free thyroxine concentrations during early pregnancy are associatedwith impaired psychomotor development in infancy. Clin Endocrinol, 1999, 50, 2, p. 149–155.
29. Pop, VJ., Vulsma, T. Maternal hypothyroxinaemia during (early) gestation. Lancet, 2005, 365, 9471, p. 1604–1606.
30. Pop, VJ., Brouwers, EP., Vader, HL., et al. Maternal hypothyroxinaemia during early pregnancy and subsequent child development: a 3-year follow-up study. Clin Endocrinol, 2003, 59, p. 282–288.
31. Pop, VJ., de Vries, E., van Baar, AL., et al. Maternal thyroid peroxidase antibodies during pregnancy: a marker of impaired child development? J Clin Endocrinol Metab, 1995, 80, p. 3561–3566.
32. Poppe, K., Velkeniers, B., Glinoert, D. Thyroid disease and female reproduction. Clin Endocrinol, 2007, 66, p. 309–321.
33. Smallridge, RC., Ladenson, PW. Hypothyroidism in pregnancy: consequences to neonatal health. J Clin Endocrinol Metab, 2001, 86, p. 2349–2353.
34. Soldin, OP., Tractenberg, RE., Hollowell, JG., et al. Trimester-specific changes in maternal thyroid hormone, thyrotropin, and thyroglobulin concentrations during gestation: trends and assciations across trimesters in iodine sufficeincy. Thyroid, 2004, 14, p. 1084–1090.
35. Soldin, OP., Soldin, D., Sastoque. M. Gestation specific thyroxine and thyroid stimulating hormone levels in the United States and worldwide. Therapeutic Drug Monitoring, 2007, 29, p. 553–559.
36. Springer, D., Límanová, Z., Zima, T., Calda, P. Vyšetření funkce štítné žlázy v těhotenství; naše výsledky. (Functional examination of maternal thyroid in pregnancy; our results.) Actual Gyn, 2009, 1, s. 50–54.
37. Springer, D., Zima, T., Limanova, Z. Reference intervals in evaluation of maternal thyroid function during the first trimester of pregnancy. Eur J Endocrinol, 2009, 160, 5, p. 791–797.
38. Springer, D., Horáček, J., Hauerová, D., Límanová, Z. Poruchy funkce štítné žlázy v těhotenství – souhrn výsledků nezávislých studií. (Thyroid malfunction in pregnancy.) Čes Gynek, 2007, 72, 6, p. 375–381.
39. Trávníček, T., a spol. Speciální patologická fyziologie. Praha: Avicenum, 1978, s. 387–396.
40. Vaidya, B., Anthony, S., Bilous, M., et al. Detection of thyroid dysfunction in early pregnancy: Universal screeing or targeted high risk case finding? J Clin Endocrinol Metab, 2007, 92, p. 203–207.
41. Vargová, V., Mechírová, V., Pytliak, M. Štítna žľaza v graviditě. (Tyhroid gland in the gravidity.) Čes Gynek, 2009, 74, s. 12–17.
42. Vermiglio, F., Lo Presti, VP., Moleti, M., et al. Attention deficit and hyperactivity disorders (ADHD) in the offsprings of mothers exposed to iodine deficiency. A possible novel iodine deficiency disorder in developed countries? J Clin Endocrinol Metab, 2004, 89, p. 6054–6060.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicína
Článek vyšel v časopiseČeská gynekologie
Nejčtenější tento týden
2013 Číslo 1- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
-
Všechny články tohoto čísla
- Zápis ze schůze výboru Endoskopické sekce ČGPS
- Programové prohlášení výboru „Sekce gynekologické endoskopie ČGPS ČLS JEP“
- Pracovní skupina pro porodnictví Ministerstva zdravotnictví České republiky
- Vzpomínka na prof. MUDr. Františka Gazárka, CSc.
-
MUDr. Čeněk Born, CSc.
Krátké připomenutí životního jubilea - Olomouc má tu čest uspořádat jubilejní XXX. celostátní konferenci Sekce perinatální medicíny České gynekologické a porodnické společnosti ČLS JEP
- Udělení čestného členství České gynekologicko-porodnické společnosti ČLS JEP profesorovi MUDr. Miloši Mlynčekovi, CSc.
- Stav kostní minerální denzity po mnohaleté aplikaci antikoncepce Depo-Provery
- Implementace robotické chirurgie v gynekologii a onkogynekologii; analýza prvního tisíce případů
- Robotem asistovaná radikální hysterektomie ve fázi „learning curve“ a její srovnání se standardní laparoskopicky asistovanou radikální vaginální a otevřenou radikální hysterektomií
- Sakrospinální fixace prolabovaného poševního pahýlu po hysterektomii sec. Miyazaki – dlouhodobé výsledky
- Editorial
- Stanovení RHD genotypu plodu z plazmy periferní krve těhotné ženy a posouzení citlivosti nových diagnostických postupů pro zavedení do klinické praxe
- Historie Porodnicko-gynekologické kliniky v Olomouci
- Porody dětí nízké a velmi nízké porodní hmotnosti ve Fakultní nemocnici v Olomouci (1993–2011)
- Incidence erytrocytární aloimunizace u těhotných žen v olomouckém regionu
- Epidemiologie a management poruch štítné žlázy v těhotenství
- Vliv délky kultivace embryí s pomalým nástupem dělení na úspěšnost IVF
- Výskyt vybraných geneticky podmíněných trombofilních markerů u pacientek podstupujících léčbu neplodnosti
- Možnosti objektivizace tkáňového traumatu u operací pro karcinom endometria
- Problematika krvácivých chorob v porodnictví
- Erytrocytární aloimunizace těhotných žen, klinický význam a laboratorní diagnostika
- Poruchy funkce štítné žlázy v těhotenství
- Česká gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Vliv délky kultivace embryí s pomalým nástupem dělení na úspěšnost IVF
- Sakrospinální fixace prolabovaného poševního pahýlu po hysterektomii sec. Miyazaki – dlouhodobé výsledky
- Erytrocytární aloimunizace těhotných žen, klinický význam a laboratorní diagnostika
- Problematika krvácivých chorob v porodnictví
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



