-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Serotoninergní syndrom – kazuistika
Serotonine syndrome – Case report
The author presents a case report of a female patient with convulsions of unknown etiology. The patient was initially treated for intoxication with an unknown combination of drugs. In the course of time serotonin syndrome was diagnosed. Regression of all symptoms of the syndrome occurred during treatment.
Keywords:
convulsions – intoxication – unconsciousness – serotonin syndrome
Autoři: Vojtíšek Petr; Nalos Daniel
Působiště autorů: Oddělení anestezie, resuscitace a intenzivní medicíny, Krajská zdravotní, a. s., Masarykova nemocnice v Ústí nad Labem, o. z.
Vyšlo v časopise: Anest. intenziv. Med., 22, 2011, č. 3, s. 159-162
Kategorie: Intenzivní medicína - Kazuistika
Souhrn
Autoři uvádějí kazuistiku pacientky s křečovým stavem nejasné etiologie. Pacientka byla původně léčena pro otravu neznámou kombinací léků, postupně však byl diagnostikován serotoninergní syndrom. Po adekvátní léčbě došlo k úplné regresi všech příznaků.
Klíčová slova:
křečový stav – otrava – bezvědomí – serotoninergní syndromÚvod
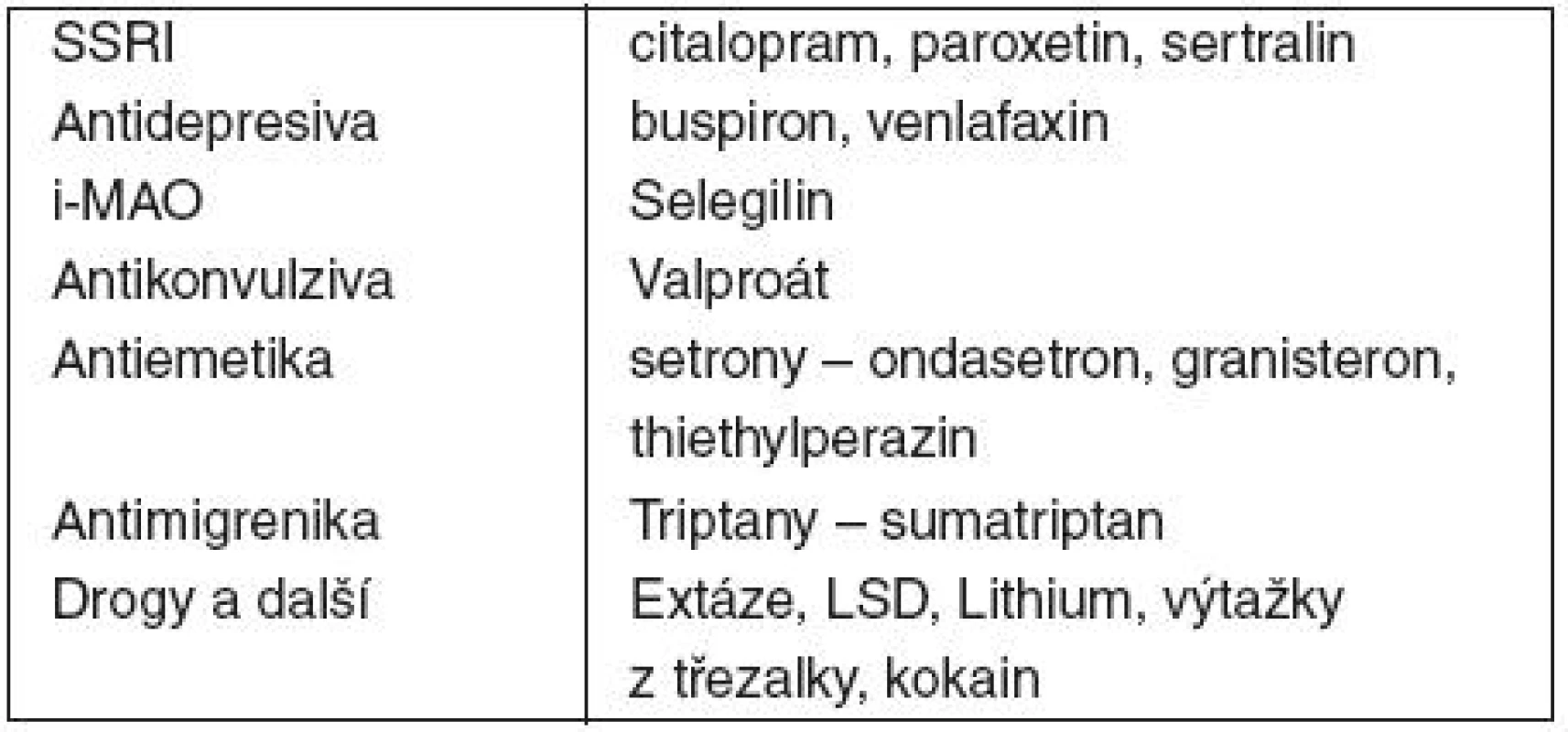
Serotoninový neboli také serotoninergní syndrom (SS) je potenciálně život ohrožující jednotkou, vznikající v důsledku nežádoucího lékového efektu v obvyklém dávkování, náhodného nebo sebevražedného požití velkého množství léků a také v důsledku neočekávaných lékových interakcí. Má široké spektrum velmi rozmanitých příznaků, diagnostika je obtížná, obzvláště při abúzu drog (tab. 1). Základními symptomy jsou změna mentálního stavu, neurovegetativní a neuromuskulární změny. Mezi lehké příznaky patří tremor, myoklonie, hyperreflexie, akatizie, zvýšené pocení, tachykardie, průjem, mydriáza. Při těžším průběhu se přidává předrážděnost, agitovanost, nespavost, rotační pohyby hlavy, extenze krční páteře, spontánní i indukovatelný klonus a hypermobilita střev. Při dalším zhoršování stavu se objevuje tachykardie, delirium, hyperpyrexie, metabolická acidóza, rhabdomyolýza, křeče, renální insuficience a diseminovaná intravaskulární koagulopatie. Diagnóza choroby není založena na specifickém testu, opíráme se hlavně o anamnézu (farmakologickou), klinické projevy a laboratorní nálezy. V diferenciální diagnostice je třeba odlišit maligní neuroleptický syndrom, maligní hypertermii a anticholinergní syndrom. K odhalení SS může napomoci Sternbachova tabulka diagnostických kritérií (tab. 2) nebo modernější Hunter Serotonin Toxicity Criteria (tab. 3). SS vzniká na podkladě hyperstimulace serotoninového (5-HT) systému, zejména postsynaptických 5-HT1A a 5-HT2 receptorů. Serotoninergní receptory jsou umístěny hlavně ve vývojově starších částech centrálního nervového systému (od mezimozku po kmen) ve strukturách, které se podílejí na regulaci bdění, příjmu potravy, emocí, sexuálního chování, zvracení atd. Existuje celkem 7 skupin těchto receptorů. Podílejí se na vzniku příznaků v různých kombinacích, proto má SS tak pestrou symptomatologii. Ačkoliv jsou moderní antidepresiva (hlavně SSRI – Specific Serotonin Reuptake Inhibitor) bezpečnější než dříve používaná antidepresiva, SS je stále aktuální. Příčinou je především velké rozšíření serotoninergních léků – kromě SSRI i antimigrenózní léky a antiemetika (tab. 1). Nebezpečné a v praxi bohužel hojně vídané kombinace jsou SSRI s tramadolem nebo kodeinem, SSRI s erytromycinem, i-MAO (inhibitor monoaminooxidázy) s petidinem. Potenciálně problematická je kombinace SSRI a atypických neuroleptik, kdy se interakce může projevit již po několika dávkách. Zvláště tramadol je zrádný svým serotonin-liberujícím účinkem. Dlouhodobě léčení mají mírné až středně závažné příznaky, ty se však mohou rychle zhoršit přidanou nevhodnou kombinací léků. Těžké případy se projeví brzy, již za několik hodin od požití velké dávky či změně dávkování. SS má široké spektrum klinicky velmi rozmanitých projevů, a proto bývá opomíjen, a obtíže bývají přičítány jiným příčinám. Léčba je založená na okamžitém vysazení vyvolávající noxy, respektive nox, zajištění základních životních funkcí a symptomatologické a podpůrné léčbě. Při vysazení vyvolávajících léků syndrom ustupuje do 24 hodin, u závažných případů přetrvává i déle, zvláště při použití léků s dlouhým poločasem. To samé platí pro požití velkých dávek léků vyvolávajících SS. Při nasazování nových léčiv do medikace je třeba respektovat bezpečnostní odstupy mezi těmito preparáty, jak ukazuje tabulka 4. Doporučuje se pečlivě hlídat teplotu a reagovat na její vzestup (antipyretika, chlazení), myoklonie a křeče tlumit benzodiazepiny (clonazepamem, v zahraničí lorazepamem) nebo jinými antikonvulzivy (pozor ale na valproát uvolňující serotonin), tabulka 1. Při potřebě umělé plicní ventilace je možno užít relaxancií, antihypertenzní terapie (podle kazuistik je vhodné zvážit kontinuální podání nitrátů). V dostupných kazuistikách byl použit i chlorpromazin (5-HT2 a 5-HT3 antagonista) a mirtazapin. Ten je všeobecně považován za serotonin-liberin, proto ho nelze k léčbě SS doporučit. Literatura uvádí i specifická antidota jako derivát LSD methysergid, cyproheptadin nebo propranolol, který blokuje 5-HT1 a 5-HT2 receptory. Tyto léky (s výjimkou propranololu) ale u nás nejsou běžně dostupné. Při dobré a intenzivní symptomatické péči jsou léčebné výsledky velmi dobré a vedou k rychlému a úplné uzdravení.
Tab. 2. Diagnostická kritéria serotoninového syndromu 
[Sternbach, 1991] Tab. 4. Kombinace léků a bezpečnostní časové odstupy 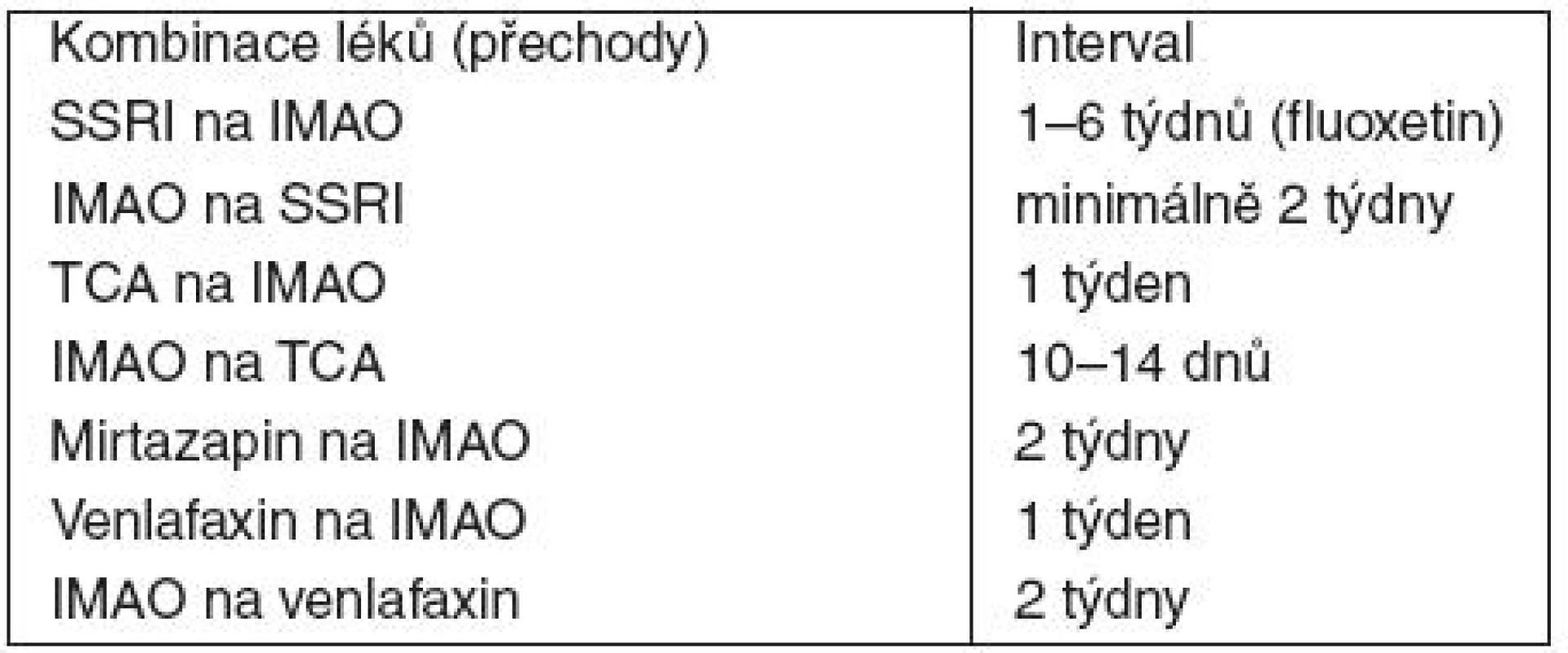
Kazuistika
Na ARIM Masarykovy nemocnice v Ústní nad Labem (MNUL) byla přijata 70letá pacientka, která se léčila pro arteriální hypertenzi, chronickou obstrukční plicní nemoc, diabetes mellitus II. typu na dietě, závažnou osteopenii s patologickými frakturami, chronický polytopní vertebrogenní algický syndrom, neurovegetativní labilitu, úzkostnou poruchu, generalizovanou artrózu a varixy dolních končetin. Podle záznamů užívala chronickou medikaci – AT1 (AngioTensin) blokátor (telmisartan), vápníkový blokátor (nitrendipin), venotonikum (tribenosid), hypolipidemikum (atorvastatin), preparát obsahující vápník, vitamin D, minerály, blokátor imidazolových receptorů (rilmenid), betablokátor (metoprolol), antihistaminikum (cetirizin), SSRI (citalopram), bronchodilatans (theophyllin) a inhalačně bronchodilatans a steroid (budesonid a formoterol). V den přijetí byla ráno, po celonočním bdění a neklidu s celkovou slabostí, nalezena RLP v posteli nemluvící, s bloudivými pohyby očí, bez křečové aktivity, s tachykardií, hypertenzí, s kvalitativní poruchou vědomí a glykémií 12,5 mmol . l-1. Lékař nalezl na místě dvě plata od DHC kont. (celkem 20 tbl.). Pacientka byla přivezena na Emergency MNUL pro suspektní intoxikaci léky. Stav se spontánně mírně zlepšil, na dotaz odpovídala s latencí, sebevražedný úmysl a větší množství požitých léků negovala. Byl odebrán materiál pro standardní toxikologického vyšetření, zavedena nazogastrická sonda, proveden výplach žaludku a podáno aktivní uhlí v obvyklých dávkách. Bylo zvažováno předávkování DHC (mióza, ale ne významná, proti tomu hypertenze a tachykardie). Stav se náhle zhoršil, došlo k agitovanosti, objevily se tonické křeče – pacientka již v této chvíli výzvě nevyhověla. V tomto stavu byla přivezena na lůžkové oddělení ARIM. Přetrvávala tachykardie (120/min.) a hypertenze (177/93 mm Hg), při křečích se pacientka škrábala nekoordinovaně po hrudi, měla trismus a bylo nutné použít mechanické omezení. Neurolog popsal masivní kvadruhypertonus, opistotonus (pod pacientku možno podložit ruku), svalové křeče byly provokované dotykem, hlukem, rozsvícením. Pacientka byla afebrilní. Jako příčinu stavu jsme diferenciálnědiagnosticky zvažovali intoxikaci neuroleptiky, tricyklickými antidepresivy a neuroinfekci (tetanus a vzteklinu). V laboratorním vyšetření byla zjištěna mírná hyperkapnie, známky dehydratace, leukocytóza, ostatní výsledky byly v mezích normy. EKG záznam byl fyziologický.
Po neurologickém vyšetření byla pacientka pro celkově špatný stav a masivní hypertonus hluboce sedována (Dormicum, Sufenta, SAS 1) a intubována při kontinuální relaxací (Arduan, TOF 0). Po intubaci došlo k poklesu MAP na 40 torrů, a byl proto nasazen kontinuálně noradrenalin. Na nízkých až středních dávkách se dařilo držet MAP na 75 torrů. Pro přetrvávající spastické dýchání (pacientka léčena pro CHOPN) byl podán Berodual mikronebulizací s dobrým efektem. Pokračovali jsme v podávání aktivního uhlí, zajistili centrální žilní a arteriální katétr. Byla provedena lumbální punkce k vyloučení neuroinfekce, s normálním biochemickým, cytologickým a kultivačním nálezem. Při pokračování diagnostického algoritmu byl volán infekcionista k vyloučení infekce tetanem. Tato infekce se zdála být méně pravděpodobnou, přesto byla podána TEGA, ALTEANA a krystalický penicilin. Maligní neuroleptický syndrom a anticholinergní syndrom se také jevily nepravděpodobné – v terapii pacientky nebyla použita neuroleptika nebo anticholinergika. Nepravděpodobná se zdála i maligní hypertermie, mimo jiné i proto, že pacientka byla afebrilní. Následovalo provedení CT vyšetření mozku s nálezem jen korové a periventrikulární atrofie. Diferenciálně diagnosticky jsme uvažovali o atypickém epileptickém statusu (na další den plánováno EEG), vzhledem k charakteru obtíží byla tato diagnóza méně pravděpodobná. Výsledky předběžného toxikologického vyšetření moče a žaludečního obsahu ukázalo pozitivitu testu na léky z chronické medikace (morfin – metabolit DHC a SSRI citalopram).
Druhý den ráno byla vysazena sedace , ale po odeznění relaxace se objevil opět hypertonus a provokované křeče. Pro zkvalitnění výsledků EEG vyšetření jsme omezili dávky benzodiazepinů. K hluboké sedaci na úroveň SAS 1 byl ale dále nutný propofol. Hypertonus při hluboké sedaci nebyl vyjádřen a pacientka byla již bez kontinuální relaxace. Nemocná potřebovala dále vysoké dávky sedativ. Hodnoty srdečních markerů a záznam EKG byly v normě. Zvýšený myoglobin odpovídal nejspíše proběhlému extrémnímu hypertonu. Amoniak byl v mezích normy, theophyllin pod terapeutickou hladinou. Teplota 38,1 °C reagovala na antipyretika a fyzikální chlazení.
Rozhodli jsem se pátrat v anamnéze. Ze zprávy záchranné služby jsme zjistili adresu a přes Policii ČR, která nalezla sousedku volající RLP, jsme získali kontakt na příbuzné. Ti donesli zprávy z předchozích vyšetření (psychiatra a ambulance bolesti) a léky, které pacientka brala – tři velké nákupní tašky plné poloprázdných krabiček (cca 400), s vesměs prošlými léky: ACE-inhibitory (více druhů), theophyllinové preparáty, tramadol v různých lékových formách, Algifen, vitamíny, řadu inhalačních β-2-mimetik a kortikoidů, vápníkové blokátory, SSRI (citalopram, sertralin) ve velkém množství a hlavně velké množství DHC a kodeinu. Pacientka – bývalá zdravotní sestra – podle rodiny léky celé roky schraňovala, neorganizovaně je užívala a nenechala si do léčby mluvit. Měla chronické bolesti, brala léky hlavně na bolest a nervy. Ošetřující lékař o této situaci nevěděl. Poslední dny byla agitovaná, neklidná, špatně spala. Manžel se synem odjeli na chatu.
Druhý den ráno po vysazení sedace byla nemocná opět agitovaná, ale již s menší intenzitou, na EEG jsme zaznamenali jen plošší křivku (důsledek sedace), bez ložiskových a epileptogenních změn. Po doplnění anamnézy byla stanoven jako příčina obtíží serotoninergní syndrom v život ohrožující podobě v důsledku kombinace SSRI (nejvíce asi citalopramu, ale i sertralinu) a DHC, kodeinu a tramadolu, vše zřejmě užívané ve velkých dávkách. Při dalším večerním odtlumení již pacientka nebyla tolik agitovaná, hypertonus byl mírnější. Vysadili jsme krystalický penicilin nasazený kvůli podezření na tetanus. Z laboratoře ve stejné době přišel výsledek dostatečné ochranné hladiny protilátek. Pacientku jsme další den odtlumili a extubovali. Provedená kontrolní vyšetření byla v mezích normy, kromě pozitivního močového nálezu. Ještě po několik dní přetrvávala agitace s nutností občasného mechanického omezení, ale mentální i fyzický stav se postupně lepšil. Pacientka byla nakonec po týdnu hospitalizace na JIP přeložena na standardní interní oddělení, k nastavení interní medikace a doléčení močové infekce. Psychiatrické konzilium provedené ještě na JIP doporučilo SSRI nenasazovat. Informovali jsme jak lékaře ambulance bolesti (kam pacientka pravidelně docházela), tak psychiatra pacientky (u nějž byla pacientka jednou na doporučení lékaře z ambulance bolesti, zprávu mu už ale nedodala) o proběhlém stavu. Za další dva dny pacientka v dobrém fyzickém a psychickém stavu propuštěna do domácího ošetřování.
Diskuse
Možné příčiny křečových stavů uvádí tabulka 5.
Tab. 5. Diferenciální diagnostika křečových stavů 
Vyloučením ostatních příčin křečových stavů se serotoninergní syndrom jeví jako nejpravděpodobnější příčina – v chronické medikaci SSRI a abúzus/otrava DHC, v toxikologii morfin (metabolit DHC). Kombinace těchto preparátů a v takových dávkách je z hlediska SS velmi nebezpečná. Avšak tato diagnóza patří mezi vzácné, proto bylo třeba v první řadě vyloučit možné běžnější příčiny, které mohly stav způsobit. Otravu DHC jsme vzhledem ke klinickému stavu pacientky vyloučili. Anticholinergní syndrom, maligní neuroleptický syndrom a maligní hypertermii jsme také vyloučili – chyběla nám vyvolávající noxa, také klinický obraz nezapadal do obrazu syndromů. Neuroinfekce či organické postižení CNS jsme prověřovali biochemickými (lumbální punkcí, latexovou reakcí) i zobrazovacími metodami (CT mozku). Vzteklinu jsme považovali vzhledem ke klinickému stavu, negativní anamnéze i epidemiologickému stavu za velmi nepravděpodobnou příčinu. Tetanus jsme také nepovažovali za pravděpodobný, ale protože se jej nepodařilo spolehlivě vyloučit (klinický obraz by mohl tetanu odpovídat), byli jsme nuceni, i při velkých pochybnostech, zahájit léčbu. Metabolický rozvrat (včetně jaterního či hypo/hyperglykemického kómatu) nemívá normální laboratorní hodnoty. Mírně zvýšený myoglobin odpovídal extrémnímu hypertonu. Uvažovaný vliv xantophyllinů téměř vyloučila jejich výrazně subterapeutická hladina. EEG a důkladné neurologické vyšetření vyloučily epileptický původ obtíží.
Ke konečné diagnóze významně přispěly získané anamnestické informace od rodinných příslušníků nemocné.
Závěr
Serotoninergní syndrom je vzácná jednotka, na kterou se pro její nízkou incidenci málo myslí. V našem případě jsme k ní dospěli pomocí vylučování všech ostatních možných diagnóz, které by se mohly podílet na kritickém stavu pacientky. Velmi nám pomohla pečlivá anamnéza od rodiny. Cílem této kazuistiky je upozornit na vzácný syndrom, který je potenciálně pro pacienta až život ohrožující.
Nebezpečnost i-MAO v kombinaci např. s pethidinem (Dolsin), ale i tramadolem, je dostatečně známá, ale SSRI jsou všeobecně považovány za bezpečné léky (obzvláště v porovnání s TCA). Jak ukazuje naše kazuistika, nemusí tomu tak být vždy. Navíc SSRI jsou běžnou medikací mnoha pacientů na oddělení intenzivní a resuscitační péče, proto je třeba věnovat velkou pozornost komedikaci. Pro lékaře v první linii (praktického lékaře, RLP, Emergency) je také důležité připomenutí, že pacient může navštěvovat řadu lékařů nezávisle na sobě, a pokud se všechna terapie nesejde v rukou jednoho lékaře (většinou praktického lékaře), může docházet i k tak bizarním polypragmaziím jako u zmíněné pacientky, která shromažďovala doma obrovské množství léků od různých lékařů a vytvářela z nich farmakologicky pozoruhodné, klinicky však velmi nebezpečné kombinace.
Došlo dne 10. 1. 2011.
Přijato dne 2. 4. 2011.Adresa pro korespondenci:
MUDr. Petr Vojtíšek
Stará 2520/45a
400 11 Ústí nad Labem
e-mail: vojtisek.p@volny.cz
Zdroje
1. Gut, J. Anticholinergika, Serotoninergika. Pediatrie pro praxi, 2005, 5, s. 201–202.
2. Mohr, P. Serotoninový syndrom – diagnostika, terapie, prevence. Psychiatrie pro praxi, 2001, 1, s. 117–120.
3. Verre, M. et al. Serotonin syndrome cause by olanzapine and clomipramine. Minerva Anestesiol., 2008, 74, p. 41–45.
4. Prokeš, M. Zvláštní typ lékové interakce: Serotoninový syndrom. [cit.2008-02-27]. Dostupný na www: <http://drugagency. cz/soubory/722896325929431.doc>
5. Gillman, P. K. Serotonin syndrome: history and risk. Fundam Clinical Pharmacology, 1998, roč. 12, s. 482–491.
6. Hamilton, S., Malone, K. Serotonin syndrome during treatment with paroxetine and risperidone. J. Clinical Psychopharmacology, 2000, roč. 20, s. 103–104.
7. Gillman, P. K. The serotonin syndrome and its treatment. J. Psychopharmacology, 1999, roč. 13, s. 100–109.
8. Brown, T. M., Skop, B. P., Mareth, T. M. Pathophysiology and management of the serotonin syndrome. Ann. Pharmacotherapy, 1996, roč. 30, s. 527–533.
Štítky
Anesteziologie a resuscitace Intenzivní medicína
Článek vyšel v časopiseAnesteziologie a intenzivní medicína
Nejčtenější tento týden
2011 Číslo 3- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
- Jak souvisí postcovidový syndrom s poškozením mozku?
- Léčba akutní pooperační bolesti z pohledu ortopeda
-
Všechny články tohoto čísla
- Zajištění dýchacích cest v roce 2011 aneb Přežije klasická laryngoskopie?
- Etorikoxib v premedikaci před tonzilektomií
- Intraoseální přístup do cévního řečiště při transplantaci jater
- Koncept ideální supraglotické pomůcky
- Úskalí pooperační péče po výkonech na krčních tepnách
- Serotoninergní syndrom – kazuistika
- Svalová slabost kriticky nemocných
-
Zajištění dýchacích cest – souhrny přednášek
Praha 11. 11. 2010 - Jedna lahvička léku pro více nemocných – racionalizace nákladů nebo cesta do pekel?
- Komentář k Dopisu redakci (Adamus M. Jedna lahvička léku pro více nemocných – racionalizace nákladů nebo cesta do pekel?)
- Jedna lahvička pro více pacientů – možnost nebo nesprávná praxe?
- Volební sjezd delegátů České lékařské společnosti J. E. Purkyně
- Anesteziologie a intenzivní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Svalová slabost kriticky nemocných
- Serotoninergní syndrom – kazuistika
-
Zajištění dýchacích cest – souhrny přednášek
Praha 11. 11. 2010 - Úskalí pooperační péče po výkonech na krčních tepnách
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání