FORMY OČNÍ LARVÁLNÍ TOXOKARÓZY V DĚTSTVÍ. PŘEHLED
Autoři:
Jan Krásný 1; Josef Šach 2
Působiště autorů:
Department of Ophthalmology, Královské Vinohrady, University Hospital, Prague, Czech Republic
1; Institute of Pathology, Královské Vinohrady University Hospital, Prague, Czech, Republic
2
Vyšlo v časopise:
Čes. a slov. Oftal., 2, 2022, No. Ahead of Print, p. 1001-1009
Kategorie:
Přehledový článek
doi:
https://doi.org/10.31348/2022/28
Souhrn
Cílem sdělení je seznámit s formami očních projevů visceral larva migrans u dětí, jak dokresluje rozsáhlá fotodokumentace. Oční larvální toxokaróza (OLT) má i v dětském věku rozdílné klinické projevy, kdy vliv má věkové zastoupení. Nejčastěji bývá přítomen periferní granulom oka často s trakčním vitreálním pruhem táhnoucím se z periferie sítnice k papile zrakového nervu. Následuje granulom zadního pólu oka zasahující většinou od makulární krajiny do střední periferie sítnice vždy s vitritidou. U dětí se může OLT projevit i postižením optického nervu (cystický granulom hlavy zrakového nervu nebo neuropatie s vitritreální reakcí), fulminativní endoftalmitidou a vzácně i difúzní chorioretinitidou. Diagnostika se opírá o klinický oftalmologický nález a také laboratorní vyšetření hladin protilátek s případnou eosinofilií. Histologické vyšetření může prokázat kulovitou polyploidní osifikaci v cévnatce na zadním pólu oka jako následek fibrotizace a kalcifikace postupující z v okolí vstřebané larvy. Celková kombinovaná léčba anthelmetikem a kortikoidem je obtížná, a ne vždy přináší dobrý efekt ve smyslu uspokojivého zlepšení zrakové ostrosti. Projevy OLTu malých dětí jsou stále spojeny v diferenciální diagnóze s retinoblastomem a klinikou dalších nitroočních chorob.
Klíčová slova:
oční larvální toxokaróza – visceral larva migrans – antihelmetika
ÚVOD
Projevy larvální toxokarózy vyvolávají u lidí larvy třetího stádia převáženě psích škrkavek (Toxocara canis) nebo kočičích škrkavek (Toxocara cati). Onemocnění má několik klinických forem. Po nákaze může vzniknout forma viscerální, oční či smíšená. Další formou je skrytá („covert“), která je subklinická a pravděpodobně nejčastější. Tito dospělí oblí červi (nematodes) žijí v tenkém střevě psů a koček. Jejich samičky po kopulaci denně uvolní do střevního obsahu vajíčka. Po defekaci se v půdních substrátech nebo ve vodě za příznivých klimatických podmínek vyvinou larvičky, které zde mohou přežívat. Jedná se tedy o všudy přítomného parazita [1]. Vyplývá z toho problematika geofagie dětí, které se takto mohou nakazit, neboť ve vzorcích půdy byla v 10–30 % nalezena přítomnost vajíček či larev v místech veřejných parků, ale i dětských hřišť [2]. Dalším možným způsobem nákazy je požití larev či vajíček v nedokonale tepelně zpracovaném mase infikovaných zvířat. Po požití mohou larvy napadnout paretického hostitele, tedy i člověka, neboť se v zažívacím traktu ze zralého vajíčka uvolní. Dále se v něm už nevyvíjí, pronikají z tenkého střeva do krevního řečiště. Krví, ale i vlastní migrací, mohou pronikat do nejrůznějších orgánů včetně oka [1].
Poprvé byly larvy odhaleny v roce 1950 H. Wilderem při rozboru 46 enukleovaných očí dětí s retinoblastomem, pseudogliomem a nejasnou endoftalmitidou. U 24 z nich odhalil larvy či larvální kapsule oblých červů doprovázené přítomností eozinofilů [3]. O dva roky později P.C. Beaver se spolupracovníky odhalili toxokarózu jako střevního parazita psů a koček ve spojitosti s lidským onemocněním, kterou pojmenovali jako viscerální larvou migrans (VLM), provázenou eozinofilií [4]. V roce 1956 R.L. Nichols revidoval histologické preparáty H. Wildera a většinu larev identifikoval jako Toxocara canis [5]. Podrobné vyšetření zánětlivých nitroočních ložisek prokázalo granulomy s přítomností eozinofilů, dále jsou zde zastoupeny epiteloidní buňky, plasmocyty, makrofágy, polymorfonukleární leukocyty a fibroblasty [6].
První zprávy o pravděpodobném výskytu oční formy larvální toxokarózy (OLT) se objevují v Československu na přelomu 60. a 70. letech minulého století [7–10]. Zásadní přelom v diagnostice larvální toxokarózy v České republice přináší zavedení moderních sérologických metod na konci minulého století, které jsou spojeny se jménem manželů M. Uhlíkové a J. Hübnera, jejichž práce dosud neztratily na významu [11–14]. Tento fakt se odrazil v několika zásadních článcích v České a slovenské oftalmologii na začátku tohoto století. Především je to rozbor forem OLT z hlediska hledání příčin a způsobu očního postižení, věkové četnosti očního postižení a o důležitosti sérologické diagnostiky v diferenciálně diagnostických rozvahách [1]. Dále to byla možnost diagnostiky toxokarózy z moku přední komory oka [15] či význam pars plana vitrektomie (PPV) v její diagnostice [16]. První dvě práce nedoprovázela fotodokumentace OLT, třetí práce spolu s kapitolou v monografii „Uveidy“ představila obrazy periferního granulomu [17]. Jednotlivé formy OLT se neliší podle věku postižení, mají svoji klinickou charakteristiku podle lokalizace. Prevalence OLT se udává 9,7 případů na 100.000 školních dětí při zahrnutí definitivních a vysoce suspektních projevů této parazitární infekce [18].
Systémové projevy VLM
Systémová viscerální infekce má všeobecně známé příznaky zánětů, a to je horečka a nevolnost, dále je to kašel, avšak většina pacientů je asymtomatická [6]. U dětí se přidává lymfadenopatie nebo hepatospenomegalie, ale také altralgie či artritidy [19] či bolesti břicha a nechutenství [20]. Dále jsou to nespecifické symptomy spojené s centrálním nervovým systémem: spavost či naopak hyperaktivita [19] a především bolesti hlavy [19,20]. Úvahu o možnosti parazitárního onemocnění přináší vyšší eozinofilie, může být 20–80 %, při současně zvýšené lymfocytóze v několikatisícových hodnotách, hlavně v prvních měsících onemocnění. Počet pozřených zralých vajíček spolu se současným imunitním stavem hostitele potom zřejmě určuje závažnost a rozsah klinických příznaků larvální toxokarózy. Těžký celkový průběh onemocnění VLM při myokarditidě či postižení centrálního nervového systému zahrnující fokální a generalizované záchvaty za spoluúčasti excesivní imunologické odpovědi na parazitární infekci může vést až ke smrti [6]. U dětí je daleko častěji zastoupená viscerální forma, OLT představuje jen 5 % [20]. Názor na příčinu vzniku očního postižení není dosud jednotný. Jestliže se nevyvine dostatečná imunita, larvy mohou volně migrovat krevní cestou bez zvláštního omezení. Pro klinický obraz je rozhodující, zda proniknou z retinální artérie či choroidálními cévami [21]. Histologicky byla potvrzena přímá invaze larvami Toxocara pro periferní vitreoretinální formu postižení [12]. Vlastní zánětlivá reakce nitroočních tkání vzniká s největší pravděpodobností senzibilizací hostitele zplodinami, které jsou vylučovány larvami či larválními antigeny, které se uvolní z odumírajících či mrtvých larev, což může být i důsledek léčby [6]. Po rozpoznání antigenní povahy hlísta je odstartována obranná imunitní reakce imunokomplexového a pozdního buněčného mechanismu, která přispěje k usmrcení larvy. Právě uvolnění dalších antigenů akcentuje další imunitní odpověď pod obrazem zánětlivé granulomatózní uveitidy [22]. U solitární OLT eozinofílie nepřesáhne 5–7 % a počet lymfocytů bývá v normě, hladiny protilátek bývají nízké až eventuálně střední. Vyšší hodnoty potom svědčí pro smíšenou formu [1].
Klinický obraz OLT
Oční projevy bývají unilaterální bez rozdílu zda se jedná o pravé či levé oko [23], což je důležitý diagnostický symptom spojený s poklesem zrakové ostrosti (ZO), který si v počátcích pacient nemusí uvědomit. Oboustranné postižení je raritní, ale možné. Až zásadní pokles vidění pro sklivcové projevy přivádí pacienta k lékaři. U dětí to může být i strabismus pro pokles ZO či leukokorie. OLT se uvádí jako jedna z možných příčin zadní uveitidy v dětské populaci vzhledem k výše uvedené geofagii v 3–18 %. V české populaci je postižení dospělé populace zásadní. Ze sestavy 182 nemocných s očními projevy bylo dětí do 15 let jen 6 %, zatímco ve věku 36 až 75 let to představovalo 73 % [1], což odpovídalo i zastoupení viscerální formy v naší republice [13]. Popisuje se častější postižení chlapců než dívek. Pro tři základní formy očního postižení se uvádí i rozdílné věkové zastoupení: pro fulminantní endoftalmitidu je to 2.–9. rok života, která je nejvíce závažná. Granulom zadního pólu oka má hlavní zastoupení v rozmezí 6–14 let. Nejčastější projev této parazitární infekce představuje periferní granulom, patří do obrazu OLT především v dospělosti [2,17]. Četnost zastoupení periferního granulomu se u dětí pohybuje okolo 60 % [25,26] a všeobecně se udává bez rozdílu věku v 44 % [6,25]. Vlastní masy granulomu OLT jsou vysoce reflektivní a potvrzují úzký kontakt vitreálních membrán se sítnicí [26]. Odpovědí na infiltraci larvami (předpokládá se několik, nikoliv jen jedna) je masivní lokální zánět v podobě granulomu bělavé barvy, který zahrnuje postižení sítnice a periferního sklivce. Důležitým faktorem pro možnost vzniku granulomu toxokarové etiologie je anamnestický údaj o požití syrového masa, což platí hlavně pro dospělé pacienty [27,28].
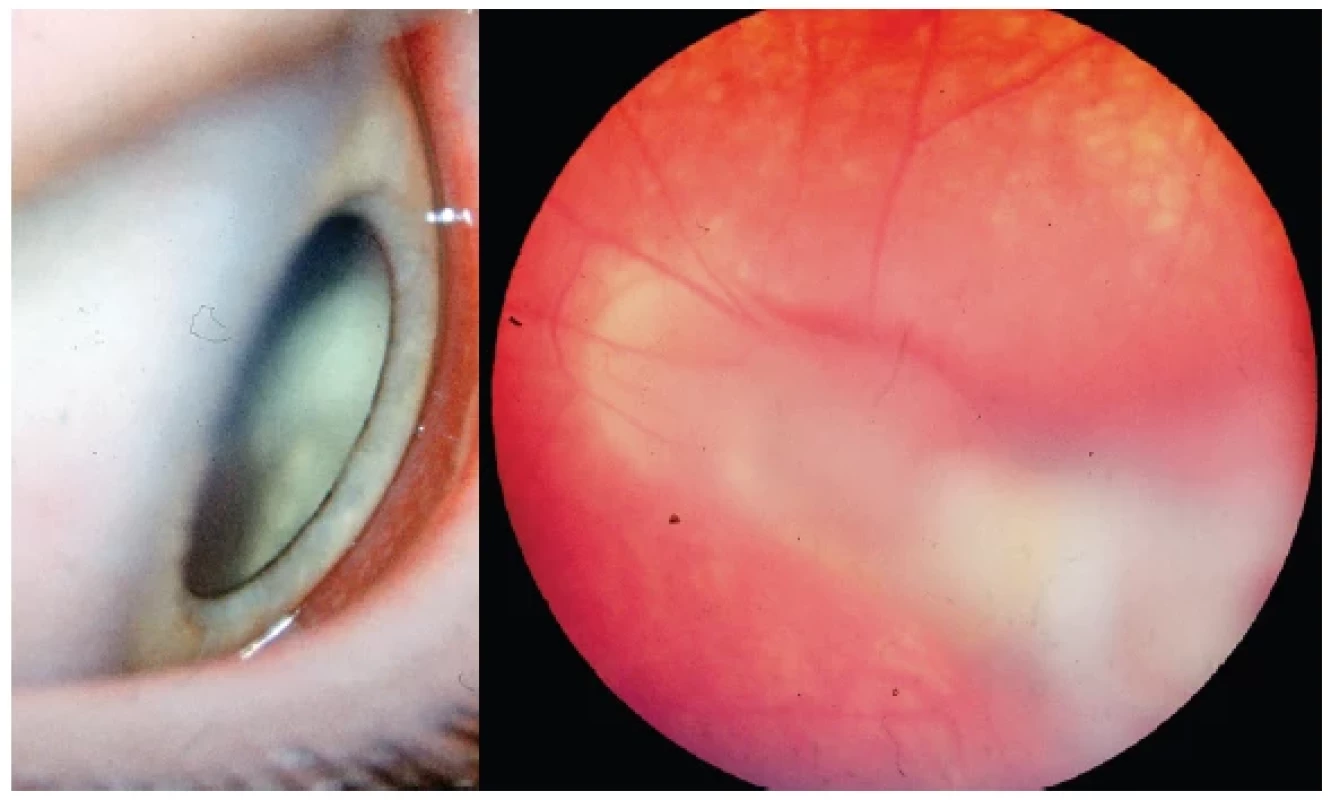
Periferní granulom se projevuje parazitárním postižením v periferii očního pozadí, kdy není zcela jasné, proč toxokarové larvy dávají zdánlivou preferenci této lokalizaci. Může to odrážet lokální retinální a choroidální vaskulární mikroanatomii vzhledem k tomu, že většina šíření tohoto parazita je zpočátku hematogenní. Zánět může být difúzní (Obrázek 1 – vlevo) a může připomínat „snowbank“ klasický pro pars planitidu, což může být diferenciálně diagnostický problém. Sklivcové membrány často obklopují vlastní granulom po obvodu a vstupují hlouběji do sklivce a méně často směřují transvitreálně. Kontrakce těchto membrán potom vyvolá trakci v podobě radiálního sítnicového falciformního záhybu. Granulom se může takto táhnout z periferie až k papile zrakového nervu (Obrázek 1 – vpravo). Mnoho periferních lézí, hlavně nasálně, je asymtomatických. Teprve vitreální zánětlivá reakce či trakce sítnice s postižením makuly může vyvolat až odchlípení sítnice. Při diagnostickém rozboru se potom odhalí vlastní zánětlivý proces.
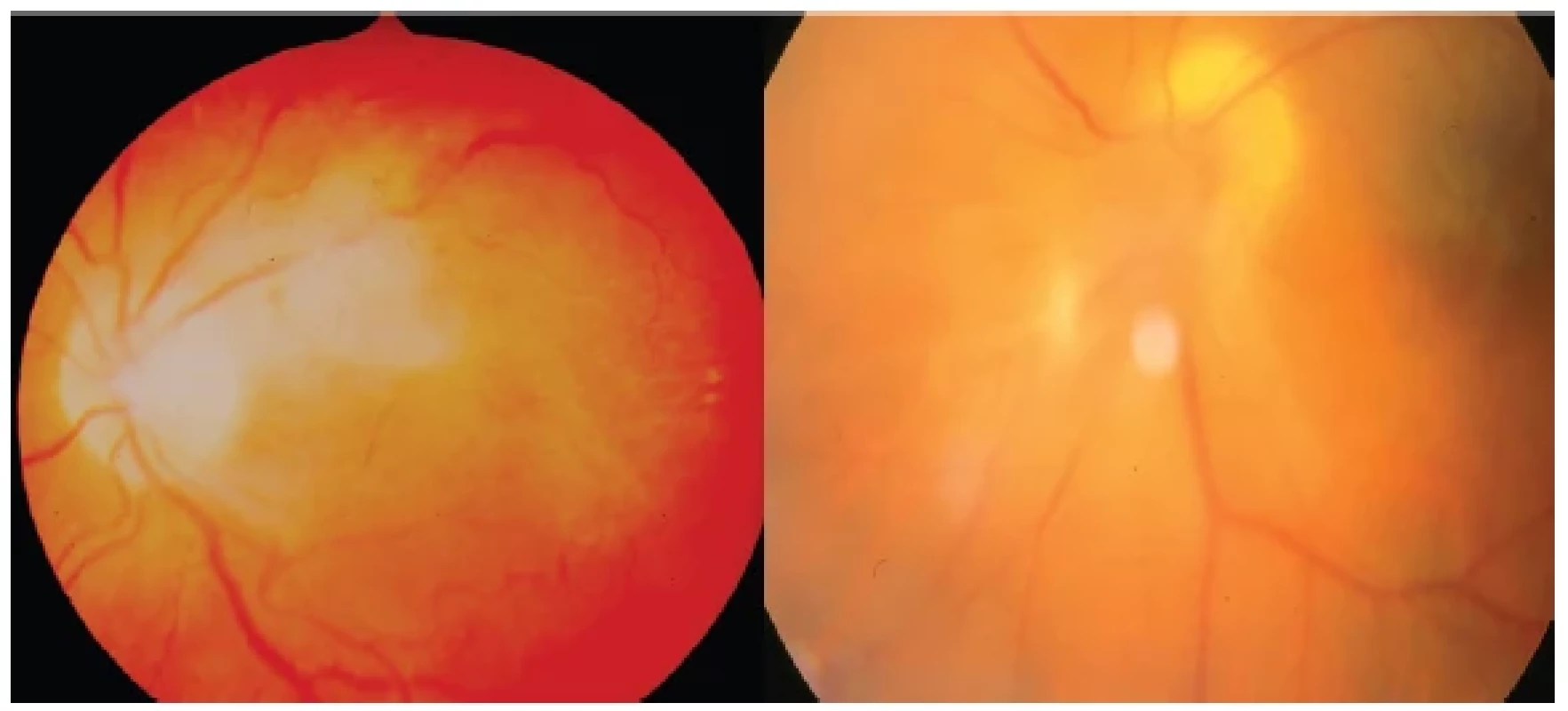
Granulom zadního pólu oka může být lokalizován kdekoliv na zadním pólu, hlavně bývá subfoveolárně (Obrázek 2 – vlevo) či juxtapapilárně (Obrázek 2 – vpravo), jedná se granulomatózní masu většinou o velikosti jednoho papilárního diametru, může být i větší. Její barva bývá bělavá či šedobělavá. Dlouhodobě trvající proces může vést k sekundární atrofii či naopak hyperplasii retinálního pigmentového epitelu. Doprovází ji vitritida různého rozsahu od minimální až k masivní s tvorbou préretinálních membranózních struktur (Obrázek 3 – vlevo). Granulom zadního pólu může být lokalizován bez kontaktu s makulární oblastí či zrakovým nervem i o větším průměru (Obrázek 3 – vpravo), což představuje nutnost diferenciálně diagnostické rozvahy ve vztahu k retinoblastomu. U malých dětí většinou souvisí jeho odhalení až s vývojem strabismu pro deprivaci ZO či při zjištěném poklesu vidění v rámci preventivních prohlídek.
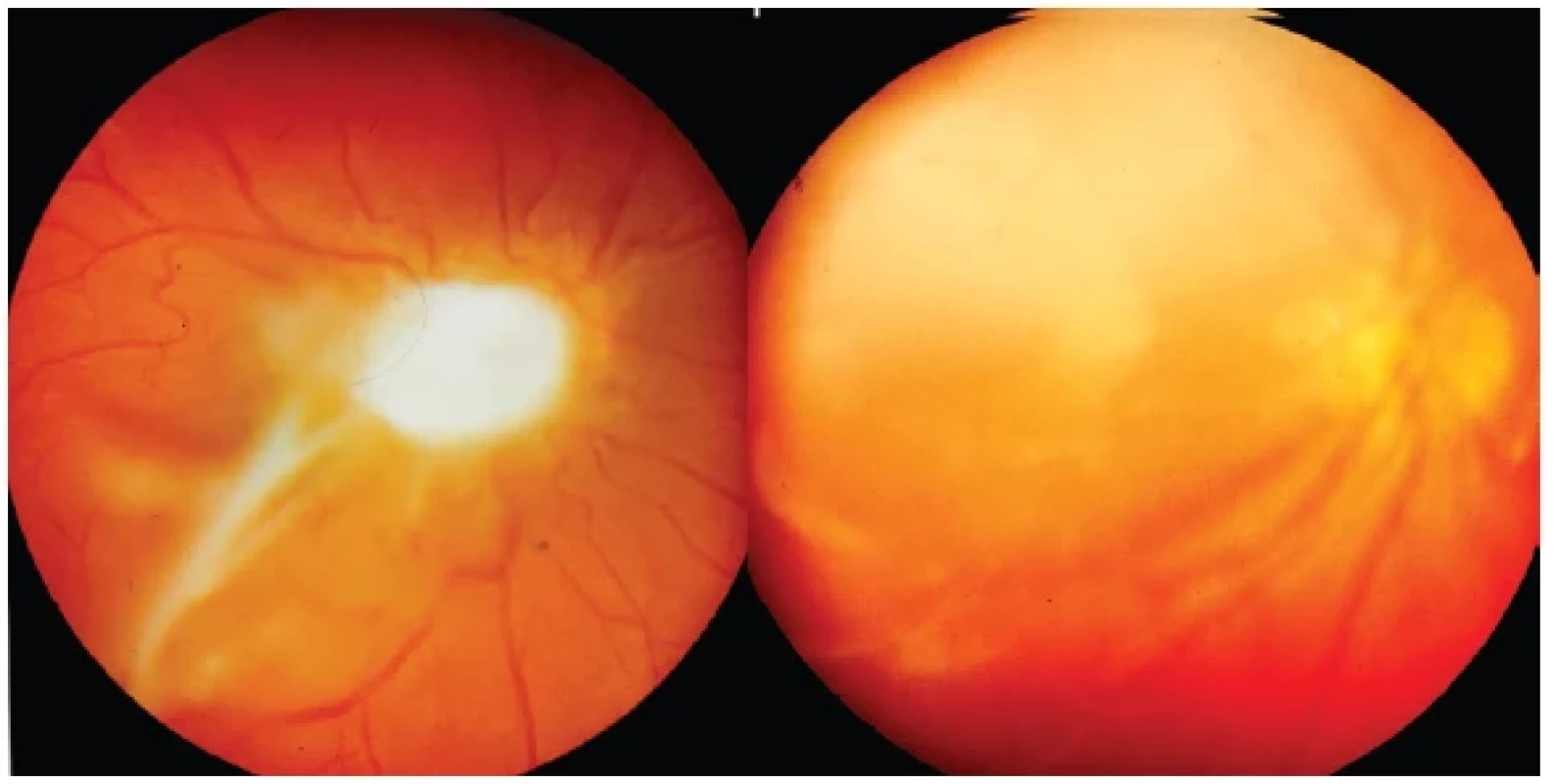
Postižení optického nervu představuje klinický obraz neuropatie provázený vitreoretinální reakcí v jeho okolí (Obrázek 4) nebo cystou v oblasti hlavy nervu (Obrázek 5). Obraz toxokarové optické neuropatie může být rozdílný, je to bolestivá akutní zánětlivá neuropatie nebo sektorovitý edém či difúzní edém většinou s peripapilární infiltrací.
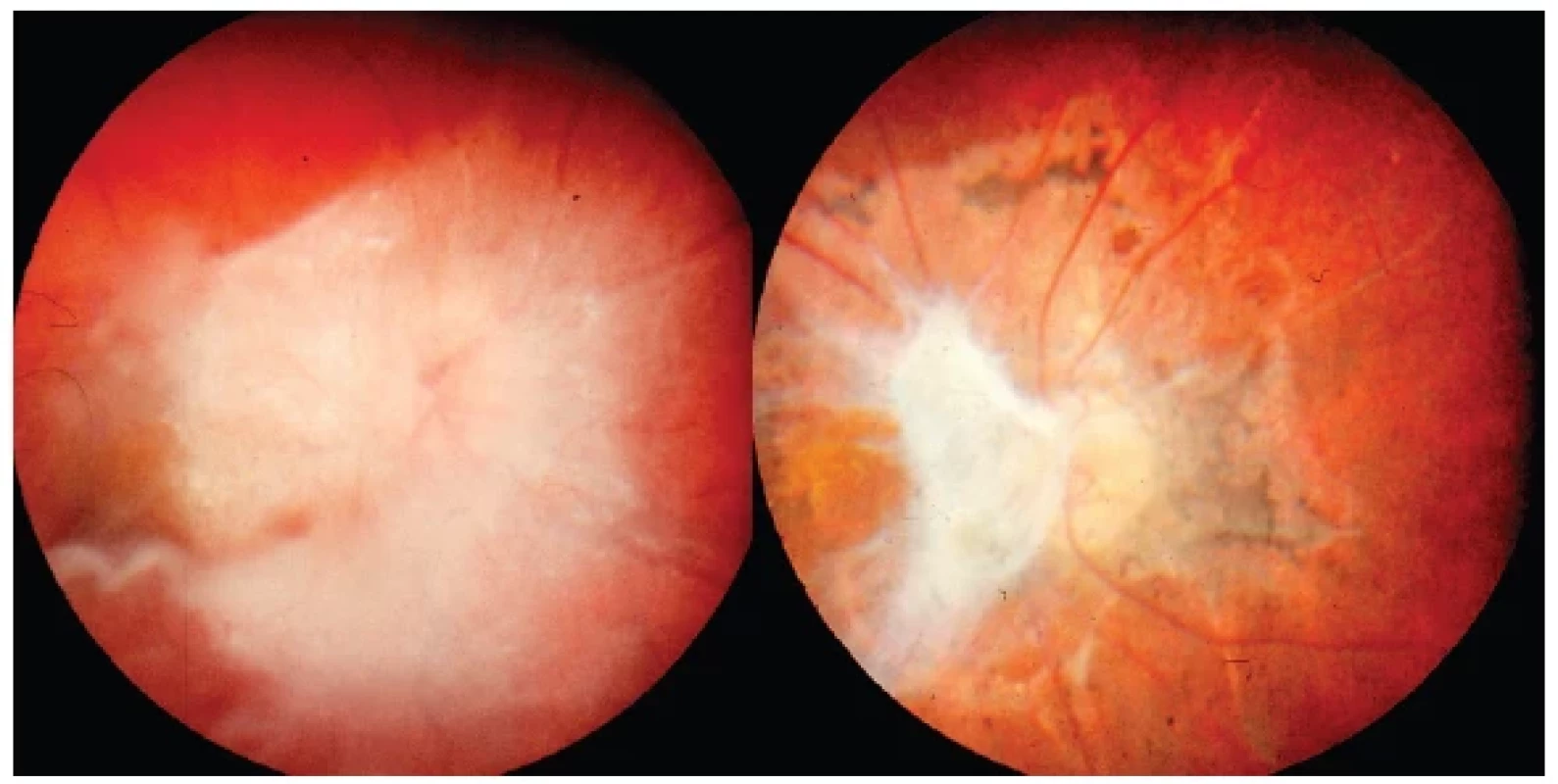
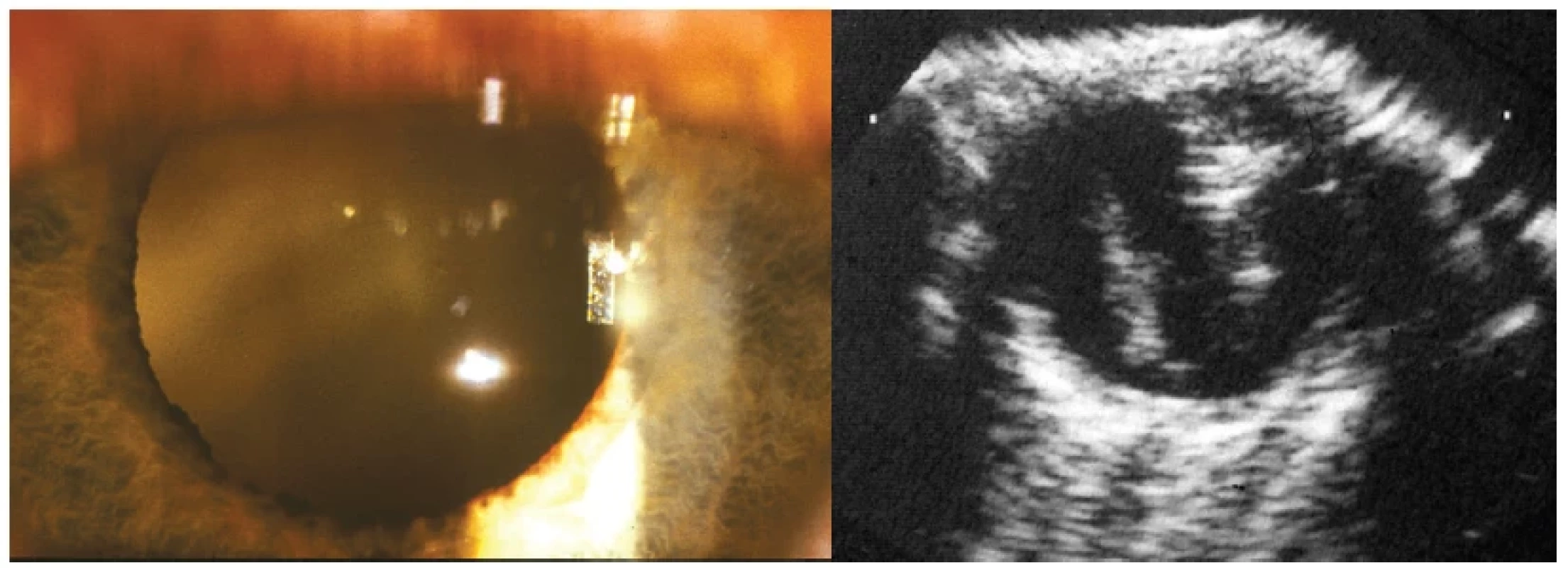
Endoftalmitis toxokarové etiologie může provázet i bolestivost a obraz smíšené injekce na bulbu v počátku onemocnění, reakce v přední komoře bývá často minimální, avšak projevem může vzácně být až hypopyon či okluzní fibrinová membrána v zornici. Zásadní obraz představuje celulární reakce ve sklivci znemožňující diferenciaci očního pozadí (Obrázek 6 – vlevo) až do obrazu leukokorie. Na ultrazvukovém obraze (UZ) je u toxokarózy přítomná nepravidelná hyperechogenita sklivce podmíněná buněčnou infiltrací a lze odhalit i hutný vazivový pruh vitreoretinální trakce táhnoucí se od centrální oblasti do periferie (Obrázek 6 – vpravo), což je dalším diferenciálně- diagnostickým problémem ve vztahu k retinoblastomu.
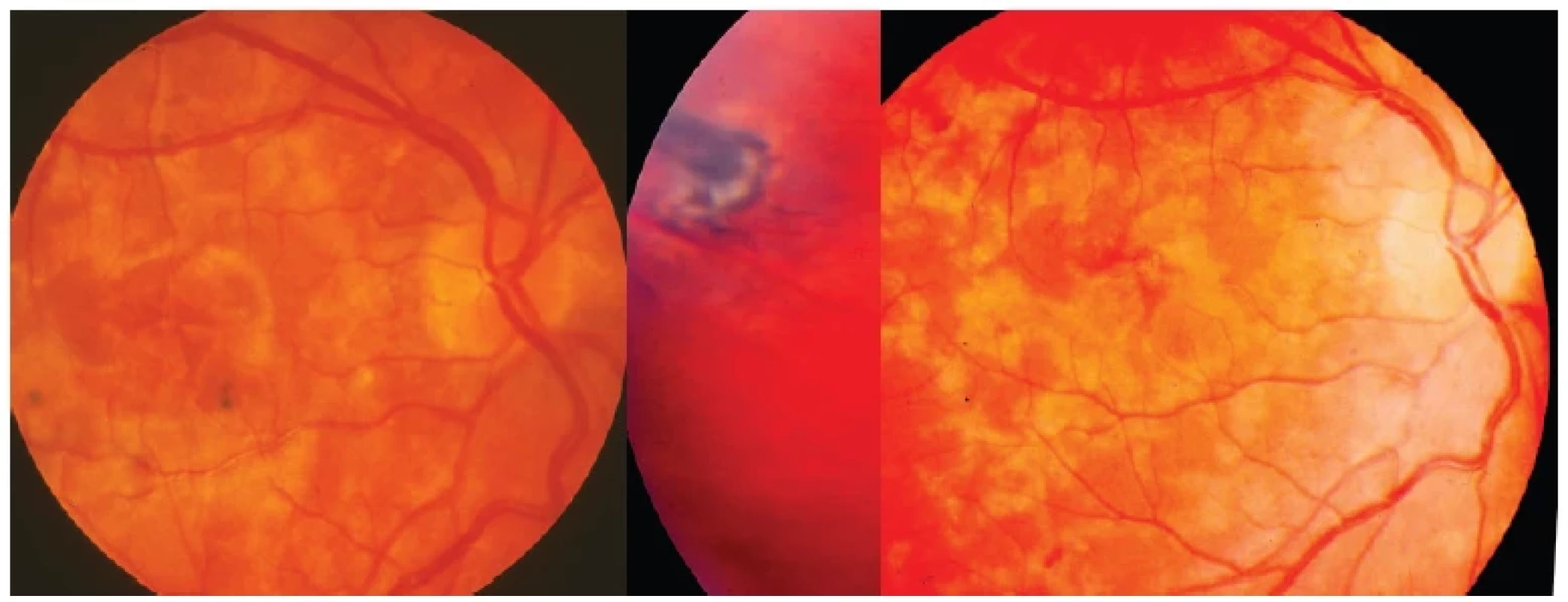
Difúzní chorioretinitida je zvažována jako další možnost OLT, přestože toto nebylo přesvědčivě identifikováno. K jejím obrazům patří difúzní jednostranná subakutní neuroretinitida (DUSN), která obvykle vede k vážné ztrátě zraku, navíc může tato infekce mít dopad i na druhé oko. Difúzní chorioretinitida či DUSN je raritní, charakterizovaná podobou (Obrázek 7) jednotlivých drobných bělavě žlutých ložisek centra i střední periferie s možným edematózním postižením hlavy zrakového nervu. Uvažuje se, že její příčinou je subretinální meandrující migrace larev vzhledem k ojedinělým pozorováním [6]. Vše naznačuje, že je způsobena osamělým neidentifikovaným červem, ale do dnešního dne jen malé množství hlístic bylo objeveno v takto postižených očích [29]. Proto by se zde mohla uplatnit smíšená forma toxokarózy v případě vysokých hladin protilátek, kdy zánětlivá reakce v nitroočních tkáních vzniká senzibilizací hostitele larválními antigeny šířenými krví [1]. Bylo dokumentováno i oboustranné postižení u desetileté brazilské dívky. Hlístice o velikosti 500–660 μm byly objeveny na obou očích v horním, respektive dolním temporálním kvadrantu sítnice [30].
Postižení předního segmentu patří k raritním pozorováním jen u dospělých pacientů, neboť u dětí nebylo zaznamenáno. Byl popsán přestup larvy přes artérie korneosklerálního limbu do čiré rohovky [6], což může vyvolat skleritidu i keratitidu v počátcích onemocnění [1]. Významné je české pozorování larvy v čočce profesorem Karlem. V první fázi onemocnění u mladé ženy byl popsán vývoj periferního chorioretinálního granulomu a až následně byla několikrát pozorována larva v oblasti zornice pod předním a zadním čočkovým pouzdrem i přes intenzivní léčbu antihelmintiky [31]. Případné samostatné postižení spojivky nebylo zatím prokázáno [6].
Diferenciální diagnostika OLT u dětí
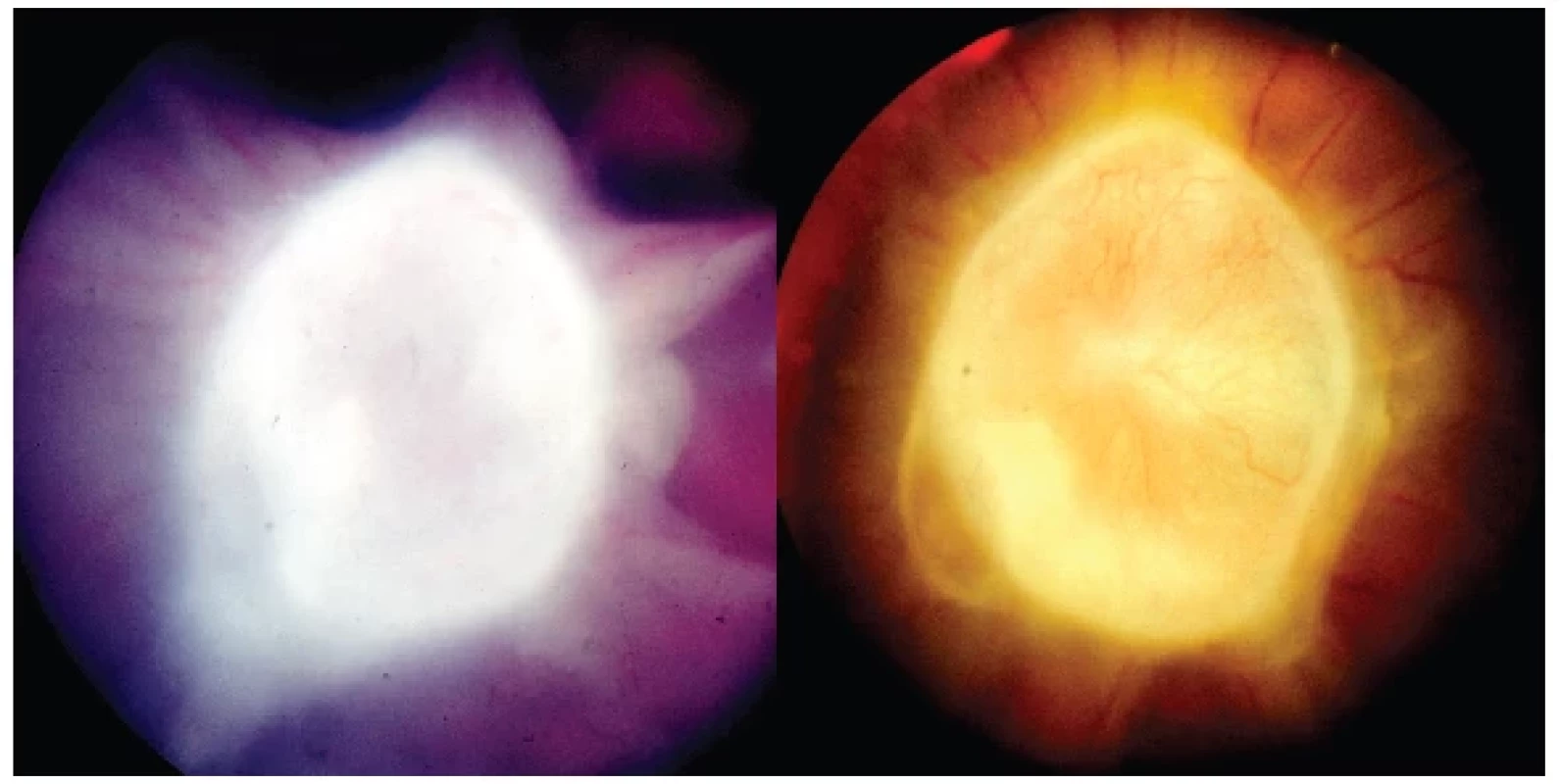
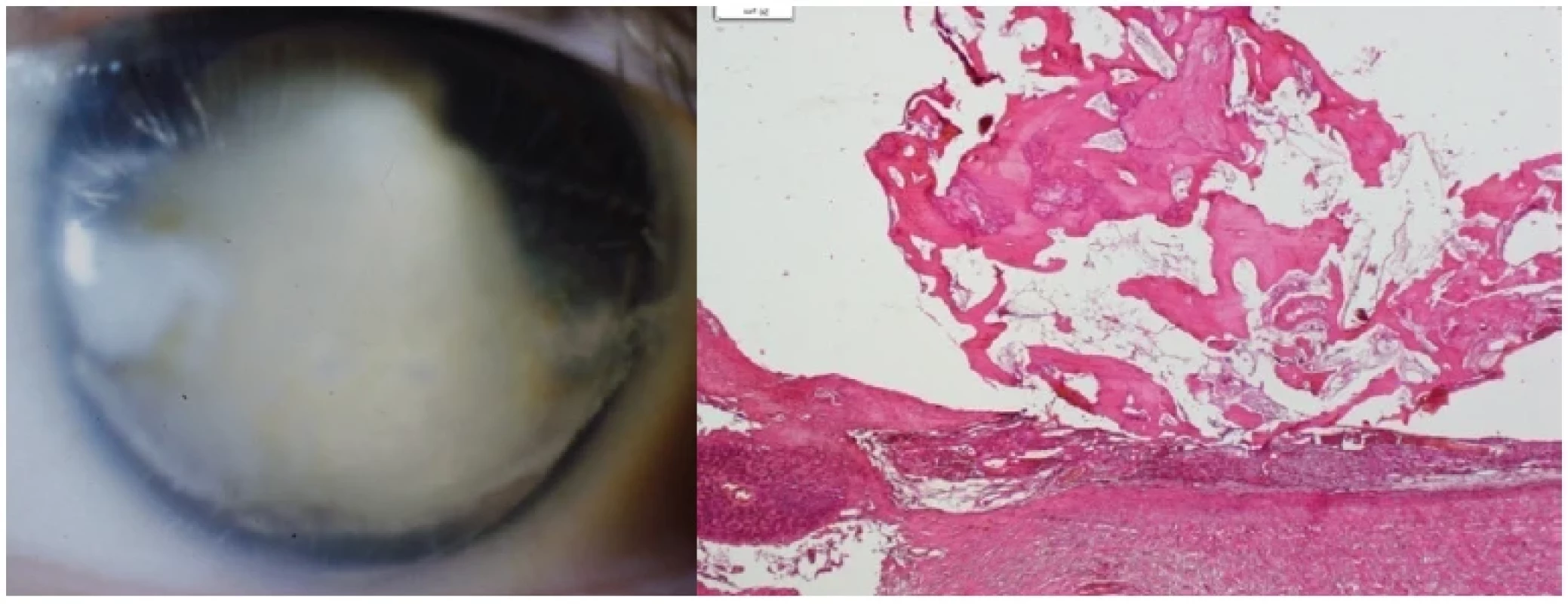
U malých dětí OLT představuje zásadně významný diferenciálně diagnostický problém simulující retinoblastom. Musí se vyloučit další onemocnění, které mají obraz leukokorie: perzistence primárního hyperplastického sklivce (PHPV) v 19 %, jizevnatá forma retinopatie nedonošených v 13,5 % a dále jsou to vrozená onemocnění zadního pólu oka. Mezi tyto stavy patří kolobóm cévnatky a zrakového nervu v 11,5 %, Coatsova choroba v 6 % a syndrom Weve v 5,5 %. Zadní uveitidy mají také diferenciálně diagnostický význam v 16,5 %, z toho samostatná OLT tvoří 9 % [32]. Tato onemocnění jsou stále diagnostickým problémem [33]. Diferenciální diagnostika [2, 6, 34, 35]: Prvá dvě uvedená onemocnění mají anamnestický podložený vznik již při narození. PHPV je spojena s klinickým obrazem mikroftalmu, často provázeným kataraktou, a především retrolentikulárními masami, vše by mělo být diagnostikováno v prvních měsících po narození. Jizevnatá forma retinopatie nedonošených představuje oboustranné onemocnění s jasnou anamnézou předčasného porodu a poporodní péče. UZ u obou onemocnění odhaluje trychtýřovité odchlípení sítnice nebo vazivové pruhy táhnoucí se od papily zrakového nervu. Coatsova choroba nemá v obraze vitreoretinální membrány, sklivec je čirý, na očním pozadí lze odhalit krystaly cholesterolu a eventuálně teleangiektasie. UZ odhaluje subretinální exsudaci. Familiární exudativní vitreoretinopatie (syndrom Weve) je charakteristická retinálním falciformním pruhem, podobným perifernímu granulomu OLT. Jedná se oboustranné autozomálně dominantní onemocnění často provázené mikroftalmem. Zásadní význam má odlišení tohoto projevu OLT od retinoblastomu, nejčastějšího maligního očního onemocnění malých dětí. I zde může napomoci UZ, který nepotvrdí kalcifikace u toxokarózy na rozdíl od retinoblastomu, ale jejich nepřítomnost tumor nevylučuje. Proto stále zůstává toxokaróza maskující diagnózou tohoto nádoru, někdy odhalená až histologicky po enukleaci. OLT je formována do granulomů či eozinofilních pseudoabscesů, s možností trakčního odchlípení sítnice doplněnou o subretinální tekutinu. Retinální pigmentový epitel atrofuje s porušením Bruchovy membrány [6]. Až později se projeví přestavba granulomů jejich postupnou fibrotizací až kalcifikací [36], což potvrzuje nález z enukleovaného bulbu pro jeho ftízu (Obrázek 8 – vlevo) vyvolanou toxokarovým zánětem. Kulovitá osifikace o průměru cca 8 mm, lokalizovaná v cévnatce, s polypoidní prominencí do sklivcové dutiny v původně formovaném zánětlivém infiltrátu (Obrázek 8 – vpravo).
V diferenciální diagnóze může napomoci vyšetření komorové vody, u retinoblastomu se odhalí laktodehydrogenáza [37] u toxokarózy jsou to její protilátky [15,16].
Laboratorní diagnostika OLT
Pro potvrzení diagnózy toxokarózy bylo v počátcích rozhodující odhalení a nalezení larvy ve fragmentu tkáně. Až od 70. let minulého století se začala využívat sérologická diagnostika, která používala antigeny připravené z dospělých červů, ale nedávala uspokojivé výsledky. Teprve De Savigny v roce 1975 připravil sekrečně-exkreční antigen (ESA) produkovaný živými larvami. Tento antigen už byl vysoce rodově specifický a byl využitý v reakci ELISA (enzyme-liked immunosorbent assay) pro jednotlivé formy larvální toxokarózy [1]. Již titr 1:8 je senzitivní pro OLT [2,38], pokud tomu odpovídá klinický oční nález, na druhou stranu je nutno si uvědomit, že je 55–80% promořenost dětské populace, což tuto diagnostiku nečiní zcela specifickou [6]. Prevalence protilátek (the antibody backgraund) se v populaci uvádí mezi 40–80 %. Hladina protilátek vyšší než 1:32 je již v 78 % senzitivní pro detekci toxokarózy [38]. Národní referenční laboratoř pro tkáňové helmitózy při IPVZ (Institut pro postgraduální vzdělávání) v Praze vypracovala vlastní modifikaci [13], kdy výsledky jsou vyjádřeny optickou denzitou, kterou do 0,4 hodnotí jako negativní, v rozmezí 0,4–0,5 jako hraniční. Hodnoty 0,5–0,9 se posuzují za nízkou pozitivitu, 0,9–1,2 jako střední a nad 1,2 značí hodnoty vysoké. Zároveň určují testem avidity (vyjadřující pevnost spoje mezi daným vzorkem séra a multivalentním antigenem) IgG pravděpodobnosti čerstvé nákazy při její nízké hladině či nákazu dlouhodobějšího trvání při její vysoké hladině [7]. Nedílnou součástí diagnostiky je porovnání hladin protilátek v séru a v nitroočních tekutinách. Užití tzv. Goldmannova-Witmerova koeficientu (GWC) napomáhá k potvrzení OLT, neboť se předpokládá tvorba nitroočních specifických protilátek IgG. V imunologické diagnóze OLT však neexistuje systematické hodnocení aplikace GWC [39]. Předpokládá se pozitivita nejméně 1,4násobku pro hladinu v nitrooční tekutině oproti séru. Čeští autoři prokázali obdobnou hladinu toxokarových protilátek IgG v séru a sklivci či vyšší, navíc ve sklivci zaznamenali přítomnost eozinofilů na rozdíl od séra [16]. Slovenští autoři potvrdili pozitivitu toxokarových protilátek v komorové vodě v méně případech než pozitivitu v séru [15], to nevyloučilo možnost smíšené formy [9]. Vyšší výtěžnost GWC byla prokázána u dětí než u dospělých a může být užitečná, pokud se u pacienta objevila zadní uveitida či vitritida nejasné etiologie. Sérologický screenig je pouze informativní pro vlastní diagnózu tohoto parazitárního onemocnění [40]. Vysoká produkce specifických protilátek IgG v rámci GWC byla v korelaci s produkcí nespecifické IgE [39]. U dětí diagnózu larvální toxokarózy podpořil nález vyšší eozinofilie a hypergamaglobulinémie E. Čím mladší bylo dítě, tím byly vyšší hladiny [20]. Právě vysoká eozinofilie ukázala na možnost diagnózy toxokarózy na prvním místě, z 1000 vyšetřovaných to bylo u poloviny, až další v pořadí to byly teprve alergické nemoci a vedlejší reakce na léky [41]. Souvislost mezi vysokou eozinofilií a pozitivitou toxokarózových protilátek IgG metodou ELISA potvrdila jejich vyšší statisticky významné zastoupení oproti nepřítomné patologické eozinofilii [42]. U pacientů s eozinofilií nad 10 % byly toxokarózové protilátky IgG metodou ELISA v 30 % pozitivní, zatímco metodou western blot byly prakticky v 50 % pozitivní [43]. Pro diagnostiku OLT hrají významnou roli klinické zkušenosti oftalmologů, ale vždy musí být podpořeny pomocnými diagnostickými metodami [19]. U postižených dospělých pacientů pomohla k diagnóze přítomnost eozinofilie a v ELISA byly přítomné pouze anamnestické hodnoty IgG s ověřeným anamnestickým údajem o požití syrového masa [27]. U dospělé ženy rovněž po požití syrového masa byl pro pokles vidění detekován edém papily zrakového nervu s cystickou lézí s peripapilárním serózním odchlípením sítnice. Pro potvrzení toxokarové etiologie hovořila eozinofilie a sérová pozitivita IgG [28].
Léčba OLT
OLT může být léčena konzervativně nebo chirurgicky v závislosti na závažnosti nitroočního zánětu. Medikamentózní terapie je na prvním místě při řešení aktivního zánětu, podle současného standardu jsou to kortikosteroidy. Slouží k redukci sklivcových opacit a tvorby membrán. Úloha antihelmetické terapie pro OLT zůstává kontroverzní, protože nebyly provedeny žádné randomizované kontrolované studie o použití antihelmetických látek, a to jak intraokulární farmakokinetické, tak farmakodynamické. Vychází se ze studií pro systémovou toxokarózu. Základ její léčby tvoří deriváty benzimidazolu. Albendazol (20 mg/kg/den) se podává po dobu 1 až 2 týdnů, silně inhibuje migraci larev. Obecně se albendazol podává u OLT v dávce 400 mg dvakrát denně u dětí a 800 mg u dospělých [17,38] po dobu až 3 týdnů. Abendazol se zdá účinnější než thiabendazol (50 mg/kg/den) doporučený jen po dobu 3–7 dní [38]. Navíc abendazol je jediným antihelmetikem, které působí proti všem vývojovým stadiím hlístů (vajíčko, larva i dospělý červ). Mechanismus účinku předpokládá degeneraci mikrotubulů střevních buněk červů a zároveň snižuje tvorbu ATP (adenosin trifosfátu), čímž vyčerpává energii a snižuje jejich motilitu. Zabíjí tím i dospělé hlísty. Thiabendazol inhibuje fumarat reduktázu, což snižuje absorbci glukózy. Fumaráza je terminální akceptor v metabolismu hlístů, nikoliv však u savců [44]. Role samostatné antihelmetické terapie u OLT zůstává nejasná, neboť nebylo prokázáno, že by jen sama mohla zabíjet larvy. Navíc klinické výsledky prokázaly, že kombinovaná terapie celkově podávaných antihelmetik a kortikosteroidů je úspěšnější než samotná terapie kortikosteroidy, neboť snížila možnost opakování zánětu. V dopadu na zlepšení vidění se oba léčebné postupy nelišily. Pro současné použití kortikosteroidů hovoří i skutečnost, že smrt larvy a její rozpad může vyvolat následnou zánětlivou reakci, kterou kortikosteroidy tlumí [38]. Úspěšnost diagnózy i léčby potvrdil pokles hladin toxokarových IgG protilátek (ELISA) v séru [45]. Naopak přetrvávající vyšší titry IgG naznačily neúčinnou léčbu souběžné infekce vyžadující její změnu [21]. V případě pozitivity hladiny IgE a její monitorování by mohlo v průběhu léčby v případě poklesu ukázat na terapeutický efekt [38]. Pozitivní odpověď na léčbu antihelmetiky provázelo snížení eozinofilie, což potvrdilo diagnózu toxokarózy [41]. Kombinovaná léčba systémovými kortikosteroidy a antihelmetikem přinesla určité zlepšení ZO i klinického nitroočního nálezu při postižení zrakového nervu [28]. Přestože v současnosti neexistují standardizované parametry dávky, trvání a způsobu podání, tak většina autorů preferuje právě kombinovanou terapii [19]. Lokalizace granulomu OLT v periferii i na zadním pólu byly ovlivnitelné léčbou. Počáteční ZO byla vždy lepší u periferního granulom, ale po léčbě již nebyl signifikantní rozdíl mezi oběma lokalizacemi zánětu [44]. Role medikamentózní terapie má své limity. Odchlípení sítnice, epiretinální membrány a persistující sklivcové opacity jsou indikací pro PPV, což platí především pro dospělé pacienty. Největší efektivita byla u sklivcových opacit a nejmenší u odchlípení sítnice. PPV přesto vedla ke stabilizaci zrakové funkce [38], někdy i k jejímu zlepšení při odstranění zánětlivých působků ve sklivci a ověření diagnózy rozborem sklivce toxokarových protilátek [16]. Většina operatérů se přiklání k ponechání granulomu na místě, neboť bývá spojen pevně se sítnicí a jeho odstranění by mohlo vést k jejímu poškození [16]. Celkově chirurgický postup individuálně pomohl [19] asi v polovině případů, a to i u makulární trakce [46]. Larva lokalizovaná subretinálně byla likvidována pomocí argonového laseru v případě DUSN [30] a intravitreálně aplikovaný ranibizumab byl efektivní v léčně sekundární neovaskularizace u OLT [47]. Obě léčebné procedury byly aplikovány u dětí okolo deseti let.
Prevence
Při nedostatku dostatečného povědomí o OLT je pro prevenci onemocnění důležité zvyšování povědomí veřejnosti o toxokaróze. Tím vyvolat snížení možnosti její expozice u člověka. Pro snížení rizika infekce musí být především pochopen zdroj přenosu. Dříve byl přímý kontakt s neléčenými infikovanými štěňaty považován za důležitý zdroj přenosu, avšak vzhledem k procentuálnímu postižení psů toxokarózou není takto dostatečně vysvětlen. Naopak náhodné požití vajíček toxokarózy v rámci geofagie je proto u dětí zásadní. Nesmírný význam má proto prevence k zabránění možnosti pozření vajíček či larev. Dobrá hygiena, mytí rukou či jejich otření před jídlem na exponovaných místech jsou důležité. To platí pro pískoviště, venkovní hříště a parky, které mohou být kontaminovány. Také ohrazení dětských hřišť a pískovišť zabraňuje možnosti kontaminace, pokud majitelé psů toto budou respektovat, spolu s odklízením exkrementů svých mazlíčků. U dospělých pacientů představuje hlavní riziko nedostatečně tepelně zpracované maso, konzumace syrového hovězího, především jater.
ZÁVĚR
Kromě uvedeného komplexního klinického rozboru dané problematiky je hlavní význam sdělení kladen na fotodokumentaci klinických nálezů OLT zadního pólu oka pouze u dětí. Jednotlivé klinické obrazy ukazují na pestrost nitroočních projevů této parazitární infekce. Projevy OLT u malých dětí jsou stále spojeny v diferenciální diagnóze především s retinoblastomem. Léčba je obtížná, a ne vždy přináší dobrý efekt. Nesmírný význam má proto prevence k zabránění možnosti pozření vajíček či larev vedoucích ke vzniku granulomů.
Autoři práce prohlašují, že vznik a téma odborného sdělení a jeho zveřejnění není ve střetu zájmů a není podpořeno žádnou farmaceutickou firmou.
Práce nabyla zadána jinému časopisu ani jinde otištěna kromě kongresových abstrakt či doporučených postupů.
Věnováno prof. MUDr. I. Karlovi, DrSc., rytíři českého lékařského stavu za rok 2007 a mému prvnímu učiteli klinické oftalmologie.
Do redakce doručeno dne: 14. 1. 2022
Přijato k publikaci dne: 24. 8. 2022
Publikováno on-line: 10. 10. 2022
MUDr. Jan Krásný
Oční klinika FNKV
Šrobarova 50
10 034 Praha 10
E-mail: jan.krasny@fnkv.cz
Zdroje
- Uhlíková M, Hübner J, Leissová M. Oční forma larvální toxokarózy v České republice. [Form of ocular larval toxocarosis in Czech Republic]. Cesk Slov Oftalmol. 2002;58:75-83. Czech.
- Wright KW, Spiegel PH. Pediatric Ophthalmology and Strabismus, 2nd ed. New York (USA). Springer; 2003; Rao, N.A.: Uveitis in Children. Chapter 29. pp.499-522.
- Wilder HC. Nematodes endophthalmitis. Trans Am Acad Ophthalmol Otolaryngol. 1950;55: 99–109.
- Beaver C, Snyder CH, Carrera GM, at al. Chronic eosinophilia due to visceral larva migrans. Pediatrics. 1959;9:7-19.
- Nichols RL. The ethiology of visceral larva migrans. J Parasitol. 1956;42:349-362.
- Pepose JS, Holland GN, Wilhelmus KR. Ocular Infection and Immunity. St. Loius (USA). Mosby; 1996; Parke DW, Shaver RP. Toxocariasis. Chapter 86. pp.1225-1235.
- Divišová G, Kadlecová V, Lomíčková H, Brůnová B. Dětské uveitidy.[Childhood uveitis]. Cesk Oftalmol. 1967;23: 86-94. Czech.
- Karel I, Peleška M. Fluoroangiografický obraz pravděpodobné toxokarové granulomatózní chorioretinitidy. [The fluoroangiographic picture in likely granulomatosis chorioretinitis of toxocariasis]. Cesk Oftalmol. 1972;28:276-231. Czech.
- Uhlíková M, Hübner J. Možnosti výskytu onemocnění visceral larva migrans v Československu. [Possibility of occurence of Visceral larva migrans disease in Czechoslovakia]. Cesk Pediatr. 1968;23:715-718. Czech.
- Valníčková J, Kouba K, Uhlíková M, et al. Centrální retinitida pravděpodobně toxokárové etiologie. [Retinitis centralis likely ethiology toxocarosis]. Cesk Oftalmol. 1975;31:209-212. Czech.
- Hübner J, Uhlíková M, Leissová M. Diagnostika časné fáze larvální toxokarózy využitím avidity IgG [Diagnosis of early phase of larval toxocariasis with application of avidity IgG]. Epidemiol Mikrobiol Imunol. 2001;50:67-70. Czech.
- Uhlíková M, Hübner J, Kolářová L, Poláčková M. Immunological studies on human larval toxocarosis. Centr Eur J Publ Hlth. 1996;4:242-245.
- Uhlíková M, Hübner J. Seroprovalence of Toxocara canis infection in Czech Republic. Centr Eur J Publ Hlth. 1998;6:195-198.
- Uhlíková M. Hübner J. Larvální toxokaróza – klinika, diagnostika a léčba nemoci [Larval toxocarosis – clinic, diagnosis and therapy of disease]. Remedia – Clinic mikrobiology. 1999; 3:255-259. Czech.
- Kostolná B, Gerinec A, Ondriska F. Diagnostika toxoplasmózy a toxokarózy z moku prednej očnej komory. [Diagnosis toxoplasmosis and toxocariasis from a humour of anterior chamber]. Cesk Slov Oftamol. 2003;59:312-318. Slovak.
- Šišková A, Říhová E, Skalická P, et al. Význam pars plana vitrektomie v diagnostice oční toxokarózy.[Importance of pars plana vitrectomy in diagnosis of ocular toxocarosis]. Cesk Slov Oftalmol. 2003;59:304-311. Czech.
- Říhová E, et al. Uveitidy [Uveitites]. Praha (Czech Republic), Grada; 2009. Chapter 2, 17. Kontur-Šišková A. Toxokaróza, pp.38-40. Czech
- Good B, Holland CV, Taylor MR, et al. Ocular toxocariasis on school children. Clin Infect Dis. 2004;39:173-178.
- Martinez-Pulgarin DF, Muňoz-Urbano M, Gomez-Sula LD, et al. Ocular toxocariasis: new diagnostic and therapeutic perspectives. Recent Pat Antiinfect Drug Discov 2015;10:35-41.
- Mazur-Melewska K, Mania A, Figlerowicz M, et al. The influence of age on a clinical presentation of Toxocara spp. infection in children. Ann Environ Med. 2012; 19:233-236.
- Hogan MJ, Kimura SJ, Spencer WH. Visceral larva migrans and periferic retinitis. J Am Med Assoc. 1965;194:1346-1347.
- Krásný J. Granulomatózní uveitidy toxokárové etiologie. [Granulomatous uveitis by ethiology of toxocarosis]. Volume of abstracts XI. Symposium of pediatric ophthalmology; ISBN 978-80-89797-00-4, Bratislava, 2015:5.
- Duguid IM. Features of ocular manifestation by toxocara. Br J Ophtalmol. 1961;45:789-796.
- Wisniewska-Ligier M, Woznakowska-Gesicka T, Sobolewska- -Dryjanska J, et al. Analysis of the course and treatment of toxocariasis in children, a long-term observation. Parasitol Res. 2012; 110:2363-2371.
- Urban B, Bakunowicz-Lazarczyk A, Michal S. Clinical features, the effectivess of treatment and function of vision organ in children and adolescents with ocular toxocariasis. Klin Oczna. 2008;110:364- 366. Polish.
- Morais FB, Maciel AL, Arantes TE, et al. Ultrasonographic findings in ocular toxocariasis. Arg Brasil Oftalmol. 2012;75:43-47.
- Choi K-D, Choi J-H, Choi S-Y, Kung JH. Toxocara optic neuropathy: clinical features and ocular findings. Int J Ophthalmol. 2018;11:520-523.
- Kim YJ, Moon CH, Chang JH. Toxocarosis of the optic disc. J Neuroophthalmol. 2013; 33:151-152.
- Sabrosa NA, de Sousza EC. Neomade infection of the eye: toxocariasis and diffuse unilateral subacute neuroretinitis. Curr Opin Ophthalmol. 2001;12:450-454.
- de Souza EC, Abujamra S, Nakashima Y, Gass JD. Diffuse bilateral subacute neuretinitis: first patients with documented nematodes in both eyes. Arch Ophthalmol. 1999;17:1349-351.
- Karel I, Peleška M., Uhlíková M, Hübner J. Larva migrans lentis. Ophthalmologica. 1977;174:14-20.
- Howard GH, Ellsworth RM. Diferential diagnosis in retinoblastoma. A statistical survey of 500 children. Relative frequency of lesions simulate retinoblastoma. Amer J Ophthalmol. 1965;60:610:622.
- Shields JA. Ocular toxocariasis. Surv Ophthalmol. 1984;28:361-381.
- HarleyRD. Pediatric Ophthalmology, 2nd ed. Philadelpia (USA):W.B.Sauders comp.; 1983; Volume II. pp.767-1402.
- Wright KW, Spiegel PH. Pediatric Ophthalmology and Strabismus, 2nd ed.New York (USA). Springer; 2003; Murphree AL, Christensen LE. Retinoblastoma and Malignant Intraocular Tumors. Chapter 35. pp.584-599.
- Šach J, Krásný J. Ocular toxocarosis. Protocol of 51st Anuual Meeting of EOPS (Europen Ophthalmic Pathology Society), London; 2012.
- Řehůřek J. Aktivita laktodehydrogenázy v diagnostice retinoblastomu [Lacte dehydrogenase activity in the diagnosis of retinoblastoma]. Cesk Slov Oftalmol.1995;51:14-18. Czech.
- Ahn SJ, Ryoo NK, Woo SJ. Ocular toxocariasis: clical features, diagnosis, treatment, and prevention. Asia Pac Alergy. 2014;4:134- 141.
- Wang ZJ, Zhou M, Cao WJ et al. Evaluation of the Goldmann- -Witmer coeficient in the immunological diagnosis of ocular toxocariasis. Acta Trop. 2016;158:20-23.
- Bae KW, Ahn SJ, Park KH, Woo SJ. Diagnostic value of the serum anti- Toxocara IgG titer for ocular toxocariasis in patients with uveitis at a tertiary hospital in Korea. Korean J Ophthalmol. 2016;30:258- 264.
- Yoon SY, Baek S, Park SY, et al. Clinical course and treatment outcome of toxocariasis-related eosinophilic disorder. Medicine. 2018;97: e12361 doi 10.1097
- Karadam SY, Ertug S, Ertabaklar H, Okyay P. The comparision of IgG antibodies specific to Toxocara spp. among eosinophilic and non- -eosinophilic groups. New Microbiol. 2008;31: 113-116.
- Artinyan E, Uysal HK, Akgul O, et al. Research on Toxocara canis antibodies obtained from patients with eosinophilia. Indian J Med Microbiol. 2014;32:383-86.
- Kalant H, Rosschlau WEH. Principes of Medical Pharmacology, Oxford (Great Britain) Oxford University Press; 1998; Keystone JS. Chemotherapy of common parasitic infection. Charter 21. pp.712-728.
- Kwon JW, Lee SY, Jee D, Cho YK. Prognosis for ocular toxocariasis according to granuloma location. PloS One, 2018; 13: doi: 10.1371/ journal. PLOS
- Amin HI, McDonald HR, Han DP, et al. Vitrectomy update for macular traction in ocular toxocariasis. Retina. 2000;20:80-85.
- Lyall DA, Hutchinson BM, Gaskell A, Varikkara M. Intravitreal Ranibizumab in the treatment of chorioidal neovascularisation secundary to ocular toxocariasis. Eye. 2010;24: 1730-1731.
Štítky
OftalmologieČlánek vyšel v časopise
Česká a slovenská oftalmologie

2022 Číslo Ahead of Print
- Diagnostický algoritmus při podezření na syndrom periodické horečky
- Aktuální poznatky o významu vitaminu B12 v terapii diabetické retinopatie
- Kontaktní dermatitida očních víček
- Stillova choroba: vzácné a závažné systémové onemocnění
- Léčba chronické blefaritidy vyžaduje dlouhodobou péči
Nejčtenější v tomto čísle


