-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Oneskorená diagnostika HAE v ambulancii imunológa
2. 11. 2020
Hereditárny angioedém je raritné dedičné ochorenie, ktoré sa prejavuje atakmi angioedému, ktorý postihuje kožu a podkožie, sliznice a podslizničné tkanivo tráviaceho a respiračného traktu. Mediátorom angioedému je bradykinín, preto v liečbe nie sú účinné anthistaminiká, kortikoidy ani adrenalín. Demonštrujeme prípad pacientky s typickými klinickými a laboratórnymi prejavmi hereditárneho angioedému a napriek tomu extrémne dlhou dobou do stanovenia diagnózy.
Hereditárny angioedém – stručný prehľad
Hereditárny angioedém (HAE) je raritné dedičné ochorenie spôsobené nedostatočnou funkciou inhibítora C1 (C1-INH) – serínovej proteázy, ktorá inhibuje komplement (zložky C1r a C1s), kontaktný systém (faktor XIIa, faktor XIa a kalikreín) a fibrinolytický systém (plazmín, tPA a uPA) (1). Nedostatočná funkcia C1-INH, spôsobená mutáciami v géne SERPING1, vedie k nekontrolovateľnému štiepeniu vysokomolekulového kininogénu a vzniku nadbytku bradykinínu. Ten sa viaže na bradykinínové receptory endotelových buniek, spôsobuje vazodilatáciu a zvýšenú cievnu permeabilitu, výsledkom ktorej je vznik opuchu – angioedému.
Angioedém býva lokalizovaný v podkoží a v podslizničnom tkanive a z jeho lokalizácie v orgánových systémoch vyplývajú klinické symptómy. Najčastejšie bývajú postihnuté končatiny, tvár a genitál (2). Opuchy bývajú asymetrické, bledé a nesvrbia (viď obr. 1). Niekedy sa na koži pred vznikom opuchu objavuje erythema marginatum. Pri opuchu v oblasti sliznice laryngu vzniká život ohrozujúci laryngeálny edém, ktorý môže potenciálne skončiť fatálne nepriechodnosťou dýchacích ciest. Ďalšie typické lokalizácie výskytu angioedému sú črevo a dutina brušná. Ich postihnutie spôsobuje bolesti brucha, vracanie, hnačku alebo zápchu, vystupňované symptómy imitujú náhlu brušnú príhodu s obrazom črevnej nepriechodnosti. Menej typickými lokalitami, ktoré môžu byť postihnuté angioedémom, sú stena močového mechúra (anúria, bolesti v podbrušku), centrálny nervový systém (migréna, prechodné parézy).
InzerceObr. 1 Opuch u pacientky s angioedémom (foto: autorka; publikované so súhlasom pacientky)
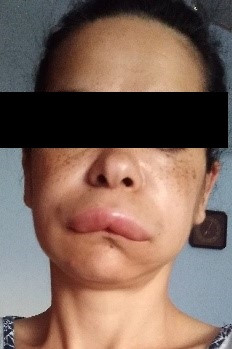
Ochorenie prebieha v atakoch, ktorých vznik je nepredvídateľný, čo sa týka doby vzniku, lokalizácie a závažnosti. Pri dlhšom priebehu ochorenia pacienti niekedy vedia opísať prodromálne príznaky – neurčité bolesti brucha, podráždenie, zmeny nálad, pocit napätia kože (2). U niektorých pacientov ataky postihujú predilekčne určité orgánové systémy. Existujú provokujúce faktory, ktorých vplyv sa spája so vznikom ataku – bežné respiračné infekcie, stresové situácie, zmeny hormonálnych hladín počas menštruačného cyklu, fyzická záťaž, mechanické pôsobenie tlaku na kožu.
Hereditárny angioedém s poruchou funkcie inhibítora C1 má typický laboratórny obraz. Pri type 1 je prítomná nízka hladina C1-INH v sére, ako aj jeho nízka funkčná aktivita. Typ 2 charakterizuje normálna alebo zvýšená hodnota C1-INH, avšak nízka funkčná aktivita. U oboch typov ochorenia je nízka hodnota C4 zložky komplementu, ktorú môžeme použiť ako rýchlu a jednoduchú skríningovú laboratórnu metodiku v diagnostike. Špecificita nízkej hodnoty C4 spolu s nízkou funkciou inhibítora C1 je 98 % pre hereditárny angioedém (3).
Okrem uvedeného klinického obrazu a laboratórnych vyšetrení je potrebné zamerať sa v diagnostike na podrobné údaje z rodinnej anamnézy, náhle a nevysvetliteľné úmrtia v rodine. K dispozícii je genetická diagnostika mutácií génu SERPING1. Zhruba štvrtina prípadov HAE vzniká na podklade de novo mutácie (4) a v tomto prípade v rodine nezachytíme výskyt ochorenia u rodinných príslušníkov.
V liečbe HAE sa v posledných rokoch udial veľký pokrok. Kedysi boli pacienti odkázaní na podávanie atenuovaných androgénov alebo kyseliny tranexámovej, prípadne na aplikáciu čerstvej mrazenej plazmy, ktorá substituovala chýbajúci inhibítor C1. Dnes používame niekoľko liekov na zvládnutie akútnych atakov (inhibítor C1 vyrobený z plazmy darcov, inhibítor C1 vyrobený rekombinantne – konestat alfa alebo antagonistu bradykinínových receptorov – ikatibant). Mimo Európy (v USA) je k dispozícii aj antagonista kalikreínu ekalantid. Na dlhodobú profylaxiu atakov sa aj. v súčasnosti využívajú atenuované androgény, u niektorých pacientov má efekt kyselina tranexámová, ale optimálnou a preferovanou alternatívou je podľa posledných medzinárodných odporúčaní podkožná aplikácia inhibítora C1 vyrobeného z plazmy (5). Novými liečebnými modalitami sú lanadelumab (plne humánna monoklonová IgG1 protilátka voči plazmatickému kalikreínu), ďalej perorálne inhibítory kalikreínu (zatiaľ v štádiu klinického skúšania) a monoklonová protilátka proti fXIIa.
Napriek tomu, že hereditárny angioedém je raritné ochorenie (výskyt 1 : 50 000) (6), je nutné ho vždy brať do úvahy pri výskyte najmä recidivujúcich angioedémov. Predkladáme opis priebehu ochorenia pacientky, u ktorej diagnostika napriek pozitívnej rodinnej anamnéze a typickému klinickému obrazu trvala dlhých 31 rokov.
Kazuistika
Vo veku 11 rokov sa u pacientky (ročník 1978) začali objavovať nesvrbivé bledé opuchy na končatinách a na tvári. Po niekoľkých rokoch sa pridružili opuchy v oblasti vonkajšieho genitálu. Opuch tváre sa vyskytoval asi 1× za rok, končatiny opúchali každý týždeň, genitál približne raz za 2 mesiace. Pacientka sa opakovane sama snažila nájsť dôvod, ktorý by vysvetlil vznik opuchu – väčšinou „obviňovala“ stravu, ale za celý čas trvania ochorenia nezistila, ktorá potravina by za každých okolností vyvolala opuch. Opuch na tvári sa vždy vyskytol v súvise so stomatologickým zákrokom, ako bola extrakcia zuba. Opuchy pretrvávali do 48 hodín, výnimočne do 4 dní.
Opakovane bola ošetrená na pohotovosti, kde bola aplikovaná liečba antihistaminikami, venóznym hydrokortizonom a kalciom. Až neskôr, pri vyšetrení na našej ambulancii, priznala, že efekt tejto liečby vlastne nikdy nepocítila, priebeh opuchového stavu bol rovnaký s touto liečbou aj bez nej. Keď prvýkrát prišla na našu ambulanciu, mala opuch na polovici tváre, ktorý sa šíril cez sánku až na krk. Už pri prvom vyšetrení bolo na základe anamnestických údajov možné predpokladať, že pacientka nemá alergické opuchy, ale že sa jedná o hereditárny angioedém. Hneď sme podali liečbu inhibítorom C1 (500 IU i.v.). Už po niekoľkých minútach observácie referovala, že prvýkrát v živote cíti, že dostala „niečo“, čo jej pomáha, a že opuch ustupuje.
Pri podrobnejšom rozbore anamnézy sme zistili, že prakticky celý život mávala zhruba 2× do mesiaca záchvaty bolestí brucha, ktoré sa spájali s hnačkami, vracaním a kŕčmi. Mávala pocit, že jej „vybuchne brucho“. Párkrát boli bolesti tak intenzívne a spojené s prekolapsovým stavom, že si musela privolať záchranku. Zhruba 5× absolvovala z diferenciálno diagnostických dôvodov gastroskopiu, niekoľkokrát sonografiu vnútrobrušných orgánov s nálezom „vody v bruchu“. Pre bolesti brucha bez efektu užívala rôzne analgetiká, pankreatické enzýmy a probiotiká.
Ako 22-ročná podstúpila apendektómiu (histologický nález z apendixu nemám k dispozícii), pričom vtedajšie symptómy opisuje ako „tie svoje“ bolesti brucha. Dnes, pri potvrdenej diagnóze, sa môžeme oprávnene domnievať, že sa jednalo skôr o jeden z brušných atakov HAE, i keď bez histologického nálezu nie je možné vylúčiť akútnu apendicitídu. Odlíšenie akútneho ataku a náhlej brušnej príhody je jednou z diferenciálno diagnostických výziev u pacientov s HAE. Pred menštruáciou a po jej skončení bývali pacientkine brušné ataky frekventnejšie a intenzívnejšie.
Z ostatných symptómov, po ktorých sme cielene pátrali, udávala časté bolesti hlavy, pri ktorých jej nezaberali bežné analgetiká (ekvivalent ataku?) a občasné ťažkosti s močením – časté nutkanie na močenie a močenie v malých porciách. 1× mala opuch na krku a vtedy si všimla, že nevie prehĺtať sliny. Stav sa upravil spontánne, bez liečby. Vždy po stomatologickom ošetrení jej opúchala tvár. Pripisovala to liekovej alergii, keďže po stomatologickom ošetrení opakovane užívala analgetiká.
Pacientka bola doporučená na našu ambulanciu až po tom, keď u jej dcéry vyslovili podozrenie na HAE. V mieste bydliska bola pritom roky sledovaná alergológom pre alergickú pereniálnu rinitídu. Už to, že pacientka opúchala napriek kontinuálnej liečbe antihistaminikami, malo lekára nasmerovať na zameranie diferenciálnej diagnostiky iným smerom. Pri odoberaní rodinnej anamnézy sme zistili, že pacientkin otec má rovnaké symptómy ako pacientka, i keď menej časté a menej intenzívne. Pacientkin bratranec z otcovej strany zomrel náhle v mladom veku po strate vedomia, ktorej predchádzal opuch na tvári (myslel si, že od zuba). Počas života mal podobné opuchové stavy, ale zriedkavé. Pri pitve (údaj od pacientky, bez dokumentácie) zistený opuch hrdla a zlyhanie srdca.
Laboratórne vyšetrenia, ktoré sme u pacientky doplnili (viď tab. 1), potvrdili naše podozrenie na diagnózu HAE s poruchou inhibítora C1. Genetická analýza verifikovala prítomnosť patogénneho variantu c.143_144delCA (p.Thr48Serfs*9) v exóne 3 v heterozygotnom stave. Rovnaký variant sa potvrdil aj u symptomatickej dcéry pacientky. Po jednoznačnom potvrdení diagnózy sme pacientke zabezpečili on demand liečbu koncentrátom inhibítora C1 a ikatibantom. Zohľadňujúc vysokú frekvenciu atakov, ich závažnosť a vplyv na kvalitu života je u tejto pacientky indikovaná dlhodobá profylaktická liečba. Keďže má verifikovaný vrodený trombofilný stav (deficit proteínu S a mutácia MTHFR), neplánujeme podávať ani androgény, ani antifibrinolytiká a pacientka bude kandidátkou na liečbu subkutánnym inhibítorom C1 alebo lanadelumabom.
Tab. 1 Laboratórne parametre
Parameter
Hodnota
Referenčné hodnoty
C3 zložka komplementu
1,29
0,81–1,57 g/l
C4 zložka komplementu
0,02 ... 0,05
0,129–0,392 g/l
C1 inhibítor – kvantita
< 0,074
0,21–0,38 g/l
C1 inhibítor – funkčná aktivita
25,00 ... 27,15 %
68–99,99 %
faktor XII – aktivita
139,60 %
70–150 %
CH50
< 11,94
41,68–95,06 U/ml
diaminooxidáza – kvantita
26,47
> 10 kIU/l
diaminooxidáza – funkčná aktivita
16,8
> 10 kIU/l
Čo si môžeme „vziať domov“
V medzinárodnej observačnej štúdii IOS (Icatibant Outcome Survey) bola priemerná doba do stanovenia diagnózy HAE v zúčastnených krajinách (Nemecko, Španielsko, Taliansko, Francúzsko, Dánsko, Veľká Británia) 8,5 roka (7,8). Naša pacientka predstavuje extrémny prípad oneskorenia diagnózy o 31 rokov od prvých symptómov. Symptómy, rodinná anamnéza a odpoveď na podávanú liečbu umožňovali diagnózu stanoviť omnoho skôr a pacientka mala „šťastie“, že ani jeden z jej početných atakov neskončil fatálne.
Anamnestické údaje od pacientov je potrebné získavať trpezlivo, dôkladne a komplexne. Diagnostika raritných ochorení sa v ostatných rokoch posúva výrazne dopredu a niektoré sa možno stanú „menej raritnými“, ako sme si doteraz mysleli. Klinik by sa nikdy nemal spoliehať na to, že sa v bežnej ambulantnej praxi s raritným ochorením nestretne. Napriek tomu, že sme pacientke potvrdili diagnózu, ktorá ju bude sprevádzať celoživotne, vieme jej poskytnúť účinnú liečbu, ktorá dokáže zabrániť fatálnym príhodám a umožní jej viesť plnohodnotný život.
MUDr. Katarína Hrubišková
Centrum pre hereditárny angioedém, V. interná klinika LF UK a UN BratislavaLiteratúra:
1. Schoenfeld A. K., Lahrsen E., Alban S. regulation of complement and contact system activation via C1 inhibitor potentiation and factor XIIa activity modulation by sulfated glycans – structure-activity relationships. PLoS One 2016; 11 (10): e0165493, doi: 10.1371/journal.pone.0165493.
2. Bork K., Aygören-Pürsün E., Bas M. et al. Guideline: Hereditary angioedema due to C1 inhibitor deficiency. Allergo J Int 2019; 28 : 16–29, doi: 10.1007/s40629-018-0088-5.
3. Henao M. P., Kraschnewski J. L., Kelbel T., Craig T. J. Diagnosis and screening of patients with hereditary angioedema in primary care. Ther Clin Risk Manag 2016; 12 : 701–711, doi: 10.2147/TCRM.S86293.
4. Bernstein J. A. Update on angioedema: evaluation, diagnosis, and treatment. Allergy Asthma Proc 2011; 32 (6): 408–412, doi: 10.2500/aap.2011.32.3469.
5. Maurer M., Magerl M., Ansotegui I. et al. The international WAO/EAACI guideline for the management of hereditary angioedema – the 2017 revision and update. World Allergy Organ J 2018; 11 (5), doi: 10.1186/s40413-017-0180-1.
6. Zanichelli A., Magerl M., Longhurst H et al. Hereditary angioedema with C1 inhibitor deficiency: delay in diagnosis in Europe. Allergy Asthma Clin Immunol 2013; 9 (1): 29, doi: 10.1186/1710-1492-9-296.
7. Zuraw B. L. Clinical Practice: Hereditary angioedema. N Engl J Med 2008; 359 : 1027–1036, doi: 10.1056/NEJMcp0803977.
8. Caballero T., Aberer W., Longhurst H. J. et al. The Icatibant Outcome Survey: experience of hereditary angioedema management from six European countries. J Eur Acad Dermatol Venereol 2017; 31 (7): 1214–1222, doi: 10.1111/jdv.14251.
Líbil se Vám článek? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Štítky
Alergologie a imunologie
Nejčtenější tento týden Celý článekPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



