-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Hereditární angioedém – charakteristika péče v Česku
12. 4. 2021
Hereditární angioedém (HAE) je vzácné vrozené onemocnění, jehož hlavním klinickým projevem jsou masivní otoky podkoží a/nebo sliznic v důsledku nekontrolované aktivace komplementového a kininového systému.
Podstatou onemocnění je mutace genu (SERPING1) pro inhibitor C1 serinové proteázy, způsobující buď jeho výrazně sníženou tvorbu, nebo afunkčnost. Jedná se o vrozený deficit inhibitoru C1 složky komplementu s autosomálně dominantním typem přenosu. Tento imunodeficit se dále dělí na HAE s deficiencí inhibitoru C1 (HAE-C1-INH) a HAE s normální hladinou a funkcí inhibitoru C1 (HAE nC1-INH). Péče o pacienty s HAE a jejich léčba je celoživotní, včetně mezigenerační péče o celé rodiny. S rozšiřováním škály dostupných preparátů a zaváděním dlouhodobé profylaxe atak jsou pacienti, na rozdíl od minulého století, schopni kvalitního života bez omezení chorobou. V Česku je díky vzniku HAE center před 10 lety péče o tyto pacienty na úrovni evropských standardů.
Etiopatogeneze a prevalence
Snížená hladina nebo funkce C1-INH má za následek nekontrolovanou aktivaci plazmatického kalikreinu, odštěpení vysokomolekulárního kininogenu a následnou patologickou hladinu bradykininu. Deregulovaná aktivita plazmatického kalikreinu a s tím spojené zvýšení hladiny bradykininu vedou ke zvýšené vaskulární permeabilitě a následnému bolestivému otoku, který je pro HAE charakteristický.
Vzácně byla u některých pacientů prokázána mutace genu pro faktor XII (HAE nC1-INH), s výrazně zvýšenou hladinou estrogenů, což může vést ke zhoršení epizod angioedému různým způsobem. V heterogenní skupině hereditárních angioedémů s normální hodnotou inhibitoru C1 (HAE nC1-INH) jsou v posledních letech charakterizovány další varianty této choroby s mutacemi genů pro angiopoetin 1 (ANGP1), plazminogen (PLG) a kininogen 1 (KNG1). Ve všech případech byl prokázán autosomálně dominantní typ přenosu. Pokud nelze prokázat příčinnou mutaci, je uváděn název HAE s normálním inhibitorem C1 nejasné příčiny (HAE-UNK). Lze přepokládat, že tyto neznámé mutace jsou výzvou pro určení dalších hereditárních jednotek angioedémů. Pro HAE nC1-INH zatím léčebná doporučení neexistují (1–3).
Prevalence HAE v populaci je udávána v rozmezí 1/40 000–50 000, prevalence vzácných forem HAE (HAE nC1-INH) se přepokládá v rozmezí 1/100 000–150 000. Deficit C1-INH může vzniknout v průběhu života v důsledku jiných patologických stavů, jakými jsou systémový lupus erythematodes, autoimunitní hemolytická anémie, monoklonální gamapatie či lymfoproliferativní onemocnění – potom se jedná o získaný angioedém (AAE – acquired angioedema) (4).
Obr. 1 Rozdělení angioedémů indukovaných bradykininem
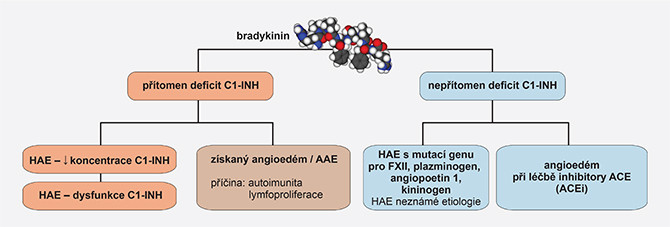
Pro HAE a AAE je typický angioedém indukovaný bradykininem bez urtikarie, charakteru otoku lokálního a asymetrického. Mechanický inzult a těžká fyzická námaha jsou jedinými definovanými faktory zevního prostředí, které mohou symptomatizovat pacienty s HAE. Jiné spouštěcí faktory jsou s převahou nepředvídatelné (infekce, stres) nebo mohou vznikat s vazbou na farmakoterapii (inhibitory ACE či estrogeny).
HAE má familiární výskyt s následujícími klinickými projevy:
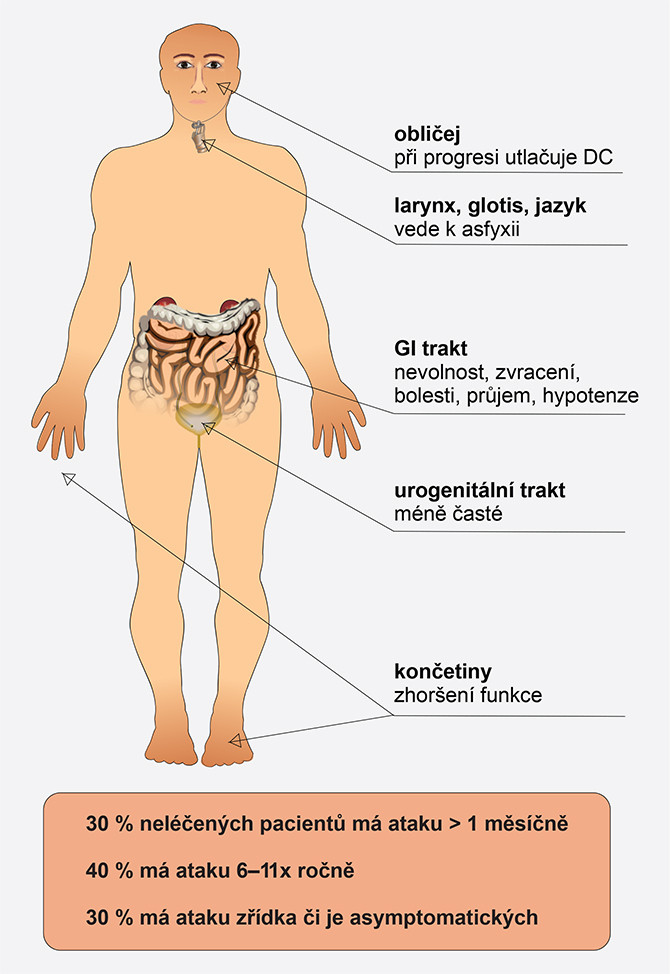
- Otoky podkoží v libovolné lokalizaci, nesvědivé, rychle nastupující, obvykle přetrvávající 2–3 dny.
- Otoky submukózy gastrointestinálního traktu vedoucí k bolestem břicha s nauzeou a zvracením, které mohou simulovat i příznaky náhlé břišní příhody (ileus, apendicitida, koliky), otoky v oblasti urogenitální.
- Otoky v oblasti laryngu vedoucí až k obstrukci dýchacích cest, respektive k asfyxii.
- Otoky orofaciální.
Obr. 2 Četnost otoků a jejich lokalizace
Péče o pacienty s HAE v Česku
Z hlediska centralizace a dostupnosti péče se za posledních 10 let situace pacientů s touto závažnou diagnózou velmi zlepšila. Do roku 2010 byla péče o tyto nemocné v rámci naší země roztříštěna a pacienti byli vedeni vzhledem k variabilnímu a individuálnímu orgánovému postižení v různých typech zdravotnických zařízení.
V roce 2011, při vstupu (tehdy inovativního) preparátu ikatibant (Firazyr, Shire) do Česka, byl na základě jednání s VZP tento lék uznán jako centrový, a jeho podávání tedy povolen pouze v rámci specializovaných center. Za podpory výboru České společnosti alergologie a klinické imunologie ČLS JEP (ČSAKI) byla tato podmínka ZP podnětem k vytvoření 4 center při ústavech klinické imunologie a alergologie fakultních nemocnic v Praze, Brně, Plzni a Hradci Králové. Bylo snahou pojmout nově vzniklá centra nejen z hlediska této nové léčebné modality, ale především s ohledem na potřebu komplexní péče o nemocné s touto závažnou chorobou.
Do těchto center jsou navíc konziliárně odesíláni i pacienti s atypickými angioedémy (s převahou bradykininové etiologie). Pacienti, u kterých byl prokázán získaný angioedém (bradykininové etiologie), zůstávají dispenzarizováni v centrech HAE. V kooperaci se specializovaným pracovištěm (většinou hematoonkologie, revmatologie) u nich probíhá léčba jejich základního onemocnění a dle tíže atak léčba angioedémů.
Nově také vznikl registr pacientů s dg. HAE při registru pro primární imunodeficience (www.pid.registry.cz), Data z registru jsou s výhodou využívána při jednání s plátci péče (5).
Systém centralizace péče, včetně zajištění dostupné medikace je velmi funkční. Je vytvořena spolupráce s Občanským sdružením imunodeficitních pacientů HAE/AAE (www.hae-imuno.cz) a HAE Junior (www.haejunior.cz).
Laboratorní diagnostika – vhodné metody a dostupnost
Při stanovení diagnózy angioedémů se významně opíráme o laboratorní diagnostiku včetně genetického vyšetření.
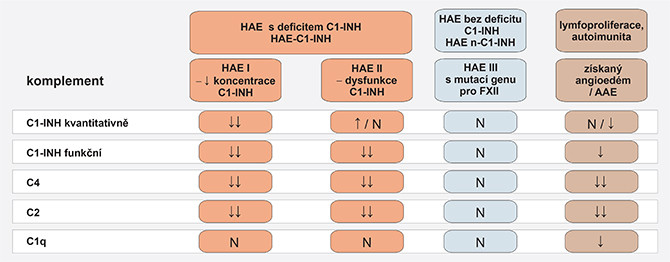
K potvrzení diagnózy HAE s deficitem C1-INH při typickém klinickém obrazu je nutná laboratorní analýza některých složek komplementu a potvrzení snížení funkční aktivity C1-INH pod 50 %. Screeningovým vyšetřením je stanovení hladiny složky komplementu C4, která je významně snížená během ataky HAE, ale i v mezidobí. V remisi však může C4 vzácně dosáhnout normální hodnoty. V případě klinického podezření musí být opakováno současné stanovení hladiny a funkce C1-INH a hladiny C4 v době plně vyjádřené klinické symptomatologie. Kvantitativní a funkční vyšetření C1-INH nám umožní rozlišit klinické jednotky v rámci hereditárního angioedému s deficiencí inhibitoru C1 (HAE-C1-INH) a HAE s normální hladinou a funkcí C1 inhibitoru (HAE nC1-INH). Nález nízké hladiny C4 a redukce funkční aktivity C1-INH má pro stanovení diagnózy 98–100% specificitu, naopak v případě normálních hodnot činí negativní prediktivní hodnota 96 %. Hodnoty hladiny C4 a funkce C1-INH nekorelují se závažností klinických příznaků. Hladina složky C3 a ostatních součástí komplementu jsou v normě (6, 7).
V případě, že je pacient léčen atenuovanými androgeny, musí být tato terapie vysazena 2 týdny před odběrem k laboratorním testům. Při terapii mraženou plazmou nebo koncentrátem C1-INH je vhodné provést odběry až po 3 dnech (8, 9)
HAE s normální hladinou a funkcí inhibitoru C1 přináší diferenciálně diagnostické obtíže v tom, že analýza komplementu neprokazuje deficit C1-INH, ale klinický obraz a hereditární podstata jej přiřazuje do rodiny HAE. Specifikem pro tuto klinickou jednotky je vztah k estrogenům, převážně jsou postiženy ženy v době těhotenství nebo léčené estrogenovou substitucí a beroucí perorální kontraceptiva. U malé části pacientů je prokazatelná mutace genu pro FXII, genetické vyšetření je tedy významným přínosem.
Stanovení hladiny C1q je důležité k vyslovení diagnózy AAE s deficitem C1-INH, kdy je hladina významně redukována a odlišuje AAE od HAE. Hladina C1q může být výjimečně snížená u některých případů HAE, ale i z jiných důvodů; jsou-li souběžně přítomny autoprotilátky nebo probíhá-li virové onemocnění.
Angioedém indukovaný inhibitory ACE (AE-ACEi) je ze všech bradykininem indukovaných angioedémů nejčastější. K nejčastěji postiženým partiím patří orofaciální oblast a jazyk. V těchto klinických proporcích a normálním nálezu při analýze komplementu se liší od HAE a AAE (viz tab. 1). Vysazení terapie je definitivním řešením problému (1, 4, 6).
Tab. 1 Laboratorní diferenciální diagnostika bradykininem indukovaných angioedémů
Obr. 3 Algoritmus diferenciálně diagnostického postupu
Dostupné preparáty pro terapii HAE v Česku
Terapeutická strategie pro léčbu pacientů s HAE v Česku vychází z doporučení vydaných WHO/EAACI (3). Terapie zahrnuje 3 zásadní oblasti:
- Terapie akutního stavu dle závažnosti příznaků (při rozvoji orofaciálních otoků, obstrukci laryngu či gastrointestinálních, urogenitálních otoků, těžkých končetinových otoků).
- Krátkodobá profylaxe před iatrogenními výkony.
- Dlouhodobá profylaxe indikovaná u všech symptomatických pacientů s ohledem na projevy onemocnění, četnost atak, kvalitu života a nemožnost dosáhnout adekvátní kontroly odpovídající epizodickou (on-demand) léčbou.
Portfolio léků se neustále rozšiřuje a pro lékaře, kteří o tyto pacienty pečují jen nepravidelně v rámci spádové péče alergologie/imunologie, je orientace v léčbě někdy obtížná. Přikládáme proto přehled léků aktuálně užívaných v Česku:
1. Koncentráty inhibitorů C1
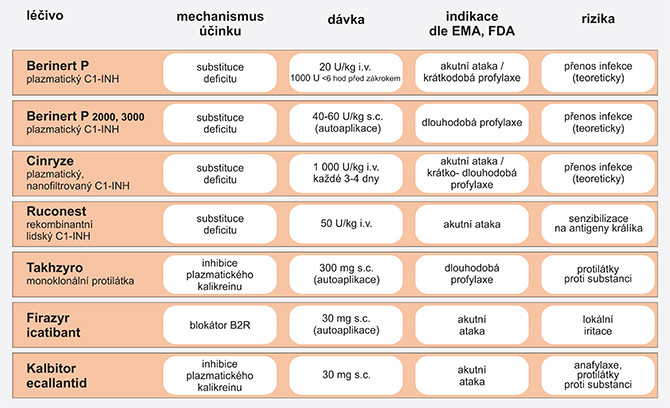
BERINERT 500 j. (plazmatický C1-INH) je užíván k i.v. aplikaci pro terapii akutní ataky u pacientů u všech věkových kategorií (20 IU na kg tělesné hmotnosti). Dále je tento preparát vhodný ke krátkodobé profylaxi v rámci předoperační prevence akutních příhod, a to v dávce 15–30 IU na 1 kilogram tělesné hmotnosti méně než 6 hodin před stomatologickým, chirurgickým či jiným zákrokem. Dávka má být zvolena s ohledem na klinické okolnosti (typ zákroku a závažnosti onemocnění).
V EU jsou registrované Berinert 2000 IU a Berinert 3000 IU (v USA pod názvem Haegerda, CSL Behring) pro subkutánní aplikaci – indikované pro dlouhodobou profylaxi atak HAE od 12 let výše s možností subkutánní autoaplikace. Doporučená dávka přípravku Berinert s.c. je 60 IU/kg tělesné hmotnosti každé 3–4 dny (2, 10, 11).
CINRYZE (nanofiltrovaný koncentrát C1-INH, Shire/Takeda) je v EU registrovaný a indikovaný k léčbě atak angioedému již od 2 let věku, dále ke krátkodobé profylaxi před iatrogenními výkony a k dlouhodobé profylaxi od 6 let věku u pacientů se závažnými/rekurentními atakami angioedému. Aplikace je intravenózní, k dlouhodobé profylaxi pro pacienty ve věku 6–11 let činí dávka 500 j. každé 3–4 dny, pro pacienty od 12 let věku 1000 j. každé 3–4 dny (10, 12). V Česku není schválena úhrada ZP.
RUCONEST (konestat alfa – rekombinantní analog lidského C1-INH /rhC1-INH/, Pharming) je vyráběný technologií rekombinantní DNA z mléka transgenních králíků. Lék je určen k i.v. aplikaci pro terapii akutní ataky u pacientů 2 let věku. Dávkování je dle tělesné hmotnosti – do 84 kg 1 intravenózní injekce s obsahem 2100 j., v případě nedostatečné klinické odpovědi lze podat dodatečnou dávku až do 4200 j., tj. 50 j./ kg). Při tělesné hmotnosti ≥ 84 kg jsou doporučeny 2 dávky, tj. 4200 j. (3, 14).
2. Léky s jiným účinkem než substituce inhibitorů C1
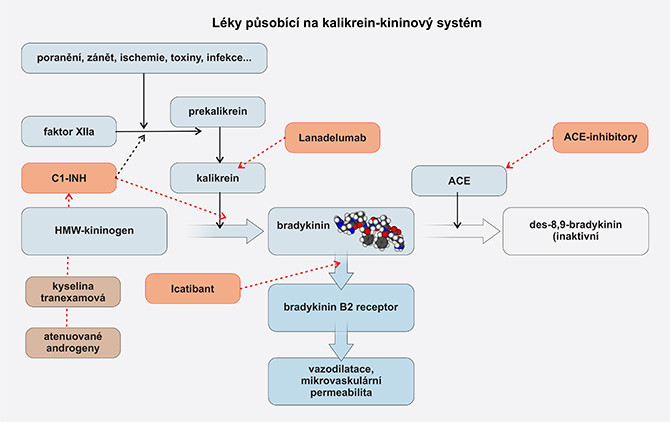
FIRAZYR (ikatibant 30 mg) je blokátor bradykininového receptoru B2. Preparát je určen k subkutánní aplikaci, nejlépe do břišní oblasti, a je indikovaný k terapii akutní ataky u pacientů od 2 let věku a o hmotnosti > 12 kg (u pediatrických pacientů je dávkování upraveno na základě hmotnosti). S převahou postačí k léčbě ataky 1 subkutánní injekce; pokud nedojde k ústupu příznaků nebo se příznaky objeví znovu, po 6 hodinách lze podat druhou injekci.
Firazyr může být včasně podáván samotným pacientem. U dětí a dospívajících ve věku 2–17 let jej aplikuje ošetřující osoba po proškolení. Pokud po autoaplikaci nebo podání ošetřující osobou nedojde k ústupu příznaků nebo se příznaky objeví znovu, musí pacient vyhledat lékařskou pomoc. Pacienti s laryngeální atakou po autoaplikaci musejí vyhledat lékařskou pomoc vždy (15).
TAKHZYRO (lanadelumab) je lidská monoklonální protilátku (IgG1κ) produkovaná v buňkách vaječníků křečíka čínského. Účinek spočívá v inhibici proteolytické aktivity plazmatického kalikreinu. Subkutánně aplikovaný lék je indikovaný k dlouhodobé profylaktické terapií HAE od 12 let věku. Počáteční dávka lanadelumabu činí 300 mg každé 2 týdny. Pokud při této dávce nedochází k atakám angioedému, je možné frekvenci podávání snížit na 1× za 4 týdny, zejména u pacientů s nízkou hmotností. Preparát byl registrován EMA ke dni 22. 11. 2018 (16, 17).
Atenuované androgeny jsou historicky užívány pro dlouhodobou profylaxi. Neměly by však být použity jako první volba. Vedlejší účinky jsou četné a objevují se u většiny pacientů. Virilizace je nejobávanější komplikací u žen, androgeny navíc mohou vést k virilizaci ženského plodu a jsou během těhotenství a laktace absolutně kontraindikované. Častý je výskyt menstruačních poruch, amenorey, rozvíjí se hirsutismus, stejně tak přibývání na váze, bolesti hlavy, myalgie, deprese a akné. U mužů androgeny negativně ovlivňují libido, spermiogram a plodnost. Pro minimalizaci nežádoucích účinků by se měla použít nejnižší účinná dávka. Většina doporučení uvádí vyhnout se dávkám > 200 mg/den pro danazol. Lék je kontraindikovaný u dětí zejména před pubertou, u pacientů s androgenně závislou malignitou, u nemocných s onemocněním jater a u žen během těhotenství a kojení. Při podávání androgenů je nutné provádět pravidelně jednou za půl roku testy laboratorních vyšetření a nejméně jednou za rok musí být proveden ultrazvuk jater (8).
Antifibrinolytika (v Česku kyselina tranexamová, Exacyl 500 mg, potahované tablety, Sanofi/Aventis) jsou historicky taktéž na ústupu. Účinnost antifibrinolytických látek v dlouhodobé profylaxi je poměrně nízká. Doporučená dávka pro dlouhodobou profylaxi činí 30–50 mg/kg denně a je rozdělená do 2 či 3 dávek; maximálně se jedná o 6 g/den. Kontraindikace zahrnují výskyt trombofilie, zvýšené trombotické riziko nebo akutní trombózu. Studie k dávkování a srovnání s jinou profylaktickou léčbou nebyly provedeny (1).
Obr. 4 Vliv léků na kalikrein-kininový systém

Doporučené léčebné postupy
Spektrum uvedených léků má svá indikační specifika, proto nyní uvádíme jednotlivé terapeutické strategie s doporučením vhodné terapie z výše uvedeného portfolia.
a) Terapie akutního stavu
Otoky kožní a submukózní tkáně při HAE jsou znetvořující, bolestivé a v případě laryngeálního angioedému až život ohrožující. V současné době je k subkutánnímu podání preferovaný inhibitor receptoru pro bradykinin B2 (ikatibant, Firazyr, 30 mg). Klinické příznaky ataky HAE s normálními hladinami funkčního C1-INH (n-C1-INH) jsou taktéž zapříčiněny lokální nadprodukcí bradykininu a jsou léčeny stejně jako ataky s deficitem C1-INH (1).
Pro intravenózní aplikaci jsou v současnosti k léčbě akutní ataky určeny plazmatické C1-INH (pd-C1-INH, Berinert, dávka 20 IU/kg) či rekombinantní C1-INH (rh-C1-INH, Ruconest). Ruconest se podává v dávce 50 j./kg a do hmotnosti 84 kg postačí dávka jedné ampule (2100 j.), při hmotnosti vyšší je doporučeno aplikovat 2 dávky (4200 j.). Pokud u dětí nedochází k adekvátní odpovědi, lze podat další dávku po uplynutí 60 minut, u dospívajících a dospělých po uplynutí 120 minut.
Čas do nástupu úlevy se obvykle pohybuje do 30–120 minut od podání. Pokud se i poté stav zhoršuje, je vhodné podat další léčbu (buď stejný preparát, či jinou lékovou skupinu).
Břišní ataky, potenciálně fatální důsledky postižení hrtanu spojeného s orálním angioedémem a otoky v oblasti horních cest dýchacích byly dlouho považovány za hlavní impulz pro akutní léčebný zásah. Je však třeba si uvědomit, že i otoky končetin zásadně znemožňují vykonávat denní činnost a zaslouží včasnou akutní léčbu s cílem zabránit končetinové dysfunkci. Existuje všeobecná shoda, že všichni pacienti s potvrzenou diagnózou by měli být vybaveni nejméně 2 dávkami léku pro akutní pomoc (ikatibant, pdC1-INH nebo rhC1-INH).
b) Krátkodobá profylaxe před iatrogenními výkony
Krátkodobá profylaxe ataky HAE je opatřením u plánovaných traumatizujících lékařských výkonů. K substituci C1-INH slouží intravenózní preparáty C1-INH (pdC1-INH) (3).
Literárně neexistuje jasné doporučení, kdy a v jakých případech zahájit krátkodobou profylaxi, ale existuje shoda, že vždy, pokud se jedná o výkon v dutině ústní a v oblasti horních cest dýchacích. Preferovaným lékem je inhibitor C1 v dávkování 15–30 j./ kg při užití pdC1-INH (Berinert). Při užití nanofiltrovaného inhibitoru C1 (Cinryze) je doporučené dávkování ve věku 2–11 let při tělesné hmotnosti 10–25 kg 500 IU přípravku, při tělesné hmotnosti > 25 kg 1000 IU, tak jako u dospělých pacientů. C1-INH by měl být podán < 6 hodin před zákrokem.
Dále bychom měli mít na paměti, že angioedém se může objevit po 3 dnech od zákroku, neboť účinnost intravenózně podaného C1-INH trvá právě 3 dny. Nemocný by měl být vybaven léky pro 2 aplikace. Výjimečně je možné (při nedostupnosti C1-INH) použit mraženou plazmu neb alternativně perorální androgen 200 mg 3× denně 5 dní před zákrokem a 2–3 dny po něm.
c) Dlouhodobá profylaxe
V posledních letech zaznamenáváme nárůst možností dlouhodobé profylaxe atak HAE. Ta je indikovaná u všech pacientů se závažnými symptomy, s ohledem na projevy onemocnění, četnost atak, kvalitu života a nemožnost dosáhnout adekvátní kontroly odpovídající on-demand léčbou.
První volbu představují pdC1-INH (subkutánní Berinert, Cinryze) a lanadelumab (Takhzyro), s limitacemi danými SPC. Na ústupu jsou historicky užívané atenuované androgeny a kyselina tranexamová (1, 6).
Koncetráty inhibitorů C1 (aplikované intravenózně či subkutánně) se jeví jako fyziologická a substituční cesta při dlouhodobé profylaxi. V roce 2008 byl schválen první nanofiltrovaný koncentrát pro dlouhodobou profylaxi pod firemní názvem Cinryze (Shire/Takeda). Další možností je s.c. aplikace pdC1-INH (Berinert P 2000, 3000).
Teoreticky mohou nežádoucí účinky pdC1-INH zahrnovat infekce přenosné plazmou a tromboembolické příhody. Naštěstí moderní technologie diagnostického screeningu a čištění plazmy činí tuto terapii bezpečnou. Přijatá opatření jsou považována za účinná proti obaleným virům jako HIV, HBV a HCV i u neobalených virů jako HAV a parvovirus B19. Doporučuje se zvážit vhodné očkování (proti hepatitidě A a B) u pacientů, kteří pravidelně/opakovaně dostávají přípravky vyrobené z lidské plazmy.
Lanadelumab (Takhyzro) je humanizovaná monoklonální protilátka specificky zaměřená vůči plazmatickému kalikreinu. Byla schválena americkým Úřadem pro kontrolu léčiv a potravin (FDA) a Evropskou lékovou agenturou (EMA) pro HAE C1-INH v roce 2018 pro dospívající a dospělé i s možností autoaplikace. Počáteční dávka činí 300 mg subkutánně každé 2 týdny s možností prodloužit interval až na 4 týdny dle efektu terapie.
Preparát je v současnosti dostupný v režimu mimořádného schvalování dle §16 (zákona č. 48/1997 Sb). Navrhovaná indikační kritéria jsou dle ČSAKI následující: za období posledních 12 měsíců 18 atak a/nebo výskyt závažné ataky HAE (závažné ataky gastrointestinální, orofaciální ataky s potenciálním otokem laryngu, angioedém v urogenitální oblasti, těžké končetinové ataky znemožňující denní činnost) vyžadující adekvátní léčbu nebo nutnost opakované léčby v průběhu jedné ataky, případně pokud profylaxe není dostatečná nebo je kontraindikovaná.
Tab. 2 Přehled léčiv v indikaci HAE
Závěr
Péče o pacienty s HAE je celoživotní a často zahrnuje i mezigenerační péči o celé rodiny, včetně konzultací při zakládání nových rodin s možností rizikového nárůstu nových dětských pacientů s dg. HAE. Vznik HAE center v Česku téměř před 10 lety postavil péči o tyto pacienty na úroveň evropských standardů.
MUDr. Irena Krčmová, CSc.
Ústav klinické imunologie a alergologie LF UK a FN Hradec KrálovéLiteratura:
1. Betschel et al. The international/Canadian hereditary angioedema guideline. Allergy Asthma Clin Immunol 2019; 15 : 72.
2. Busse P, Bygum A, Edelman J et al. Safety of C1-esterase inhibitor in acute and prophylactic therapy of hereditary angioedema: findings from the ongoing international Berinert patient registry. J Allergy Clin Immunol Pract 2015; 3 : 213–219.
3. Maurer M, Magerl M, Ansotegui I et al. The international WAO/EAACI guideline for the management of hereditary angioedema – the 2017 revision and update. Allergy 2018; 73(8): 1575–1596.
4. Sobotková M, Zachová R, Hakl R et al. Acquired angioedema with C1 inhibitor deficiency: occurrence, clinical features, and management: a nationwide retrospective study in the Czech Republic patients. Int Arch Allergy Immunol 2021 Jan 20 : 1–8, doi: 10.1159/000512933 [Epub ahead of print].
5. Hakl R. Současné možnosti léčby hereditárního angioedému. Vnitřní lékařství 2016; 62(9): 736–739.
6. Busse PJ, Christiansen SC. Hereditary angioedema. N Engl J Med 2020; 382 : 1136–1148.
7. Krčmová I. Hereditární angioedém – trendy v léčbě. Interní medicína 2017; 19(3): 131–137.
8. Zuraw BL, Davis DK, Castaldo AJ, Christiansen SC. Tolerability and effectiveness of 17-alpha-alkylated androgen therapy for hereditary angioedema: a re-examination. J Allergy Clin Immunol Pract 2016; 4 : 948–955.
9. Wentzel N, Panieri A, Ayazi M et al. Fresh frozen plasma for on-demand hereditary angioedema treatment in South Africa and Iran. World Allergy Organ J 2019; 12 : 100049.
10. Craig T, Zuraw B, Longhurst H et al. Long-term outcomes with subcutaneous C1-inhibitor replacement therapy for prevention of hereditary angioedema attacks. J Allergy Clin Immunol Pract 2019; 7(6): 1793–1802.e2.
11. Longhurst H, Zinser E. Prophylactic therapy for hereditary angioedema. Immunol Allergy Clin North Am 2017; 37 : 557–570.
12. Zuraw BL, Busse PJ, White M et al. Nanofiltered C1 inhibitor concentrate for treatment of hereditary angioedema. N Engl J Med 2010; 363 : 513–522.
13. Riedl MA, Grivcheva-Panovska V, Moldovan D et al. Recombinant human C1 esterase inhibitor for prophylaxis of hereditary angio-oedema: a phase 2, multicentre, randomised, double-blind, placebo-controlled crossover trial. Lancet 2017; 390 : 1595–1602.
14. Valerieva A, Staevska M, Jeseňák M et al. Recombinant human C1 esterase inhibitor as short-term prophylaxis in patients with hereditary angioedema. J Allergy Clin Immunol Pract 2020; 8(2): 799–802.
15. Malbran A, Riedl M, Ritchie B et al. Repeat treatment of acute hereditary angioedema attacks with open-label icatibant in the FAST-1 trial. Clin Exp Immunol 2014; 177 : 544–553.
16. Banerji A, Riedl MA, Bernstein JA et al. Effect of lanadelumab compared with placebo on prevention of hereditary angioedema attacks: a randomized clinical trial. JAMA 2018; 320 : 2108–2121.
17. Valerieva A, Senter R, Wu MA et al. Lanadelumab for the prevention of attacks in hereditary angioedema. Expert Rev Clin Immunol 2019; 15(12): 1239–1248.
18. Settipane RA, Bukstein D, Riedl M. Shared decision making in HAE management. Allergy Asthma Proc 2020; 41: S55–S60.
19. Stolz LE, Horn PT. Ecallantide: a plasma kallikrein inhibitor for the treatment of acute attacks of hereditary angioedema. Drugs Today (Barc) 2010; 46(8): 547–555.
20. Banerji A, Li Y, Busse P et al. Hereditary angioedema from the patient's perspective: a follow-up patient survey. Allergy Asthma Proc 2018; 39 : 212–223.
Líbil se Vám článek? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Štítky
Alergologie a imunologie
Nejčtenější tento týden Celý článekPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



