-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
INTERAKTIVNÍ KAZUISTIKA: Venetoklax u nemocného s relapsem CLL a delecí 17p
27. 2. 2025
V následujícím kazuistickém sdělení pojatém interaktivní formou prezentujeme případ staršího nemocného s nepříznivou cytogenetikou a opakovanými relapsy chronické lymfocytární leukémie (CLL). V rámci 4. linie léčby byl použit inhibitor antiapoptotického proteinu Bcl-2 venetoklax a bylo dosaženo kompletní remise s negativitou měřitelné reziduální nemoci (MRD). Kazuistika rovněž popisuje management zvládání komplikací v průběhu terapie.
Úvod
Stanovení diagnózy CLL není důvodem pro zahájení léčby. Onemocnění má velmi různorodý průběh, část nemocných dokonce léčbu nepotřebuje vůbec. U jiných pacientů onemocnění opakovaně relabuje a vyžaduje několik linií léčby. Ve všech případech, tedy v první linii i při relapsu, zahajujeme léčbu až po splnění kritéria aktivního onemocnění iwCLL.1
V predikci prognózy onemocnění a předpokládané odpovědi na terapii u konkrétního pacienta využíváme několik prognostických ukazatelů: mutační stav genů pro variabilní část těžkého řetězce imunoglobulinu (IGHV), stanovení chromosomových abnormalit fluorescenční in situ hybridizací (FISH), karyotyp leukemických buněk a testování mutací genu TP53 Sangerovým sekvenováním DNA. Prognosticky nepříznivými faktory jsou nemutovaný stav IGHV, delece 17p a/nebo mutace genu TP53 a komplexní změny karyotypu.
InzerceV posledních letech došlo k zásadním změnám a rozšíření terapeutických možností, jež přinesly zlepšení prognózy pro nemocné s CLL včetně těch s nepříznivou cytogenetikou. Nová léčiva cíleně ovlivňují signální dráhy B-buněčného receptoru a antiapoptický protein Bcl-2. Moderní terapie inhibitorem Bcl-2 venetoklaxem je poměrně dobře tolerována, výhodou je její perorální podávání a lze ji využít i pro starší pacienty s přidruženými onemocněními. Pozornost vyžaduje poněkud odlišné spektrum nežádoucích účinků.
Stále platí, že CLL je nevyléčitelné onemocnění a jedinou potenciálně kurativní metodou je alogenní transplantace krvetvorných kmenových buněk. Její provedení je nicméně po zavedení těchto nových molekul do terapie nemocných s CLL spíše výjimečné.
Popsaný případ ukazuje průběh léčby staršího nemocného s opakovaně relabující CLL a nepříznivým cytogenetickým profilem onemocnění. Použití léčebných režimů v jednotlivých liniích odpovídalo v té době aktuálním doporučením, dostupnosti a úhradě jednotlivých preparátů. Ve 4. linii léčby jsme využili kombinaci anti-CD20 monoklonální protilátky rituximabu s inhibitorem Bcl-2 venetoklaxem.2
Popis případu
Muži narozenému v roce 1942, hypertonikovi bez jiných přidružených onemocnění, byla v roce 2001 diagnostikována CLL. Onemocnění bylo několik let bezpříznakové, až v roce 2010 vyžadovalo terapii. Nemocný byl léčen na hematologické ambulanci v rajonní nemocnici perorálním režimem chlorambucil + prednison od března 2010 do března 2011 a dosáhl parciální remise.
K progresi s indikací pro zahájení 2. linie terapie došlo v březnu 2014, důvodem byla masivní splenomegalie a rychle progredující lymfocytóza. Nemocný, v té době 72letý, byl předán k další léčbě na naši kliniku. Pro upřesnění prognózy onemocnění jsme doplnili vyšetření prognostických ukazatelů. Prokázali jsme nemutovaný stav IGHV, vyšetřením FISH byla zachycena delece chromosomu 13q a malý klon s delecí 17p. Dysfunkce proteinu p53 nebyla potvrzena.
#199 V 1. linii nemocný nebyl léčen monoklonální protilátkou, využili jsme tedy ve 2. linii imunochemoterapii – kombinaci monoklonální protilátky anti-CD20 rituximabu a chlorambucilu. Pacient dosáhl parciální remise (přetrvávala jen mírná splenomegalie) s normálním krevním obrazem a bez klinických příznaků onemocnění.
Časná progrese CLL nastala již v červnu 2016. Cytogenetickým a FISH vyšetřením jsme prokázali deleci 13q, potvrdili jsme selekci klonu CLL buněk s delecí 17p (73 %). V té době byly pro nemocné s touto nepříznivou cytogenetickou abnormitou dostupné pouze režimy s kortikoidy a anti-CD52 monoklonální protilátka alemtuzumab. Pacient byl tehdy 74letý, kromě hypertenze bez významných přidružených onemocnění. Ve 3. linii léčby jsme zvolili monoterapii alemtuzumabem. Léčba však byla komplikována reaktivací cytomegalovirové (CMV) infekce, opakovaně febrilní neutropenií stupně 4 a trombocytopenií stupně 3 dle CTCAE (Common Terminology Criteria for Adverse Events).3 Cytopenie přetrvávala ještě několik měsíců po ukončení terapie. Postupně se stav upravil, došlo k normalizaci laboratorního nálezu a pacient dosáhl kompletní remise onemocnění, která trvala do dubna 2018.
Relaps onemocnění v roce 2018 se manifestoval pomalu progredující lymfocytózou, muž neměl žádné klinické potíže ani známky aktivity onemocnění. Volili jsme tedy strategii watch & wait až do září 2021, kdy se stav nemocného zhoršil, trápily ho B-symptomy (únava, noční poty), progredovala splenomegalie a lymfocytóza. Cytogenetickým vyšetřením jsme před 4. linií léčby prokázali komplexní karyotyp (dominující delece 17p, delece 13q, strukturní aberace chromosomů 4, 6, 8, 18 a 20), Sangerovým sekvenováním DNA jsme potvrdili mutaci genu TP53.
#200 V roce 2021 byl pro nemocné s časným relapsem do 2 let od ukončení předchozí linie léčby dostupný a hrazený režim VenR. Schéma použitého léčebného protokolu je uvedeno v tab. 1. Nemocný byl v té době již 79letý, ale stále v dobré kondici, kromě hypertenze bez přidružených onemocnění. Léčba se komplikovala opakovaně neutropenií stupně 3 a febrilní neutropenií stupně 4 dle CTCAE, s respirační infekcí.
Tab. 1 Léčebný režim venetoklax + rituximab: Ramp-up fáze venetoklaxu trvá 35 dnů. Cyklus 1–24 se opakuje každých 28 dnů.
Ramp-up fáze venetoklaxu
20 mg p.o.
den 1–7
50 mg p.o.
den 8–14
100 mg p.o.
den 15–21
200 mg p.o.
den 22–28
400 mg p.o.
den 29–35
VenR
venetoklax 400 mg p.o.
kontinuálně cyklus 1–24
rituximab 375 mg/m² i.v.
cyklus 1, den 1
rituximab 500 mg/m² i.v.
cyklus 2, den 1
rituximab 1600 mg s.c.
cyklus 3–6, den 1
#201 Obr. 1 Doporučený postup pro hematologické toxicity6
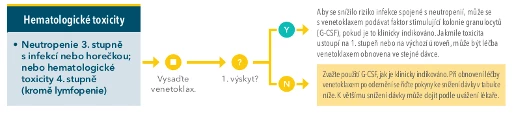

Nemocný dostával podpůrnou léčbu – preventivně kotrimoxazol a valaciklovir, pro hypogamaglobulinémii jsme substituovali imunoglobuliny, při neutropenii jsme aplikovali růstové faktory stimulující kolonie granulocytů (G-CSF). Z důvodu recidivující neutropenie i přes tuto podporu jsme dávku venetoklaxu v posledních měsících léčby redukovali na 300 mg denně. Další průběh terapie trvající celkově 24 měsíců již byl bez komplikací, pacient dosáhl kompletní remise s negativitou měřitelné reziduální nemoci (MRD) na základě vyšetření z kostní dřeně 3 měsíce po ukončení léčby průtokovou cytometrií s citlivostí 10–4. V současné době nemá žádné klinické potíže, trvá kompletní remise, laboratorní parametry krevního obrazu jsou v normě.
Diskuse
Klíčovou úlohu v léčbě CLL, zejména v případě relapsu, dnes zaujímají inhibitory signálních drah B-buněčného receptoru. Venetoklax je selektivním inhibitorem antiapoptotického proteinu Bcl-2. Jeho působení je nezávislé na drahách proteinu TP53.
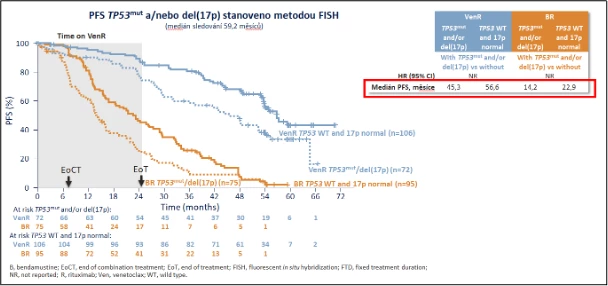
Benefit režimu venetoklax + rituximab (VenR) oproti imunochemoterapii bendamustin + rituximab (BR) pro nemocné s relabující/refrakterní CLL byl hodnocen v randomizované otevřené klinické studii fáze III MURANO. Primárním sledovaným parametrem studie byla doba přežití bez progrese onemocnění (PFS). Studie byla ukončena v srpnu 2022, po 7 letech sledování. Benefity PFS (obr. 2) přetrvávaly ještě 5 let po dokončení léčby VenR, se 77% snížením rizika progrese nemoci nebo úmrtí oproti BR; 50 % pacientů v rameni s VenR bylo bez progrese přibližně 2,5 roku po dokončení léčby.4 Hodnocení PFS u nemocných s mutací TP53 a/nebo delecí 17p v 5 letech sledování demonstruje graf na obr. 3.2 Ačkoliv medián PFS v rameni VenR byl kratší u pacientů s mutací TP53 a/nebo delecí 17p oproti pacientům bez této nepříznivé cytogenetické změny, 50 % účastníků v rameni VenR s mutací TP53 a/nebo delecí 17p bylo bez známek progrese onemocnění přibližně 2 roky po dokončení léčby. Dosažení MRD jako prognosticky příznivého parametru prodlužujícího PFS i celkové přežití (OS) bylo v rameni VenR významně vyšší oproti rameni BR (62 vs. 13 %).5
Obr. 2 Přežití bez progrese, 5 let po dokončení léčby VenR4

Obr. 3 Přežití bez progrese dle mutace TP53 a/nebo delece 17p, 3 roky po dokončení léčby VenR2
Závěr
Kazuistika demonstruje velmi dobrou účinnost i toleranci režimu venetoklax + rituximab u staršího nemocného s nepříznivou cytogenetikou v rámci 4. linie léčby chronické lymfocytární leukémie. Toxicita byla úspěšně zvládnuta podpůrnou léčbou, pacient absolvoval kompletní léčbu, redukce dávky venetoklaxu u něj byla potřebná až v posledních měsících monoterapie. Dosáhl kompletní remise onemocnění s nedetekovatelnou zbytkovou nemocí, která přetrvává již téměř 3 roky. Rozšíření terapeutických možností o preparáty cíleně ovlivňující signální dráhy B-buněčného receptoru a antiapoptotický protein Bcl-2 přineslo zlepšení prognózy nemocných s CLL, benefitem je zejména pro pacienty s relabující/refrakterní CLL s nepříznivou cytogenetikou.
MUDr. Jana Zuchnická, MUDr. Jana Mihályová, prof. MUDr. Roman Hájek, CSc.
Klinika hematoonkologie LF OU a FN OstravaReference:
1. Hallek M., Cheson B. D., Catovsky D. et al. iwCLL guidelines for diagnosis, indications for treatment, response assessment, and supportive management of CLL. Blood 2018; 131 (25): 2745–2760, doi: 10.1182/blood-2017-09-806398.
2. Seymour J. F., Kipps T. J., Eichhorst B. et al. Venetoclax–rituximab in relapsed or refractory chronic lymphocytic leukemia. N Engl J Med 2018; 378 (12): 1107–1120, doi: 10.1056/NEJMoa1713976.
3. Common Terminology Criteria for Adverse Events. National Cancer Institute, 2025. Dostupné na: https://ctep.cancer.gov/protocolDevelopment/electronic_applications/ctc.htm
4. Kater A., Harrup R., Kipps T. J. et al. S201 Final 7-year follow up and retreatment substudy analysis of MURANO: venetoclax–rituximab (VenR)-treated patients with relapsed/refractory chronic lymphocytic leukemia (R/R CLL). Hemasphere 2023; 7 (Suppl.): e492813f, doi: 10.1097/01.HS9.0000967716.49281.3f.
5. Kater A., Seymour J. F., Hillmen P. et al. Fixed duration of venetoklax–rituximab in relapsed/refractory chronic lymphocytic leukemia eradicates minimal residual disease and prolongs survival: post-treatment follow-up of the MURANO phase III study. J Clin Oncol 2019; 37 (4): 269–277, doi: 10.1200/JCO.18.01580.
6. SPC Venclyxto. Dostupné na: www.abbvie.cz/content/dam/abbvie-dotcom/cz/documents/spc/SPC_Venclyxto_11-8-2023.pdf
Líbil se Vám článek? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Štítky
Hematologie a transfuzní lékařství Onkologie
Přihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




