-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
INTERAKTIVNÍ KAZUISTIKA: Kombinace venetoklaxu s azacitidinem v léčbě nemocných s AML směřovaných k alogenní transplantaci krvetvorby
28. 2. 2025
Následující kazuistika představuje případ pacientky, která podstoupila neintenzivní terapii akutní myeloidní leukémie (AML) pomocí kombinace venetoklaxu s azacitidinem (VEN + AZA). Vzhledem k nižší toxicitě a velmi dobré toleranci je tato léčba výhodná u starších nemocných nebo pacientů unfit v době stanovení diagnózy, přitom jde o plnohodnotnou alternativu intenzivní léčby, která navíc umožňuje následnou kurativní alogenní transplantaci krvetvorby (HSCT).
Popis případu
60letá žena byla v lednu 2024 na naši kliniku odeslána praktickým lékařem, u kterého byla došetřována pro nehojící se aftózní stomatitidu, po zjištění pancytopenie s přítomností blastových elementů v periferní krvi. Ve vstupním vyšetření krevního obrazu dominovala leukopenie 2,90 × 109/l s hlubokou neutropenií (absolutní počet neutrofilů 0,05 × 109/l), 70 % leukocytů představovaly myeloblasty. Dále byla přítomná makrocytová anémie (hemoglobin 100 g/l) a mírná trombocytopenie (115 × 109/l). Pacientka byla dosud zdravá, bez významných komorbidit, s výkonnostním stavem dle ECOG 2, ale biologicky přibližně o 5 let starší. Vstupně horší stav výživy daný rovněž minimálním perorálním příjmem v posledních 2 týdnech při rozsáhlé aftózní stomatitidě.
V cytogenetickém vyšetření dominoval klon s delecí 7q22, 7q31 a delecí 17p, dále byly přítomné numerické a strukturální aberace chromosomů 1, 2, 11 a 17. Sekvenování nové generace (NGS) prokázalo pouze mutaci IDH1 typu R132C s VAF (variant allele frequency) 44,7 %. Na základě cytogenetiky a molekulárně genetických vyšetření byla diagnóza uzavřena jako AML s cytogenetickými abnormalitami asociovanými s myelodysplazií dle WHO 2022. S ohledem na komplexní změny karyotypu a deleci 17p šlo o AML nepříznivého rizika dle ELN 2022, kdy jedinou potenciálně kurativní léčbou je alogenní transplantace krvetvorby.
#202 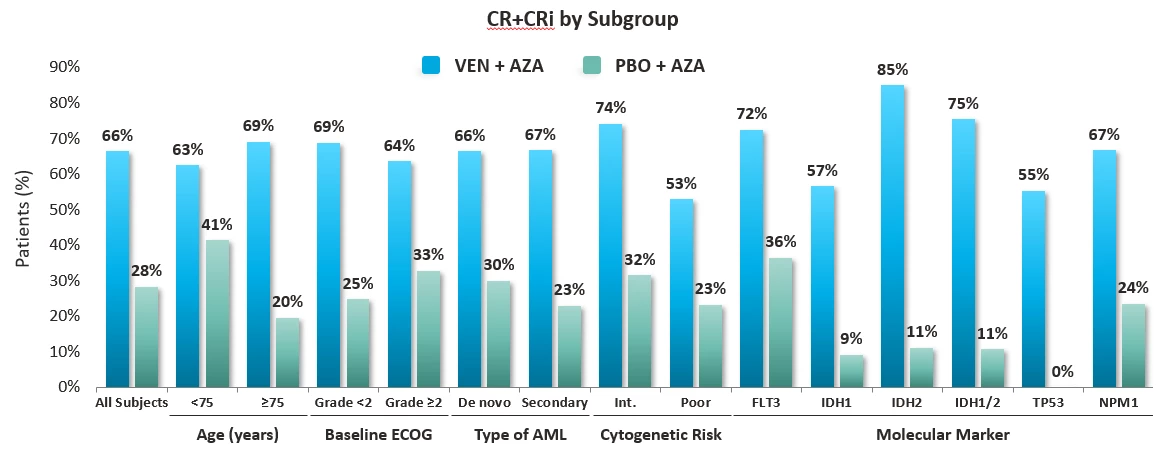
Vzhledem k celkovému stavu pacientka vstupně nebyla vhodným kandidátem intenzivní indukční chemoterapie. Navíc tato AML bývá velmi často refrakterní ke standardní indukční léčbě. Výhodnější se u těchto velmi nepříznivých forem AML jeví léčba kombinací VEN + AZA, po které ve studii VIALE-A dosáhlo remise 55 % pacientů s AML s mutací nebo delecí TP53.1 Proto jsme zahájili 1. cyklus léčby azacitidinem (75mg/m2 D1–7) v kombinaci s venetoklaxem (100 mg D1–28) redukovaným na 25 % dávky při vorikonazolu, silném inhibitoru CYP3A, nasazeném profylakticky při těžké vstupní neutropenii stupně IV.
První cyklus proběhl bez komplikací a léčba byla pacientkou celkově velmi dobře tolerována, proto proběhla plně v ambulantním režimu. S ohledem na prohloubení anémie byly podány 3 transfuzní jednotky erytrocytů. V den 21 prvního cyklu byla provedena kontrolní aspirace kostní dřeně, cytologicky nastal pokles relativní koncentrace myeloblastů ze 62 na 2 %. Došlo tedy k uspokojivé blastoredukci a se závěrem léčebná odpověď typu MLFS (morphologic leukemia free state) bylo podávání venetoklaxu po 21 dnech ukončeno. Ke dni 26 prvního cyklu došlo k normalizaci koncentrace trombocytů v periferní krvi a v den 46 krevní obraz pacientky splnil parametry kompletní remise včetně transfuzní nezávislosti.
S ohledem na jinak dobrý stav a nepřítomnost komorbidit jsme pacientce navrhli alogenní HSCT, se kterou souhlasila. Registr dárců kostní dřeně potvrdil dostupnost HLA-shodných dárců. Procesy spojené se zajištěním odběru transplantátu od vhodného dárce vyžadují určitý čas, bylo tedy nutné, aby pacientka absolvovala ještě nejméně 2 cykly léčby kombinací VEN + AZA.
#203 S ohledem k výskytu protrahované neutropenie před prvním cyklem a dosažení kompletní remise jsme se u této pacientky rozhodli od 2. cyklu zkrátit podání venetoklaxu ze 21 na 14 dní. Druhý cyklus tak nebyl zatížen hematologickou toxicitou a došlo k zhojení stomatitidy se zlepšením perorálního příjmu. Po 3. cyklu byla provedena kontrolní aspirace kostní dřeně s dosažením negativity měřitelné zbytkové nemoci (MRD) na úrovni cytogenetické i molekulární. Od 22. dne 3. cyklu opět došlo k rozvoji neutropenie IV. stupně.
#204 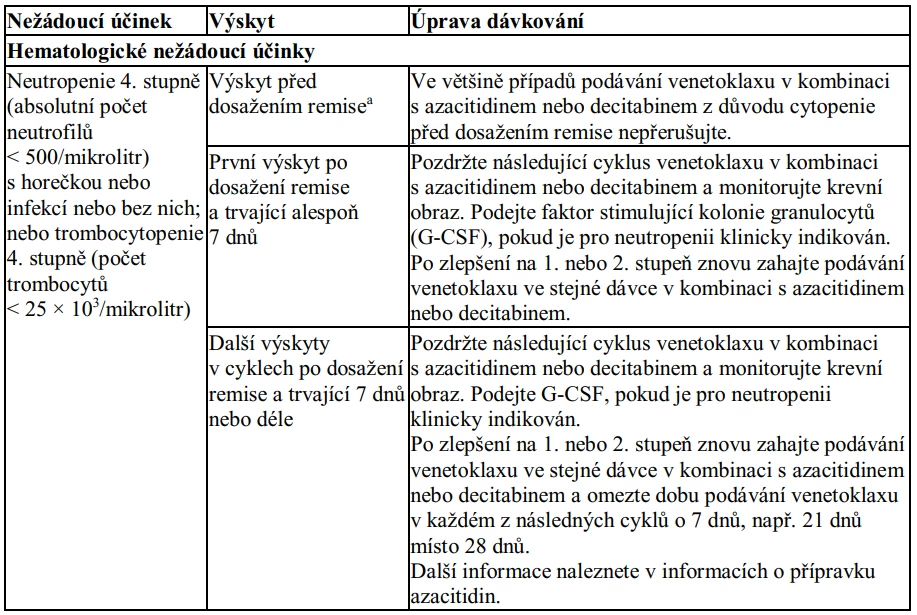
Protrahovaná neutropenie je jedním z častých projevů hematologické toxicity léčby kombinací VEN + AZA a v případě opakovaného výskytu je doporučena úprava délky podávání azacitidinu nebo venetoklaxu, případně redukce dávkování azacitidinu. Týdenní odklad léčby u naší pacientky byl dostatečný k normalizaci hladiny neutrofilů. Přes odklad léčby byl 4. cyklus spojen opět s výskytem neutropenie IV. stupně. Pokud by pacientka v léčbě pokračovala, přiklonili bychom se k aplikaci G-CSF a následně k redukci dávky azacitidinu na 75 %. Pacientka však méně toxickou léčbu velmi dobře tolerovala, podařilo se jí výrazně zlepšit stav výživy a celkovou kondici. Přes opakované neutropenie IV. stupně léčba nebyla komplikována infekcí, a proto mohla nadále směřovat k alogenní HSCT po čtvrtém cyklu VEN + AZA.
Alogenní transplantace proběhla po nemyeloablativním přípravném režimu fludarabin + melfalan, transplantát periferních krvetvorných buněk (17,6 × 106 CD34+ buněk/kg příjemce) byl od HLA-shodného nepříbuzného dárce (muž, 31 let). V rámci profylaxe reakce štěpu proti hostiteli (GvHD) byl podán potransplantační cyklofosfamid a jako imunosuprese byla použita kombinace cyklosporin a mykofenolát mofetil. K přihojení došlo v den +15 a potransplantační průběh byl komplikován lehkou formou akutní GvHD horního trávicího traktu v kombinaci s engraftment syndromem, s promptním efektem kortikoterapie. Pacientka dosáhla kompletního dárcovského chimerismu v den +29, další komplikace se nevyskytly a postupně byla vysazována imunosuprese, jejíž podávání bylo ukončeno ke dni +115 po transplantaci.
Aktuálně uběhl 1 rok od stanovení diagnózy AML vysokého rizika s komplexním karyotypem včetně mutace TP53 a pacientka je 6 měsíců po alogenní HSCT v kompletní remisi, s kompletním dárcovským chimerismem a bez známek GvHD. Zahájila standardní očkování a má plnou kvalitu života.
Závěr
Venetoklax v kombinaci s azacitidinem nepochybně přinesl zásadní pokrok v neintenzivní léčbě starších pacientů s AML.
Tato kazuistika poukazuje na možnost využití kombinace VEN + AZA jako plnohodnotné alternativy intenzivní chemoterapie u pacientů, u kterých není standardní indukční léčba vhodná a současně nejsou kandidáty paliativní léčby. U těchto nemocných obvykle díky dosažení remise po úvodní léčbě dojde k zásadnímu zlepšení zdravotního stavu a mohou následně podstoupit alogenní transplantaci krvetvorby. Tento přístup podporují například výsledky retrospektivní analýzy srovnávající pacienty léčené intenzivní chemoterapií nebo kombinací VEN + AZA, kteří po dosažení remise podstoupili HSCT, přičemž celkové přežití po 5 letech bylo vyšší ve skupině léčené kombinací VEN + AZA.2 Zároveň se VEN + AZA zdá být vhodnou volbou i pro skupinu pacientů s AML vysokého rizika s mutací TP53 nebo s komplexním karyotypem.
Neintenzivní léčba je sice také zatížená hematologickou toxicitou, ta je však zvládnutelná, s přibývajícími zkušenostmi velmi dobře predikovatelná a díky úpravě režimu a podpůrné terapii je především délka neutropenie minimální, což zásadně snižuje riziko infekčních komplikací oproti intenzivní léčbě.
Závěrem lze říct, že VEN + AZA má své místo i v léčbě mladších pacientů s AML a zásadně rozšiřuje možnosti personalizované terapie.
MUDr. Barbora Dluhošová
Klinika hematoonkologie LF OU a FN OstravaReference:
- DiNardo C. D., Jonas B. A., Pullarkat, V. et al. Azacitidine and venetoclax in previously untreated acute myeloid leukemia. N Engl J Med 2020; 383 : 617–629, doi: 10.1056/NEJMoa2012971.
- Fuqua J. 1487 Effectiveness of intensive chemotherapy with 7+3 versus vidaza and venetoclax in acute myeloid leukemia with sequential stem cell transplant: results from real-world cohorts. 65th ASH Annual Meeting, San Diego, 2023 Dec. Dostupné na: https://ash.confex.com/ash/2023/webprogram/Paper187949.html
Líbil se Vám článek? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Štítky
Hematologie a transfuzní lékařství Onkologie
Přihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




