-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Když se řekne amyloid…
12. 12. 2022
Termín „amyloid“ poprvé použil německý lékař Rudolf Virchow v polovině 19. století. Popsal tak patologicky se vyskytující látku, o které se původně domníval, že jde o škrob. Ačkoliv se velmi brzy přišlo na to, že se jedná o látku bílkovinné povahy, odkaz na škrob (z řeckého amylon) již v názvu zůstal.
Struktura amyloidu
Po dalších 100 let byl termín amyloid spojován s různými extracelulárními látkami. Detailnější porozumění jejich stavbě a vlastnostem ale přišlo až s rentgenografickou analýzou struktury proteinů v 70. letech 20. století.
Amyloidy patří mezi vláknité (fibrilární) proteiny. Jejich základní strukturu tedy tvoří vlákno (fibrila) složené typicky ze 2 a více protofilament. Ta tvoří polypeptidové řetězce uspořádané do podoby tzv. beta-skládaného listu (viz obr. 1), což je jedna z přirozených forem sekundární struktury proteinů.
Obr. 1. Struktura amyloidové fibrily (upraveno podle: 2) 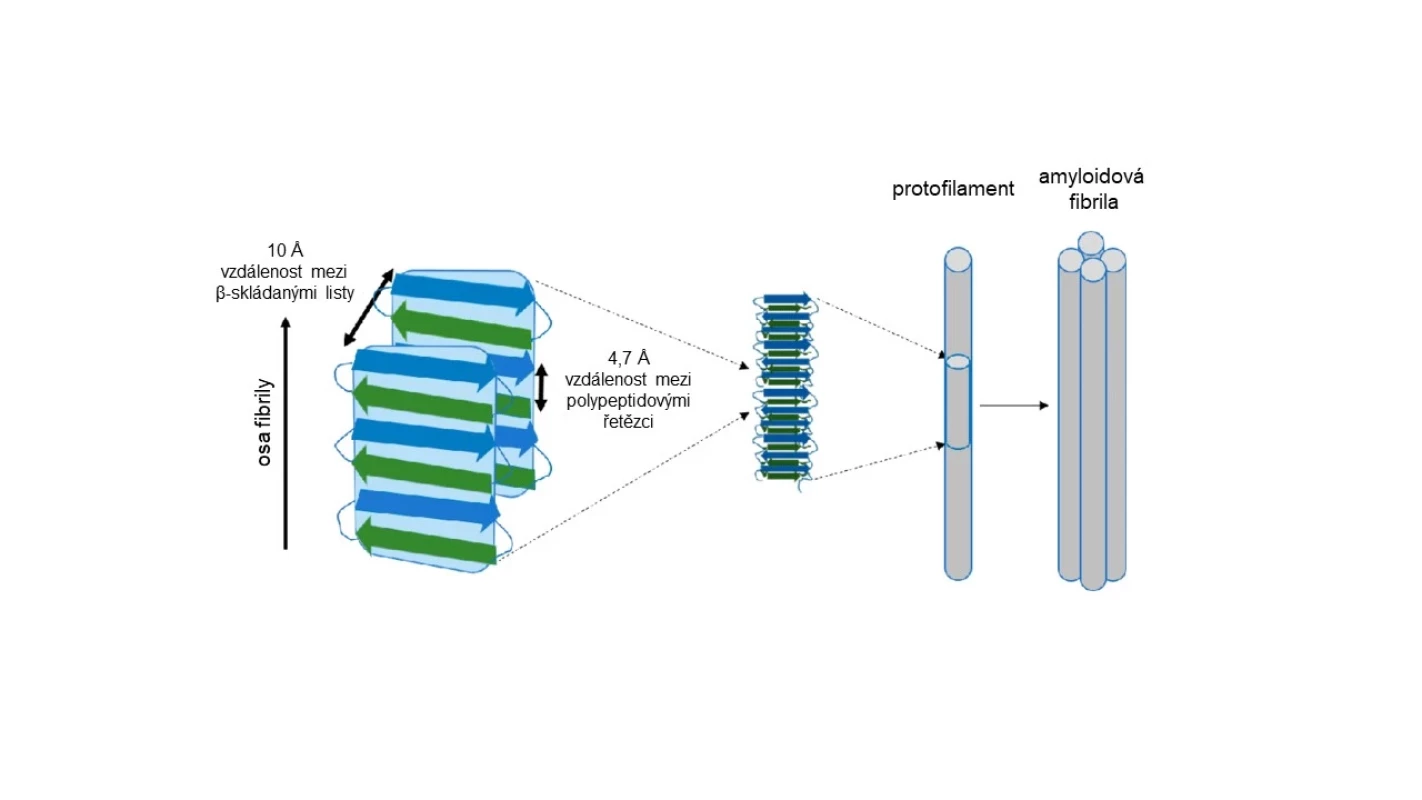 Inzerce
InzerceOd roku 2018 oficiální nomenklatura považuje jakékoliv vlákno tvořené beta-skládanými listy za amyloidovou fibrilu. Termín tedy ztratil svou původní patologickou konotaci, na kterou jsme byli v medicíně zvyklí, neboť se termín amyloid vžil zejména pro patologická depozita specifických bílkovinných shluků nacházených při histopatologickém vyšetření tkání. Důvodem této změny byla reflexe faktu, že vláknité proteiny se strukturou β-skládaných listů plní v přírodě i fyziologické funkce:
- U člověka se amyloidové fibrily uplatňují například při tvorbě zásob polypeptidových hormonů nebo ve struktuře přenašeče melaninu v melanosomech.
- Bourec morušový produkuje protein fibroin se strukturou amyloidového vlákna (tj. přírodní hedvábí).
- Bakterie vylučují amyloidové fibrily jako součást biofilmu.
Amyloid v histologickém preparátu
Při pozorování optickou mikroskopií se amyloid jeví jako amorfní látka, která se barví konžskou červení a poté vykazuje specifické optické vlastnosti. Při průchodu polarizovaného světla přes amyloid s interkalovaným barvivem dochází k dvojlomu a změně zabarvení struktury. Nejčastěji se uvádí, že lze pozorovat zelené zbarvení, ale praxe posledních let upřesňuje, že lze pozorovat také žlutou a červenou barvu v závislosti na řezu tkáně a orientaci fibril in situ.
Amyloidová depozita a amyloidózy
Kromě funkčních amyloidových vláken se v organismu mohou vytvářet i patologická depozita. Ta netvoří pouze protein samotný, ale i další proteiny a proteoglykany, jejichž funkce zatím není zcela prostudována. Mezi nejznámější depozita patří tzv. plaky amyloidu β nalézané v mozkové kůře pacientů v s Alzheimerovou nemocí (AD). Termín „plak“ je ovšem nesprávný, neboť navozuje dojem plochých útvarů. Depozita amyloidových vláken jsou přitom spíše kulovitá. Z názvosloví používaného u AD se „plaky“ již asi nepodaří vymýtit, ale pro jiné shluky amyloidu by se tento termín používat neměl.
Jako amyloidózu potom označujeme onemocnění vyvolané hromaděním a patologickým shlukováním amyloidových fibril nebo jejich nesprávnou tvorbou. V současnosti je identifikováno 18 amyloidových proteinů, které vyvolávají systémová onemocnění, a 22 amyloidů, jejichž patologická depozita byla nalezena místně. Příkladem systémového onemocnění může být AL amyloidóza, při které se v různých orgánech hromadí depozita strukturálně abnormálních lehkých řetězců imunoglobulinu, nebo transthyretinová amyloidóza postihující například periferní nervy a myokard. Závažnou chorobu, jež se v Česku vyskytuje nejčastěji v získané formě, představuje kardiomyopatie způsobená transthyretinovou amyloidózou (ATTR-CM). Pro zlepšení prognózy těchto nemocných je klíčová časná diagnostika a následná terapie. Jako užitečný nástroj ke zhodnocení pravděpodobnosti výskytu ATTR-CM u pacientů se srdečním selháním slouží webová aplikace wtATTR-CM estimATTR založená na metodě strojového učení.
Některá onemocnění charakteristiku amyloidóz splňují, avšak zatím je takto oficiálně nenazýváme. Do této skupiny se řadí právě například Alzheimerova nebo Parkinsonova nemoc s výskytem shluků amyloidu lokálně v CNS.
(jam)
Zdroje:
1. Benson M. D., Buxbaum J. N., Eisenberg D. S. et al. Amyloid nomenclature 2020: update and recommendations by the International Society of Amyloidosis (ISA) nomenclature committee. Amyloid 2020; 27 (4): 217−222, doi: 10.1080/13506129.2020.1835263.
2. Vahdat Shariat Panahi A. The importance of macrophages, lipid membranes and seeding in experimental AA amyloidosis. Linköping University Electronic Press, 2019, doi: 10.3384/diss.diva-159658.
Líbil se Vám článek? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Štítky
Neurologie
Nejnovější kurzy
Autoři: MUDr. Radim Mazanec, Ph.D.
Přejít do kurzů
Nejčtenější tento týden Celý článekPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



