-
Medical journals
- Career
Role nefrometrického skóre RENAL v rámci predikce vzniku pseudoaneurysmatu intrarenálních arterií časně po minimálně invazivní parciální resekci ledviny
Authors: T. Kondo; K. Omae; T. Takagi; S. Morita; Y. Hashimoto; H. Kobayashi; J. Iizuka; K. Yoshida; K. Tanabe
Published in: Urol List 2014; 12(2): 58-64
Overview
Cíle:
Pseudoaneurysma intrarenálních arterií (RAP) může představovat život ohrožující komplikaci, k níž může dojít po parciální resekci ledviny. Autoři hodnotí incidenci RAP, u něhož zatím nedošlo k ruptuře (detekováno pomocí trojrozměrné CT angiografie – CTA), časně po minimálně invazivní parciální resekci ledviny (včetně laparoskopické a robotické operace). Dále hodnotí možnost využití nefrometrického skóre při predikci vzniku RAP.Metody:
V období od února 2012 do listopadu 2013 podstoupilo 101 pacientů s renálními tumory minimálně invazivní parciální resekci ledviny. Tři až čtyři dny po operaci byla provedena CTA a radiologové (zaslepeně) diagnostikovali RAP. Pomocí logistického regresního modelu analyzovali autoři faktory, které mohou potenciálně ovlivňovat vznik RAP.Výsledky:
Míra incidence RAP časně po minimálně invazivní parciální resekci (MIPR) byla nečekaně vysoká – 21,7 % (detekováno pomocí CTA). U pacientů s RAP byl přítomen signifikantně větší tumor (p = 0,02) a významně vyšší skóre parametru N indikující blízkost tumoru k renálnímu sinu (p = 0,01) než u pacientů, u nichž nedošlo ke vzniku RAP. Multivariátní analýza však prokázala, že ani celkové nefrometrické skóre ani hodnota jednotlivých komponent neměly významný vliv na vznik RAP. Velikost tumoru představovala jediný významný nezávislý prediktor vzniku RAP po minimálně invazivní resekci ledviny.Závěr:
Parametr N nefrometrického skóre představuje významný prediktor vzniku RAP podle univariátní analýzy, nikoli však podle multivariátní analýzy. Komponentu N nefrometrického skóre tedy lze považovat za jeden z faktorů užitečných pro predikci vzniku RAP.Klíčová slova:
renální neoplazma, nefrektomie, aneurysma, falešný, laparoskopie, robotikaÚvod
Podle aktuálních guidelines představuje parciální resekce ledviny v současné době standardní operační techniku pro léčbu malých tumorů ledviny [1,2]. Otevřená parciální resekce se doporučuje primárně jako standardní referenční modalita, zatímco laparoskopická parciální resekce se uvádí jako volitelná modalita vhodná pro centra disponující většími zkušenostmi [1,2]. Toto doporučení je založeno na výsledcích studií, které uvádějí vyšší incidenci pooperačních komplikací a delší trvání ischemie při laparoskopickém přístupu než při otevřené operaci [3 – 5]. V poslední době je stále častěji indikována roboticky asistovaná laparoskopická parciální resekce, jež poskytuje benefit v podobě zkrácení délky trvání teplé ischemie [6,7]. Ačkoli je robotický přístup spojen s menším výskytem komplikací (ve srovnání s otevřenou operací) [8], nebylo dosud prokázáno, zda robotická operace poskytuje výhodu v podobě menší morbidity než laparoskopický nebo otevřený přístup.
Jednou z nejzávažnějších komplikací, k níž může dojít po parciální resekci ledviny, je vznik pseudoaneurysmatu intrarenálních arterií (RAP) [9,10]. Může se jednat o život ohrožující stav vyžadující opakovanou hospitalizaci nebo akutní řešení. Nejnovější studie uvádějí vyšší incidenci RAP po laparoskopické operaci než po otevřené parciální resekci [11,12]. Pro prevenci vzniku této komplikace je tedy nezbytné identifikovat příslušné rizikové faktory.
Kutikov et al vytvořili nefrometrické skóre RENAL založené na kalkulaci anatomických parametrů tumoru odstraněného při parciální resekci ledviny [13]. Bylo prokázáno, že tento standardizovaný systém umožňuje predikovat výskyt komplikací po parciální resekci ledviny [14,15]. Existuje tedy možnost, že by toto skóre bylo možné využít rovněž pro predikci vzniku RAP.
V rámci ověření této hypotézy jsme provedli 3D CT angiografii (CTA) u pacientů krátce po parciální resekci ledviny (výkony provedené od února 2012) s cílem detekovat výskyt RAP, u nichž ještě nedošlo k ruptuře. Naše předběžné výsledky prokazují vyšší incidenci RAP než dřívější studie [16]. Vyšší incidence (18 %) této komplikace byla navíc zaznamenána při laparoskopické parciální resekci. V této studii hodnotíme roli nefrometrického skóre v rámci predikce RAP po minimálně invazivní parciální resekci ledviny (včetně laparoskopické a robotické techniky).
Materiál a metody
Pacienti
Design této studie byl schválen radou Women’s Medical University v Tokiu. V období od února 2012 do listopadu 2013 podstoupilo na našem oddělení 114 pacientů s renálními tumory minimálně invazivní parciální resekci ledviny. Třináct pacientů nemohlo podstoupit CTA z důvodu alergie na kontrastní látku, astmatu nebo dysfunkce ledviny. Do studie bylo nakonec zařazeno 101 pacientů, konkrétní parametry jsou uvedeny v tab 1.
Stadium tumorů z renálních buněk bylo stanoveno na základě TNM klasifikace podle International Union Against Cancer TNM (2009) [17]. Klinicko‑patologické faktory autoři hodnotili na základě zdravotní dokumentace pacientů. Nefrometrické skóre RENAL autoři spočítali na základě publikovaných studií [13]. Stručně shrnuto – na škále 1 – 3 byly hodnoceny následující čtyři parametry: 1. velikost tumoru, 2. endofytické/ exofytické parametry, 3. blízkost tumoru k vývodnému systému a 4. jeho lokalizace vzhledem k pólové linii ledviny. Celkový součet všech výše uvedených parametrů je označován jako nefrometrické skóre. Na základě celkového skóre byly tumory klasifikovány do následujících kategorií: tumory se skóre 4 – 6 byly označeny jako málo komplikované, tumory se skóre 7 – 9 jako středně komplikované a tumory se skóre 10 – 12 jako velmi komplikované. Velikost tumoru byla stanovena jako průměr v mm na CT scanu. Po ukončení výkonu byl stanoven odhad krevní ztráty a procentuální podíl zachovaného renálního parenchymu (PPRP). Peroperační vizuální odhad PPRP (vyjadřující procentuální podíl operované ledviny) byl stanoven na základě konsenzu mezi operatérem a asistentem. Patologická diagnóza byla stanovena na základě klasifikace Světové zdravotnické organizace z roku 2004 [18]. Výskyt peroperačních komplikací byl hodnocen v průběhu 90 dnů po operaci a komplikace klasifikovány na základě systému podle Dinda et al [19].
Operační technika
Laparoskopickou i robotickou parciální resekci ledviny jsme prováděli standardní technikou popsanou v jiných publikacích [20,21]. Všechny výkony se prováděly v teplé ischemii. Při laparoskopické parciální resekci jsme zavedli 4 – 5 portů a ledvina byla mobilizována uvnitř Gerotovy fascie, s výjimkou perirenální tukové tkáně kolem tumoru. Hilus ledviny byl zasvorkován pomocí Satinskyho svorky, případně jsme zasvorkovali pouze renální arterii pomocí Bulldog svorky (na základě preference operatéra). Po dokončení incize jsme renální sinus uzavřeli pomocí pokračovací sutury, případně byl vývodný systém uzavřen pomocí vstřebatelné polyglaktinové sutury. Co se týče vnějších stehů, okraje renálního parenchymu byly přiblíženy pomocí vstřebatelné polyglaktinové sutury (s umístěním polštářku Surgicel® do rány, nebo bez tohoto umístění). Při robotické technice byl užit systém se třemi nebo čtyřmi rameny (na základě preference operatéra). Operace byla provedena podobným způsobem jako v případě laparoskopického přístupu. Ve většině případů však byly zasvorkovány pouze renální arterie a nikoli renální žíly.
Trojrozměrná CT angiografie (CTA)
Krátce po výkonu pacienti podstoupili 3D CT s aplikací kontrastní látky (zpravidla třetí den po operaci). CT vyšetření bylo provedeno pomocí systému 16 - (Aquilion 16: TOSHIBA Medical systems, Otawara, Japonsko a Light Speed 16: GE Medical Systems , Tokio, Japonsko) a 64 - (Aquilion 64: TOSHIBA Medical systems, Otawara, Japonsko) s mutidetektorovými scanery. Všechny snímky hodnotil jediný radiolog. Cílem studie bylo detekovat výskyt RAP po parciální resekci ledviny. Dále jsme u všech pacientů, u nichž bylo diagnostikováno RAP, hodnotili různé parametry.
Hodnocení předoperační a pooperační funkce ledviny
Předoperační a pooperační funkci ledviny jsme hodnotili na základě odhadu rychlosti glomerulární filtrace (eGFR). Pro odhad eGFR byla užita modifikovaná izotopová diluční spektrometrie (IDMS). Použili jsme rovnici ze studie Modification of Diet in Renal Disease (MDRD), kterou doporučuje Japonská nefrologická společnost. Tato rovnice je vhodnější pro japonskou populaci než dříve publikované rovnice [22]: eGFR (ml/ min/ 1,73 m2) = 194 × hodnota kreatininu v séru( – 1,094) × věk( – 0,287) × 0,739 (u žen).
Statistická analýza
Pro statistickou analýzu byl užit program JMP® 8.0.2 (SAS Institute Inc., Cary, NC, USA). Kvantitativní parametry byly srovnávány pomocí Mann‑Whitneyho U - testu, kvalitativní parametry pomocí Fisherova testu. Pro stanovení proměnných nezávisle korelujících se vznikem RAP byly užity univariátní a multivariátní logistické regresní modely. Rozdíl byl považován za signifikantní v případě p < 0,05.
Výsledky
Parametry pacientů s/ bez RAP
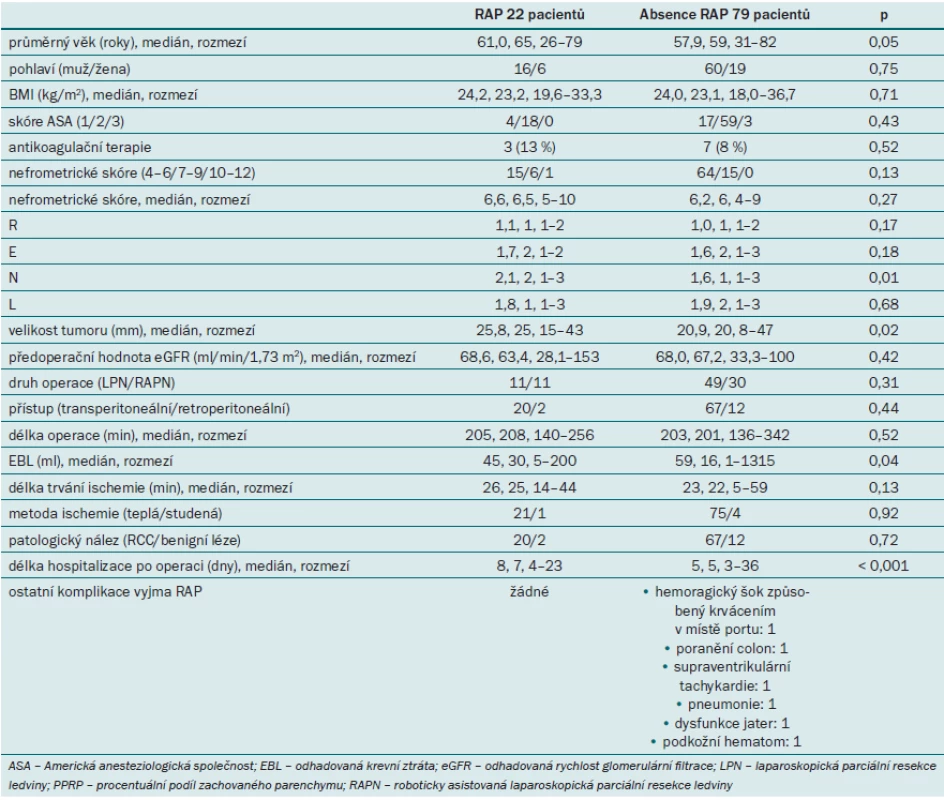
Tab. 1 uvádí parametry pacientů zařazených do studie. Pomocí CTA po výkonu bylo RAP detekováno celkem u 22 pacientů (21,7 %). Obr. 1 zobrazuje reprezentativní nález RAP při CTA. Čtrnáct pacientů podstoupilo okamžitou akutní arteriální embolizaci, u dalších osmi pacientů došlo ke spontánní regresi RAP. Všechny případy RAP byly detekovány před rupturou a náhodně. Srovnávali jsme parametry pacientů s/ bez RAP (non‑RAP). Věk, pohlaví, předoperační hodnota eGFR ani užívání antikoagulancií se mezi oběma skupinami významně nelišily. U pacientů s RAP byly přítomny významně větší tumory (25,8 vs 20,9 mm; p = 0,02) a významně vyšší skóre parametru N (2,1 vs 1,6; p = 0,01) ve srovnání s non‑RAP skupinou. Šedesát pacientů podstoupilo parciální resekci ledviny pomocí laparoskopického přístupu, 41 pacientů pomocí robotického přístupu. Délka operace i délka trvání ischemie byly v obou skupinách srovnatelné. Pacienti s RAP byli z důvodu léčby komplikace po výkonu hospitalizováni déle. U pacientů s RAP se nevyskytovaly žádné další komplikace, zatímco v non‑RAP skupině se vyskytlo šest případů komplikací včetně hemoragického šoku v důsledku pooperačního krvácení z místa portu (stupeň 4) a poranění colon (stupeň 3b). U žádného z pacientů nedošlo k úniku moči.
Image 1. Reprezentativní nález pseudoaneurysmatu intrarenálních arterií (RAP). 5mm RAP bylo detekováno pomocí CT angiografie. 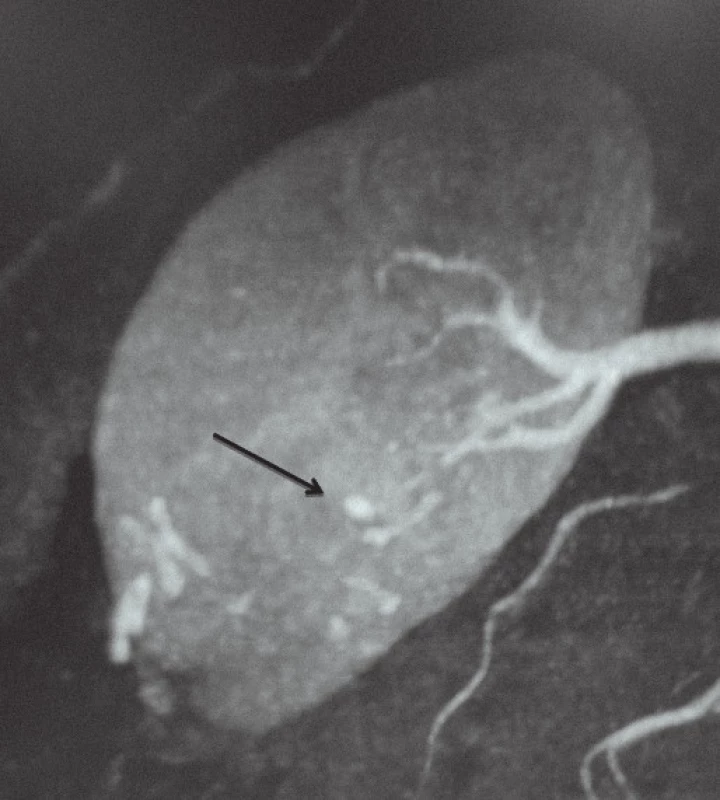
Vliv nefrometrického skóre na vznik RAP
Obr. 2 ukazuje incidenci RAP v jednotlivých podskupinách podle nefrometrického skóre. Incidence RAP činila 19 % (15/ 79) u pacientů s málo komplikovaným onemocněním, 29 % (6/ 21) u pacientů se středně komplikovaným onemocněním a 100 % (1/ 1) u pacientů s velmi komplikovaným onemocněním. Incidence RAP se zvyšovala spolu se zvyšujícím se stupněm komplikovanosti onemocnění, tento výsledek však nedosahoval statistické významnosti. Dále jsme hodnotili roli každé z komponent nefrometrického skóre v rámci výskytu RAP (obr. 3). Incidence RAP byla vyšší ve druhé podskupině (2) než v první (1) podskupině, tento výsledek opět nebyl statisticky signifikantní. Co se týče parametru N, RAP bylo přítomno u 8 % (4/ 52) pacientů v podskupině 1; u 52 % (12/ 23) pacientů v podskupině 2 a u 23 % (6/ 26) pacientů v podskupině 3. Incidence RAP byla významně nižší u pacientů v podskupině 1 než dalších dvou podskupinách (p < 0,001). S ohledem na parametr E nebyl mezi jednotlivými skupinami zaznamenán žádný rozdíl v incidenci RAP.
Image 2. Incidence pseudoaneurysmatu intrarenálních arterií po minimálně invazivní parciální resekci ledviny podle celkového nefrometrického skóre. Tmavě zelená barva indikuje procento pacientů s RAP, světle zelená barva procento pacientů bez RAP. 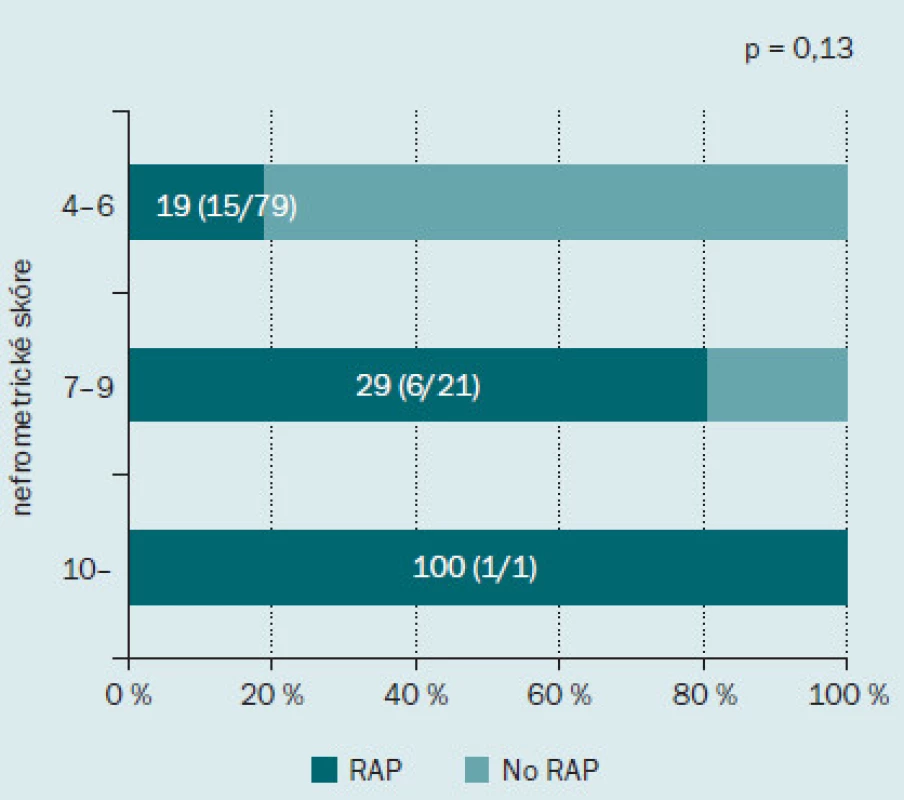
Image 3. Incidence pseudoaneurysmatu intrarenálních arterií po minimálně invazivní parciální resekci ledviny podle jednotlivých komponent nefrometrického skóre. Tmavě zelená barva indikuje procento pacientů s RAP, světle zelená barva procento pacientů bez RAP. 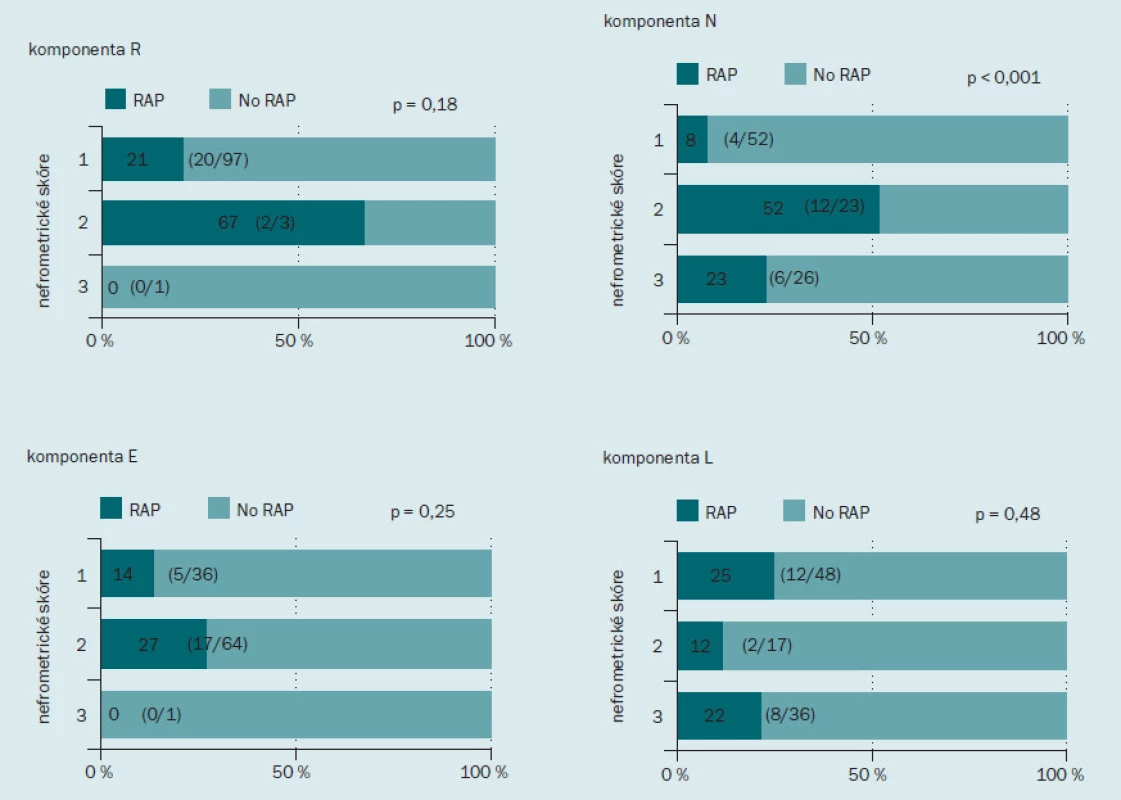
Faktory predikující výskyt RAP
Dále jsme zjišťovali, zda lze nefrometrické skóre užít pro predikci vzniku RAP v rámci univariátní i multivariátní analýzy (tab. 2). Univariátní analýza prokázala, že parametr N a velikost tumoru představovaly významný prediktor vzniku RAP. Podle multivariátní analýzy však jediný nezávislý prediktor vzniku RAP představovala velikost tumoru. Celkové nefrometrické skóre ani žádná z komponent nevykazovaly významnou roli v rámci predikce vzniku RAP.
Table 2. Faktory ovlivňující vznik RAP (podle logistické regresní analýzy). 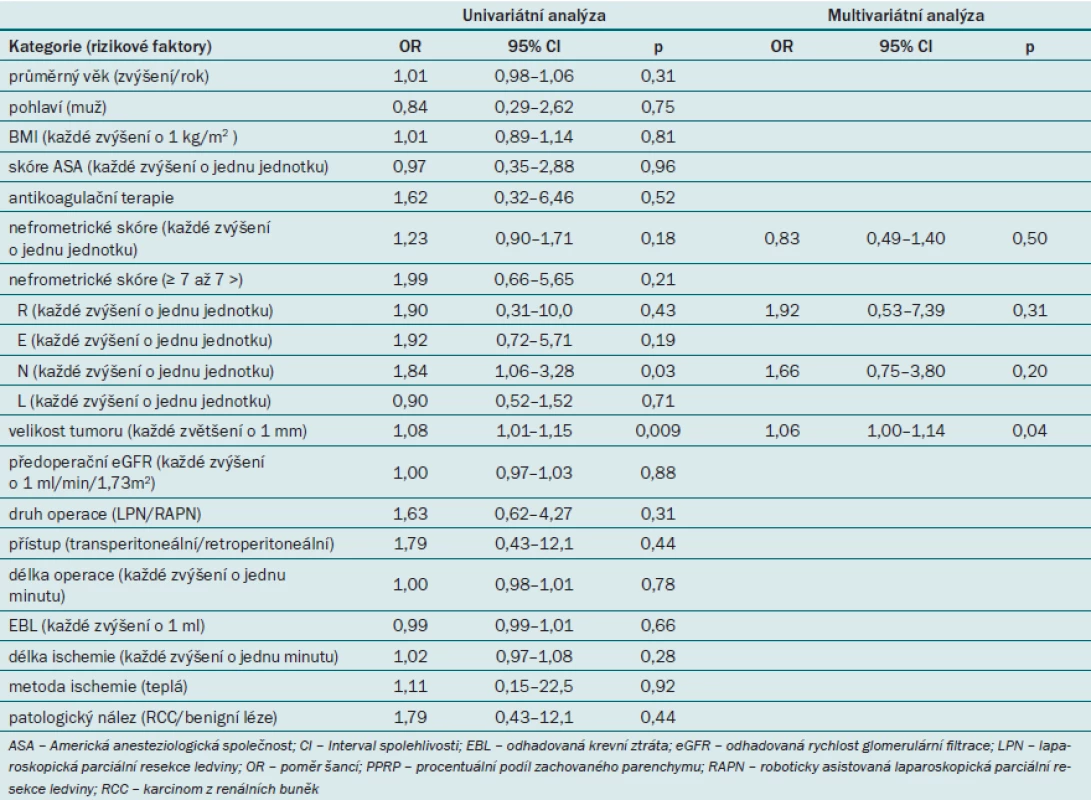
Diskuze
Výsledky studie prokazují nečekaně vysokou míru incidence RAP (u něhož zatím nedošlo k ruptuře) – časně po minimálně invazivní resekci ledviny bylo pomocí CTA RAP detekováno u 21,7 % pacientů. U pacientů s RAP byl přítomen signifikantně větší tumor (p = 0,02) a významně vyšší skóre parametru N (p = 0,01) než u pacientů, u nichž nedošlo ke vzniku RAP. Multivariátní analýza však prokázala, že ani celkové nefrometrické skóre ani hodnota jednotlivých komponent neměly významný vliv na vznik RAP. Velikost tumoru představovala jediný významný nezávislý prediktor vzniku RAP po minimálně invazivní parciální resekci ledviny.
RAP představuje jednu z nejzávažnějších komplikací, k nimž může dojít po parciální resekci ledviny [9,10]. Obvykle je RAP detekováno až poté, co dojde k jeho ruptuře, což způsobí makroskopickou hematurii nebo bolest v boku v důsledku krvácení v perirenální oblasti. V několika ojedinělých případech bylo RAP rovněž detekováno incidentálně během radiologického vyšetření [23]. RAP se obvykle manifestuje přibližně během prvních 14 dnů po operaci [24,25] a ve většině případů musí být pacient hospitalizován a podstoupit okamžitou léčbu. Tato komplikace může ohrozit život pacienta a má nepříznivý dopad na kvalitu jeho života. RAP je obvykle diagnostikováno na základě angiografického vyšetření [11], byly však zaznamenány případy detekce RAP pomocí CT angiografie [26]. U většiny pacientů lze tuto komplikaci vyřešit provedením arteriální embolizace [12].
Bylo prokázáno, že parciální resekce ledviny laparoskopickým nebo robotickým přístupem je spojena s vyšší mírou incidence RAP než otevřená operace [11,12]. Netsch et al uvádějí 1,4% incidenci (4/ 289) po otevřené parciální resekci a 5,0% (2/ 40) incidenci po laparoskopické operaci [11]. U všech pacientů se vyskytovaly symptomy a všichni podstoupili arteriální embolizaci. Ghoneim et al ve své studii uvádějí 0,6% incidenci (7/ 1 160) RAP po otevřené operaci a 2,7% incidenci (8/ 301) po laparoskopické operaci [12]. Jain el al v nedávné době hodnotili míru incidence RAP na základě systematického přehledu a komparativní analýzy zahrnující 5 229 pacientů [25]. Autoři uvádějí 1,0% míru incidence po otevřené parciální resekci ledviny a 1,96% míru incidence po minimálně invazivní operaci. Rozdíl dosahoval statistické významnosti (p < 0,001).
Tato studie uvádí nečekaně vysokou míru incidence (20 %) RAP (u něhož zatím nedošlo k ruptuře) po minimálně invazivní resekci ledviny. Tato míra incidence byla vyšší než incidence zaznamenaná v našem centru po otevřené parciální resekci ve stejném časovém období (7,8 %; 12/ 154). Někteří autoři předpokládají, že naložení stehů v ledvinném lůžku nebo renálním parenchymu může natrhnout arterioly, což v konečném důsledku vede ke vzniku RAP [24,27]. Příčina vyšší míry incidence RAP po minimálně invazivní parciální resekci však zůstává stále nejasná. Existuje několik potenciálních vysvětlení, jako např. vznik traumatu v důsledku užívání větší jehly při MIPR, skutečnost, že okraje renálního parenchymu nejsou přiblíženy dostatečně těsně jako při otevřené operaci [27], případně v důsledku tlaku pneumoperitonea nejsou zřetelné malé vaskulární léze [12].
Nefrometrické skóre RENAL představuje vynikající systém pro číselné vyjádření anatomických parametrů tumorů ledviny [13]. Tento systém se zdá vhodnější než jiná skóre, např. v systému PADUA je nezbytné hodnotit velké množství parametrů [28] a systém c - index vyžaduje složitější výpočet [29]. Nefrometrické skóre zohledňuje čtyři následující parametry: velikost tumoru, exofytické/ endofytické parametry, blízkost tumoru k renálnímu sinu a jeho umístění vzhledem k polární linii ledviny. Poslední studie prokazují benefit užívání tohoto standardizovaného systému v rámci predikce výskytu komplikací po parciální resekci ledviny [14,15]. Simhan et al uvádějí, že vyšší stupeň komplikovanosti tumoru (hodnoceno pomocí nefrometrického skóre) úzce souvisí se vznikem závažných komplikací [14]. Autoři uvádějící následující míru výskytu komplikací: 6,4 % u pacientů s málo komplikovanými tumory, 11,1 % u pacientů se středně komplikovanými tumory a 21,9 % u pacientů s velmi komplikovanými tumory. Multivariátní analýza prokázala, že komplikované tumory jsou nezávislým prediktivním faktorem (OR: 5,4; CI, 1,2 – 24,2). Stroup et al uvádějí, že nefrometrické skóre RENAL souviselo s únikem moči [15]. Vyšší skóre RENAL nasvědčovalo vyššímu riziku úniku moči (OR: 1,56; p = 0,002). Naopak podle výsledků Pnga et al a Mufarrije et al vyšší nefrometrické skóre nesouviselo s mírou výskytu komplikací u pacientů léčených pomocí robotické parciální resekce ledviny [30,31].
Naše výsledky odpovídají výsledkům autorů Pnga et al a Mufarrije et al s ohledem na skutečnost, že celkové nefrometrické skóre neumožňuje predikovat výskyt pooperačních komplikací. Naše studie ukazuje, že parametr N (indikující blízkost tumoru k renálnímu sinu) byl signifikantním ukazatelem v univariátní analýze, což je pravděpodobně v souladu se zjištěním, že při léčbě centrálně lokalizovaných tumorů je laparoskopická parciální resekce spojena s vyšší incidencí RAP [12,32]. Liu et al rovněž doporučují užívat parametr N jako jediný prediktor celkového výskytu komplikací a pooperačního krvácení po minimálně invazivní parciální resekci ledviny [33]. Ke krvácení může docházet v důsledku ruptury RAP. Parametr N tedy může zastávat významnější roli v rámci predikce výskytu komplikací (včetně RAP) po parciální resekci ledviny než celkové nefrometrické skóre nebo případně ostatní komponenty. Multivariátní analýza však nepotvrdila, že by parametr N představoval statisticky nezávislý prediktor. Je tedy nutné analyzovat další faktory ovlivňující vznik RAP.
Nakonec bychom chtěli zdůraznit limitace naší studie v podobě retrospektivního hodnocení zkušeností z jediného centra. Ne ve všech případech, kdy je pomocí CTA detekováno RAP, u něhož zatím nedošlo k ruptuře, je nezbytná arteriální embolizace. Je třeba prokázat, které faktory se podílejí na vzniku klinicky významného RAP. Naše údaje bude nutné potvrdit v multicentrické prospektivní studii s větší populací pacientů.
Závěr
Výsledky naší studie prokazují neočekávaně vysokou míru incidence RAP (u něhož zatím nedošlo k ruptuře) časně po minimálně invazivní parciální resekci ledviny. Parametr N představuje významný prediktor vzniku RAP podle univariátní analýzy, nikoli však podle multivariátní analýzy. Hodnotu N nefrometrického skóre tedy lze považovat za jeden z faktorů užitečných pro predikci vzniku RAP.
Tsunenori Kondo MD, PhD
Department of Urology
Tokyo Women‘s Medical University
8-1, Kawada-cho, Shinjuku-ku
Tokyo 162-8666, Japan
tkondo@kc.twmu.ac.jp
Sources
1. Novick AC, Campbell SC, Belldegrun A et al. Guideline for Management of the clinical stage 1 renal mass. USA: American Urological Association Education and Research, Linthicum 2009.
2. Ljungberg B, Cowan NC, Hanbury DC et al. EAU guidelines on renal cell carcinoma: the 2010 update. Eur Urol 2010; 58(3): 398 – 406. doi: 10.1016/ j.eururo.2010.06.032.
3. Abukora F, Nambirajan T, Albqami N et al. Laparoscopic nephron sparing surgery: evolution in a decade. Eur Urol 2005; 47(4): 488 – 493; discussion: 493.
4. Gill IS, Kavoussi LR, Lane BR et al. Comparison of 1,800 laparoscopic and open partial nephrectomies for single renal tumors. J Urol 2007; 178(1): 41 – 46.
5. Porpiglia F, Volpe A, Billia M et al. Laparoscopic versus open partial nephrectomy: analysis of the current literature. Eur Urol 2008; 53(4): 732 – 742; discussion: 42 – 43. doi: 10.1016/ j.eururo.2008.01.025.
6. Aboumarzouk OM, Stein RJ, Eyraud R et al. Robotic versus laparoscopic partial nephrectomy: a systematic review and meta‑analysis. Eur Urol 2012; 62(6): 1023 – 1033. doi: 10.1016/ j.eururo.2012.06.038.
7. Patel HD, Mullins JK, Pierorazio PM et al. Trends in renal surgery: robotic technology is associated with increased use of partial nephrectomy. J Urol 2013; 189(4): 1229 – 1235. doi: 10.1016/ j.juro.2012.10.024.
8. Ficarra V, Minervini A, Antonelli A et al. A multicentre matched - pair analysis comparing robot - assisted versus open partial nephrectomy. BJU Int 2013. doi: 10.1111/ bju.12570.
9. Albani JM, Novick AC. Renal artery pseudoaneurysm after partial nephrectomy: three case reports and a literature review. Urology 2003; 62(2): 227 – 231.
10. Cohenpour M, Strauss S, Gottlieb P et al. Pseudoaneurysm of the renal artery following partial nephrectomy: imaging findings and coil embolization. Clin Radiol 2007; 62(11): 1104 – 1109.
11. Netsch C, Brüning R, Bach T et al. Management of renal artery pseudoaneurysm after partial nephrectomy. World J Urol 2010; 28(4): 519 – 524. doi: 10.1007/ s00345 ‑ 010 ‑ 0572 ‑ 0.
12. Ghoneim TP, Thornton RH, Solomon SB et al. Selective arterial embolization for pseudoaneurysms and arteriovenous fistula of renal artery branches following partial nephrectomy. J Urol 2011; 185(6): 2061 – 2065. doi: 10.1016/ j.juro.2011.02.049.
13. Kutikov A, Uzzo RG. The R.E.N.A.L. nephrometry score: a comprehensive standardized system for quantitating renal tumor size, location and depth. J Urol 2009; 182(3): 844 – 853. doi: 10.1016/ j.juro.2009.05.035.
14. Simhan J, Smaldone MC, Tsai KJ et al. Objective measures of renal mass anatomic complexity predict rates of major complications following partial nephrectomy. Eur Urol 2011; 60(4): 724 – 730. doi: 10.1016/ j.eururo.2011.05.030.
15. Stroup SP, Palazzi K, Kopp RP et al. RENAL nephrometry score is associated with operative approach for partial nephrectomy and urine leak. Urology 2012; 80(1): 151 – 156. doi: 10.1016/ j.urology.2012.04.026.
16. Takagi T, Kondo T, Tajima T et al. Enhanced computed tomography after partial nephrectomy in early postoperative period to detect asymptomatic renal artery pseudoaneurysm. Int J Urol 2014. doi: 10.1111/ iju.12462.
17. Sobin LH, Gospodarowicz M, Wittekind CH. Kidney (ICD – O C64). In: TNM classification of malignant tumours. 7th ed. New York: Wiley - Liss 2009 : 255 – 257.
18. Eble JN, Sauter G, Epstein JI et al. Classification of tumours: pathology and genetics of tumours of the urinary system and male genital organs. In: World Health Organization Classification of Tumours. Lyon, France: IARC Press 2004.
19. Dindo D, Demartines N, Clavien PA. Classification of surgical complications: a new proposal with evaluation in a cohort of 6336 patients and results of a survey. Ann Surg 2004; 240(2): 205 – 213.
20. Gill IS, Desai MM, Kaouk JH et al. Laparoscopic partial nephrectomy for renal tumor: duplicating open surgical techniques. J Urol 2002; 167(2 Pt 1): 469 – 477; discussion: 475 – 476.
21. Rogers CG, Singh A, Blatt AM et al. Robotic partial nephrectomy for complex renal tumors: surgical technique. Eur Urol 2008; 53(3): 514 – 521.
22. Matsuo S, Imai E, Horio M et al. Revised equations for estimated GFR from serum creatinine in Japan. Am J Kidney Dis 2009; 53(6): 982 – 992. doi: 10.1053/ j.ajkd.2008.12.034.
23. Shapiro EY, Hakimi AA, Hyams ES et al. Renal artery pseudoaneurysm following laparoscopic partial nephrectomy. Urology 2009; 74(4): 819 – 823. doi: 10.1016/ j.urology.2009.03.056.
24. Hyams ES, Pierorazio P, Proteek O et al. Iatrogenic vascular lesions after minimally invasive partial nephrectomy: a multi‑institutional study of clinical and renal functional outcomes. Urology 2011; 78(4): 820 – 826. doi: 10.1016/ j.urology.2011.04.063.
25. Jain S, Nyirenda T, Yates J et al. Incidence of renal artery pseudoaneurysm following open and minimally invasive partial nephrectomy: a systematic review and comparative analysis. J Urol 2013; 189(5): 1643 – 1648. doi: 10.1016/ j.juro.2012.11.170.
26. Moore CJ, Rozen SM, Fishman EK. Two cases of pseudoaneurysm of the renal artery following laparoscopic partial nephrectomy for renal cell carcinoma: CT angiographic evaluation. Emerg Radiol 2004; 10(4): 193 – 196.
27. Singh D, Gill IS. Renal artery pseudoaneurysm following laparoscopic partial nephrectomy. J Urol 2005; 174(6): 2256 – 2259.
28. Ficarra V, Novara G, Secco S et al. Preoperative aspects and dimensions used for an anatomical (PADUA) classification of renal tumours in patients who are candidates for nephron - sparing surgery. Eur Urol 2009; 56(5): 786 – 793. doi: 10.1016/ j.eururo.2009.07.040.
29. Simmons MN, Ching CB, Samplaski MK et al. Kidney tumor location measurement using the C index method. J Urol 2010; 183(5): 1708 – 1713. doi: 10.1016/ j.juro.2010.01.005.
30. Png KS, Bahler CD, Milgrom DP et al. The role of R.E.N.A.L. nephrometry score in the era of robot - assisted partial nephrectomy. J Endourol 2013; 27(3): 304 – 308. doi: 10.1089/ end.2012.0182.
31. Mufarrij PW, Krane LS, Rajamahanty S et al. Does nephrometry scoring of renal tumors predict outcomes in patients selected for robot - assisted partial nephrectomy? J Endourol 2011; 25(10): 1649 – 1653. doi: 10.1089/ end.2011.0003.
32. Nadu A, Kleinmann N, Laufer M et al. Laparoscopic partial nephrectomy for central tumors: analysis of perioperative outcomes and complications. J Urol 2009; 181(1): 42 – 47; discussion: 47. doi: 10.1016/ j.juro.2008.09.014.
33. Liu ZW, Olweny EO, Yin G et al. Prediction of perioperative outcomes following minimally invasive partial nephrectomy: role of the R.E.N.A.L nephrometry score. World J Urol 2013; 31(5): 1183 – 1189. doi: 10.1007/ s00345 ‑ 012 ‑ 0876 ‑ 3.
Labels
Paediatric urologist Urology
Article was published inUrological Journal

2014 Issue 2-
All articles in this issue
- Transrektální cílený ultrazvuk o vysoké intenzitě při léčbě lokalizovaného karcinomu prostaty
- Aktivní přístup k časné detekci karcinomu prostaty – co je smysluplné a co již škodlivé
- Karcinom prostaty – od hormonální závislosti po kastračně rezistentní nádor
- Roboticky asistovaná radikální cystektomie – operační postupy a hodnocení onkologických a funkčních výsledků a výskyt komplikací
- Funkční a onkologické výsledky po radikální cystektomii a vytvoření ortotopické neoveziky u žen
- Techniky LESS a NOTES: minulost, současnost a další vývoj
- Role nefrometrického skóre RENAL v rámci predikce vzniku pseudoaneurysmatu intrarenálních arterií časně po minimálně invazivní parciální resekci ledviny
- Erektilní dysfunkce a její léčba – farmakologický a klinický profil avanafilu
- Urological Journal
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Aktivní přístup k časné detekci karcinomu prostaty – co je smysluplné a co již škodlivé
- Karcinom prostaty – od hormonální závislosti po kastračně rezistentní nádor
- Transrektální cílený ultrazvuk o vysoké intenzitě při léčbě lokalizovaného karcinomu prostaty
- Erektilní dysfunkce a její léčba – farmakologický a klinický profil avanafilu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career