-
Medical journals
- Career
EAU Guidelines pro léčbu karcinomu prostaty - Část první: Screening, diagnostika a léčba klinicky lokalizovaného karcinomu
Authors: A. Heidenreich; J. Bellmunt; M. Bolla; S. Joniau; M. Mason; V. Matveev; N. Mottet; H. P. Schmid; T. Van Der Kwast; T. Wiegel; F. Zattoni
Published in: Urol List 2011; 9(2): 83-94
Overview
Cíl:
Naším cílem je prezentovat souhrn poslední verze EAU (Evropské urologické asociace) Guidelines pro screening, diagnostiku a léčbu klinicky lokalizovaného karcinomu prostaty, publikované v roce 2010.Metody:
Členové panelu hodnotili nejnovější důkazy publikované v letech 2007–2010. Aktualizovali stávající guidelines a na základě systematického hodnocení literatury (které zahrnovalo průzkum online databáze a přehledů literatury) klasifikovali jednotlivé důkazy na základě úrovní důkazů a stupně doporučení.Výsledky:
Kompletní verze guidelines je k dispozici v centrále EAU a na webové stránce www.uroweb.org. Důkazy, které máme v současné době k dispozici, neospravedlňují zahájení plošného screeningu PSA (prostatického specifického antigenu) pro detekci karcinomu prostaty. Diagnostickou metodou volby je systematická biopsie prostaty v lokální anestezii pod ultrazvukovou kontrolou. U mužů s karcinomem prostaty s nízkým rizikem a dlouhou očekávanou délkou života je jednou z možností aktivní sledování. PSADT (doba do zdvojnásobení hladiny PSA) < 3 roky a progrese onemocnění (na základě biopsie prostaty) jsou indikátory pro zahájení aktivní léčby. U mužů s lokálně pokročilým karcinomem prostaty, u nichž není nezbytná lokální terapie, je adekvátní alternativou k ADT (androgen-deprivační terapii) metoda pozorného vyčkávání (WW). Oba přístupy dosahují srovnatelných onkologických výsledků. Aktivní léčba se obvykle doporučuje u pacientů s lokalizovaným onemocněním a dlouhou očekávanou délkou života. Prospektivní randomizovaná studie prokázala, že radikální prostatektomie (RP) dosahuje lepších výsledků než WW. U pacientů s onemocněním ohraničeným na orgán je léčbou volby nervy šetřící RP, při užití neoadjuvantní andro-genní deprivace nebylo prokázáno žádné zlepšení výsledných parametrů. Při radioterapii se doporučuje následující dávkování: alespoň 74 Gy u pacientů s nízkým rizikem a 78 Gy u pacientů se středně vysokým rizikem. U pacientů s lokálně pokročilým onemocněním je léčbou volby tříletý cyklus adjuvantní ADT. Tato modalita dosahuje vynikajících výsledků s ohledem na míru přežití specifickou pro karcinom i celkovou dobu přežití. Sledování po lokální terapii je založeno zejména na základě hladiny PSA. Sledování anamnézy specifické pro onemocnění se zobrazovacím vyšetřením je indikováno pouze v případě, že se objeví symptomy.Závěr:
Poznatky v oblasti léčby karcinomu se rychle vyvíjí. Tato EAU Guidelines pro léčbu karcinomu prostaty prezentují souhrn nejnovějších informací a implementují je do klinické praxe.Klíčová slova:
karcinom prostaty, EAU Guidelines, přehled, sledování, záchranná radioterapie, záchranná radikální prostatektomie, androgenní deprivace, chemoterapie, MDV3100, abirateron, docetaxel, kyselina zoledronová, denosumab1. ÚVOD
Poslední aktualizovaný souhrn EAU Guidelines pro léčbu karcinom prostaty byl uveřejněn v roce 2008 [1]. Kompletní verze guidelines je vzhledem k řadě významných změn, které ovlivňují klinické řešení karcinomu prostaty, průběžně aktua-lizována. Tento článek podává souhrn informací obsažených v aktualizované verzi z roku 2010. Pro snazší hodnocení kvality uváděných údajů byly jednotlivé informace klasifikovány podle LE (úrovní důkazu) a GR (stupně doporučení) na základě obecných pravidel EBM – medicíny založené na důkazech [2].
2. EPIDEMIOLOGIE
V Evropě představuje karcinom prostaty nejčastěji se vyskytující solidní neoplazma. Incidencí 214 případů/1 000 mužů předčí výskyt karcinomu plic i kolorektálního karcinomu [3]. Karcinom prostaty posti-huje častěji starší muže, větší riziko onemocnění tedy představuje v rozvinutých zemích, kde tvoří přibližně 15 % všech karcinomů u mužů, zatímco v rozvojových zemích pouze 4 % [4]. V incidenci karcinomu prostaty byly zaznamenány obrovské regionální odlišnosti: od 68,8 případů na Maltě až po 182 případů v Belgii [4].
3. RIZIKOVÉ FAKTORY
Faktory podmiňující vznik karcinomu prostaty nebyly dosud dostatečně prozkoumány, přesto však byly identifikovány tři hlavní rizikové faktory: vyšší věk, etnikum a dědičná komponenta.
Jestliže byl u příbuzného v první linii diagnostikován karcinom prostaty, má muž minimálně dvojnásobné riziko, že tímto karcinomem onemocní. Pokud byl karcinom diagnostikován u dvou nebo více příbuzných v první linii, pak se riziko zvyšuje pěti - až jedenácti-násobně [5]. Přibližně 9 % pacientů má skutečně dědičnou formu karcinomu prostaty. O tomto typu karcinomu lze hovořit v případě, že byl karcinom dia-gnostikován u tří nebo více příbuzných anebo pokud u dvou příbuzných došlo k časnému vzniku onemocnění (tj. ve věku < 55 let).
4. KLASIFIKACE
V těchto guidelines je užívána TNM klasifikace The Union Internationale Contre le Cancer z roku 2009 [6]. Při určování stupně (grade) karcinomu se doporučuje užívat Gleasonovo skóre. Podle současného mezinárodního úzu se (modifikované) Gleasonovo skóre karcinomu prostaty detekovaného při biopsii prostaty skládá z Gleasonova grade dominatní (nejrozsáhlejší) části karcinomu plus nejvyššího grade, bez ohledu na rozsah (neplatí zde pravidlo 5 %). U vzorku odebraného při radikální prostatektomii (RP) by mělo být zaznamenáno jak primární, tak i sekundární Gleasonovo grade. Dále je vhodné zaznamenat i případný terciární grade a jeho přibližný podíl z celkového objemu karcinomu.
5. SCREENING KARCINOMU PROSTATY
V současné době neexistují žádné důkazy, které by podporovaly zahájení masového screeningového programu pro časnou detekci karcinomu prostaty v celkové populaci [8] (úroveň důkazu: 2). Účinnost screeningu karcinomu prostaty byla doposud hodnocena ve dvou velkých randomizovaných studiích: americké studii PLCO (the Prostate, Lung, Colorectal, and Ovary trial) a evropské (ERSPC) European Randomised Study of Screening for Prostate Cancer [9,10] (úroveň důkazu: 1b).
Ve studii PLCO bylo 76 693 mužů randomizováno ke screeningu PSA a DRE (jednou za rok) nebo běžné péči (kontrolní skupina) [9]. Po sedmi letech sledování byla zaznamenána následující indicence karcinomu prostaty na 10 000 člověko/let: 116 (2 820 karcinomů) ve screeningové skupině a 95 (2 322 karcinomů) v kontrolní skupině (rate ratio: 1,22) [9]. Incidence úmrtí na 10 000 člověkolet činila 2,0 (50 úmrtí) ve screeningové skupině a 1,7 (44 úmrtí) v kontrolní skupině (poměr: 1,13). Členové PLCO týmu dospěli k závěru, že mortalita na karcinom prostaty u mužů podstupujících screening byla velmi nízká a významně se nelišila mezi oběma skupinami (úroveň důkazu: 1b).
Do studie ERSPC bylo zařazeno celkem 162 243 mužů ve věku 55–69 let [10]. Muži byli randomizováni do dvou skupin: muži zařazení do první skupiny podstoupili v průměru jednou za čtyři roky screening PSA, muži v druhé – kontrolní skupině nepodstoupili žádný screening. Během střední doby sledování 9 let byla zaznamenána následující kumulativní incidence karcinomu prostaty: 8,2 % ve screeningové skupině a 4,8 % v kontrolní skupině [10]. Rozdíl absolutních rizik činil 0,71 úmrtí na 1 000 mužů. To znamená, že abychom zabránili jednomu úmrtí na karcinom prostaty, musí 1 410 mužů podstoupit screening a 48 mužů s karcinomem musí podstoupit léčbu. Členové ERSPC týmu dospěli k závěru, že screening PSA snižuje riziko úmrtí na karcinom prostaty o 20 %, ale na druhou stranu je spojen s vysokým rizikem indikace zbytečné léčby (úroveň důkazu: 1b).
Oběma studiím se dostalo značné pozornosti v tisku a bylo publikováno velké množství komentářů. Ve studii PLCO byla u mužů podstupujících screening zaznamenána následující míra kompliance: 85 % pro měření hladiny PSA a 86 % pro DRE. V kontrolní skupině však byla během prvního roku zaznamenána 40% míra kontaminace, která se v průběhu šestého roku dále zvýšila na 52 % (PSA screening) a 41–46 % (DRE). Kompliance pro biopsii byla 40–52 % ve studii PLCO vs 86 % ve studii ERSPC. Studie PLCO tedy pravděpodobně nikdy neumožní odpovědět na otázku, zda může screening ovlivnit mortalitu na karcinom prostaty, nebo nikoli.
V nedávné době provedená retrospektivní analýza hodnotí incidenci, metastatické šíření a příčinu úmrtí (během osmi let sledování) ve skupině 11 970 mužů, kteří byli zařazeni do screeningové větve ERSCP, a v kontrolní skupině 133 287 mužů, kteří nepodstoupili žádný screening [1]. Relativní riziko (RR) vzniku metastatického šíření karcinomu prostaty činí ve screeningové skupině (ve srovnání s kontrolní skupinou) 0,47 (p < 0,001). Rovnež RR mortality specifické pro karcinom prostaty bylo významně nižší ve screeningové větvi (RR: 0,63; p = 0,008). Pokles absolutní mortality činil 1,8 úmrtí na 1 000 mužů. Na základě těchto údajů je zřejmé, že skutečný benefit studie ESRPC bude patrný až po 10–15 letech sledování, zejména z důvodu 41% poklesu výskytu metastáz ve screeningové větvi. Rovněž očekáváme výsledky týkající se ekonomické zátěže a vedlejších účinků spojených s intenzivnějším screeningem.
Většina velkých urologických společností (ne-li všechny) se na základě výsledků těchto dvou velkých randomizovaných studií shoduje na tom, že zahájení plošného masového screeningu karcinomu prostaty není v současné době na místě. Vhodnějším přístupem je nabídnout časnou detekci (tzv. „oportunistický screening“) dobře informovaným mužům (viz kap. 6). Následující dvě klíčové otázky stale zůstávají nezodpovězeny:
V jakém věku zahájit časný screening?
V jakém časovém intervalu opakovat PSA sreening a DRE?
Volba časného PSA screeningu by měla odrážet společné rozhodnutí lékaře i pacienta, které zohlední všechny benefity i nevýhody. První měření PSA se doporučuje ve 40. roce života. Od této hranice je možné stanovit interval pro další screening [10–12] (stupeň doporučení: B). U mužů s počáteční hodnotou PSA < 1 ng/ml může být postačující interval 8 let [10]. U mužů starších 75 let s počáteční hodnotou PSA ≤ 3 ng/ml není další testování PSA vzhledem k velmi nízkému riziku úmrtí na karcinom prostaty nutné [13].
6. DIAGNOSTIKA A STAGING KARCINOMU PROSTATY
Hlavní metody pro diagnostikování karcinomu prostaty zahrnují DRE, měření koncentrace PSA v séru a biopsii naváděnou pomocí TRUS (transrektálního ultrazvukového vyšetření). Přibližně u 18 % pacientů je karcinom prostaty detekován pouze na základě nálezu DRE, bez ohledu na hladinu PSA [14] (úroveň důkazu: 2a). Podezřelý nález DRE u pacientů s hladinou PSA do 2 ng/ml má pozitivní prediktivní hodnotu 5–30 % [15] (úroveň důkazu: 2a).
Je třeba stanovit hraniční hodnotu PSA pro nejvyšší riziko karcinomu prostaty (tab. 1). Při analýze PSA je třeba mít na paměti, že rozdílné testy mohou ukazovat rozdílný výsledek koncentrace PSA v séru [16], což komplikuje klinickou interpretaci PSA i volného PSA (%fPSA). Při srovnání klasického kalibrovaného testu pro měření hladiny PSA a volného PSA (fPSA) Hybritech a nového „standardizovaného“ testu Světové zdravotnické organizace (WHO) Access byl zjištěn až 25% rozdíl (o 25 % nižší hladina PSA i fPSA). Pro docílení stejné senzitivity/specifity vyšetření je nutné při užívání WHO testu zvolit hraniční hodnotu PSA 3 nebo 3,1 μg/l, zatímco při užívání tradičního kalibrovaného testu hodnotu 4 μg/l. Hraniční hodnota pro volný testosteron je pro oba testy stejná.
Table 1. Riziko karcinomu prostaty při nižších hodnotách PSA. 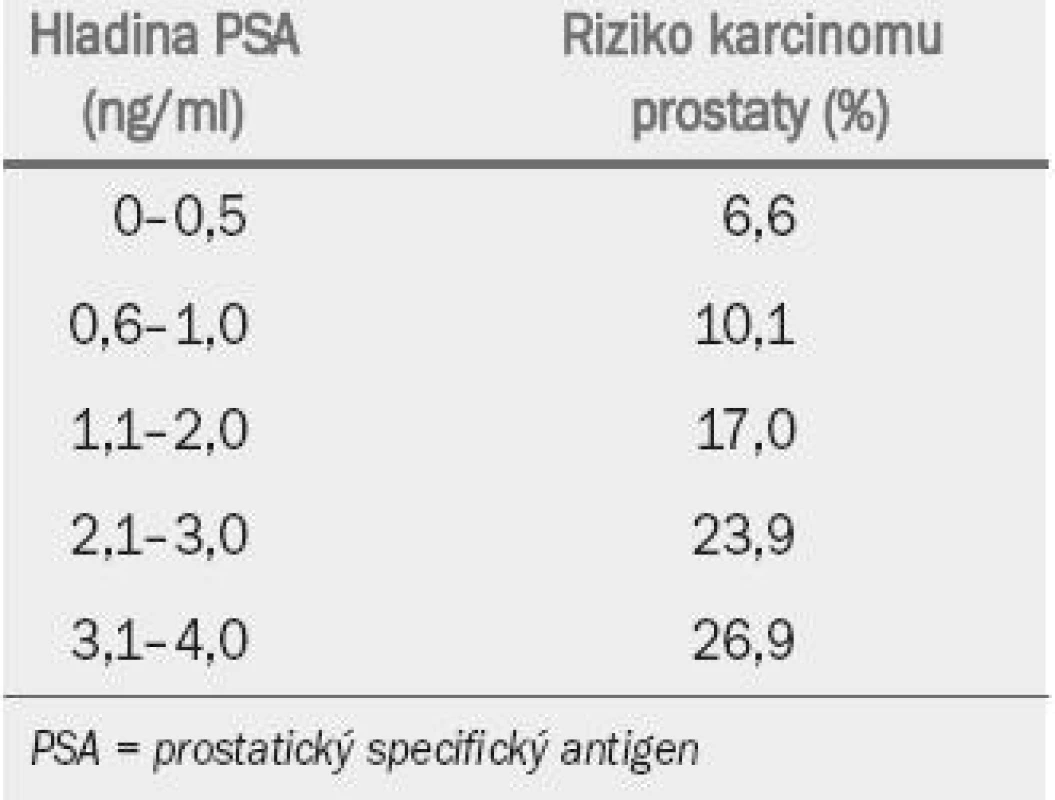
Hladina PSA představuje kontinuální parametr: čím vyšší hodnota, tím větší je pravděpodobnost přítomnosti karcinomu prostaty. Výsledky nejnovější americké preventivní studie [17] podtrhují zjištění, že u řady mužů může být i navzdory nízké hladině PSA přítomen karcinom prostaty (úroveň důkazu: 2a). Tab. 4 ukazuje míru výskytu karcinomu prostaty v závislosti na hladině PSA u 2 950 mužů s normální hladinou PSA v placebo skupině.
Doposud byly popsány následující modifikace sérových hodnot PSA, které mohou zlepšit specifitu PSA při časné detekci karcinomu prostaty:
- denzita PSA
- denzita PSA přechodné zóny
- věkově specifické referenční rozmezí
- molekulární formy PSA
V prospektivní multicentrické studii byl karcinom prostaty detekován u 56 % mužů s hladinou volného/celkového (f/t) PSA < 0,10 a pouze u 8 % mužů s hladinou volného/celkového (f/t) PSA > 0,25 [8] (úroveň důkazu: 2a). Tento výsledek potvrdila v nedávné době provedené screeningová studie zahrnující 27 730 mužů s PSA v rozmezí 2,1–10 ng/ml [18]. Užívání f/t PSA pomohlo významně snížit počet zbytečně prováděných biopsií a signifikantně zvýšit míru detekce karcinomu prostaty. Přesto je nutné tento parametr užívat obezřetně, protože některé preanalytické a klinické faktory mohou ovlivňovat hladinu f/t PSA. Kupříkladu volný PSA je nestabilní při 4 °C a při pokojové teplotě.
Parametry PSAV (velocita PSAV) a PSA DT (PSA Doubling Time = doba do zdvojnásobení hladiny PSA) hrají při diagnostice karcinomu prostaty pouze omezenou roli vzhledem k tomu, že dosud nebyly dořešeny některé rozporuplné otázky, jako interferující pozadí (celkový objem prostaty, benigní hyperplazie prostaty), interval mezi měřením hladiny PSA, zrychlení/ /zpomalení PSAV a PSA DT v průběhu času. Prospektivní studie neprokázaly, že by tyto proměnné poskytovaly jakoukoli další informaci k údajům získaným při měření hladiny PSA.
Na rozdíl od výše zmiňovaných sérových markerů se pro měření hodnoty nového biomarkeru PCA 3 (biomarker pro karcinom prostaty 3) užívá močový sediment po masáži prostaty [21]. Měření hladiny této RNA specifické pro karcinom prostaty je prozatím považováno za experimentální metodu. V rámci populačních studií může tento parametr přinášet užitečné informace, jeho význam u jednotlivých pacientů je však velmi diskutabilní. Na základě žádného z výše popsaných biomarkerů však v současné době nelze stanovit, zda je nezbytné u pacienta provést biopsii pro vyloučení přítomnosti karcinomu prostaty, nebo nikoli. Molekulární marker může být nápomocný při zvažování provedení opakované biopsie u mužů, u nichž i navzdory negativnímu výsledku první biopsie přetrvává podezření na přítomnost karcinomu prostaty [22,23]. U mužů, u nichž opakovaná biopsie prokáže pozitivní výsledek, bylo zaznamenáno významně vyšší PCA3 skóre než u mužů s negativním výsledkem opakované biopsie (69,5 vs 37,7; p < 0,001). U pacientů s f/t PSA < 10 % lze PCA3 považovat za významný predikátor karcinomu prostaty. Při užití PCA3 > 30 se procento pozitivního výsledku biopsie zvýšilo ze 17,8 % na 30,6 % u mužů s f/t PSA 10–20 % a ze 23,9 % na 37,0 % u mužů s f/t PSA > 20 %.
Standardní metodou odběru vzorku pro histopatologické vyšetření je v současné době TRUS nebo transperineální biopsie laterální části prostaty s užitím 18 G bioptické jehly [24,25]. Nutnost provedení biopsie prostaty je vhodné posoudit na základě hodnoty PSA a/nebo podezřelého nálezu při DRE. Dále je vhodné zohlednit věk pacienta, potenciální výskyt komorbidit a případné důsledky výkonu. První zvýšení hladiny PSA by nemělo být impulzem pro okamžitou indikaci biopsie. Poté, co byla jako možná diagnóza vyloučena prostatitida, je třeba výsledek potvrdit po několika týdnech pomocí stejného testu za standardních podmínek. Jedinou výjimku představují pacienti s PSA > 20 ng/ml.
U prostaty o objemu 30–40 ml je nutné odebrat alespoň osm vzorků. Odběr více než 12 vzorků nepřinese výrazně jednoznačnější výsledek (úroveň důkazu: 1a). Nejnovější metodu v rámci profylaxe představuje orální nebo intravenózní aplikace chinolonů. Bylo prokázáno, že ciprofloxacin dosahuje lepších výsledků než ofloxacin [27] (úroveň důkazu: 1b). Další moderní metodou je periprostatický blok naváděný pomocí ultrazvukového vyšetření [28] (úroveň důkazu: 1b). Při první biopsii je vhodné vzorky odebírat co nejvíce posteriorně a laterálně z periferní části prostatické žlázy. Další vzorky je třeba odebrat z oblastí, kde DRE/TRUS identifikovaly podezřelý nález.
Indikace pro opakované provedení biopsie zahrnují: zvyšující se a/nebo trvale zvýšenou hladinu PSA, podezřelý nález při DRE a atypické malé acinární proliferace prostaty. Optimální doba pro provedení biopsie nebyla doposud stanovena. Čím později je opakovaná biopsie indikována, tím vyšší je procento detekce karcinomu prostaty [29]. Intraepiteliální prostatická neoplazie vysokého grade (PIN) představuje indikaci pro opakované provedení biopsie pouze v případě, že se nachází multifokálně [29] (úroveň důkazu: 2a). Pakliže i navzdory negativním biopsiím přetrvává podezření na přítomnost karcinomu prostaty, může být indikována magnetická rezonance (MRI) pro vyšetření potenciální přítomnosti karcinomu v anteriorní části prostaty s následným provedením TRUS nebo biopsie (pod kontrolou MRI) v podezřelé oblasti.
Karcinom prostaty je diagnostikován na základě histologického vyšetření [30]. V případě, že je identifikována podezřelá glandulární léze, je vhodné zvážit provedení pomocných barvicích technik (např. barvení bazálních buněk) a další zpracování vzorku biopsie (ve větší hloubce) [30].
U každého místa odběru biopsie je třeba zaznamenat procento pozitivních vzorků a Gleasonovo skóre na základě klasifikačního systému z roku 2005 [31]. Diagnóza Gleasonova skóre ≤ 4 by se neměla objevit ve výsledku histologie z biopsie [31]. Dále je nutné při každé biopsii zaznamenat objem (procentuálně) nebo délku (v milimetrech) zasažení vzorku karcinomem [30,31] a případné rozšíření mimo prostatu. Obvykle je zaznamenána přítomnost PIN o vysokém grade a perineurální invaze.
Je nutné zaznamenat rozsah i jediného malého jádra adenokarcinomu (např. < 1 mm nebo < 1 %), a to i v případě, že je přítomen pouze v jediném vzorku biopsie, protože tento nález může být indikací pro další diagnostické testy nebo opakované provedení biopsie před zahájením léčby [32,33].
Volba dalších diagnostických metod závisí na dostupných terapeutických modalitách s přihlédnutím k věku, komorbiditám a preferencím pacienta [34–41]. Vyšetření, která nemohou ovlivnit volbu léčby, je obvykle možné vynechat. Guidelines pro diagnostiku a staging karcinomu prostaty jsou shrnuta v tab. 2 a 3.
Table 2. Guidelines pro diagnostiku karcinomu prostaty. 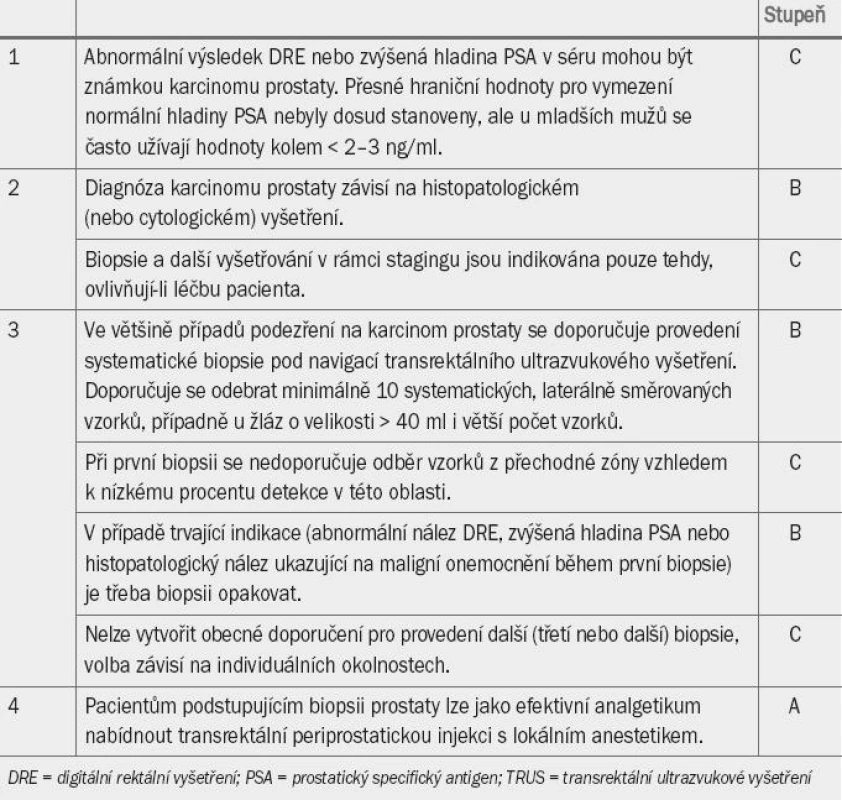
Table 3. Guidelines pro určení stadia karcinomu prostaty. 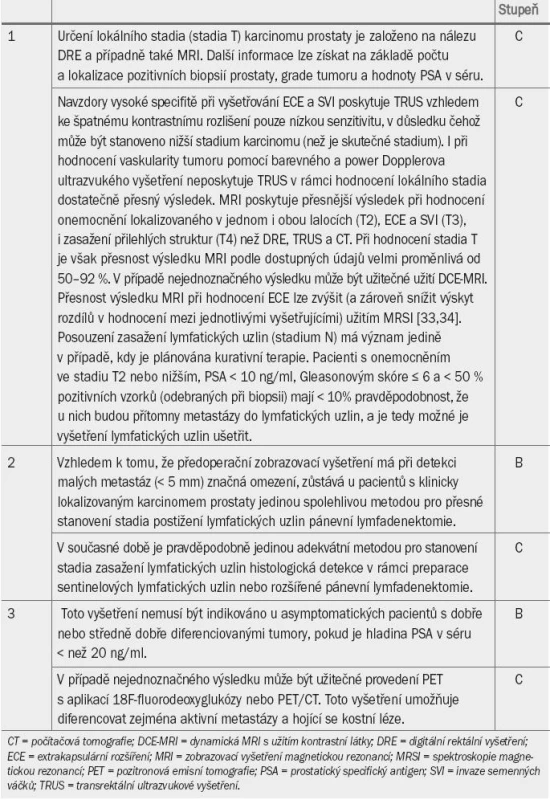
7. PRIMÁRNÍ LOKÁLNÍ LÉČBA KARCINOMU PROSTATY
Léčba karcinomu prostaty (i v případě klinicky lokalizovaného onemocnění) se stává díky nejrůznějším terapeutickým modalitám specifickým pro jednotlivá stadia onemocnění čím dál složitější.
Doporučuje se následující postup:
- U pacientů s karcinomem prostaty s nízkým rizikem (PSA < 10 ng/ml a Gleasonovým skóre (na základě vzorku z biopsie) 6 a cT1c–cT2a) nebo středním rizikem (PSA 10,1–20 ng/ml nebo Gleasonovým skóre (na základě vzorku z biopsie) 7 nebo cT2b–c) se doporučuje zvolit postup ve spolupráci s urologem a radiačním onkologem.
- U pacientů s karcinomem prostaty s vysokým rizikem (PSA < 20 ng/ml nebo Gleasonovým skóre (na základě vzorku z biopsie) 8–10 nebo ≥ cT3a) se doporučuje prodiskutovat možnosti neoadjuvantní a adjuvantní léčby se členy multidisciplinárního panelu.
- Pakliže nebyl zvolen multidisciplinární přístup, je vhodné pečlivě zaznamenat, která guidelines byla užita při volbě léčby.
Vzhledem k nedostatku randomizovaných kontrolovaných studií k této problematice není ve většině případů možné stanovit, že by jedna terapie dosahovala významně lepších výsledků než jiná. Přesto lze na základě dostupných údajů vyvodit některá doporučení. V tab. 2 je uveden souhrn informací pro diagnostiku karcinomu prostaty, které jsou rozděleny na základě stadia onemocnění v době diagnostikování karcinomu. Dále jsou uvedena doporučení pro nejrůznější metody léčby.
7.1. Aktivní sledování
Aktivní sledování (AS) je nutné odlišovat od metody WW (tzv. pozorného vyčkávání). WW spočívá v odložení symptomatické léčby (která nemá za cíl vyléčit onemocnění) u pacientů, kteří nejsou vhodnými kandidáty pro agresivní lokální terapii, zatímco AS je třeba chápat jako vhodnou terapii pro pacienty, jimž může být nabídnuta kurativní léčba. U pacientů s karcinomem prostaty o velmi nízkém riziku není okamžitě zahájena léčba. Pacienti jsou pečlivě sledováni a kurativní léčba je zahájena až v případě, že dojde k progresi onemocnění nebo se vyskytne riziko progrese.
Podstata AS spočívá ve snížení rizika indikace zbytečné léčby u pacientů s karcinomem prostaty ohraničeným na orgán s nízkým rizikem. Tato metoda byla vyvinuta na základě předběžných výsledků [42,43], které ukazují, že muži s dobře diferencovaným karcinomem prostaty mají 80–90% míru přežití po dobu 20 let. Pro podporu AS máme zatím k dispozici pouze nevyzrálá data z randomizovaných klinických studií se sledováním < 10 let.
Podle nejnovějších důkazů jsou vhodnými kandidáty pro AS muži s karcinomem prostaty s nízkým rizikem a očekávanou délkou zbytku života > 10 let. Pouze asi 30 % pacientů bude muset později podstoupit radikální léčbu [44]. Muži s očekávanou délkou zbytku života > 15 let mají vyšší riziko, že zemřou na karcinom prostaty (úroveň důkazu: 3).
Nejrůznější studie uvádí různá kritéria pro potenciální kandidáty pro AS [45]:
- karcinom prostaty ohraničený na orgán (T1–T2)
- Gleasonovo skóre ≤ 6
- karcinom identifikovaný ve ≤ 3 vzorcích biopsie
- karcinom postihující < 50 % každého vzorku biopsie
- PSA < 10 ng/ml
Pro definici progrese karcinomu byla navíc užita rozdílná kritéria [45,46], ačkoli všechny výzkumné skupiny shodně užily následující kritéria:
- PSA DT s hraniční hodnotou v rozmezí ≤ 2 až ≤ 4 roky
- progrese Gleasonova skóre na ≥ 7 při opakované biopsii (prováděná v intervalu 1–4 roky)
- progrese PSA > 10 ng/ml
V poslední době je však role PSA DT pro posouzení potřeby intervence zpochybňována [47]. Ve skupině 290 mužů s karcinomem prostaty s nízkým rizikem, kteří podstoupili AS, byla u 35 % jedinců zaznamenána biochemická progrese (Gleasonovo skóre ≥ 7, více než dva pozitivní vzorky, nebo > 50% zasažených jader). PSADT (p = 0,83) ani PSAV (p = 0,06) nijak významně nesouvisely s progresí onemocnění (na základě biopsie). V jiné studii testující AS byla progrese onemocnění při opakované biopsii prokázána u 36 % mužů [48]. U pacientů s negativním výsledkem při první opakované biopsii byla zaznamenána 82% pravděpodobnost, že v dalších pěti letech nedojde k progresi onemocnění, zatímco u pacientů s pozitivním výsledkem byla pouze 50% pravděpodobnost. Obě studie poukazují na význam každoročního opakování biopsie v rámci monitorování mužů v programu AS, a to i bez ohledu na hodnotu PSA DT.
7.2. Konzervativní léčba lokálně pokročilého karcinomu prostaty
K dispozici máme pouze minimum publikací, které by se zabývaly odloženou léčbou lokálně pokročilého karcinomu prostaty. V nedávné době provedené randomizované klinické studii III. fáze (EORTC 30981) bylo celkem 985 pacientů s onemocněním T0–4 N0–2 M0 (kteří nebyli vhodnými kandidáty pro lokální léčbu s kurativním záměrem) randomizováno do dvou skupin. V první skupině byla indikována okamžitá ADT (androgen--deprivační terapie), zatímco v druhé skupině byla ADT zahájena až v momentě, kdy došlo k symptomatické progresi onemocnění, nebo v případě výskytu závažných komplikací [49]. Po střední době sledování 7,8 let bylo ve skupině pacientů, kteří podstoupili okamžitou ADT, zaznamenáno mírné, ale statisticky významné zlepšení celkové doby přežití (OS). Mezi oběma skupinami nebyl zaznamenán žádný významný rozdíl v mortalitě na karcinom prostaty ani v době přežití bez výskytu symptomů. Doba od randomizace pacientů do progrese onemocnění (refrakterního na hormonální léčbu) se v obou skupinách významně nelišila. Střední doba do zahájení odložené léčby (od počátku studie) činila 7 let. 126 pacientů (25,6 %) z této skupiny zemřelo, aniž by kdykoli podstoupilo léčbu (44 % všech úmrtí v této skupině pacientů). Autoři odhalili významné rizikové faktory predisponující k signifikantně horšímu výsledku [50]: v obou skupinách bylo vypozorováno, že pacienti s počáteční hodnotou PSA > 50 ng/ml měli > 3,5× vyšší riziko úmrtí na karcinom prostaty než pacienti s počáteční hodnotou PSA ≤ 8 ng/ml. V případě počáteční hodnoty PSA v rozmezí 8–50 ng/ml bylo riziko úmrtí na karcinom prostaty přibližně 7,5× vyšší u pacientů s PSA DT < 12 měsíců než u pacientů s PSA DT > 12 měsíců. Interval mezi odpovědí na okamžitou ADT a biochemickým relapsem PSA významně koreluje s počáteční hodnotou PSA, což nasvědčuje tomu, že i počáteční hladina PSA může odrážet agresivní povahu tumoru.
7.3. Radikální prostatektomie
Radikální prostatektomie představuje jedinou terapeutickou modalitu, u níž byl v prospektivní randomizované studii prokázán benefit v době přežití specifické pro karcinom oproti WW [51,52]. Většina pacientů zařazených do těchto studií však měla onemocnění se středním rizikem, a nejednalo se tedy o pacienty s karcinomem prostaty diagnostikovaným při screeningu. Výsledky tedy nelze automaticky vztahovat na běžnou klinickou praxi. U mužů s normální erektilní funkcí a onemocněním ohraničeným na orgán je léčbou volby nervy šetřící radikální prostatektomie. Vhodnost a rozsah pánevní lymfadenektomie zůstává nadále rozporuplným tématem. U mužů s < 50 % pozitivních vzorků (při biopsii) a karcinomem s nízkým rizikem je riziko zasažení lymfatických uzlin velmi nízké [53]. Naopak u mužů s karcinomem prostaty se středním a vysokým rizikem by měla být vždy provedena pánevní lymfadenektomie [54].
Při léčbě karcinomu ve stadiu cT3 je vzhledem k vysoké pravděpodobnosti pozitivních lymfatických uzlin a/nebo pozitivních chirurgických okrajů nutné zvolit multimodální (kombinovaný) přístup [55–60]. U karcinomu ve stadiu cT3 je často (ve 13–27 % případů) stanoveno vyšší stadium (než je skutečné stadium) [55,56]. Problematický je výběr pacientů, u nichž není přítomno ani zasažení lymfatických uzlin ani semenných váčků (SVI). Při predikci patologického stadia onemocnění mohou být užitečné nomogramy, které zohledňují hladinu PSA, stadium tumoru a Gleasonovo skóre [58]. Radikální prostatektomii při léčbě karcinomu ve stadiu T3 by měl provádět pouze zkušený operatér, aby byla zaručena přijatelná míra morbidity a zlepšení onkologického výsledku: míra přežití specifická pro karcinom po 5 letech (95 %), 10 letech (90 %) i 15 letech (79 %).
Neoadjuvantní androgenní deprivace nepřináší významný benefit v OS ani v době přežití bez progrese – tato modalita tedy nemá v rámci chirurgické léčby karcinomu prostaty žádný význam [61].
Indikace adjuvantní ADT po RP představuje kontroverzní téma [62]. Ačkoli jediná prospektivná randomizovaná studie prokázala signifikantní výhodu okamžité ADT v době přežití u pacientů s pozitivními lymfatickými uzlinami [63], je třeba vzít v úvahu, že většina pacientů měla makroskopické onemocnění lymfatických uzlin a 70 % pacientů mělo pozitivní chirurgické okraje a/nebo SVI. Není známo, zda adjuvantní ADT může mít stejný benefit u pacientů s minimálním zasažením lymfatických uzlin. Nejnovější aktualizace studie Early Prostate Cancer neprokázala, že by přidání 150 mg/den bicalutamidu nad rámec běžné léčby přinášel jakýkoli benefit v OS [64]. V nejnovější retrospektivní analýze údajů z databáze Surveillance Epidemiology and End Results byly u 731 mužů, kteří podstoupili v letech 1991–1999 radikální prostatektomii, identifikovány pozitivní lymfatické uzliny; 209 z nich užívalo ADT [65]. Mezi pacienty, u nichž byla indikována ADT, a druhou skupinou pacientů nebyl zazanamenán statisticky signifikantní rozdíl v OS. Rovněž nebyl zaznamenán žádný statisticky významný rozdíl v přežití při různé délce trvání ADT: 90, 150, 180 a 365 dnů.
Pro léčbu mikroskopického zasažení lymfatických uzlin nebylo doposud stanoveno žádné doporučení.
7.4. Adjuvantní ozařování zevním paprskem při léčbě karcinomu prostaty pT3 nebo pTxR1
Tři prospektivní randomizované studie hodnotí roli okamžité pooperační radio-terapie. Navzdory rozdílným kritériím pro zařazení pacientů dospěly všechny studie k závěru, že radioterapie významně zlepšuje klinickou/biologickou dobu přežití 5 let o přibližně 20 % (p < 0,0001) [66–68]. Okamžitá pooperační radioterapie je pacienty dobře snášena, s rizikem močové toxicity (III.–IV. stupně) u ≤ 3,5 % pacientů.
Aktualizované výsledky studie Southwest Oncology Group 8794 [69] po střední době sledování 11,5 let ukazují, že adjuvantní radioterapie významně zlepšuje ve srovnání s opožděnou radioterapií dobu přežití 15 let bez vzniku metastáz (46 vs 38 %; p = 0,036) i OS (47 vs 37 %; p = 0,053). Guidelines pro radikální prostatektomii jsou uvedena v tab. 4.
Table 4. Guidelines a doporučení pro (a) radikální prostatektomii a (b) definitivní radioterapii. 
Pacientům s onemocněním ve stadiu T1–2 N0 (nebo T3 N0 při vybraných prognostických faktorech), pT3 pN0 s vysokým rizikem lokálního selhání po RP vzhledem k pozitivním chirurgickým okrajům a/nebo SVI a negativnímu PSA lze (pakliže pacient podepíše informovaný souhlas) nabídnout následující dvě modality:
- buď okamžitou radioterapii s aplikací 60–64 Gy do operačního pole [66–68] poté, co je obnovena močová funkce, nebo
- klinické a biologické monitorování s následným provedením záchranné radioterapie a aplikací minimálně 66 Gy v momentě, kdy hladina PSA narůstá, ovšem nepřesáhne 0,5 ng/ml.
7.5. Radioterapie
Ačkoli za zlatý standard lze považovat 3D konformní radioterapii (3D-CRT), v současné době se stále častěji užívá její vylepšená verze – IMRT (radioterapie s modulovanou intenzitou). Tab. 4 uvádí guidelines pro využití radioterapie při léčbě karcinomu prostaty.
Při léčbě karcinomu prostaty s nízkým rizikem se při zevním ozařování doporučuje dávka alespoň 74 Gy, která je spojena s významně vyšší mírou přežití bez biochemické recidivy než aplikace < 72 Gy (69 vs 63 %; p = 0,046) [71].
Řada studií prokázala, že při léčbě karcinomu cT1c–T3 se středním rizikem má postupné zvyšování dávky významný dopad na dobu přežití pěti let bez progrese (dávkování v rozmezí 76–81 Gy) [72].
U pacientů s onemocněním s vysokým rizikem má zevní ozařování s postupným zvyšováním dávky rovněž dopad na dobu přežití pěti let bez biochemické recidivy [73], neumožňuje však kontrolu rizika systémové recidivy. Při léčbě lokalizovaného karcinomu prostaty se středním a vysokým rizikem vede kombinace zevního ozařování se šestiměsíčním cyklem ADT k významnému zlepšení míry OS po dobu osmi let (13% benefit) (p < 0,001) [70,73]. EORTC-22961 prokázala, že tříletý cyklus ADT poskytuje (oproti krátkodobé aplikaci ADT) při léčbě lokálně pokročilého karcinomu prostaty 4,7% benefit v OS po střední době sledování 5,2 let [70].
Indikace tříletého cyklu konkomitantní (s neoadjuvantní nebo bez neoadjuvantní) a adjuvantní ADT je tedy nezbytná a představuje v současné době standard pro radioterapeutickou léčbu karcinomu prostaty s vysokým rizikem.
Řada prospektivních randomizovaných studií hodnotí onkologický účinek ADT s/bez EBRT (radioterapie s ozařováním zevním paprskem) [74–76]. Studie skandinávské skupiny „The Scandinavian Prostate Cancer Group-7“ zahrnuje 875 mužů s lokálně pokročilým karcinomem prostaty, kteří byli randomizováni k endo-krinní léčbě nebo ADT s EBRT o dávkování minimálně 70 Gy [74]. Po střední době sledování 7,6 let byla ve skupině pacientů podstupujících ADT zaznamenána významně vyšší míra mortality specifické pro karcinom (23,9 vs 11,9 %), míra celkové mortality (39,4 vs 29,6 %) i biochemické recidivy (74,7 vs 25,5 %; p < 0,0001). V nedávné době byla uveřejněna abstrakta dvou prospektivních randomizovaných klinických studií, které se zabývají stejnou problematikou [75–76]. V kanadské studii bylo 1 205 mužů s lokálně pokročilým karcinomem prostaty randomizováno k samotné ADT nebo ADT v kombinaci s EBRT o dávce 65–69 Gy [75]. Po střední době sledování šesti let vedlo doplnění léčby o EBRT k významnému poklesu rizika úmrtí (HR: 0,77; p = 0,033), kumulativní doba přežití po deset let specifická pro karcinom činila 15 vs 23 %. Ve francouzské studii bylo 263 pacientů s lokálně pokročilým karcinomem prostaty randomizováno k ADT nebo ADT v kombinaci s EBRT [76]. Po době sledování alespoň pěti let dosáhla kombinována léčba významně lepších výsledků jak s ohledem na dobu přežití bez progrese (60,9 vs 8,5 %; p = 0,001), tak i lokoregionální progresi (9,7 vs 29 %; p = 0,0002), i progresi metastáz (3 vs 10,8 %; p = 0,018).
7.6. Transperineální brachyterapie o nízké dávce
Transperineální brachyterapie představuje bezpečnou a účinnou techniku pro léčbu karcinomu prostaty s nízkým rizikem. Následující parametry představují kritéria pro indikaci tohoto typu léčby [77]:
- stadium cT1c–T2a N0, M0
- Gleasonovo skóre ≤ 6 na základě dostatečného počtu náhodně odebraných vzorků biopsie
- počáteční hodnota PSA ≤ 10 ng/ml
- ≤ 50 % vzorků biopsie zasažených karcinomem
- objem prostaty < 50 ml
- příznivé skóre IPPS (International Prostate Symptom Score)
Různé instituce publikovaly výsledky permanentní implantace zrn po střední době sledování v rozmezí 36 a 120 měsíců [78,79]. Doba přežití pět let bez recidivy se pohybovala v rozmezí 71–93 % a doba přežití deset let v rozmezí 65–85 %. Doplnění brachyterapie o nízké dávce o neoadjuvantní nebo adjuvantní ADT nepřináší žádný benefit [37].
7.7. Ozařování pánevních uzlin
Ve studii Groupe d’Etude des Tumeurs Uro-Génitales bylo 444 pacientů randomizováno k EBRT prostaty (66–70 Gy) nebo EBRT prostatického lůžka a pánevních uzlin (46 Gy) [79] s cílem posoudit potenciální benefit ozařování pánevních uzlin u mužů s lokalizovaným karcinomem prostaty s vysokým rizikem. Doba přežití pět let bez progrese a OS byly v obou skupinách srovnatelné, což prokazuje, že neexistuje žádná obecná indikace pro ozařování pánevních lymfatických uzlin.
7.8. Inovativní techniky
Radioterapie s modulovanou intenzitou umožňuje homogenní zvyšování radiace (až na 86 Gy v rámci cíleného objektu) při současném dodržení tolerovatelné dávky pro okolní orgány vystavené riziku.
Největší zkušenosti s touto technikou uvádí Memorial Sloan-Kettering Cancer Centre. Výsledky dosažené v tomto institutu byly v nedávné době aktualizovány a hodnotí kontrolu karcinomu a míru toxicity ve dvou skupinách pacientů [80,81].
První skupina zahrnuje 561 pacientů s onemocněním ohraničeným na orgán, jimž byla aplikována dávka 81 Gy. Při užití definice Americké společnosti pro radiační onkologii byla zaznamenána následující míra přežití po osm let bez biochemické recidivy: 85 % u pacientů s nízkým rizikem, 76 % u pacientů se středním rizikem a 72 % u pacientů s vysokým rizikem.
Druhá skupina zahrnuje 478 pacientů s onemocněním ohraničeným na orgán, jimž byla aplikována dávka 86,4 Gy. Na základě nadir plus 2 ng/ml byla zaznamenána následující míra přežití pět let bez biochemické recidivy: 98 % u pacientů s nízkým rizikem, 85 % u pacientů se středním rizikem a 70 % u pacientů s vysokým rizikem.
7.8.1. Ozařování protonovým paprskem a paprskem z iontů uhlíku
Teoreticky představuje protonové záření lákavou alternativu k ozařování karcinomu prostaty pomocí fotonového paprsku, protože ukládá většinu radiační dávky v konci dráhy částic v tkáni (the Bragg peak), zatímco fotonové paprsky ukládají radiaci podél této dráhy. Protonové paprsky mají navíc velmi ostrý pokles po uvolnění, díky čemuž lze ušetřit normální tkáň pod touto oblastí. Fotonové paprsky ukládají energii až do momentu, kdy opustí organizmus, včetně výstupní dávky.
Pouze jediná studie testující účinnost protonové terapie (v rámci jedné větve studie) uveřejnila v nedávné době své dlouhodobé výsledky [82,83]. Ve studii The Proton Radiation Oncology Group 9509 bylo 393 můžů s klinicky lokalizovaným karcinomem prostaty randomizováno k EBRT o dávce 70,2 Gy vs kombinované fotonové a protonové terapii o dávce 79,2 Gy. Po střední době sledování 9,4 let byla zaznamenána následující odhadovaná míra biochemické progrese po deseti letech: 32 % u pacientů léčených pomocí standardní dávky vs 17 % u pacientů léčených pomocí vyšší dávky (p < 0,001). Index symptomů karcinomu prostaty se mezi oběma skupinami významně nelišil, a to jak s ohledem na močovou obstrukci/iritaci (23,3 vs 24,6; p = 0,36), močovou inkontinenci (10,6 vs 9,7; p = 0,99), střevní problémy (7,7 vs 7,9; p = 0,70) a sexuální dysfunkci (68,2 vs 65,9; p = 0,65). Pro posouzení onkologické účinnosti fotonového záření však bude nutné srovnávat účinek IMRT a fotono-vých paprsků při stejném dávkování v rámci prospektivní randomizované studie.
8. SLEDOVÁNÍ PACIENTŮ S KARCINOMEM PROSTATY
Pacienti s karcinomem prostaty, kteří podstoupili lokální léčbu s cílem vyléčit onemocnění, jsou obvykle sledováni po dobu minimálně deseti let nebo do pokročilého věku pacienta, kdy je další sledování zbytečné (tab. 5). V případě podezření na lokální recidivu onemocnění lze měření hladiny PSA doplnit o DRE.
Table 5. Guidelines pro sledování pacientů, kteří podstoupili primární léčbu s cílem vyléčit onemocnění. 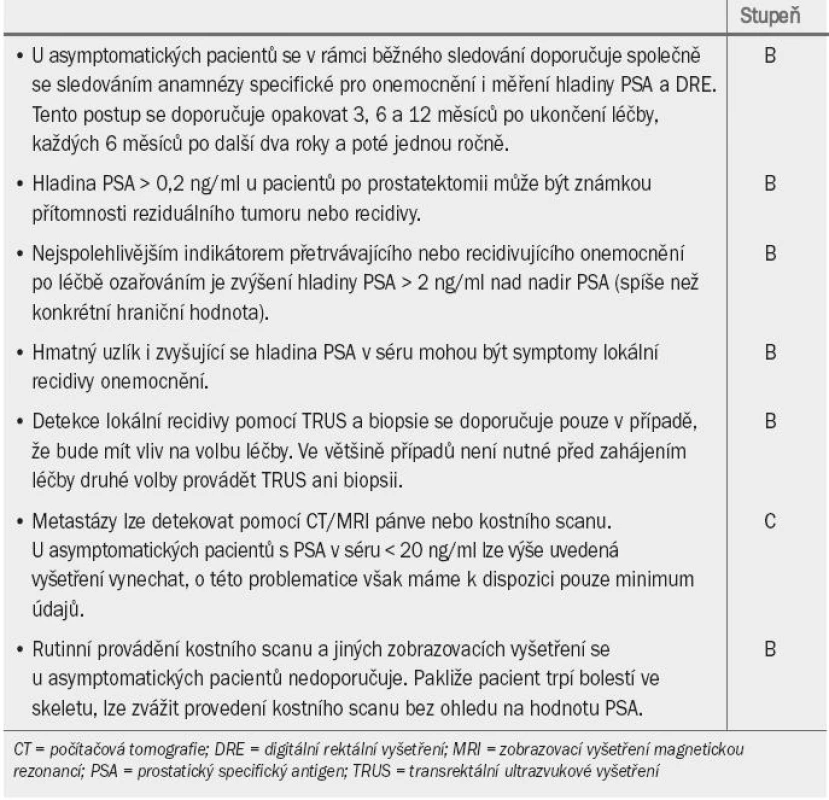
9. ALTERNATIVNÍ MOŽNOSTI PRO LOKÁLNÍ LÉČBU KARCINOMU PROSTATY
Pro léčbu pacientů s klinicky lokalizovaným karcinomem prostaty, kteří nejsou vhodnými kandidáty pro radikální prostatektomii, jsou nyní k dispozici alternativní terapeutické možnosti jako EBRT a/nebo brachyterapie, kryochirurgická ablace prostaty (CSAP) a fokusovaný ultrazvuk o vysoké intenzitě (HIFU) [84,85]. V době vzniku tohoto dokumentu nebyly k dispozici dostatečné údaje o HIFU, aby bylo možné tuto modalitu zařadit mezi doporučení pro léčbu. Podle přístupu hodnocení jednotlivých doporučení (Grading of Recommendations Assessment, Development and Evaluation approach) mají dostupné údaje týkající se účinnosti a bezpečnosti HIFU při léčbě karcinomu prostaty velmi nízkou kvalitu, zejména díky skutečnosti, že studie zabývající se touto problematikou postrádají srovnání s kontrolní skupinou. Význam HIFU při léčbě karcinomu prostaty je nutné podrobit dalšímu výzkumu. Následující faktory by bylo možné považovat za indikace pro HIFU: karcinom prostaty s nízkým nebo středním rizikem a velikost prostaty < 40 ml (v momentě terapie).
Dlouhodobé výsledky nejsou doposud k dispozici. Míra přežití bez biochemické recidivy po pět let je (u pacientů s nízkým rizikem) horší než po RP. Pacientům je tedy nutné poskytnout patřičné informace. V nedávné době byly publikovány slibné výsledky randomizované studie srovnávající účinnost EBRT vs CSAP u pacientů s lokalizovaným karcinomem prostaty [86]. Studie zahrnovala celkem 244 mužů s karcinomem prostaty s nízkým a středním rizikem. Všichni pacienti užívali neoadjuvantní ADT. Po střední době sledování 100 měsíců nebyl mezi oběma větvemi studie zaznamenán žádný rozdíl s ohledem na progresi onemocnění po 36 měsících, OS ani dobu přežití specifickou pro karcinom. Pozitivní výsledky mohou být zapřičiněny malým počtem pacientů a skutečností, že všichni pacienti užívali neoadjuvantní ADT, což znemožňuje vyvození signifikantních klinických závěrů.
10. SOUHRN
Tento dokument představuje pouze souhrn informací, pro podrobnější informace a vyčerpávající seznam literatury je čtenář odkázán na kompletní verzi EAU Guidelines (ISBN 978-90-79754-70-0), která jsou k dispozici na webové stránce EAU (www.uroweb.org).
Axel Heidenreich1, Joaquim Bellmunt2, Michel Bolla3, Steven Joniau4, Malcolm Mason5, Vsevolod Matveev6, Nicolas Mottet7, Hans-Peter Schmid8, Theo van der Kwast9, Thomas Wiegel10, Filiberto Zattoni11
1Department of Urology, RWTH University Aachen, Aachen, Germany
2Department of Medical Oncology, University Hospital Del Mar, Barcelona, Spain
3Department of Radiation Therapy, C.H.U. Grenoble, Grenoble, France
4Department of Urology, University Hospital Gasthuisberg, Leuven, Belgium
5Department of Oncology and Palliative Medicine, Velindre Hospital, Cardiff, United Kingdom
6Department of Urology, Russian Academy of Medical Science, Cancer Research Centre, Moscow, Russia
7Department of Urology, Clinique Mutaliste de la Loire, Saint-Etienne, France
8Department of Urology, Kantonspital St. Gallen, St. Gallen, Switzerland
9Department of Pathology, University Health Network, Toronto, Canada
10Department of Radiation Oncology, University Hospital Ulm, Ulm, Germany
11Department of Urology, University of Padua, Padua, Italy© 2010 European Association of Urology. Published by Elsevier B.V. All rights reserved.
Sources
1. Heidenreich A, Aus G, Bolla M et al. EAU guidelines on prostate cancer. Eur Urol 2008; 53 : 68–80.
2. US Department of Health and Human Services. Agency for Healthcare Research and Quality Web site. http://www.ahcpr.gov/.
3. Jemal A, Siegel R, Ward E et al. Cancer statistics, 2008. CA Cancer J Clin 2008; 58(2): 71–96.
4. Ferlay J, Parkin DM, Steliarova-Foucher E. Estimates of cancer incidence and mortality in Europe 2008. Eur J Cancer 2010; 46(4): 765–781.
5. Bratt O. Hereditary prostate cancer: clinical aspects. J Urol 2002; 168(3): 906–913.
6. Sobin LH, Gospodariwicz M, Wittekind C et al. TNM classification of malignant tumors. UICC International Union Against Cancer. ed 7. Hoboken, NJ: Wiley-Blackwell; 2009. 243–248.
7. Gleason DF, Mellinger GT. Prediction of prognosis for prostatic adenocarcinoma by combined histological grading and clinical staging. J Urol 1974; 111(1): 58–64.
8. Ilic D, O’Connor D, Green S et al. Screening for prostate cancer: a Cochrane systematic review. Cancer Causes Control 2007; 18(3): 279–285.
9. Andriole GL, Crawford ED, Grubb III RL et al. Mortality results from a randomized prostate-cancer screening trial. N Engl J Med 2009; 360(13): 1310–1319.
10. Schröder FH, Hugosson J, Roobol MJ, et al; ERSPC Investigators. Screening and prostate-cancer morta-lity in a randomized European study. N Engl J Med 2009; 360(13): 1320–1328.
11. van Leeuwen PJ, Connolly D, Gavin A et al. Prostate cancer mortality in screen and clinically detected prostate cancer: estimating the screening benefit. Eur J Cancer 2010; 46(2): 377–383.
12. Börgermann C, Loertzer H, Hammerer P et al. Problems, objective, and substance of early detection of prostate cancer [in German]. Urologe A 2010; 49(2): 181–189.
13. Carter HB, Kettermann AE, Ferrucci L et al. Prostate specific antigen testing among the elderly; when to stop? J Urol 2008; 174 (Suppl 1): 600, Abstract 1751.
14. Carvalhal GF, Smith DS, Mager DE et al. Digital rectal examination for detecting prostate cancer at prostate specific antigen levels of 4 ng/ml or less. J Urol 1999; 161(3): 835–839.
15. Loeb S, Catalona WJ. What is the role of digital rectal examination in men undergoing serial screening of serum PSA levels? Nat Clin Pract Urol 2009; 6(2): 68–69.
16. Stephan C, Köpke T, Semjonow A et al. Discordant total and free prostate-specific antigen (PSA) assays: does calibration with WHO reference materials diminish the problem? Clin Chem Lab Med 2009; 47(11): 1325–1331.
17. Thompson IM, Pauler DK, Goodman PJ et al. Prevalence of prostate cancer among men with a prostate-specific antigen level ≤ 4.0 ng per milliliter. N Engl J Med 2004; 350(22): 2239–2246.
18. Kobori Y, Kitagawa Y, Mizokami A et al. Free-tototal prostate-specific antigen (PSA) ratio contributes to an increased rate of prostate cancer detection in a Japanese population screened using a PSA level of 2.1-10.0 ng/ml as a criterion. Int J Clin Oncol 2008; 13(3): 229–232.
19. O’Brien MF, Cronin AM, Fearn PA et al. Pretreatment prostatespecific antigen (PSA) velocity and doubling time are associated with outcome but neither improves prediction of outcome beyond pretreatment PSA alone in patients treated with radical prostatectomy. J Clin Oncol 2009; 27(22): 3591–3597.
20. Vickers AJ, Savage C, O’Brien MF, Lilja H. Systematic review of pretreatment prostate-specific antigen velocity and doubling time as predictors for prostate cancer. J Clin Oncol 2009; 27(3): 398–403.
21. Deras IL, Aubin SM, Blase A et al. PCA3: a molecular urine assay for predicting prostate biopsy outcome. J Urol 2008; 179(4): 1587–1589.
22. Remzi M, Haese A, van Poppel H et al. Follow-up of men with an elevated PCA3 score and a negative biopsy: does an elevated PCA3 score indeed predict the presence of prostate cancer? BJU Int 2010; 106(8): 1138–1142.
23. Ploussard G, Haese A, van Poppel H, et al. The prostate cancer gene 3 (PCA3) urine test in men with previous negative biopsies: does free-to-total prostate-specific antigen ratio influence the performance of the PCA3 score in predicting positive biopsies? BJU Int 2010; 106(8): 1143–1147.
24. Hara R, Jo Y, Fujii T et al. Optimal approach for prostate cancer detection as initial biopsy: prospective randomized study comparing transperineal versus transrectal systematic 12-core biopsy. Urology 2008; 71(2): 191–195.
25. Takenaka A, Hara R, Ishimura T et al. A prospective randomized comparison of diagnostic efficiency between transperineal and transrectal 12-core prostate biopsy. Prostate Cancer Prostatic Dis 2008; 11(2): 134–138.
26. Eichler K, Hempel S, Wilby J et al. Diagnostic value of systematic biopsy methods in the investigation of prostate cancer: a systematic review. J Urol 2006; 175(6 Pt 1): 1605–1612.
27. Aron M, Rajeev TP, Gupta NP. Antibiotic prophylaxis for transrectal needle biopsy of the prostate: a randomized controlled study. BJU Int 2000; 85(6): 682–685.
28. Adamakis I, Mitropoulos D, Haritopoulos K et al. Pain during transrectal ultrasonography guided prostate biopsy: a randomized prospective trial comparing periprostatic infiltration with lidocaine with the intrarectal instillation of lidocaine-prilocain cream. World J Urol 2004; 22(4): 281–284.
29. Merrimen JL, Jones G, Walker D et al. Multifocal high grade prostatic intraepithelial neoplasia is a significant risk factor for prostatic adenocarcinoma. J Urol 2009; 182(2): 485–490.
30. Van der Kwast TH, Lopes C, Santonja C et al. Guidelines for processing and reporting of prostatic needle biopsies. J Clin Pathol 2003; 56(5): 336–340.
31. Epstein JI, Allsbrook WC Jr, Amin MB; ISUP Grading Committee. The 2005 International Society of Urologic Pathology (ISUP) Consensus Conference on Gleason Grading of Prostatic Carcinoma. Am J Surg Pathol 2005; 29 : 1228–1242.
32. Herkommer K, Kuefer R, Gschwend JE, Hautmann RE, Volkmer BG. Pathological T0 prostate cancer without neoadjuvant therapy: clinical presentation and follow-up. Eur Urol 2004; 45(1): 36–41.
33. Trpkov K, Gao Y, Hay R et al. No residual cancer on radical prostatectomy after positive 10-core biopsy: incidence, biopsy findings, and DNA specimen identity analysis. Arch Pathol Lab Med 2006; 130(6): 811–816.
34. Fuchsjager M, Shukla-Dave A, Akin O et al. Prostate cancer imaging. Acta Radiol 2008; 49(1): 107–120.
35. Wang L, Hricak H, Kattan MW et al. Prediction of seminal vesicle invasion in prostate cancer: incremental value of adding endorectal MRI to the Kattan Nomogram. Radiology 2007; 242(1): 182–188.
36. Hoivels AM, Heesakkers RAM, Adang EM et al. The diagnostic accuracy of CT and MRI in the staging of pelvic lymph nodes in patients with prostate cancer: a meta-analysis. Clin Radiol 2008; 63(4): 387–395.
37. Husarik DB, Miralbell R, Dubs M et al. Evaluation of [(18)F]-choline PET/CT for staging and restaging of prostate cancer. Eur J Nucl Med Mol Imaging 2008; 35(2): 253–263.
38. Schiavina R, Scattoni V, Castellucci P et al. 11C-choline positron emission tomography/computerized tomography for preoperative lymph-node staging in intermediate-risk and high-risk prostate cancer: comparison with clinical staging nomograms. Eur Urol 2008; 54(2): 392–401.
39. Heidenreich A, Varga Z, Von Knobloch R. Extended pelvic lymphadenectomy in patients undergoing radical prostatectomy: high incidence of lymph node metastasis. J Urol 2002; 167 : 1681–1686.
40. Briganti A, Passoni N, Ferrari M et al. When to perform bone scan in patients with newly diagnosed prostate cancer: external validation of the currently available guidelines and proposal of a novel risk stratification tool. Eur Urol 2010; 57(4): 551–558.
41. Beheshti M, Vali R, Langsteger W. [18F]Fluorocholine PET/CT in the assessment of bone metastases in prostate cancer. Eur J Nucl Med Mol Imaging 2007; 34(8): 1316–1317.
42. Chodak GW, Thisted RA, Gerber GS et al. Results of conservative management of clinically localized prostate cancer. N Engl J Med 1994; 330(4): 242–248.
43. Albertsen PC, Hanley JA, Gleason DF et al. Competing risk analysis of men aged 55 to 74 years at diagnosis managed conservatively for clinically localized prostate cancer. JAMA 1998; 280(11): 975–980.
44. Klotz L, Zhang L, Lam A et al. Clinical results of long-term follow-up of a large, active surveillance cohort with localized prostate cancer. J Clin Oncol 2010; 28(1): 126–131.
45. Klotz L. Active surveillance for prostate cancer: a review. Curr Urol Rep 2010; 11(3): 165–171.
46. Krakowsky Y, Loblaw A, Klotz L. Prostate cancer death of men treated with initial active surveillance: clinical and biochemical characteristics. J Urol 2010; 184(1): 131–135.
47. Al Otaibi M, Ross P, Fahmy N et al. Role of repeated biopsy of the prostate in predicting disease progression in patients with prostate cancer on active surveillance. Cancer 2008; 113(2): 286–292.
48. Ross AE, Loeb S, Landis P et al. Prostate-specific antigen kinetics during follow-up are an unreliable trigger for intervention in a prostate cancer surveillance program. J Clin Oncol 2010; 28(17): 2810–2816.
49. Studer UE, Whelan P, Albrecht W et al. Immediate or deferred androgen deprivation for patients with prostate cancer not suitable for local treatment with curative intent: European Organisation for Research and Treatment of Cancer (EORTC) Trial 30891. J Clin Oncol 2006; 24(12): 1868–1876.
50. Studer UE, Collette L, Whelan P et al. Using PSA to guide timing of androgen deprivation in patients with T0-4 N0–2 M0 prostate cancer not suitable for local curative treatment (EORTC 30891). Eur Urol 2008; 53 : 941–949.
51. Bill-Axelson A, Holmberg L, Ruutu M et al., Scandinavian Prostate Cancer Group Study No. 4. Radical prostatectomy versus watchful waiting in early prostate cancer. N Engl J Med 2005; 352(19): 1977–1984.
52. Bill-Axelson A, Holmberg L, File´n F et al. Scandinavian Prostate Cancer Group Study Number 4. Radical prostatectomy versus watchful waiting in localized prostate cancer: the Scandinavian prostate cancer group-4 randomized trial. J Natl Cancer Inst 2008; 100(16): 1144–1154.
53. Heidenreich A, Pfister D, Thüer D et al. Percentage of positive biopsies predicts lymph node involvement in men with low-risk prostate cancer undergoing radical prostatectomy and extended pelvic lymphadenectomy. BJU Int 2011; 107(2): 220–225.
54. Briganti A, Chun FK, Salonia A et al. Validation of a nomogram predicting the probability of lymph node invasion based on the extent of pelvic lymphadenectomy in patients with clinically localized prostate cancer. BJU Int 2006; 98(4): 788–793.
55. Yossepowitch O, Eggener SE, Bianco FJ Jr et al. Radical prostatectomy for clinically localized, high risk prostate cancer: critical analysis of risk assessment methods. J Urol 2007; 178(2): 493–9, discussion 499.
56. Ward JF, Slezak JM, Blute ML et al. Radical prostatectomy for clinically advanced (cT3) prostate cancer since the advent of prostate-specific antigen testing: 15-year outcome. BJU Int 2005; 95(6): 751–756.
57. Pierorazio PM, Guzzo TJ, Han M et al. Long-term survival after radical prostatectomy for men with high Gleason sum in pathologic specimen. Urology 2010; 76(3): 715–721.
58. Joniau S, Hsu CY, Lerut E et al. A pretreatment table for the prediction of final histopathology after radical prostatectomy in clinical unilateral T3a prostate cancer. Eur Urol 2007; 51(2): 388–396.
59. Van Poppel H, Joniau S. An analysis of radical prostatectomy in advanced stage and high-grade prostate cancer. Eur Urol 2008; 53(2): 253–259.
60. Loeb S, Smith ND, Roehl KA et al. Intermediate-term potency, continence, and survival outcomes of radical prostatectomy for clinically high-risk or locally advanced prostate cancer. Urology 2007; 69(6): 1170–1175.
61. Shelley MD, Kumar S, Wilt T et al. A systematic review and meta-analysis of randomised trials of neoadjuvant hormone therapy for localised and locally advanced prostate carcinoma. Cancer Treat Rev 2009; 35(1): 9–17.
62. Kumar S, Shelley M, Harrison C et al. Neoadjuvant and adjuvant hormone therapy for localised and locally advanced prostate cancer. Cochrane Database Syst Rev 2006, CD006019.
63. Messing EM, Manola J, Yao J, et al. Eastern Cooperative Oncology Group study EST 3886. Immediate versus deferred androgen deprivation treatment in patients with node-positive prostate cancer after radical prostatectomy and pelvic lymphadenectomy. Lancet Oncol 2006; 7(6): 472–479.
64. McLeod DG, Iversen P, See WA, et al; Casodex Early Prostate Cancer Trialists’ Group. Bicalutamide 150 mg plus standard care vs standard care alone for early prostate cancer. BJU Int 2006; 97(2): 247–254.
65. Wong YN, Freedland S, Egleston B, et al. Role of androgen deprivation therapy for node-posi-tive prostate cancer. J Clin Oncol 2009; 27(1): 100–105.
66. Bolla M, van Poppel H, Collette L et al; European Organization for Research and Treatment of Cancer. Postoperative radiotherapy after radical prostatectomy: a randomized controlled trial (EORTC trial 22911). Lancet 2005; 366(9485): 572–578.
67. Wiegel T, Bottke D, Steiner U et al. Phase III postoperative adjuvant radiotherapy after radical prostatectomy compared with radical prostatectomy alone in pT3 prostate cancer with postoperative undetectable prostate-specific antigen: ARO 96-02/AUO AP 09/95. J Clin Oncol 2009; 27(18): 2924–2930.
68. Swanson GP, Thompson IM, Tangen C et al. Update of SWOG 8794: adjuvant radiotherapy for pT3 prostate cancer improves metastasis free survival. Int J Radiat Oncol Biol Phys 2008; 72(4): S31.
69. Thompson IM, Tangen CM, Paradelo J et al. Adjuvant radiotherapy for pathological T3N0M0 prostate cancer significantly reduces risk of metastases and improves survival: long-term followup of a randomized clinical trial. J Urol 2009; 181(3): 956–962.
70. Bolla M, de Reijke TM, Van Tienhoven G et al. Duration of androgen suppression in the treatment of prostate cancer. N Engl J Med 2009; 360(24): 2516–2527.
71. Kupelian P, Kuban D, Thames H et al. Improved biochemical relapse-free survival with increased external radiation doses in patients with localized prostate cancer: the combined experience of nine institutions in patients treated in 1994 and 1995. Int J Radiat Oncol Biol Phys 2005; 61(2): 415–419.
72. Peeters ST, Heemsbergen WD, Koper PCM et al. Dose-response in radiotherapy for localized prostate cancer: results of the Dutch multicenter randomized phase III trial comparing 68 Gy of radiotherapy with 78 Gy. J Clin Oncol 2006; 24(13): 1990–1996.
73. D’Amico A, Renshaw AA, Loffredo M et al. Androgen suppression and radiation vs radiation alone for prostate cancer; a randomized controlled trial. JAMA 2008; 299(3): 289–295.
74. Widmark A, Klepp O, Solberg A et al. Scandinavian Prostate Cancer Group Study 7; Swedish Association for Urological Oncology 3. Endocrine treatment, with or without radiotherapy, in locally advanced prostate cancer (SPCG-7/SFUO-3): an open randomized phase III trial. Lancet 2009; 373(9660): 301–308.
75. Warde PR, Mason MD, Sydes MR et al. NCIC CTG PR.3/MRC PRO7/SWOG JPR3 investigators. Intergroup randomized phase III study of andro-gen deprivation therapy (ADT) plus radiation the-rapy (RT) in locally advanced prostate cancer (PCa) (NCIC-CTG, SWOG, MRC-UK, INT: T94-0110; NCT00002633). J Clin Oncol 2010; 28(Suppl): 18s, Abstract CRA4504.
76. Mottet N, Peneau M, Mazeron J et al. Impact of radiotherapy (RT) combined with androgen deprivation (ADT) versus ADT alone for local control in clinically locally advanced prostate cancer. J Clin Oncol 2010; 28 (Suppl): 15s, Abstract 4505.
77. Ash D, Flynn A, Batterman J et al; ESTRA/EAU Urological Brachytherapy Group; EORTC Radiotherapy Group. ESTRO/EAU/EORTC recommendations on permanent seed implantation for localized prostate cancer. Radiother Oncol 2000; 57(3): 315–321.
78. Voulgaris S, Nobes JP, Laing RW et al. State-of-the-art: prostate LDR brachytherapy. Prostate Cancer Prostatic Dis 2008; 11(3): 237–240.
79. Taira AV, Merrick GS, Butler WM et al. Long-term outcome for clinically localized prostate cancertreated with permanent interstitial brachytherapy. Int J Radiat Oncol Biol Phys 2011; 79(5): 1336–1342.
80. Pommier P, Chabaud S, Lagrange JL et al. Is there a role for pelvic irradiation in localized prostate adenocarcinoma? Preliminary results of GETUG-01. J Clin Oncol 2007; 25(34): 5366–5373.
81. Zelefsky MJ, Chan H, Hunt M et al. Longterm outcome of high dose intensity modulated radiation therapy for patients with clinically localized prostate cancer. J Urol 2006; 176(4 Pt 1): 1415–1419.
82. Cahlon O, Zelefsky MJ, Shippy A et al. Ultrahigh dose (86.4 Gy) IMRT for localized prostate cancer: toxicity and biochemical outcomes. Int J Radiat Oncol Biol Phys 2008; 71(2): 330–337.
83. Talcott JA, Rossi C, Shipley WU et al. Patient-reported long-term outcomes after conventional and high-dose combined proton and photon radiation for early prostate cancer. JAMA 2010; 303(13): 1046–1053.
84. Babaian RJ, Donnelly B, Bahn D et al. Best practice statement on cryosurgery for the treatment of localized prostate cancer. J Urol 2008; 180(5): 1993–2004.
85. Warmuth M, Johansson T, Mad P. Systematic review of the efficacy and safety of high-intensity focussed ultrasound for the primary and salvage treatment of prostate cancer. Eur Urol 2010; 58(6): 803–815.
86. Donnelly BJ, Saliken JC, Brasher PM et al. A randomized trial of external beam radiotherapy versus cryoablation in patients with localized prostate cancer. Cancer 2010; 116(2): 323–330.
Labels
Paediatric urologist Urology
Article was published inUrological Journal

2011 Issue 2-
All articles in this issue
- Možnosti primární prevence karcinomu prostaty – běžná klinická praxe, nereálná fikce nebo blízká budoucnost?
- Screening karcinomu prostaty
- Přehled nejnovějších technologií pro léčbu karcinomu prostaty (robotické systémy, laparoskopie, brachyterapie, kryoterapie, technologie Cyberknife)
- Budou dosaženy očekávané počty nádorů ledvin a močového měchýře?
- Zanedbání profesionální péče při výkonu lékařského povolání v urologické praxi v USA: trendy a analýza
- EAU Guidelines pro léčbu karcinomu prostaty - Část první: Screening, diagnostika a léčba klinicky lokalizovaného karcinomu
- EAU Guidelines pro léčbu karcinomu prostaty - Část druhá: Léčba pokročilého, recidivujícího karcinomu prostaty rezistentního vůči kastraci
- Urological Journal
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Přehled nejnovějších technologií pro léčbu karcinomu prostaty (robotické systémy, laparoskopie, brachyterapie, kryoterapie, technologie Cyberknife)
- EAU Guidelines pro léčbu karcinomu prostaty - Část první: Screening, diagnostika a léčba klinicky lokalizovaného karcinomu
- Screening karcinomu prostaty
- EAU Guidelines pro léčbu karcinomu prostaty - Část druhá: Léčba pokročilého, recidivujícího karcinomu prostaty rezistentního vůči kastraci
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

