-
Medical journals
- Career
Intenzita a délka tkáňové ischemie těžce polytraumatizovaných pacientů v závislosti na délce přednemocniční péče, péče na urgentním příjmu a operačním čase registrované mikrodialýzou svalové tkáně
Authors: Filip Burša; Leopold Pleva
Authors‘ workplace: Lékařská Fakulta Ostravské university v Ostravě ; Letecká záchranná služba Moravskoslezského kraje ; Anesteziologicko resuscitační klinika Fakultní nemocnice Ostrava
Published in: Úraz chir. 21., 2013, č.1
Overview
ÚVOD:
Efektivní, rychlá a dostatečně agresivní léčba hemoragického šoku a traumatem indukované koagulopatie snižuje morbiditu a mortalitu polytraumatizovaných pacientů. Manifestní nebo okultní šok a s ním spojená tkáňová ischemie je podstatou multiorgánového selhávání u kriticky nemocných pacientů. Monitorace metabolizmu tkání je možná prostřednictvím mikrodialýzy. Cílem studie bylo zjistit, jak souvisí ischemie tkání (L/P; laktát/pyruvát) s délkou péče o tyto pacienty.METODA:
Prospektivní observační studie, dospělí polytraumatizovaní pacienti s traumaticko-hemoragickým šokem. Sledovanými veličinami byl tkáňový laktát a pyruvát pomocí mikrodialýzy periferní svalové tkáně. Dále demografická data, časová osa péče (TICU=přednemocniční péče, péče na urgentním příjmu, operační doba) a hladiny hemoglobinu a sérového laktátu.VÝSLEDKY:
Hodnota tkáňového poměru laktát/pyruvát (L/P) závisí na ošetřovací době v prvních fázích péče o těžce poraněné pacienty. Pacienti ve skupině s TICU ≤ 240 minut měli nižší hodnoty L/P poměru (22,9 versus 30,3), nižší stupeň ischemie a kratší dobu trvání ischemie (1 hodina versus 7,5 hodin). Letecky byla přepravována těžší traumata s o 17% vyšším ISS skórem, s o 21% vyšším L/P a téměř dvojnásobným sérovým laktátem v porovnání s pozemním transportem, kdy doba přednemocniční péče byla srovnatelná.ZÁVĚR:
Periferní svalová tkáň u traumaticko-hemoragického šoku vykazuje ischemii v závislosti na rychlosti péče v časných fázích poranění. Vyšší stupeň ischemie a delší trvání ischemie byl zaznamenán u pacientů, kteří byli déle ošetřováni. Leteckou záchrannou službou se transportují závažnější traumata s těžším šokovým stavem a i přes často technicky náročnější a vzdálenější místa zásahu je tento druh transportu rychlejší.Klíčová slova:
mikrodialýza, šok, laktát, přednemocniční, urgentní.ÚVOD
Polytrauma je nejčastější příčina úmrtí dospělých do 40 let věku a incidence úmrtí spojená s traumaty je 60-80/100,000 traumat ve vyspělých zemích. Klíčovou příčinou morbidity a mortality je hemoragický šok [5, 27]. Bezprostředně (do 30 minut od traumatu) zemře 50 % raněných na poranění neslučitelná se životem nebo neprůchodnost dýchacích cest. Časně (do 4 hodin) zemře 30 % zraněných nejčastěji na následky těžkého hemoragického šoku. Tito nemocní mohou být potenciálně zachráněni agresivním přístupem k resuscitaci oběhu. Na pozdní následky polytraumatu zemře okolo 20 % pacientů, kdy dominujícím problémem je multiorgánové selhání (MODS). Jedním ze základních předpokladů úspěšné léčby je rychlé a účelné zajištění pacienta v přednemocniční péči, rychlý a šetrný transport do nemocničního zařízení a dále sofistikovaná diagnostika a léčba na urgentním příjmu, na kterou zpravidla navazuje operační řešení traumatu a dále intenzivní léčba na jednotkách resuscitační péče. Zásadním přínosem je pak existence sítě traumacenter, která se specializují na péči o nejtěžší poranění a nabízejí široké spektrum diagnostických a léčebných postupů v celé šíři chirurgických oborů, včetně specializovaného resuscitačního oddělení. Traumacentra jsou úzce napojena na střediska leteckých záchranných služeb, která zajišťují specializovanou přednemocniční péči, rychlý a šetrný transport pacienta [24].
Řada prací se zabývá optimalizací péče o tyto kriticky nemocné pacienty a jak pro intenzivní péči, tak pro taktiku operačního výkonu jsou vypracovány doporučené postupy [5, 27]. Zájem je v poslední době upřen především k rychlé a efektivní triáži pacientů v traumaticko-hemoragickém šoku, správné diagnostice a tedy účelné léčbě těžkých forem traumatem indukované koagulopatii (TIC) [3]. Pozornost je upřena na správnou volbu náhradního roztoku tekutin a strategie podávání krevních derivátů a transfuzních přípravků.
V přednemocniční péči je důležité správně identifikovat pacienty ohrožené selháváním životních funkcí nebo již se selhávajícími orgánovými funkcemi, základně zajistit a stabilizovat pacienta a rychle transportovat do traumatologického centra v případě podezření na závažné trauma. Podpora nebo náhrada orgánových funkcí musí být provedena efektivně a nesmí docházet ke zbytečným prodlevám. Těžce poraněný pacient v šoku by měl být adekvátně analgosedován, oxygenován a oběhově resuscitován abychom snížili spotřebu kyslíku v organizmu a zajistili perfuzi vitálně důležitých orgánů. Transport musí být dostatečně rychlý a šetrný, aby se předešlo dalšímu prohloubení šoku nebo poškození orgánů protrahovanou tkáňovou ischemií. Triáži, diagnostice i terapii polytraumatizovaných pacientů na urgentním příjmu se věnuje velké množství autorů a jsou vypracovány podrobné doporučené postupy péče [5]. Pokud je indikováno operační řešení poranění, mělo by vycházet z taktiky damage control surgery, která je již více než dvě desetiletí v praxi a stále je doplňována a modifikována novými zkušenostmi z péče o tyto pacienty [27].
Vodítkem k adekvátní terapii TIC jsou kromě klinického stavu pacienta globální parametry ischemie organizmu, jako je hladina laktátu v krvi, saturace centrální venózní krve kyslíkem, dodávka a spotřeba kyslíku v organizmu, hemodynamické monitorování srdečního výdeje a parametrů krevního obrazu. Změnám na úrovni makrocirkulace a globálního metabolizmu předcházejí změny na úrovni buněk a tkání. Sledování tkáňového metabolizmu je možné prostřednictvím techniky mikrodialýzy [2].
Z tkáňových markerů ischemie lze usuzovat na kondici buněk, míru centralizace/reperfuze oběhu nebo i mitochondriální dysfunkci, která je buněčnou podstatou multiorgánového selhávání u kriticky nemocných. Mikrodialýza je metoda, která umožňuje sledování tkání a buněk analýzou extracelulární tekutiny. Jedná se o kontinuální sběr extracelulární tekutiny pomocí mikrodialyzační sondy zavedené do tkáně a následné analýze tohoto dialyzátu prostřednictvím biochemického analyzátoru. Mikrodialýza je ověřena v řadě prací na animálních modelech, ale začíná být součástí i klinického výzkumu a pozvolna se zavádí do praxe. Látky, které informují o míře anaerobního metabolizmu a energetickém metabolizmu buněk jsou především laktát, pyruvát, glycerol a glukóza, které byly cílem našeho monitorování. Velmi důležitý je poměr laktát/pyruvát (L/P) v extracelulární tekutině jako časný marker nastupující ischmie [12]. Vzestup poměru laktát/pyruvát je užitečným nástrojem pro monitoraci hemoragického šoku [17, 25], kdy zvýšení jeho hodnot nad 25 informuje o nástupu anaerobního metabolizmu. Podání krevní transfuze vede ke snížení tkáňového L/P poměru u septických pacientů [10]. Technika mikrodialýzy má velmi široké teoretické možnosti využití v experimentální, ale dnes již i klinické medicíně. Je možno sledovat hladiny farmak ve tkáních, dostupnost antibiotik a chemoterapeutik nebo sledovat imunologický stav analýzou tkáňových cytokinů [14, 6, 21, 23]. Mikrodialýza se uplatňuje i při operacích nebo transplantacích [26]. Modifikací metody lze určovat i míru prokrvení dané tkáně pomocí průtokových markerů jako etanol [28], urea [8, 19] nebo například značených molekul [7].
Pro monitoraci pacientů byla použita periferní svalová tkáň jako dobře dostupný kompartment, který je diskriminován redistribucí srdečního výdeje již v časných fázích hemoragického šoku, ve prospěch vitálně důležitých orgánů. Pokud myocyty začnou fungovat v režimu anaerobní glykolýzy, změní se redoxní stav buněk a následně pak koncentrace látek v extracelulární tekutině, které se tohoto metabolizmu účastní. Sérový laktát je výsledkem jak produkce, například při ischemii nebo stresu, tak spotřeby laktátu, který vstupuje jako substrát do metabolizmu v tkáních, jako jsou játra, srdce nebo mozek. Hladina sérového laktátu v šoku může být zkreslena prodlouženou clearencí laktátu a četnými neischemickými vlivy [11]. Pro rozlišení mezi ischemickým/neischemickým zvýšením laktátu je zapotřebí monitorovat buď poměr NAD+/NADH nebo L/P [9]. Tkáňový laktát je výsledkem čisté produkce, za předpokladu, že nemonitorujeme tkáň schopnou utilizovat laktát jako energetický substrát. Sérové koncentrace arteriálního laktátu, jejichž sledování je běžnou praxí, jsou výsledkem metabolizmu v celém organizmu, kdy normální hodnoty nevylučují okultní šok [18]. Poměr L/P je senzitivnější marker pro diagnostiku ischemie a jeho elevace koreluje s mortalitou [22] a morbiditou [4]. Normální hodnota poměru laktát/pyruvát (L/P) je do 25, některé práce uvažují ovšem s vyšším triggerem a za ischemii považují až hodnoty přesahující 30 nebo i 35 [16].
METODIKA
Jedná se o prospektivní observační studii realizovanou v letech 2009 až 2013 ve Fakultní nemocnici v Ostravě. Vstupní kritéria pro zařazení do studie byli polytraumatizovaní dospělí mezi 18 až 60 lety s hemoragickým šokem. Sledování bylo zahájeno do 6 hodin od příjmu. Byly zaznamenány demografická data, časová osa péče (přednemocniční péče, péče na urgentním příjmu a doba pobytu na operačním sále; celkový čas je čas od události traumatu do okamžiku přijmu na intenzivní péči-TICU), hladiny hemoglobinu a laktátu. Mikrodialyzační sonda byla umístěna do muculus Deltoideus. Byla použita sonda CMA 60 (CMA Microdialysis AB, Stockholm, Sweden) s dialyzačním roztokem CMA Perfusion fluid T1 (lactate free Ringersolution). Perfuze byla zajištěna pumpou CMA 106 konstantní rychlostí 0,3 µl/min. Následná analýza proběhla v analyzátoru CMA IscusFlex (CMA Microdialysis AB) pomocí setu reagencií pro analýzu laktátu, pyruvátu, glycerolu a glukózy, CMA Reagent set A. Tkáňové hodnoty byly analyzovány v hodinových intervalech. Hodnoty krevního obrazu a laktátu pak ve dvouhodinových intervalech biochemickým analyzátorem (Rochecobas b221 OMNI S). Studie byla schválena etickou komisí včetně informovaného souhlasu, který v případě poruchy vědomí pacienta podepsal lékař a svědek.
Pro statistickou analýzu byl použit program R, verze 2.15.2. Byla hledána závislost mezi dobou přednemocniční péče, péčí na urgentním příjmu a dobou péče na operačním sále a intenzitou a délkou trvání tkáňové ischemie hodnocené podle výše poměru tkáňového laktátu/pyruvátu (L/P). Byla porovnána letecky a pozemně transportována traumata s místem zásahu vzdálenějším než 15 km od ostravského traumacentra. Bylo stanoveno ISS skóre, doby péče, hodnota L/P a sérový laktát v prvních 24 hodinách.
VÝSLEDKY
Statistické analýze bylo podrobeno 41 pacientů. Na obrázku 1 vidíme frekvenční rozdělení zkoumaných veličin.
Image 1. Popis souboru pacientů Vek – věk pacientů, ISS – International severityscore, PNP – doba ošetření přednemocničně (min), UP – doba ošetření na urgentním příjmu (min), OP – operační čas (min), Celkem – součet časů PNP+UP+OP, m – průměr, s – směrodatná odchylka 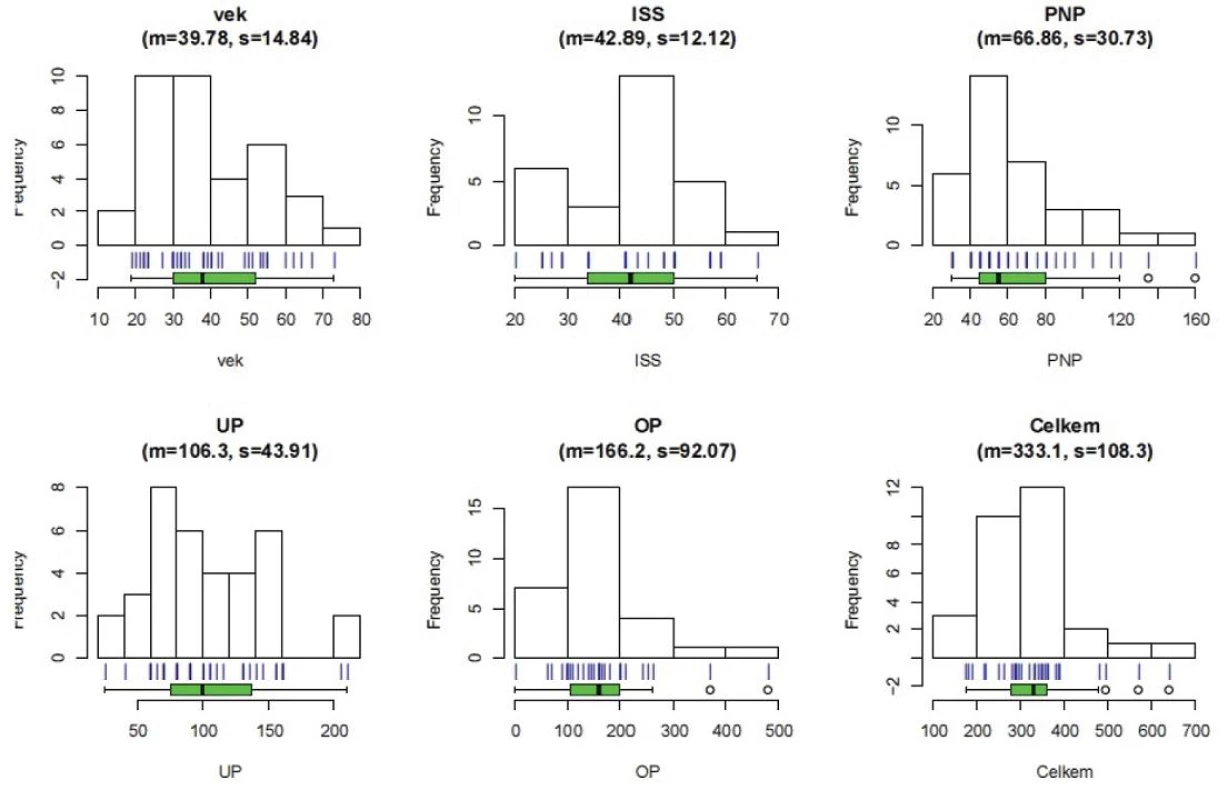
Na následujících obrázcích je vidět závislost L/P na ošetřovací době v jednotlivých kategoriích.
Ve skupině pacientů s časem TICU≤ 240 minut byl medián maximální hodnoty L/P v prvních 12 resp. 24 hodinách 22,9 resp. 23,55. Pro skupinu TICU>240 minut byly odpovídající hodnoty L/P poměru 30,3 resp. 29,15. Doba, kdy byl L/P poměr > 25 byla 1 hodina pro skupinu TICU≤ 240 minut a 7,5 hodin pro skupinu TICU>240 minut. Tíže poranění byla srovnatelná v obou skupinách (ISS skóre v TICU≤ 240 minut bylo 41 a v TICU>240 minut bylo 45) a skupiny měly rovněž stejné průměrné stáří (41 let v TICU≤ 240 minut a 39 let v TICU>240 minut).
DISKUZE
Péče o těžce traumatizované pacienty by se měla řídit standardními doporučeními pro diagnostické i terapeutické intervence [5]. Délka péče a rychlost provádění těchto úkonů se promítá do tíže ischemie periferních tkání a rychlosti eliminace šoku. Mikrodialýza se stává součástí běžné klinické praxe zejména na poli neurointenzivní péče [13, 16], kde jsou tkáňové parametry zavzaty do diagnostických a terapeutických algoritmů. Objevuje se řada prací, například z oblasti endokrinologie, kontroly glykémie u diabetiků nebo například plastické a rekonstrukční chirurgie [1]. V oblasti intenzivní péče a traumatologie zatím takováto doporučení ne-existují. V poslední době se množí práce, které poukazují na účelné využití techniky mikrodialýzy v péči o kriticky nemocné [10]. Sledováním tkáňového metabolizmu u traumaticko-hemoragického šoku je stále předmětem především animálních studií a klinických dat je velmi málo [12]. V animálním modelu na prasatech byl hodnocen poměr L/P v podkožní tkáni u hemoragického šoku, kdy s progresí hemoragie koreloval zvyšující se poměr L/P [17].
Poměr tkáňového laktátu/pyruvátu (L/P) je obecně uznávaným markerem ischmie [17, 10] a tím, že se jedná o poměr dvou veličin, které jsou ovlivňovány lokálnimi vlivy, jako centralizace oběhu (a tím pádem hypoperfuze periferní tkáně) oba stejně, je jeho interpretace jednodušší než vysvětlení trendu hladiny tkáňového laktátu. Většinou se udává jako prahová hodnota L/P pro ischemii 25. Řada prací především v neurointenzivní péči ale uvažuje s vyšším triggrem okolo 35 až 40 [16]. U pacientů ve velmi těžké fázi hemoragického šoku často nalezneme hodnoty okolo 40 někdy až 60.
V tabulce 1 vidíme sledované veličiny pro jednotlivé pacienty. Nejnižší námi zaznamenaná hodnota hemoglobinu byla 9 g/l u pacienta s infaustní prognózou svého poranění, který poraněním časně podlehl. Nejnižší hodnoty hemoglobinu nemusejí být naměřeny v časné fázi při prvních odběrech, kdy je oběh maximálně centralizován a intravaskulární objem není doplněn z intersticia nebo tekutinovou terapií. První vyšetření krevního obrazu tak nemůže být vodítkem k odhadu tíže poranění a vysoká hodnota hemoglobinu nesmí vést k podcenění situace a zdržení při podávání tekutin a krevních derivátů. Velmi cenným vodítkem je naopak Base Exces (BE) [15].
Table 1. Sledované hodnoty u jednotlivých pacientů 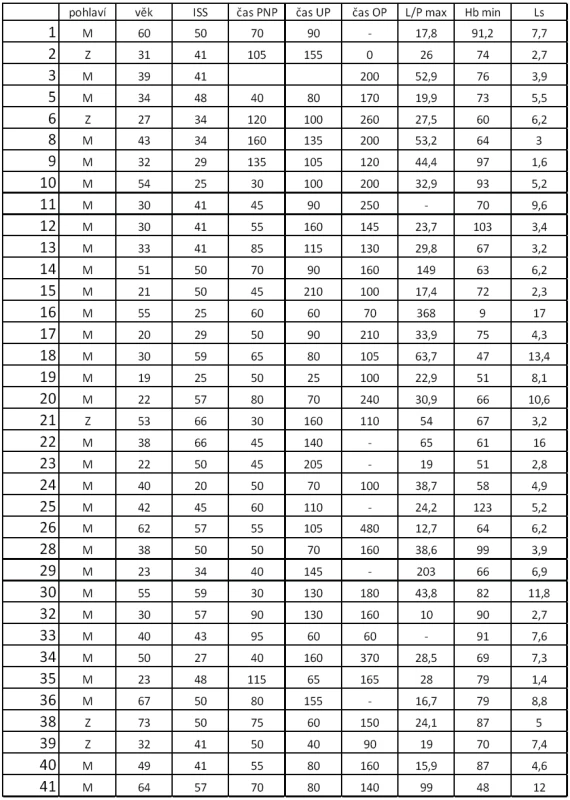
ISS - International severityscore, PNP – doba ošetření přednemocničně (min), UP – doba ošetření na urgentním příjmu (min), OP – operační čas, L/P max – nejvyšší dosažená hodnota tkáňového poměru laktát/pyruvát v prvních 24 hodinách, Hbmin – nejnižší naměřená hodnota hemoglobinu (g/l) v prvních 24 hodinách, Ls – nejvyšší hodnota sérového laktátu (mmol/l) v prvních 24 hodinách Nejvyšší hodnoty jak sérového laktátu, tak tkáňového poměru L/P se vyskytují až v druhých 12 hodninách prvního dne sledování. Vyšší maximální hodnoty L/P byly pozorovány u pacientů ošetřovaných přednemocničně déle než 60 minut. U pacientů ošetřovaných déle než 90 minut naopak byla maximální hodnota nižší, což může svědčit o nižší celkové tíži poranění a tudíž i delšího transportu bez využití letecké záchranné služby. Doba tkáňové ischemie, ať již zvolíme jako ischemický trigger hodnotu 25, 30 nebo 35, je delší při delší době ošetřování v přednemocničné péči, jak je vidět na obrázku 2. Stejně tak je doba tkáňové ischemie prodloužena s prodlouženou dobou ošetřování na urgentním příjmu (obr. 3). Při hodnocení délky tkáňové ischemie (L/P nad 25) vztažené k délce operačního času můžeme pozorovat, že pacienti s dobou kratší než 90 minut měli vyšší L/P, než pacienti ošetřovaní 90 až 180 minut, nad 180 minut L/P opět stoupal. Těžší traumata jsou ošetřena rychleji s důrazem na základní rychlou stabilizaci, stavění krvácení a dekontaminaci podle strategie damage control surgery a mají vyšší poměr L/P. Operační výkon přesahující 180 minut vede k vyšším hodnotám L/P. Pokud jako triger pro tkáňovou ischemii zvolíme 35, je jasně vidět, že s délkou operační doby stoupá tato již velmi zásadní tkáňová ischemie a rychle ošetření pacienti mají dobu této ischemie kratší (obr. 4). Podobné závěry lze vyčíst i z celkové doby ošetření před přijetím pacientka na lůžko intenzivní péče (obr. 5). Z navrženého dělení do kategorií podle L/P se zdá jako výhodnější uvažovat o těžké tkáňové ischemii až při překročení hodnoty L/P >30 a hodnoty 25 až 30 považovat za lehkou tkáňovou ischemii.
Image 2. Závislost L/P na délce ošetřovací doby v přednemocniční péči.L.P max 24h – cPNP – četnost nejvyšší hodnoty L/P v prvních 24 hodinách v závislosti na délce přednemocniční péče, L.P nad 25- cPNP – doba trvání L/P nad 25 v závislosti na délce přednemocniční péče, analogicky pro L/P 30 a 35 (ve dnech) 
Image 3. Závislost L/P na délce ošetřovací doby na urgentním příjmu L.P nad 25- cUP – doba trvání L/P nad 25 v závislosti na délce péče na urgentním příjmu, analogicky pro L/P 30 a 35 (ve dnech) 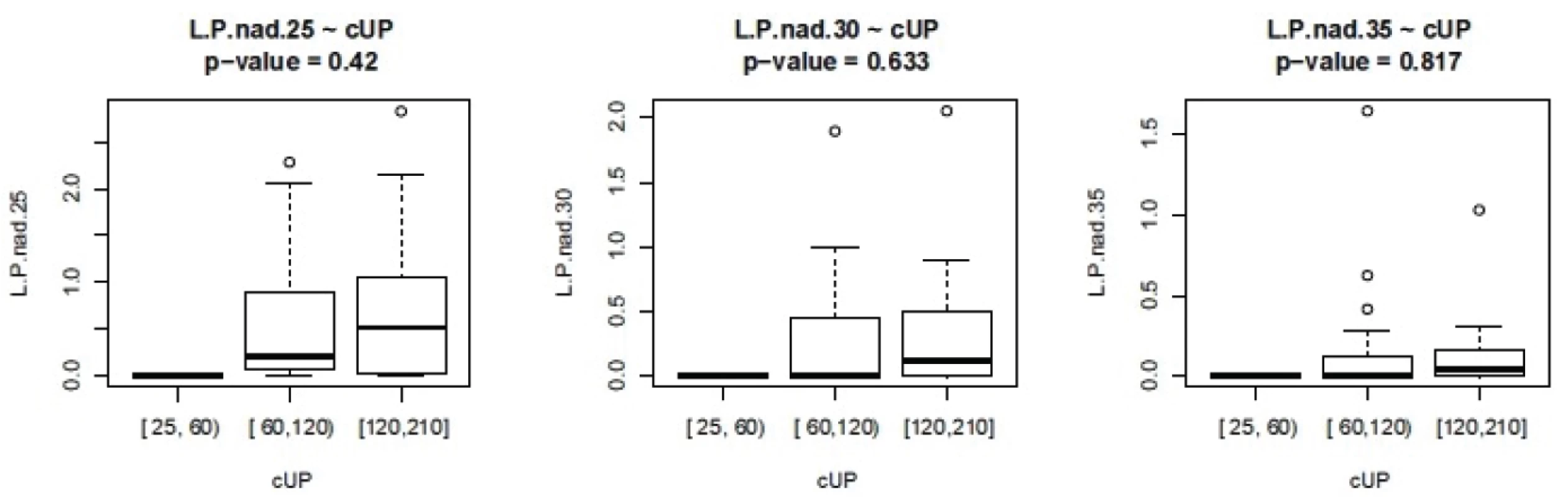
Image 4. Závislost L/P na délce operačního času.L.P nad 25- cUP – doba trvání L/P nad 25 v závislosti na délce operace, analogicky pro L/P 30 a 35 (v minutách). 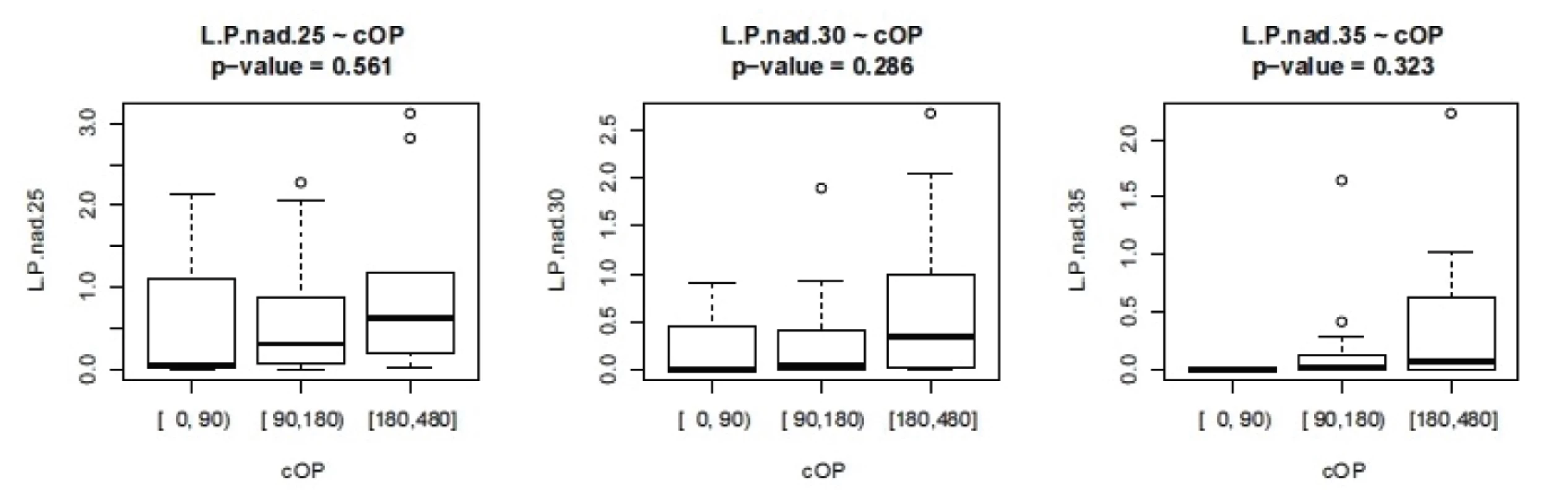
Image 5. Závislost L/P na celkové ošetřovací době.L.P nad 25 – doba trvání L/P nad 25, analogicky pro L/P 30 a 35 (v minutách) 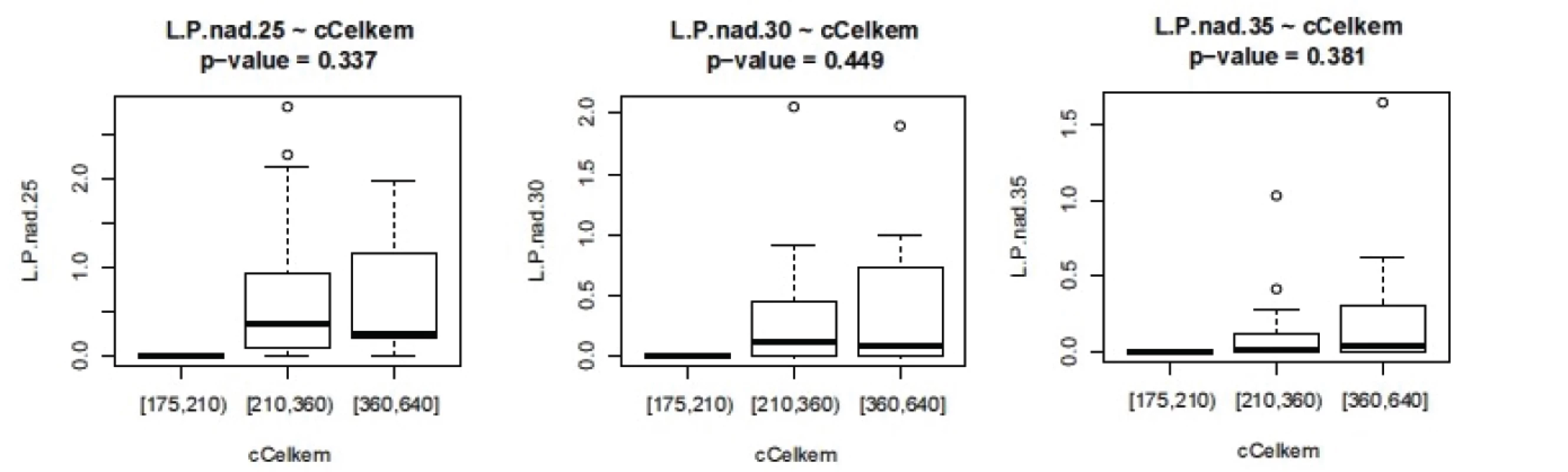
Pacienty jsme rozdělili podle celkové doby ošetření (od události traumatu do příjmu na jednotku intenzivní péče = TICU) do dvou skupin. Čas TICU byl zvolen na 240 minut, jako součet „ideálních” časových rámců pro přednemocniční péči (60 minut), péči na urgentním příjmu (60 minut) a pro dobu pobytu na operačním sále (90 minut). Ve skupině pacientů s časem TICU≤ 240 minut byla ischemie tkání jak v prvních 12, tak 24 hodinách celkově méně intenzivní ve srovnání s déle ošetřovanými pacienty. Rovněž doba trvání tkáňové ischmie byla u rychleji ošetřených pacientů kratší. Rychlost zajištění pacienta a provádění terapeutických a diagnostických úkonů ovlivňuje tíži šoku a rychlost jeho eliminace, a tím pádem i míru tkáňové ischemie. Rychlost ošetření samozřejmě nesmí být na úkor snížení kvality resuscitační péče. Spíše je nutné vyhnout se zbytečným prodlením, protože tato zdržení mouhou mít vliv na morbiditu pacienta.
Významnou roli v přednemocniční péči o těžce poraněné hraje rychlý a šetrný transport leteckou záchrannou službou, zejména v případě vzdálenějších a méně dos-tupných míst zásahu. Jak znázorňuje tabulka 2, letecky byla přepravována těžší traumata s o 17 % vyšším ISS skórem. Hodnota L/P byla v případě letecky transportovaných traumat o 21 % vyšší, kdy průměrná hodnota 40,4 znamená velmi těžkou ischemii tkání a těžký šokový stav. Odpovídá tomu i nejvyšší hodnota sérového laktátu, která v případě letecky transportovaných pacientů byla téměř dvojnásobná. Doba přednemocniční péče byla srovnatelná (byla dokonce kratší o 3 %), ale je potřeba si uvědomit, že tato těžší traumata jsou náročnější na primární ošetření a často i místo zásahu je technicky hůře přístupné.
Table 2. Rozdělení podle typu přednemocničního transportu-pozemní/letecký 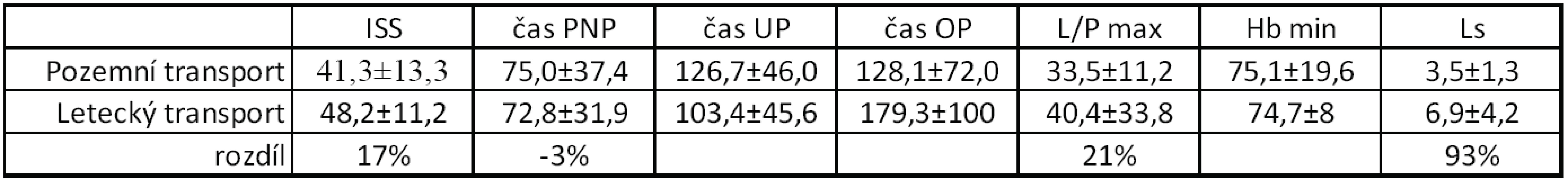
ISS - International severityscore, PNP – doba ošetření přednemocničně (min), UP – doba ošetření na urgentním příjmu (min), OP – operační čas, L/P max – nejvyšší dosažená hodnota tkáňového poměru laktát/pyruvát v prvních 24 hodinách, Hbmin – nejnižší naměřená hodnota hemoglobinu (g/l) v prvních 24 hodinách, Ls – nejvyšší hodnota sérového laktátu (mmol/l) v prvních 24 hodinách. Uvedeny průměrné hodnoty, směrodatné odchylky a rozdíl v procentech mezi pozemním a leteckým transportem (uvažována traumata s místem zásahu vzdálenější než 15 km od ostravského traumacentra) ZÁVĚR
Rychlost a agresivita resuscitační péče se projeví na tíži ischemie tkání. Delší doba ošetřování jak v přednemocniční péči, tak na urgentním příjmu prodlužuje délku trvání tkáňové ischemie periferní svalové tkáně. Na délku tkáňové ischemie má vliv i délka operační doby. Pacienti ošetřeni do 240 minut před přijetím na jednotku intenzivní péče měli signifikantně nižší maximální hodnotu L/P i celkovou délku trvání tkáňové ischemie (L/P>25), tedy rychlejší eliminaci šoku. Leteckou záchrannou službou se transportují závažnější traumata s těžším šokovým stavem a i přes často technicky náročnější a vzdálenější místa zásahu je tento druh transportu rychlejší.
Mikrodialýza je moderní metoda na hranici experimentální a klinické praxe a hodnoty, které pomocí této můžeme sledovat, přinášejí nový pohled na stav buněk kriticky nemocných pacientů. Metoda má velký potenciál sledování nejrůznějších molekul v nejrůznějších lokalizacích. Poměr L/P může informovat o míře eliminace šoku a může pomoci při tekutinové resuscitaci jako „end-point“ resuscitace.
Poděkování: Za statistické zpracování děkuji Michalu Burdovi, IT4Innovations, Division University of Ostrava, Institute for Research and Applicationsof Fuzzy Modeling, Department of Biostatistics, Czech Republic, e-mail: michal.burda@osu.cz. Dále děkuji sesterskému personálu intenzivní péče ARK, Fakultní nemocnice Ostrava za sběr dat a rovněž děkuji mým kolegům z ARK za pomoc při zařazování pacientů do studie.
ZKRATKY
MODS syndrom multiorgánové dysfunkce TIC traumatem indukovaná koagulopatie L/P laktát/pyruvát MUDr. Filip Burša
bursaf@seznam.cz
Sources
1. BLIXT, C., ROOYACKER,SO, ISAKSSON, B. et al. Continuous on-line glucose measurement by microdialysis in a central vein. A pilot study. Crit Care. 2013, 17, R87.
2. BURSA, F., OLOS, T., PLEVA, L. et.al. Metabolism monitoring with microdialysis in the intensive care. Cas Lek Cesk. 2011, 150, 605–609.
3. COTTON, BA, DOSSETT, LA, HAUT, ER. et al. Multicenter validation of a simplified score to predict massive transfusion in trauma. J Trauma. 2010, 69, S33–S39.
4. DIMOPOULOU, N., ORFANOS, SE et. al. Kinetics of adipose tissue microdialysis-derived metabolites in critically ill septic patients:associations with sepsis severity and clinical outcome. Shock. 2011, 35, 342–348.
5. DONAT, R., SPAHN, B., CERNY, V. et. al. Management of bleeding and coagulopathy following major trauma: an updated European guideline. Crit Care. 2013, 17, R76.
6. DOUGLAS, A., ALTUKRONI, M., UDY, AA et. al. The pharmacokinetics of cefazolin in patients undergoing elective & semi-elective abdominal aortic aneurysm open repair surgery. BMC Anesthesiol. 2011, 22, 11–15.
7. FARNEBO, S., SAMUELSSON, A., HENRIKSSON, J. et. al. Urea clearance: a new method to register local changes in blood flow in rat skeletal muscle based on microdialysis. Clin Physiol Funct Imaging. 2010, 30, 57–63.
8. FARNEBO, S., ZETTERSTEN, EK, SAMUELSSON, A. et al. Assessment of blood flow changes in human skin by microdialysis urea clearance. Microcirculation. 2011, 18, 198–204.
9. FEIFEI, S., CHUNYAN, D., JIANSHENG, X. et al. Biochemical Issues in Estimation of Cytosolic Free NAD/NADH Ratio. PLoS One. 2012, 7, e345–325.
10. KOPTERIDES, P., THEODORAKOPOULOU, M., NIKITAS, N. et. al. Red blood cell transfusion affects microdialysis-assessed interstitial lactate/pyruvate ratio in critically ill patients with late sepsis. Intensive Care Med. 2012, 38, 1843–1850.
11. LARACH, DB, KOFKE, WA, LE ROUX, P. Potential non-hypoxic/ischemic causes of increased cerebral interstitial fluid lactate/pyruvate ratio: a review of available literature. Neurocrit Care. 2011, 15, 609–622.
12. LARENTZAKIS, A., TOUTOUZAS, KG, PAPALOIS, A. et al. Porcine model of haemorrhagic shock with microdialysis monitoring. J Surg Res. 2013, 179, 177–182.
13. LEROUX, P. Haemoglobin management in acute brain injury. Curr Opin Crit Care. 2013, 19, 83–91.
14. LIU, X., KRUGER, PS, ROBERTS, MS. How to Measure Pharmacokinetics in Critically Ill Patients? Curr Pharm Biotechnol. 2011, 12, 2037–2043.
15. MANUEL, M., ULRIKE, N., THOMAS, B. et. al. Renaissance of base deficit for the initial assessment of trauma patients: a base deficit-based classification for hypovolemic shock developed on data from 16,305 patients derived from the TraumaRegister DGU®. Crit Care. 2013, 17, R42.
16. MESSERER, M., DANIEL, RT, ODDO, M. Neuromonitoring after major neurosurgical procedures. Minerva Anestesiol. 2012, 78, 810–822.
17. OHASHI, H., KAWASAKI, N., FUJITANI, S. et. al. Utility of microdialysis to detect the lactate/pyruvate ratio in subcutaneous tissue for the reliable monitoring of haemorrhagic shock. J Smooth Muscle Res. 2009, 45, 269–278.
18. SAKR, Y., DUBOIS, MJ, DE BACKER, D. et al. Persistent microcirculatory alterations are associated with organ failure and death in patients with septic shock. Crit Care Med. 2004, 32, 1825–1831.
19. SAMUELSSON, A, FARNEBO, S., MAGNUSSON, B. et. al. Implications for burn shock resuscitation of a new in vivo human vascular microdosing technique (microdialysis) for dermal administration of noradrenaline. Burns. 2012, 38, 975–983.
20. SHOEMAKER, WC, APPEL, PL, KRAM, HB. Tissue oxygen debt as a determinant of lethal and nonlethal postoperative organ failure. Crit Care Med. 1988, 16, 1117–1120.
21. SIMON, F., KARLANDER, LE. Continous assessment of concentrations of cytokines in experimental injuriesof the extremity. Int J Clin Exp Med. 2009, 2, 354–362.
22. SUISTOMAA, M., RUOKONEN, E., KARI, A. et al. Time-pattern of lactate and lactate to pyruvate ratio in the first 24 hours of intensive care emergency admissions. Shock. 2000, 14, 8–12.
23. TYVOLD, SS, SOLLIGÅRD, E., GUNNES, S. et al. Bronchial microdialysis of cytokines in the epithelial lining fluid in experimental intestinal ischemia and reperfusion before onset of manifest lung injury. Shock. 2010, 34, 517–524.
24. WADE,CE, DEL JUNCO, DJ, HOLCOMB, JB. Variations between level I trauma centers in 24-hours mortality in severe injured patients requiring a massive transfusion. J Trauma. 2011, 71, 389–393.
25. WAELGAARD, L., DAHL, BM, KVARSTEIN, G. et. al. Tissue gas tension and tissue metabolites for detection of organ hypoperfusion and ischemia. Acta Anaesthesiol Scand. 2012, 56, 200–209.
26. WAELGAARD, L., THORGERSEN, EB, LINE, PD et. al. Microdialysis monitoring of liver grafts by metabolic parameters, cytokine production, and complement activation. Transplantation. 2008, 86, 1096–1103.
27. WAIBEL, BH, ROTONDO, MM. Damage control surgery: it‘s evolution over the last 20 years. Rev Col Bras Cir. 2012, 39, 314–321.
28. WIDEGREN, U., HICKNER, RC, JORFELDT, L. et al. Muscle blood flow response to mental stress and adrenaline infusion in man: microdialysis ethanol technique compared to (133)Xe clearance and venous occlusion plethysmography. Clin Physiol Funct Imaging. 2010, 30, 52–61.
Resortní program výzkumu a vývoje – MZ III na léta 2010 – 2015, identifikační kód NT11371-5/2010 – účelová podpora IGA MZ ČR projektu Metabolická odezva organizmu u polytraumat.
Labels
Surgery Traumatology Trauma surgery
Article was published inTrauma Surgery

2013 Issue 1-
All articles in this issue
- Intenzita a délka tkáňové ischemie těžce polytraumatizovaných pacientů v závislosti na délce přednemocniční péče, péče na urgentním příjmu a operačním čase registrované mikrodialýzou svalové tkáně
- Experimentální léčba diafyzárního kostního defektu využitím biodegradabilních materiálů a spongioplastiky a jejich srovnání
- Zhodnocení výsledků embolizace sleziny u pacientů s polytraumatem – 4leté zkušenosti
- Je přesné umístění zevního fixátoru loketního kloubu v ose rotace podstatné? Studie na kadaverech
- Trauma Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Experimentální léčba diafyzárního kostního defektu využitím biodegradabilních materiálů a spongioplastiky a jejich srovnání
- Zhodnocení výsledků embolizace sleziny u pacientů s polytraumatem – 4leté zkušenosti
- Je přesné umístění zevního fixátoru loketního kloubu v ose rotace podstatné? Studie na kadaverech
- Intenzita a délka tkáňové ischemie těžce polytraumatizovaných pacientů v závislosti na délce přednemocniční péče, péče na urgentním příjmu a operačním čase registrované mikrodialýzou svalové tkáně
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

