-
Medical journals
- Career
Využití perkutánního přenosu kostní dřeně při léčbě aseptických pakloubů dlouhých kostí
Authors: Petr Krátký
Authors‘ workplace: Department of Surgery, JESENÍK HOSPITAL, spol. s r. o., Jeseník ; Chirurgické oddělení, JESENICKÁ NEMOCNICE, spol. s r. o., Jeseník
Published in: Úraz chir. 17., 2009, č.1
Overview
CÍL:
Cílem práce je informovat o nenáročné metodě, kterou jsme použili opakovaně při léčbě aseptických pakloubů dlouhých kostí ve snaze ovlivnit biologické aspekty hojení.METODA:
Princip metody spočívá v odběru punktátu z lopaty kyčelní kosti, obsahujícího mesenchymální kmenové buňky a jeho aplikace do oblasti pakloubu ve snaze stimulovat v této oblasti kostní hojení.ZÁVĚR:
Dle našich zkušeností může tento postup přispět ke zhojení kostního defektu.KLÍČOVÁ SLOVA:
aseptický pakloub, mesenchymální kmenové buňky, perkutánní přenos kostní dřeně.ÚVOD
Vznik aseptického pakloubu, jako následku léčby zlomeniny dlouhých kostí, je komplikací, s níž se dříve či později setká každý chirurg, zabývající se systematicky léčením poranění končetinového skeletu.
Často jsou příčiny jeho vzniku mechanické, kdy nejčastěji v důsledku nesprávně zvoleného implantátu, který nezajistí dostatečnou stabilizaci zlomeniny (příliš tenký nebo krátký hřeb, dlaha, nedostatečně fixující oba fragmenty) nebo v důsledku nedostatečné sádrové fixace při konzervativní léčbě, dochází k nežádoucím, zejména střižným a rotačním pohybům v místě zlomeniny, které znemožňují nebo přinejmenším znesnadňují osifikaci vazivového svalku a vedou ke vzniku hypertrofického pakloubu. Jinou mechanickou příčinou, vyúsťující ve vznik oligotrofického pakloubu, je stabilizace zlomeniny po nedostatečné repozici nebo v distrakci, nezajišťující dostatečný kontakt fragmentů, což opět znemožňuje vznik pevného kostěného svalku. V obou těchto případech se jedná o paklouby vitální s dobrou trofikou kostních fragmentů a k jejich zhojení postačí zpravidla zajištění stabilní fixace s kompresí.
Za biologické příčiny rozvoje pakloubu lze obecně označit ty, které vedou ke zhoršení trofiky kostních fragmentů a ovlivňují tak negativně schopnost kostní novotvorby v místě zlomeniny. Možno je rozdělit na celkové, kdy například v důsledku povšechné arteriosklerózy či diabetické angiopatie je apriori porušeno prokrvení postižené oblasti, a na místní, když nejčastěji přímým působením úrazového násilí dochází k porušení vitality kostní tkáně v místě zlomeniny, zpravidla ve formě avitálních mezifragmentů zejména při tříštivých vysokoenergetických poraněních. Jednou z příčin vzniku avitálních kostních okrsků či fragmentů může být nešetrná operační technika při otevřeném způsobu osteosyntézy, zejména dlahové. Takto vzniklé avitální paklouby lze dále rozdělit na dystrofické, kdy dochází k přihojení mezifragmentu nedevitalizovaným okrajem, jeho druhý okraj je však avitální a nemá tendenci k hojení. Nekrotický pakloub vzniká, jestliže celý nekrotický mezifragment tvoří jakousi separační vrstvu a neumožňuje tak hojení. Defektní pakloub vzniká nejčastěji následkem otevřených ztrátových kostních poranění. Atrofický pakloub je konečným stavem předchozích tří typů, kdy kostní defekt je vyplněn vazivovou jizvou bez schopnosti kostní novotvorby.
Nejčastějším způsobem ošetření těchto pakloubů je resekce nekrotické kosti, stabilizace a vyplnění defektu auto nebo alogením štěpem.
METODA
Inspirováni pracemi zahraničních autorů, publikovanými v první polovině 90. let, o perkutánním přenosu autologní kostní dřeně, zkušenostmi hradeckého ortopedického pracoviště a informacemi o vlastnostech dospělých kmenových buněk a jejich schopnostech, rozhodli jsme se využít metodu perkutánního přenosu punktátu kostní dřeně jako doplňující léčbu při ošetření pakloubu [1,2-10].
Vždy předcházela úprava stávající fixace ve dvou případech naložení zevní fixace s vytvořením komprese v místě pakloubu, 2x dynamizace tibiálního hřebu s osteotomií fibuly, u jednoho nemocného jsme po 11měsíčním léčení MCD aparátem nahradili fixátor plastovou ortézou. Poté jsme v celkové anestezii za aseptických kautel jehlou pro sternální punkci nebo bioptickou kostní jehlou odebrali 5–10 ml punktátu z kostní dřeně v oblasti zadní hrany lopaty kyčelní kosti těsně za ilickou spinou. Takto získaný punktát jsme perkutánně aplikovali za RTG kontroly do vazivových struktur pakloubu. Na rozdíl od postupu, publikovaného Gargem a Sharmou, jsme se omezili na jeden přenos a neopakovali punkci po třech týdnech. Výkon jsme provedli při použití ATB profylaxe po dobu 48 hodin s první dávkou podanou 6 hodin před výkonem. RTG kontroly jsme prováděli v třítýdenních intervalech. Ani jednou jsme nezaznamenali zánětlivou komplikaci.
KAZUISTIKY A VÝSLEDKY
48letý lesní dělník utrpěl při likvidaci kalamity na Slovensku při pádu ulomeného kmene otevřenou zlomeninu horní třetiny levé vřetenní kosti s rozsáhlou devastací kožního krytu proximálního předloktí a parézou hluboké větve n. radialis; primárně ošetřen v místě úrazu, zlomenina fixována Prevotovým prutem, zavedeným z processus styloideus radii v dobrém postavení, ošetření měkkých tkání, končetina fixována doplňující loketní sádrovou dlahou. Po pěti týdnech zhojeny měkké tkáně, nemocný přijat na naše pracoviště k dalšímu léčení a rehabilitaci. Na RTG zlomenina na rozhraní horní a střední třetiny radia, ošetřená nitrodřeňovou osteosyntézou v dobrém postavení s minimálními známkami hojení (obr. 1). Dále ponechána doplňující sádrová fixace, která snímána pro rehabilitaci. Po dalších sedmi týdnech na RTG obraz vytvářejícího se hypertrofického pakloubu. Naložena zevní fixace Zlín s vytvořením komprese v místě zlomeniny, výkon doplněn aplikací 5 ml punktátu z kostní dřeně (obr. 2). Po třech týdnech zřetelná kostní reparace, po šesti týdnech od výkonu pevně zhojeno, fixátor odstraněn (obr. 3).
Image 1. RTG nález před aplikací zevní fixace a punktátu kostní dřeně 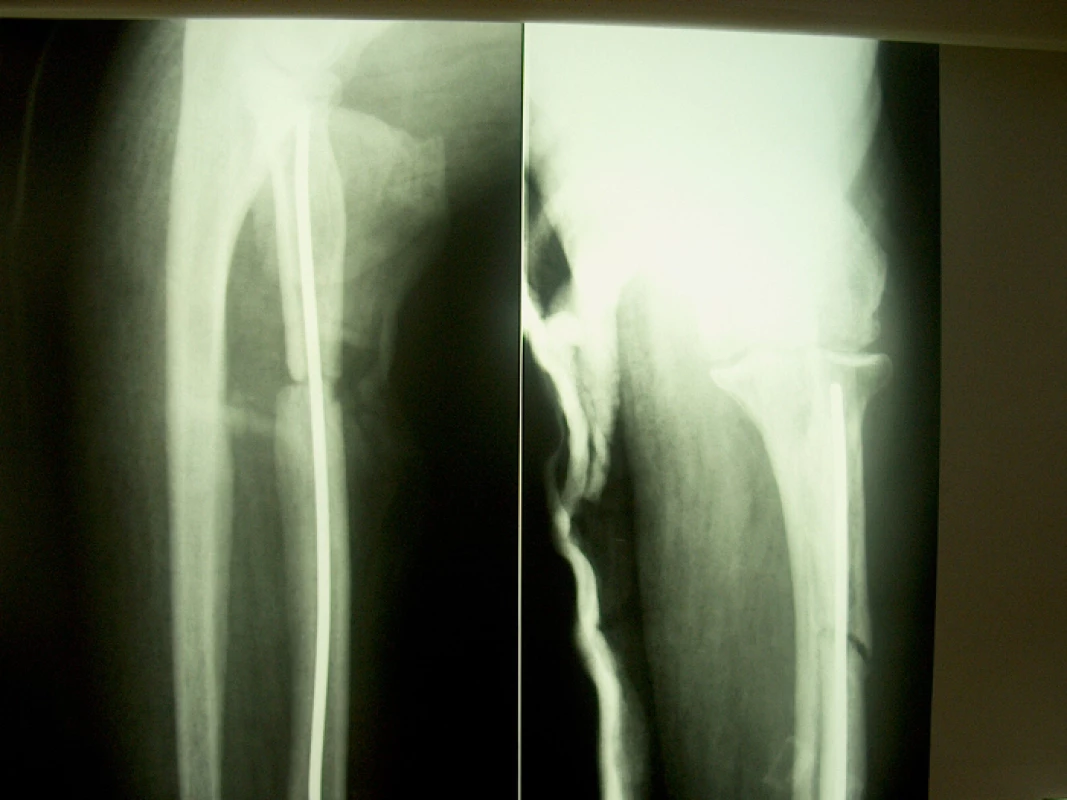
Image 2. RTG nález ve 4. týdnu po punkci 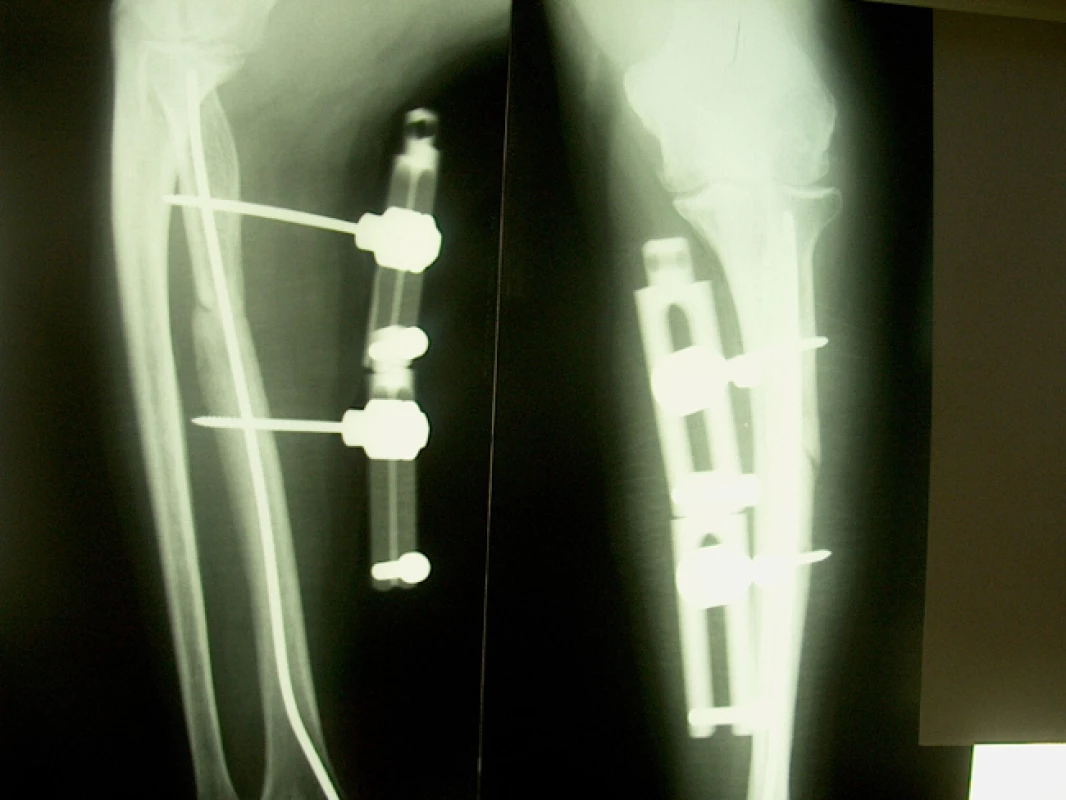
Image 3. RTG nález dva a půl měsíce po ošetření 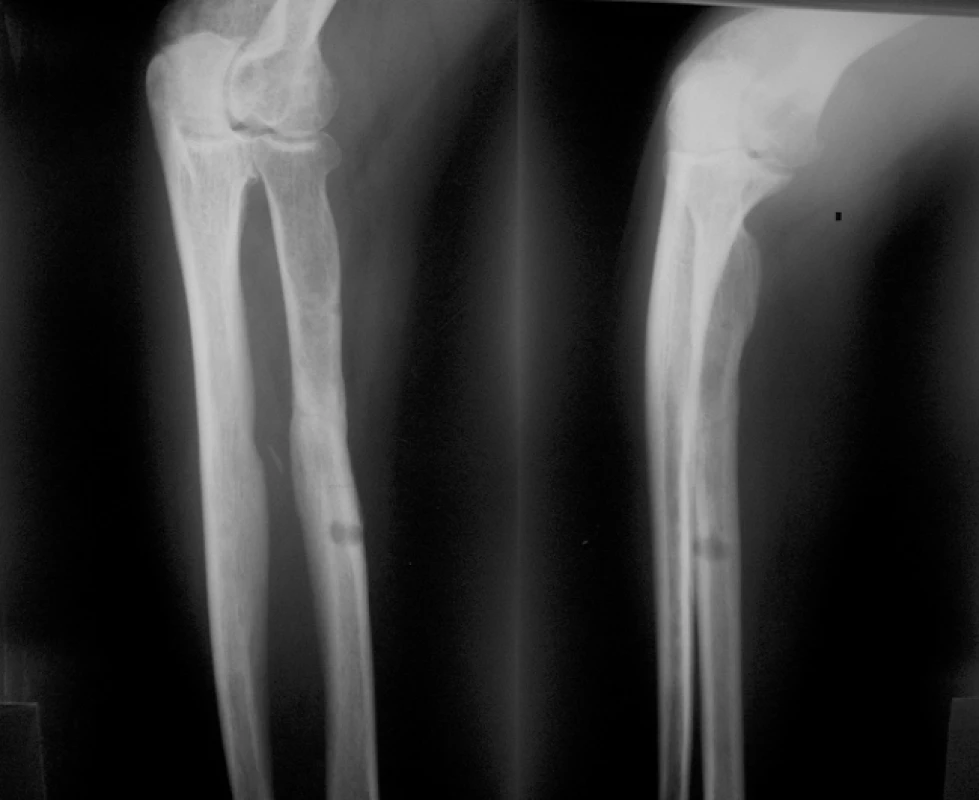
54letý muž poraněný na levém bérci při výbuchu sudu od benzínu přivezen na naše oddělení několik hodin po úraze s tříštivou zlomeninou levého bérce; tříštivá zóna s mnoha různě velkými fragmenty začíná asi 4 cm pod úrovní proximálních kloubních ploch tibie a končí 10 cm nad hlezenným kloubem. Na končetině kromě drobných povrchních popálenin příznaky rozvíjejícího se kompartement syndromu. Po nezbytné přípravě v celkové anestezii provedeny fasciotomie s uvolněním všech bércových kompartmentů, prozatímní stabilizace skeletu MCD aparátem s pěti kruhy, ukotveným horním kruhem v proximální metafýze a distálně dvěma kruhy v distálním fragmentu (obr. 4, 5, 6)). Třetí den při odeznívající mikrocirkulační poruše doplněna pomocí volných kruhů a tažných drátů repozice zlomeniny s fixací hlavních fragmentů tříštivé zóny v uspokojivém postavení (obr. 7). Po odeznění otoku v následujících týdnech obnoven kožní kryt. Po 18 týdnech od úrazu povolujeme částečné zatěžování na fixátoru, 11 měsíců od úrazu jsou na RTG již zřetelné známky reparace mezi hlavními fragmenty. Po odstranění fixátoru bérec klinicky pevný, v RTG obraze je patrno pod proximální metafýzou v oblasti s výskytem četných drobných mezifragmentů několik linií resp. defektů kostní struktury, kde zjevně nedochází k osifikaci. Doporučujeme zatěžování končetiny v plastové ortéze, které nečiní nemocnému žádné obtíže, RTG obraz se však během následujících 7 měsíců nemění. Rozhodujeme se proto pro ošetření popisovanou metodou a aplikujeme do defektů celkem 15 ml punktátu. Během 5 následujících měsíců pozorujeme na RTG zjevné známky hojení v místě defektů (obr. 8).
Obr. 4–6: Stav po primárním ošetření úrazu 
Image 4. RTG nález před sejmutím ZF 
Image 5. RTG nález 6 měsíců po aplikaci punktátu 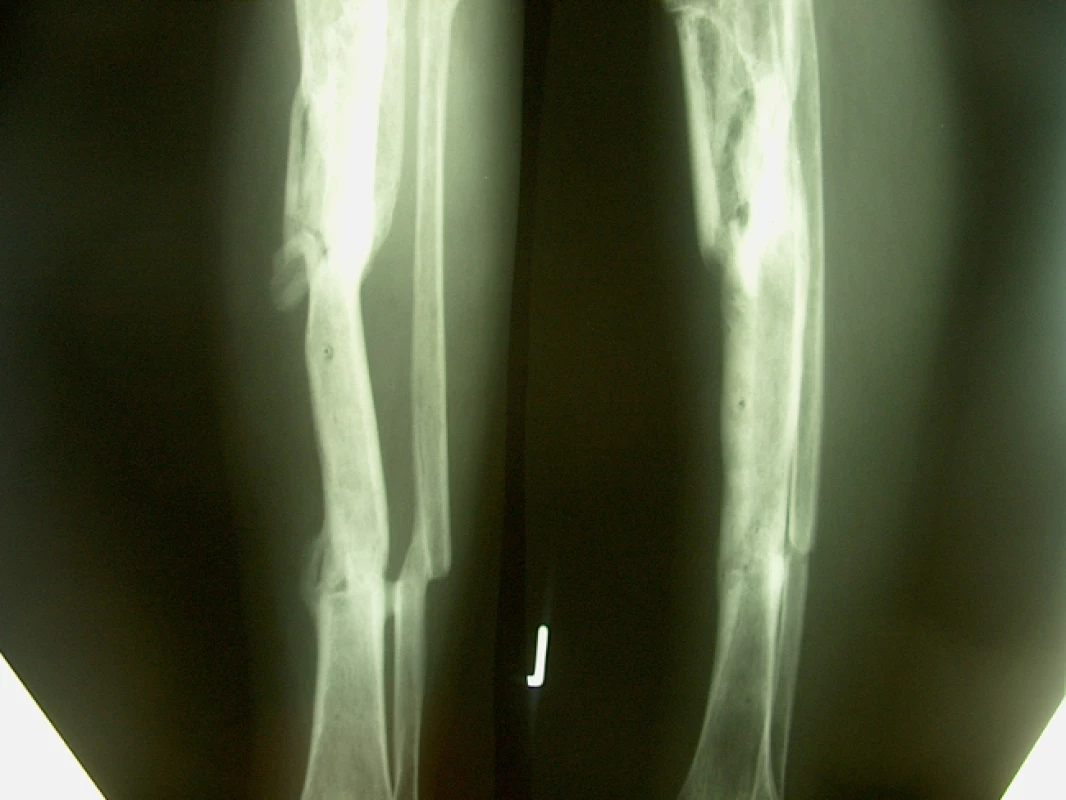
46letý muž, ošetřen staticky zajištěným nepředvrtaným tibiálním hřebem pro šikmou zlomeninu na rozhraní střední a dolní třetiny tibie s vylomeným trojúhelníkovým mezifragmentem z dorzální korkalis a s podhlavičkovou zlomeninou fibuly. Osm měsíců po osteosynéze přes provednou dynamizaci a osteotomii fibuly nacházíme na RTG snímku známky tvořícího se pakloubu. Pakloub ošetřen punkčním přenosem kostní dřeně při ponechání hřebu, po 4 měsících zhojení defektu (obr. 9, 10).
Image 6. RTG nález před ošetřením punkcí 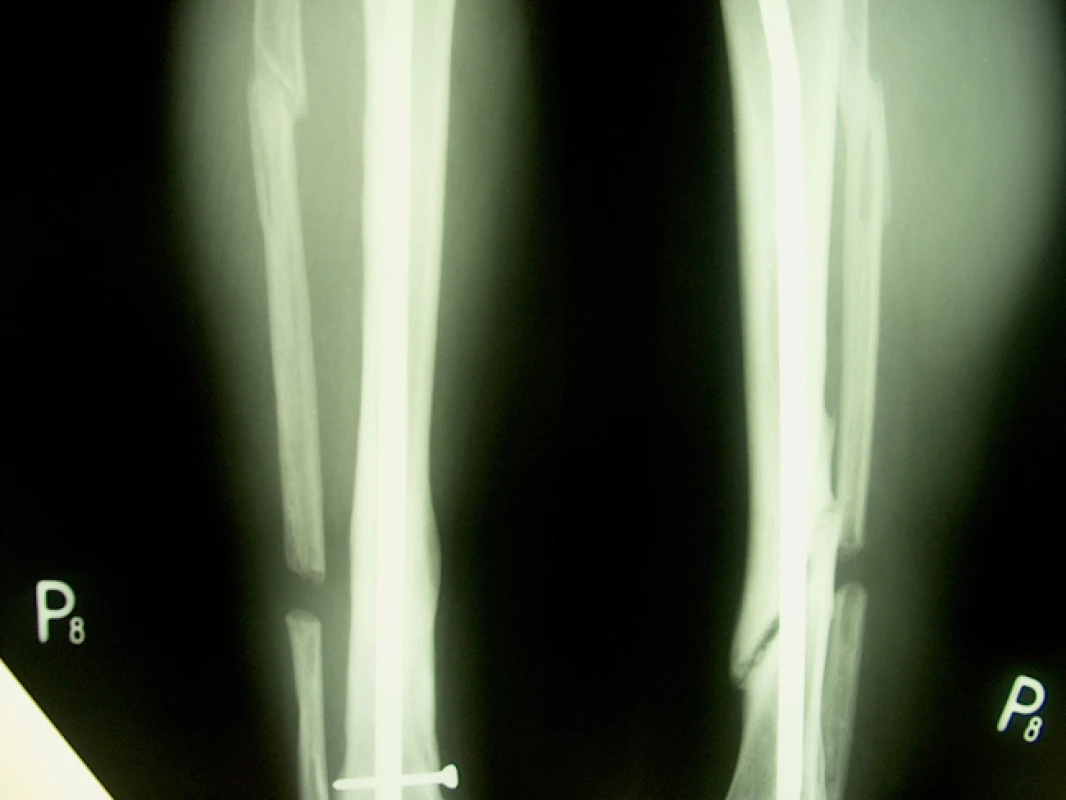
Image 7. RTG nález 4 měsíce po punkci 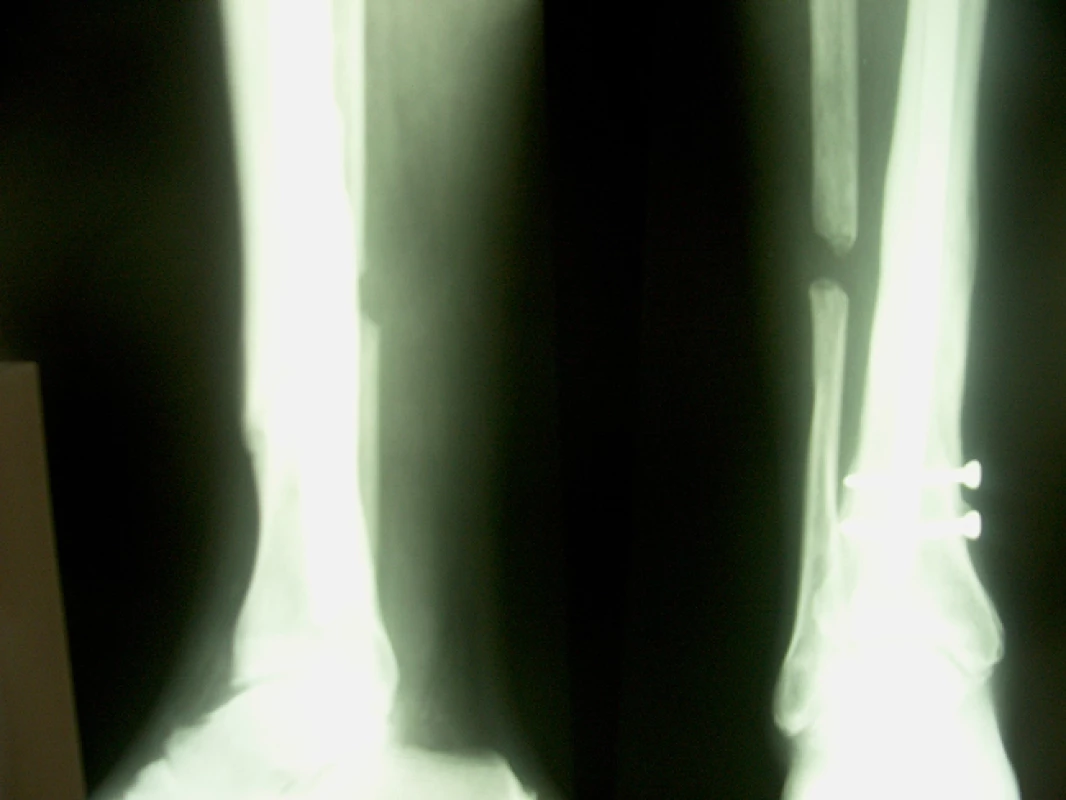
Popisovaný způsob ošetření jsme použili celkem u pěti nemocných. Domníváme se, že nejméně ve třech případech ze čtyř přispěl k úspěšnému zhojení.
V případě pátého nemocného nelze výsledek po-soudit pro velmi krátkou dobu od provedení.
DISKUZE
Kmenové buňky jsou buňky navazující na embryonální vývoj. Jsou to buňky nezralé, nediferencované, mající schopnost, přeneseny v tomto stadiu svého vývoje do jiné tkáně, vytvářet buňky shodné s buňkami tkáně, do níž jsou zavedeny. Jsou obsaženy v embryích - embryonální kmenové buňky, fétu, pupečníkové krvi. Jsou obsaženy i ve tkáních dospělých jedinců jako tzv. dospělé nebo somatické kmenové buňky. Významným depem dospělých kmenových buněk je kostní dřeň.
Počátek éry výzkumu kmenových buněk se datuje kolem roku 1960, kdy jako první byly popsány tzv. hematopoetické kmenové buňky, diferencující se v jednotlivé krevní buňky. O několik let později byly popsány mesenchymální kmenové buňky kostní dřeně jako směs buněčných kolonií, z nichž se generují buňky kostních, chrupavčitých, tukových a vazivových tkání. 1 ml punktátu kostní dřeně obsahuje průměrně 100 milionů buněk, z čehož menší část tvoří kmenové mesenchymální buňky. Většinu tvoří erytroblasty, normoblasty, premyelocyty, megamyelocyty, granulocyty a lymfocyty.
V letech 1986 a 1989 publikovali Paley a Connolly [3, 8] ve svých pracích výsledky studie, v níž porovnávali kostní hojení po aplikaci punktátu kostní dřeně do kostních defektů po osteotomii u králíků a hojení stejných defektů bez této aplikace.
V roce 1993 Garg a Sharma [5] prezentovali soubor 20 nemocných s nehojícími se zlomeninami, ošetřenými metodou perkutánního přenosu punktátu autologní kostní dřeně s doplňující fixací.
ZÁVĚR
Tato práce není v žádném případě projevem ambice vstupovat do procesu výzkumu kmenových buněk. Je jen pokusem shrnout některé výsledky dosavadního poznání a aplikovat je v podobě pro pacienta nenáročného, s minimálním rizikem spojeného, technicky jednoduchého a dle našich dosavadních zkušeností pozitivní efekt přinášejícího léčebného výkonu.
Inspirací k použití metody byly práce, publikované na přelomu 80. a 90. let, poznatky z oblasti výzkumu kmenových buněk a v neposlední řadě osobní sdělení přednosty orthopedické kliniky FN v Hradci Králové Doc. MUDr. Karpaše, který obdobnou metodu, vycházející ze stejného principu, úspěšně použil u osmi svých nemocných.
MUDr. Petr Krátký
Chirurgické odd. Jesenické nemocnice, spol. r. o.
p.kratky@jesnem.cz
Sources
1. ASHTON, B.A. et al. Formation of Bone and Car-tilage by Marrow Stromal Cells in Diffusion Cham-bers in Vivo, Clin Orthop. 1980, 151, 294–307.
2. BURWELL R. G. Studies in the transplantation of bone. J Bone Joint Surg. 1964, 46B, 110–140.
3. CONNOLLY, J. et al., Development of an Osteo-genic Bone-Marrow Preparation. J Bone Joint Surg. 1989, 71A, 684–691.
4. CUMMINE, J. Osteogenesis after bone and bone-marrow transplantation, Acta Orthop Scand. 1977, 48, 15–24.
5. GARG, N.K. et al. Percutaneous autogenous bone marrow grafting in 20 cases of ununited fracture, Acta Orthop Scand. 1993, 64, 671–672.
6. HEALEY, J.H. et al. Percutaneous Bone Marrow Grafting of Delayed Union and Nonunion in Cancer Patiens. Clin Orthop.1990, 256, 280–285.
7. LANE, J.M. et al., Bone Marrow and Recombinant Human Bone Morphogenetic Protein – 2 in Osseous Repair, Clin Orthop. 1999, 361, 216–227.
8. PALEY, D. et al. Percutaneous Bone Marrow Graf-ting of Fractures and Bony Defects, Clin Orthop. 1986, 208, 300–312.
9. Pleva, L. Zevní fixace v traumatologii. 1. vyd. Ostrava: Tiskárna Cicero, 1992. 175 s.
10. SALAMA, R., WEISSMAN, S.L. The clinical use of combined xenografts of bone and autologous red marrow. J Bone Joint Surg. 1978, 60-B, 111–115.
11. TAKAGI, K., MARSHALL, R.U. The Role of Bone Marrow in Bone Morphogenetic Protein-induced Re-pair of Femoral Masive Diaphyseal Defects, Clin Orthop.1982, 171, 224–231.
Labels
Surgery Traumatology Trauma surgery
Article was published inTrauma Surgery

2009 Issue 1
Most read in this issue- Poranění růstové ploténky distální tibie v dětském věku – epidemiologická studie
- Využití perkutánního přenosu kostní dřeně při léčbě aseptických pakloubů dlouhých kostí
- Trakční poranění močového měchýře při poranění pánve
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career



