-
Medical journals
- Career
Genetické testy pro výběr dárce hematopoetických kmenových buněk a potransplantační monitorování
Authors: M. Vraná; H. Čechová; K. Pegová; S. Nazarová; A. Vítek
Authors‘ workplace: Ústav hematologie a krevní transfuze, Praha
Published in: Transfuze Hematol. dnes,23, 2017, No. Supplementum1, p. 68-74.
Category:
Overview
Alogenní transplantace hematopoetických kmenových buněk je jedním ze způsobů léčby hematologických malignit. Cílem naší práce byla analýza vlivu použitých testů pro výběr dárce a následné potransplantační monitorování na přežití pacientů po provedené transplantaci. Analyzovaný soubor zahrnoval 611 transplantací od HLA shodných dárců.
Část zaměřená na výběr dárce posuzovala vliv přesnosti testů shody hlavního histokompatibilního systému (HLA). V této části byl analyzován soubor 292 pacientů transplantovaných od nepříbuzných dárců. Ten byl rozdělen podle používaných genetických metod. Výsledky prokázaly statisticky významný rozdíl v délce přežití po alo-HSCT mezi skupinou pacientů, u nichž shoda HLA byla geneticky stanovena pouze v HLA II. třídy, a skupinou, kde byla genetickými metodami stanovena shoda v HLA I. i II. třídy (p = 0,0189). Přesnost použitých metod (PCR se sekvenčně specifickými primery vs. Sangerovo sekvenování) přežití transplantovaných pacientů dále zásadně neovlivnila (p = 0,6077).
Část zabývající se potransplantačním monitorováním hodnotila míru buněčného chimerismu (kompletní, smíšený, mikrochimerismus) a použitou metodu. V této části byl analyzován soubor 474 pacientů transplantovaných od nepříbuzných i příbuzných dárců. Při porovnání délky přežití mezi kategoriemi pacientů se smíšeným a kompletním chimerismem byl zaznamenán vysoce signifikantní rozdíl jak ve skupině pacientů monitorovaných pomocí Variable Number of Tandem Repeats analýzy v kombinaci se Short Tandem Repeats analýzou, tak i ve skupině monitorované vysoce citlivou metodou kvantitativní PCR v reálném čase (p < 0,0001, respektive p = 0,0002). Detekce smíšeného chimerismu je tak vysoce rizikovým faktorem potransplantačního průběhu. Jako potenciálně riziková byla prokázána i skupina pacientů s mikrochimerismem (p = 0,0201).
Předpokladem úspěšné transplantace je výběr vhodného dárce na základě genotypové shody v HLA systému a sledování dynamiky buněčného chimerismu po provedení vlastní transplantace pomocí citlivých metod.KLÍČOVÁ SLOVA:
HLA – chimerismus – alo-HSCT – qPCRÚVOD
Alogenní transplantace hematopoetických kmenových buněk (alo-HSCT) je jednou z používaných modalit v léčbě hematologických malignit. Pro úspěšnost alo-HSCT je zásadní shoda v HLA systému (Human Leukocyte Antigens). Produkty jeho enormně polymorfních genů jsou transmembránové glykoproteiny, které rozpoznávají v organismu cizí struktury, a tím zahajují kaskádu imunitních odpovědí. Neshoda v HLA oblasti mezi dárcem a příjemcem transplantátu může navodit odhojení tohoto štěpu, popř. způsobit nemoc štěpu proti hostiteli GvHD (Graft Versus Host Disease), která je vážnou až fatální komplikací alo-HSCT. Testy HLA pomocí genetických metod, které jsou v praxi využívány od devadesátých let, významně přispívají ke znalostem polymorfismů HLA [1], a tím i ke zpřesnění shody mezi pacientem a dárcem alo-HSCT. Vyhledání vhodného dárce hematopoetických kmenových buněk dle míry jeho shody s pacientem v HLA systému je v ÚHKT prováděno v souladu s odbornými požadavky Evropské federace pro imunogenetiku již od doby první provedené transplantace v roce 1986.
Dalším významným genetickým testem pro alo-HSCT je monitorování buněčného chimerismu po provedené transplantaci. Pomocí něj lze sledovat dynamiku přihojení štěpu, přežívání a množení dárcovských buněk. Zároveň je zásadní pro včasné zachycení návratu autologní krvetvorby po původním přihojení štěpu, které naznačuje riziko relapsu onemocnění. Za tímto účelem se vyšetření buněčného chimerismu provádí v ÚHKT od roku 1992. Pomocí vysoce variabilních polymorfismů lokalizovaných v rámci celého genomu lze určit rozdíly v DNA profilu příjemce a dárce, a odlišit tak původ buněk. Molekulární analýza individuálního buněčného chimerismu v daném časovém bodě po transplantaci krvetvorných buněk je pak nespecifickým markerem potransplantační krvetvorby pro všechny diagnózy s cílem poskytnout co nejpřesvědčivější diagnostické podklady pro klinická rozhodnutí.
Přesnost používaných genetických metod pro testování HLA shody i pro sledování buněčného chimerismu se neustále dynamicky vyvíjí. Cílem naší práce byla analýza vlivu použitých testů na úspěšnost alo-HSCT provedených v ÚHKT.
Jak vyšetření HLA genotypizace, tak i vyšetření buněčného chimerismu splňují požadavky na akreditované vyšetření nejen podle českých norem, ale i podle standardů European Federation for Immunogenetics (EFI). Vyšetření HLA genotypizace je akreditováno pod touto asociací již od roku 2006 a jako první laboratoř v České republice se ÚHKT v roce 2013 akreditovalo u EFI i pro oblast vyšetření buněčného chimerismu. Pro tyto metodiky organizujeme pro tuzemské i zahraniční účastníky externí hodnocení kvality již od roku 2005. Od roku 2014 jsme byli také zařazeni do seznamu poskytovatelů External proficiency testing v rámci EFI [2].
SOUBOR VYŠETŘENÝCH A METODIKA
Analyzovaný soubor
Celkově bylo v letech 1986–2013 v ÚHKT transplantováno 917 pacientů. Sledovaný soubor zahrnuje 611 z nich, kteří podstoupili alo-HSCT od HLA shodných dárců. Je tvořen 356 muži a 255 ženami ve věkovém rozmezí od 16 do 86 let s mediánem 45 let. Pacienti byli rozděleni do 8 diagnostických skupin, a to na pacienty s akutní myeloidní leukemií (AML), akutní lymfoblastickou leukemií včetně lymfoblastického lymfomu (ALL a LBL), chronickou myeloidní leukemií (CML), chronickou lymfoblastickou leukemií spolu s lymfomem z malých lymfocytů a prolymfocytární leukemií (CLL, SLL, PLL), lymfomy typu Hodgkin a non-Hodgkin, myelodysplastickým syndromem (MDS), myeloproliferativním onemocněním a ostatními nezařazenými diagnózami. Pacienti před alo-HSCT podstoupily myeloablativní nebo nemyeloablativní přípravu a vlastní transplantace proběhla podáním štěpu periferních kmenových buněk (PBPC), buněk kostní dřeně (BM) a v jednom případě pupečníkové krve (CB). Podrobné počty jsou uvedeny v grafech 1 a 2.
Graph 1. Rozdělení souboru pacientů podle diagnostických skupin 
Graph 2. Rozdělení souboru pacientů podle přípravného režimu a typu štěpu 
Vysvětlivky: CB – cord blood (pupečníková krev), PBPC – periferní krvetvorné kmenové buňky, BM – bone marrow (kostní dřeň) V tomto souboru byl analyzován vliv přesnosti použitých genetických testů HLA a buněčného chimerismu na celkové přežívání pacientů po transplantaci. Analýza vlivu testů HLA byla provedena u 292 pacientů transplantovaných od nepříbuzných dárců v celém sledovaném období. Pro sledování vlivu dynamiky buněčného chimerismu byl vybrán soubor 474 pacientů, kteří podstoupili alo-HSCT mezi léty 1998–2013 (u pacientů transplantovaných před rokem 1998 nejsou k dispozici statisticky zhodnotitelná data).
METODIKA
V letech 1986–1998 byly lokusy HLA II. třídy DRB1 a DQB1 na úrovni rozlišení alel testovány genetickou metodou a antigeny HLA I. třídy (A, B a C) pouze sérologicky. V uvedeném období byla použita metoda PCR-SSP (polymerázová řetězová reakce se sekvenčně specifickými primery).
Od roku 1999 byla prováděna genotypizace nejen HLA I. třídy, ale i II. třídy (lokusy HLA-A, B, C, DRB1 a DQB1) na úrovni rozlišení alel, a to v letech 1999–2006 výhradně metodou PCR-SSP a od roku 2006 nově zavedenou přesnější metodou SBT (sequence-based typing). Tato metoda umožňuje nejen přesnou genotypizaci známých alel HLA systému, ale i detekci alel nových [3].
Pro testování buněčného chimerismu byla od roku 1992 používána analýza polymorfismů typu Variable Number of Tandem Repeats (VNTR) s citlivostí 1–5 %, následně v kombinaci s analýzou Short Tandem Repeats (STR) s citlivostí 1 %. Obě metody jsou založené na stanovení genotypu délkových polymorfismů fragmentační analýzou, a to buď na agarózovém gelu (VNTR) nebo v genetickém analyzátoru (STR). Od června roku 2011 byla zavedena vysoce citlivá metoda analýzy polymorfismů typu krátkých inzercí a delecí (indel) pomocí kvantitativní PCR v reálném čase (qPCR) založená na TaqMan technologii [4,5]. Podle interních validací byla stanovena citlivost jako 0,035 %. Od prosince 2012 byla zavedena multiplexní analýza qPCR, která umožňuje zvýšit efektivitu a snížit finanční náročnost metody [6]. Pro správnou kvantifikaci buněčného chimerismu je zásadní nejen citlivost používaných metod, ale je důležité brát v úvahu i případné cytogenetické změny primárního onemocnění, pro které pacient alo-HSCT podstoupil. Výběr nevhodného polymorfismu může vést k chybné interpretaci výsledků. Z toho důvodu jsou vybírány alespoň dva polymorfismy ležící na odlišných chromozomech [7].
Všechny statistické parametry byly zpracovány pomocí softwaru GraphPad Prism 4.03 (La Jolla, CA, USA) a data následně vyhodnocena metodou analýzy přežití (Kaplanova-Meierova analýza). Signifikance byla stanovena pomocí Mannova-Whitneyova testu na hladině významnosti 0,05.
VÝSLEDKY
HLA genotypizace
Testovaný soubor 292 pacientů transplantovaných od HLA shodných nepříbuzných dárců byl rozdělen do dvou skupin podle genetických testů HLA shody, druhá skupina pak následně do kategorií podle použitých genotypizačních metod. U obou skupin bylo hodnoceno celkové tříleté přežití pacientů po provedené alo-HSCT.
První skupina zahrnuje 23 pacientů (8 % z analyzovaného souboru), u kterých byla kompatibilita HLA mezi pacientem a dárcem stanovena genetickými metodami pouze v lokusech HLA II. třídy (lokusy DRB1 a DQB1). Míra shody HLA I. třídy (antigeny HLA-A, B a Cw) byla určena sérologicky. Jedná se o pacienty transplantované v letech 1986–1998. Ze sledování potransplantačního průběhu byla u této skupiny pacientů stanovena pravděpodobnost tříletého přežití 26 % s mediánem délky přežití méně než čtyři měsíce.
Druhá skupina zahrnuje 269 pacientů, kteří byli transplantováni po roce 1998. V této skupině byla míra HLA shody testována genetickými metodami v lokusech HLA I. i II. třídy (HLA-A, B, Cw, DRB1 a DQB1). Pravděpodobnost tříletého přežití těchto pacientů je 55 %, medián délky přežití nebyl při této analýze dosažen.
Tato skupina byla dále rozdělena na dvě kategorie podle použitých genotypizačních metod HLA, a to na kategorii s testy HLA shody metodou PCR-SSP (transplantace v letech 1999–2005) a kategorii testovanou přesnější metodou SBT (transplantace v letech 2006–2013). V jednotlivých kategoriích byla pravděpodobnost tříletého přežití 58%, respektive 54%.
Byl zaznamenán signifikantní rozdíl tříletého přežití mezi skupinou pacientů transplantovaných do roku 1998 v porovnání s pacienty transplantovanými po roce 1998, kdy genetické testy HLA kompatibility zahrnovaly lokusy HLA I. i II. třídy (p = 0,0189). Mezi kategoriemi pacientů testovaných různými metodami genotypizace HLA I. a II. třídy (transplantace v letech 1999–2005 vs. 2006–2013) signifikantní rozdíl zaznamenán nebyl (p = 0,6077). Přesné rozdělení souboru do jednotlivých skupin, pravděpodobnost tříletého přežití a medián přežití jsou uvedeny v tabulce 1. Křivky přežití jsou zobrazeny v grafu 3.
Table 1. Rozdělení souboru pacientů podle použitých metod testování HLA shody 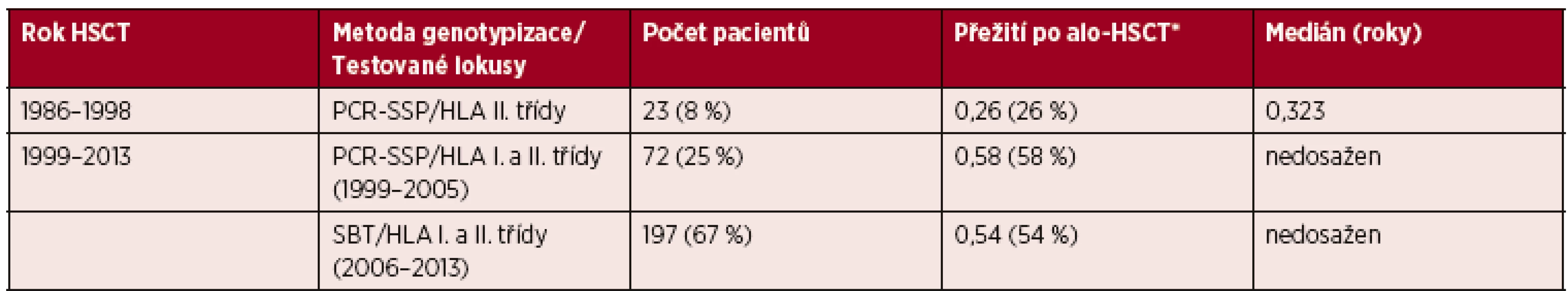
Vysvětlivky: *Pravděpodobnost tříletého přežití po provedené alo-HSCT. Graph 3. Křivka přežití ve skupinách podle použitých metod testování HLA shody 
Vyšetření buněčného chimerismu
Soubor 474 pacientů transplantovaných od HLA shodných příbuzných i nepříbuzných dárců byl rozdělen podle používaných metod do dvou skupin. Podle míry chimerismu byl následně diferencován na kategorii pacientů s kompletním chimerismem (CC, detekce pouze genotypu dárce), se smíšeným chimerismem (MC, současná detekce genotypu dárce i příjemce) a ve druhé skupině i s mikrochimerismem (Mc, smíšený chimerismus s přítomností genotypu příjemce nižší než 1 %). V jednotlivých kategoriích bylo hodnoceno celkové tříleté přežití pacientů po alo-HSCT.
První skupina zahrnuje 337 pacientů (71 % z celkového souboru). Míra chimerismu byla určena metodami VNTR a STR analýzy používanými v období let 1992–5/2011. Pravděpodobnost tříletého přežití byla v kategorii pacientů s kompletním chimerismem 67% (medián délky přežití nedosažen) a v kategorii pacientů se smíšeným chimerismem pouze 14% (medián délky 0,548 let). Mikrochimerismus nebylo možné detekovat díky nízké citlivosti metod.
Druhá skupina představuje 137 pacientů (29 % z celkového souboru). Míra chimerismu byla stanovena spolu s STR analýzou nově také metodou detekce polymorfismů typu indel používanou od června 2011 do současnosti. Díky vysoké citlivosti této metody je možné rozlišit jak kategorii pacientů s CC a MC, tak i kategorii pacientů s Mc. Pravděpodobnost tříletého přežití byla v kategorii pacientů s CC 72 % (medián délky přežití nedosažen), s MC 19 % (medián délky přežití 0,663 let) a s Mc 42 % (medián délky přežití 2,149 roku) – tabulka 2, graf 4.
Table 2. Rozdělení souboru pacientů podle použitých metod a míry buněčného chimerismu 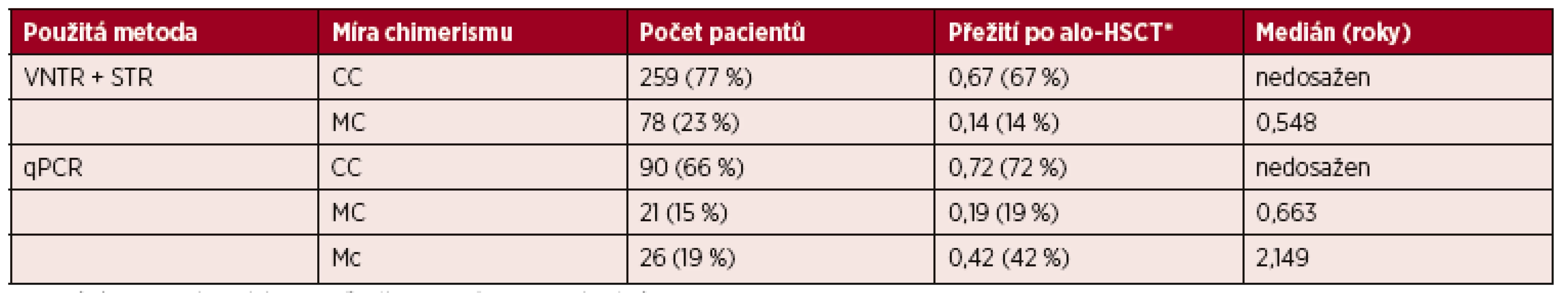
Vysvětlivky: *Pravděpodobnost tříletého přežití po provedené alo-HSCT. VNTR = Variable Number of Tandem Repeats, STR = Short Tandem Repeats, qPCR = kvantitativní PCR v reálném čase. CC = kompletní chimerismus, MC = smíšený chimerismus, Mc = mikrochimerismus Graph 4. Křivka přežití podle míry chimerismu 
V obou skupinách byl zaznamenán vysoce signifikantní rozdíl v délce přežití mezi kategoriemi pacientů se smíšeným a kompletním chimerismem (první skupina p < 0,0001; druhá skupina p = 0,0002). Detekce smíšeného chimerismu je tak vysoce rizikový faktor potransplantačního průběhu.
Ve druhé skupině se jako potenciálně riziková prokázala už i kategorie pacientů s přítomností autologní krvetvorby nižší než 1 %, tedy mikrochimerismem. Rozdíl v délce přežití mezi touto kategorií a kategorií pacientů s kompletním chimerismem byl signifikantní (p = 0,0201).
Při vzájemném porovnání skupin byl také zaznamenán pokles počtu pacientů se smíšeným chimerismem (23 % vs. 15 %), a to zejména díky včasnému odhalení rizikových pacientů pomocí qPCR, a tím snížení pravděpodobnosti progrese do vysoce rizikové kategorie smíšeného chimerismu. Včasná detekce autologní krvetvorby je tedy pro délku přežití zásadní. Procentuální zastoupení pacientů v jednotlivých kategoriích a skupinách znázorňuje graf 5.
Graph 5. Procentuální zastoupení pacientů v jednotlivých kategoriích mezi skupinami podle míry chimerismu 
Při vzájemném porovnání podle míry detekovaného chimerismu mezi skupinami bylo zjištěno mírné zlepšení tříletého přežití v kategorii pacientů s kompletním i smíšeným chimerismem, i když rozdíl nedostáhl nastavenou hladinu signifikance (CC; p = 0,4390 a MC; p = 0,7291).
DISKUSE
Z uvedených křivek tříletého celkového přežití v závislosti na přesnosti typizace HLA se v našem souboru jeví jako zásadní zavedení genotypizace HLA I. třídy od roku 1999. Nicméně je nutné zdůraznit, že v tomto roce bylo současně s genotypizací HLA I. třídy v ÚHKT zavedeno také podávání ATG pacientům transplantovaným od nepříbuzných dárců. Je prokázáno, že podání ATG před převodem štěpu snižuje riziko vzniku akutní a chronické GVHD, a zlepšuje tak potransplantační průběh [8]. Významné zlepšení přežívání nelze tedy přičítat pouze zpřesnění testování HLA shody mezi pacienty a dárci alo-HSCT.
Upřesnění HLA genotypizace pomocí SBT bez doplnění testování dalších HLA lokusů v roce 2006 nepřineslo žádné výrazné změny v přežití transplantovaných pacientů (viz graf 3).
V souladu s našimi výsledky a s aktuálními poznatky z renomovaných zdrojů lze předpokládat, že rozšíření testování HLA shody přináší zlepšení přežití transplantovaným pacientům. Genem HLA, který je aktuálně zkoumán jako další významný faktor pro zlepšení potransplantačního průběhu, je HLA-DPB1. Tento lokus je sledován již dlouhodobě, nicméně nalezení dárce s úplnou shodou v HLA-A, -B, -C, -DRB1, -DQB1 i -DPB1 je však problematické, jak ukázala již naše starší práce [9]. Provedené studie však dokladují různý vliv konkrétních DPB1 neshod na potransplantační průběh. Některé typy neshod v DPB1 lokusu (označované jako permisivní) jsou pacienty po alo-HSCT dobře tolerovány a nezhoršují přežití po alo-HSCT [10, 11]. Novým trendem je proto hledání dárců s permisivními DPB1 neshodami. Testování HLA pro vyhledání vhodných nepříbuzných dárců i v DPB1 lokusu bylo v ÚHKT zavedeno od roku 2016. Naše první výsledky dokazují možnost nalezení dárců s kompletní shodou ve standardně sledovaných HLA lokusech a s permisivními neshodami v HLA-DPB1 (tab. 3), nicméně data z dlouhodobého sledování potransplantačního průběhu nejsou u našich pacientů dosud dostupná.
Table 3. Míra shody v HLA-DPB1 lokusu – přehled vzorků zpracovaných v období XI/2016 až VIII/2017: 66 pacientů + 208 dárců 
Zavedení metody qPCR pro monitorování hladiny buněčného chimerismu do rutinního vyšetření zásadně zpřesnilo hodnocení potransplantačního průběhu pacientů. V České republice jsme metodu qPCR zavedli do praxe od roku 2011 jako jedna z prvních laboratoří. Vyznačuje se vysokou citlivostí 0,035 %, čímž umožní zachytit relaps mnohem dříve než klasické metody. Ahci et al. (2017) publikovali zjištění, že predikovat relaps lze 180 dní před jeho vznikem v podstatně více případech metodou qPCR než STR analýzou (v kostní dřeni 100 % vs. 37,5 %, v periferní krvi 100 % vs. 12,5 %) [12]. Přínos metody qPCR prokázal již dříve i Koldehoff et al. (2006) [13], který uvádí schopnost detekovat relaps pomocí qPCR 120 vs. 30 dní před jeho začátkem (p < 0,007).
Z našich výsledků vyplývá, že použitím citlivé metody qPCR ve druhé skupině dochází k odlišení kategorie pacientů s mikrochimerismem, která je již považována za rizikovou. Z tohoto důvodu je následně vhodné tyto pacienty monitorovat v kratších časových intervalech. Při trvajícím nárůstu autologní krvetvorby lze pak manipulací s imunosupresí a eventuálně dalšími léčebnými postupy se štěpem celý proces ovlivnit, a docílit tak opět kompletního dárcovského chimerismu. K progresi do vysoce rizikové kategorie smíšeného chimerismu tak dochází u menšího počtu pacientů.
ZÁVĚR
Naše práce potvrdila vliv použití genetických testů na přežití pacientů po alo-HSCT. Shoda mezi pacientem a dárcem identifikovaná genotypizací v oblasti HLA I. i II. třídy (HLA-A, B, C, DRB1, DQB1) na úrovni stanovení alel je základním požadavkem úspěchu transplantace od nepříbuzných dárců. Vliv detailní přesnosti použitých genotypizačních metod nebyl prokázán. Otázkou zůstává, zda zahrnutí dalších vybraných lokusů HLA do rutinního výběru dárců může u našich pacientů dále zvýšit úspěšnost prováděných transplantací.
Pro monitorování buněčného chimerismu u pacientů po alo-HSCT je důležité používat metody s vysokou citlivostí, jako je qPCR, která umožní včasně rozpoznat molekulární relaps. V případě nálezu smíšeného chimerismu nebo mikrochimerismu je žádoucí sledovat jeho dynamiku. Při narůstajícím trendu je nutné zahájit co nejdříve efektivní léčbu.
Podíl autorů na přípravě rukopisu
MV, SN – autoři pro část HLA genotypizace
HČ, KP – autoři pro část buněčného chimerismu
KP – statistické zpracování dat formou grafů a tabulek
AV – klinický konzultant
Poděkování
Podpořeno projektem (Ministerstva zdravotnictví ČR) koncepčního rozvoje výzkumné organizace (00023736, ÚHKT).
Prohlášení autorů
Autoři práce prohlašují, že s v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Ing. Milena Vraná
Oddělení HLA
Ústav hematologie a krevní transfuze
U Nemocnice 2094/1
128 20 Praha 2
e-mail: milena.vrana@uhkt.cz
Sources
1. Robinson J, Halliwell JA, Hayhurst JH, et al. The IPD and IMGT/HLA Database: allele variant databases. Nucleic Acids Res 2015;43:D423–431.
2. Cechova H, Pegova K, Nadvornikova S, et al. The external proficiency testing and long-term determination of cell chimaerism in The National Reference Laboratory for DNA Diagnostics in the Czech Republic. Tissue Antigens 2016;87(4):268.
3. Mrazek F, Onderkova J, Konigova N, et al. A novel HLA-B allele HLA-B*35 : 279 identified by sequencing-based typing in a Czech pa-tient. Int J Immunogen 2016;43(4):246–248.
4. Alizadeh M, Bernard M, Danic B, et al. Quantitative assessment of hematopoietic chimerism after bone marrow transplantation by real-time quantitative polymerase chain reaction. Blood 2002;99(12):4618–4625.
5. Qin XY, Li GX, Qin YZ, et al. Quantitative assessment of hematopoietic chimerism by quantitative real-time polymerase chain reaction of sequence polymorphism systems after hematopoietic stem cell transplantation. Chin Med J (Engl) 2011;124(15):2301–2308.
6. Leontycova M, Cechova H, Pegova K, et al. Validation study of real-time polymerase chain reaction monoplex and multiplex analysis in chimerism testing. Tissue Antigens 2014;84(1):49.
7. Pegova K, Leontovycova M, Pavlatova L, et al. The choice of suitable polymorphisms for cell chimerism monitoring of patients after allogeneic hematopoietic stem cell transplantation, Tissue Antigens 2017;89(6):416.
8. Bacigalupo A, Lamparelli T, Barisione G, et al. Thymoglobulin prevents chronic graft-versus-host disease, chronic lung dysfunction, and late transplant-related mortality: long-term follow-up of a randomized trial in patients undergoing unrelated donor transplantation. Biol Blood Marrow Transplant 2006;12(5):560–565.
9. Ludajic K, Balavarca Y, Bickeboeller H, et al: Impact of HLA-DPB1 allelic and single amino acid mismatches on HSCT. Brit J Haematol 2008;142(3):436–443.
10. Vraná M, Dobrovolná M, Cetkovský P, Nazarová S, Vondráčková H, Sedláček P. Analýza HLA-DPB1 genu u transplantací hematopoetických kmenových buněk. Čas Lék Čes 2006;145 : 126–129.
11. Crivello P, Zito L, Sizzano F, et al. The impact of amino acid variability on alloreactivity defines a functional distance predictive of permissive HLA-DPB1 mismatches in hematopoietic stem cell transplantation. Biol Blood Marrow Transplant 2015;21 : 233–241.
12. Ahci M, Stempelmann K, Buttkereit U, et al. Clinical utility of quantitative PCR for chimerism and engraftment monitoring after allogeneic stem cell transplantation for hematologic malignancies. Biol Blood Marrow Transplant; publikováno elektronicky 8. června 2017 DOI: 10.1016/j.bbmt.2017.05.031.
13. Koldehoff M, Steckel NK, Hlinka M, Beelen DW, Elmaagacli AH. Quantitative analysis of chimerism after allogeneic stem cell transplantation by real-time polymerase chain reaction with single nucleotide polymorphisms, standard tandem repeats, and Y-chromosome-specific sequences. Am J Hematol 2006;81(10):735–746.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2017 Issue Supplementum1-
All articles in this issue
- Genetické testy pro výběr dárce hematopoetických kmenových buněk a potransplantační monitorování
- Centrum pro vzácné choroby červené krevní řady v Ústavu hematologie a krevní transfuze
- Transfuze a imunohematologie v ÚHKT
- Standardní a velkoobjemové separace krvetvorných buněk z periferní krve za použití nového protokolu pro kontinuální sběr mononukleárních buněk Spectra Optia
- Dysfibrinogenemie a afibrinogenemie v České republice
- Molekulárně genetická vyšetření prováděná v Ústavu hematologie a krevní transfuze u pacientů s myelodysplastickým syndromem
- Funkční následky mutací v genu pro nukleofosmin u akutní myeloidní leukemie
- Současné trendy v léčbě a diagnostice chronické myeloidní leukemie
- Využití molekulárně cytogenetických technik při analýze chromozomových aberací u hematologických malignit
- Transplantace krvetvorných buněk v Ústavu hematologie a krevní transfuze (1986–2016)
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Dysfibrinogenemie a afibrinogenemie v České republice
- Centrum pro vzácné choroby červené krevní řady v Ústavu hematologie a krevní transfuze
- Transfuze a imunohematologie v ÚHKT
- Funkční následky mutací v genu pro nukleofosmin u akutní myeloidní leukemie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

