-
Medical journals
- Career
Získaný angioedém s deficitem C1 inhibitoru u pacientky s B-lymfomem nízké malignity a efekt léčby základního onemocnění na projevy angioedému
Authors: M. Sobotková 1; J. Segethová 2
Authors‘ workplace: Ústav imunologie 2. LF a FN Motol, Praha 1; Oddělení klinické hematologie FN Motol, Praha 2
Published in: Transfuze Hematol. dnes,23, 2017, No. 3, p. 145-150.
Category: Comprehensive Reports, Original Papers, Case Reports
Overview
Získaný angioedém s deficitem C1 inhibitoru je vzácné onemocnění, které se projevuje otoky kůže a sliznic v různých lokalitách. Nejčastěji bývá asociován s hematologickými malignitami nebo monoklonální gamapatií. Léčba základního hematologického onemocnění může příznivě ovlivnit projevy angioedému. V naší kazuistice představíme pacientku se získaným deficitem C1 inhibitoru asociovaným se splenickým lymfomem, u které léčba lymfomu navodila kompletní klinickou remisi i normalizaci laboratorních parametrů komplementu.
KLÍČOVÁ SLOVA:
angioedém – C1 inhibitor – bradykinin – splenický lymfom z marginální zónyÚVOD
C1 inhibitor (C1-INH) je protein syntetizovaný převážně v játrech. Patři mezi tzv. serpiny – inhibitory serinových proteáz. Jeho regulační úloha spočívá nejen v inhibici aktivované složky komplementu C1r a C1s a MASPs (s MBL asociované serinové protézy), ale mimo jiné i aktivovaného faktoru XII, IX a kalikreinu v systému koagulačním a plazminu a tkáňového aktivátoru plazminogenu v systému fibrinolytickém. Zvýšená aktivita těchto kaskádovitých systémů vede k nadměrné produkci bradykininu, který je pak hlavním mediátorem zodpovědným za vznik angioedému u tohoto onemocnění [1, 2].
Deficit C1 inhibitoru, ve smyslu snížené koncentrace v plazmě či jen jeho snížené funkce, může být vrozený nebo získaný. Vrozenou formu označujeme jako hereditární angioedém s deficitem C1 inhibitoru (C1-INH-HAE). Jedná se o autozomálně dominantně dědičné onemocnění podmíněné mutací genu pro C1-INH lokalizovaného na 11. chromozomu. Se získanou formou (acquired angioedema with C1 inhibitor deficiency, C1-INH-AAE) se setkáváme zpravidla u jedinců starších 40 let s jinou základní diagnózou [2, 3]. Obvykle se jedná o hematologické malignity (35–48 % případů), nejčastěji o non-Hodgkinské lymfomy (NHL) vycházející z B řady. Z nich až 75 % představují splenické lymfomy z marginální zóny. U 30–35 % pacientů doprovází C1-INH-AAE monoklonální gamapatii, téměř vždy monoklonální gamapatii nejasného významu (MGUS). Další část pacientů (asi 8–10 %) má prokázáno autoimunitní onemocnění (někdy i společně s hematologickou malignitou) a 1–6 % trpí jinou malignitou nežli hematologickou. Asi u 20–25 % případů žádné základní vyvolávající onemocnění neprokážeme [4, 5]. Zatímco u C1-INH-HAE bývá udáván výskyt v populaci asi 1 : 50 000, C1-INH-AAE je asi 10krát vzácnější a odhadovaný výskyt se tím pádem pohybuje kolem 1 : 500 000. Jedná se tedy o onemocnění velmi vzácné a celosvětově publikované případy se počítají na stovky [1, 3].
Patogeneze deficitu C1-INH u C1-INH-AAE zatím nebyla dopodrobna objasněna. U C1-INH-HAE v důsledku genové mutace dochází k nedostatečné tvorbě C1-INH nebo syntéze funkčně defektního proteinu. U C1-INH - -AAE je jedním předpokládaným mechanismem masivní aktivace klasické cesty komplementové kaskády nádorovou tkání s následnou konsumpcí jednotlivých složek. Dále u většiny těchto pacientů prokážeme protilátky proti C1-INH, které mohou inhibovat jeho funkci. O podílu obou zmiňovaných mechanismů na vzniku deficitu C1 inhibitoru se diskutuje, ale v důsledku konsumpce komplementu zpravidla (ale ne vždy) u pacientů se získaným deficitem C1-INH prokážeme i snížení C1q složky komplementu, na rozdíl od pacientů s formou vrozenou (laboratorní nálezy u pacientů s C1-INH-HAE a AAE tabulka 1). Tyto laboratorní parametry však nemusí být snížené trvale a byly popsány případy s prokazatelným deficitem C1 inhibitoru pouze v akutní atace (při otoku) [2, 6].
Table 1. Laboratorní nálezy u pacientů se získaným a vrozeným angioedémem s deficitem C1 inhibitoru [2] ![Laboratorní nálezy u pacientů se získaným a vrozeným angioedémem s deficitem C1 inhibitoru [2]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/d807e3dee3005d9cf06249e4577ae516.png)
C1-INH-HAE – hereditární angioedém s deficitem C1 inhibitoru, C1-INH-AAE – získaný angioedém s deficitem C1 inhibitoru Typ I – forma hereditárního angioedému se sníženou koncentrací i funkcí C1 inhibitoru, kterou najdeme asi u 85 % pacientů s dědičnou formou deficitu C1 inhibitoru Typ II – dědičná forma deficitu C1 inhibitoru, u které je porušena jen jeho funkce, C1-INH – C1 inhibitor Klinicky se jak dědičná, tak získaná forma angioedémů s deficitem C1-INH projevuje nesvědivými otoky kůže a sliznic, které mohou vznikat prakticky kdekoli. Spontánně odeznívají za 2–5 dní a nebývají doprovázeny kopřivkou. Vznikají buď bez zjevné příčiny, nebo je mohou vyvolat některé faktory jako například trauma, psychická nebo fyzická zátěž, infekce, invazivní vyšetření a operační výkony nebo některé léky (ACE inhibitory, estrogeny). Často bývají lokalizovány na končetinách nebo obličeji, ale objevují se i v dutině ústní či dýchacích cestách, což může pacienta bezprostředně ohrozit na životě. Nepříjemné jsou také otoky sliznic trávicího traktu, které mohou napodobovat náhlou příhodu břišní [1, 2].
Z hlediska terapie je třeba brát v úvahu nejen léčbu vlastních angioedémů, ale také možnost léčby základního onemocnění. Terapeutické možnosti pro léčbu C1-INH-AAE jsou popsány v tabulkách 2 a 3. Je zde třeba upozornit, že otoky, u nichž je hlavním mediátorem bradykinin zpravidla nereagují na konvenční léčbu kortikosteroidy a antihistaminiky a vyžadují léčbu specifickou. Ta je velmi nákladná a v České republice je poskytována pouze ve specializovaných centrech [2, 3]. Získané formy angioedému s deficitem C1-INH nejčastěji doprovází onemocnění hematologická, u kterých se však z hlediska terapie u asymptomatických nemocných obvykle volí strategie pečlivého sledování (watch and wait) a k léčbě se přistupuje až při zjevné progresi choroby. Podle publikovaných kazuistik i větších studií se však zdá, že terapie základního onemocnění u pacientů s C1-INH AAE velmi často vede ke kompletnímu nebo alespoň částečnému vymizení projevů i zlepšení laboratorních nálezů [5, 7, 8]. V naší kazuistice představíme pacientku, u které byl diagnostikován získaný angioedém s deficitem C1 inhibitoru a následně i B-lymfom nízké malignity (low grade). Po léčbě hematologického onemocnění u ní došlo k vymizení projevů angioedému i normalizaci koncentrace i funkce C1 inhibitoru a C4 složky komplementu.
Table 2. Léčebné možnosti u angioedémů s deficitem C1 inhibitoru [3] ![Léčebné možnosti u angioedémů s deficitem C1 inhibitoru [3]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/4282a9e78e06e168d340315eb1ab5d1b.png)
Terapie akutní ataky – léčba již vzniklého otoku. Dlouhodobá profylaxe – léčba, která má snížit frekvenci a závažnost angioedémů a používá se u pacientů s častými nebo závažnými projevy. Krátkodobá profylaxe – léčba, kterou podáváme pacientovi, jenž je nebo bude vystaven možnému spouštěči ataky. apoužití krevní plazmy je nouzové řešení, pokud není k dispozici jiné specifické léčivo bnení v Evropě registrován cúčinek je při menší a pomalejší než u ostatních výše zmíněných léků Table 3. Mechanismus účinku léků používaných v léčbě angioedémů s deficitem C1 inhibitoru 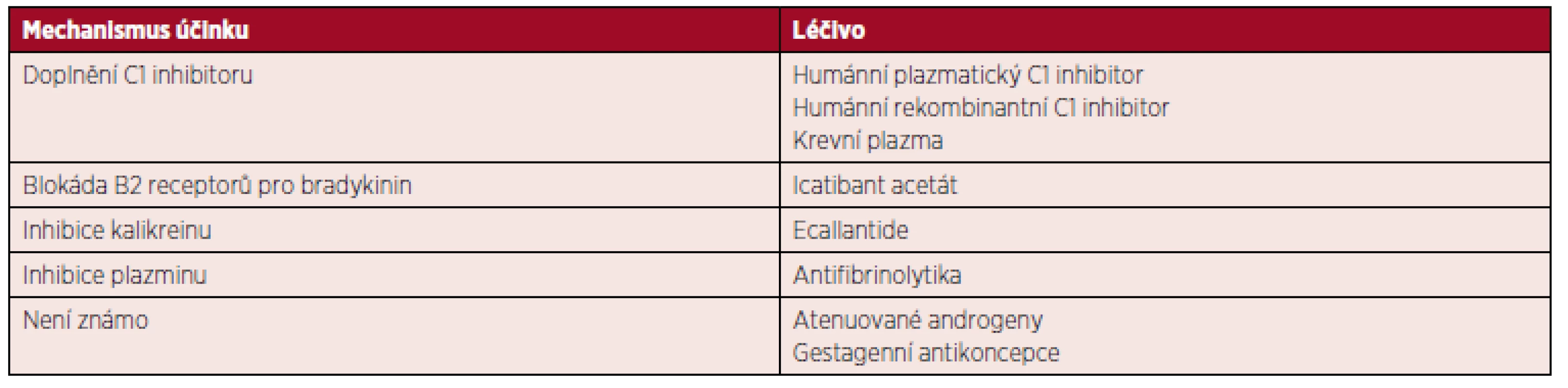
KAZUISTIKA
Naší pacientkou je žena narozená v roce 1953, které v době diagnózy C1-INH-AAE bylo 62 let. Jedná se o diabetičku 2. typu a hypertoničku, která se také léčí pro chronickou obstrukční chorobu bronchopulmonární, hyperurikemii, vředovou chorobou gastroduodenální a psoriázu. Dále byla po cholecystektomii pro litiázu, operaci pro extrauterinní graviditu a trpí syndromem spánkové apnoe.
Angioedémy se u pacientky poprvé objevily v lednu 2015, tedy ve věku 61 let. Jednalo se o mírné nesvědivé otoky v obličeji, které se objevovaly asi 1krát měsíčně a spontánně regredovaly do druhého dne. Pacientku tyto potíže neobtěžovaly natolik, aby vyhledala lékaře, ale v červnu došlo k rozvoji otoku v dutině ústní, který si vyžádal převoz záchrannou službou na nemocniční pohotovost. Pacientka byla léčena parenterálně podanými kortikosteroidy (methylprednisolon) a antihistaminiky (bisulepin) s regresí otoku do 3–4 hodin. Sloužící lékař indikoval změnu v antihypertenzní medikaci a ACE inhibitor (perindopril) vyměnil za kalciový blokátor. Také doporučil vyšetření imunologem.
Imunologické vyšetření a léčba
První imunologické vyšetření absolvovala pacientka v červenci 2015 na pracovišti v místě bydliště. Bylo zjištěno snížení koncentrace i funkce C1 inhibitoru i C4 složky komplementu, a proto byla odeslána k vyšetření do pražského centra pro léčbu HAE v Ústavu imunologie FNM (Fakultní nemocnice v Motole). V rámci našeho vstupního vyšetření jsme museli na jedné straně vzít v úvahu laboratorní výsledky, které odpovídaly diagnóze C1-INH-HAE/AAE, ale na druhé straně také dobrou odpověď na léčbu kortikosteroidy a antihistaminiky, která není pro tuto diagnózu typická. Vzhledem k tomu, že naše vstupní laboratorní vyšetření podezření na deficit C1-INH nepotvrdilo, byla zahájena terapie antihistaminiky (desloratadin) jako léčba možného idiopatického histaminergního angioedému. Pouze v případě závažného otoku, který by nereagoval na léčbu antihistamiky a kortikosteroidy, bylo indikováno podání icatibantu (blokátor B2 receptorů pro bradykinin). Výsledky laboratorních imunologických vyšetření byly velmi variabilní (tab. 4), ale výrazné snížení C4 složky komplementu bylo přítomno ve všech těchto vyšetřeních. Deficit C1 inhibitoru byl posléze zachycen opakovaně. Na základě těchto nálezů byla nakonec vyslovena diagnóza deficitu C1 inhibitoru a pacientka byla vybavena předplněnou injekcí s icatibant acetátem pro případ závažného otoku.
Table 4. Laboratorní nálezy u pacientky před zahájením léčby lymfomu 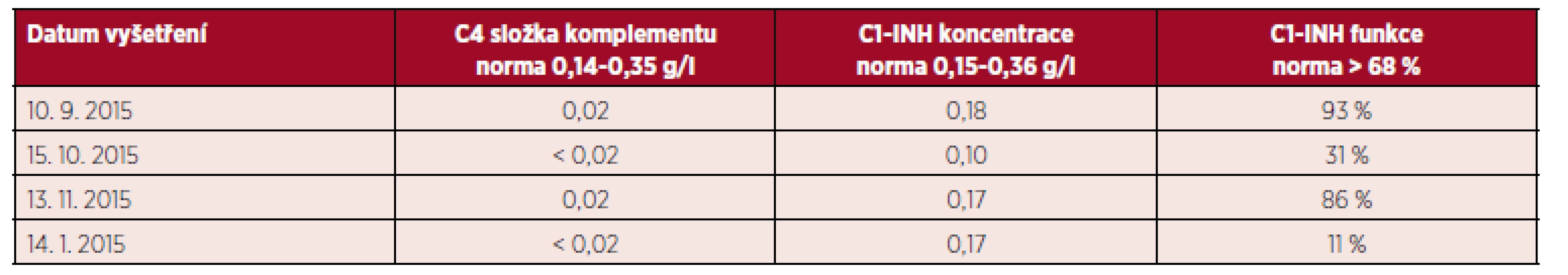
C1-INH – C1 inhibitor, patologické hodnoty zvýrazněny tučně Zbývalo dořešit, zda se jedná o hereditární či získanou formu. Jelikož nebylo přítomno snížení C1q složky komplementu, mohlo by se jednat i o formu dědičnou, nicméně věk při první manifestaci angioedémů byl 61 let, což je typické spíše pro formu získanou. Navíc v rodině pacientky na otoky nikdo jiný netrpěl. Již při vstupním klinickém vyšetření také byla zjištěna splenomegalie se slezinou přesahující asi 1–2 cm přes žeberní oblouk. UZ vyšetření břicha a následně i CT břicha podezření na splenomegalii potvrdilo. Na základě výše uvedených skutečností bylo vysoce suspektní, že se jedná o získaný angioedém s deficitem C1 inhibitoru při základním hematologickém onemocnění. Pacientka byl proto odeslána k dalšímu vyšetření na oddělení hematologie FNM.
Hematologické vyšetření a léčba
Pacientka podstoupila vyšetření v hematologické ambulanci pro výraznou splenomegalii. Na CT břicha byla kromě splenomegalie popsána také lymfadenopatie podél slezinných cév (největší uzlina o velikosti 13 x 21 mm lokalizována v hilu sleziny) a zmnožené retroperitoneální uzliny (obr. 1). CT hrudníku lymfadenopatii neprokázalo. Krevní obraz s diferenciálním rozpočtem byl s normálním nálezem a paraprotein v séru nebyl detekován. Nejprve jsme provedli sternální punkci, která byla morfologicky s nespecifickým nálezem, ale podle průtokové cytometrie byly zastiženy B lymfocyty (2,4 % z celku) s imunofenotypem CD19+ CD20+ CD5 - CD10 - CD38 - kappa - lambda - nejistého významu. Cytometrické vyšetření NHL přesvědčivě neprokázalo. Z tohoto důvodu jsme doplnili trepanobiopsii kostní dřeně. Histologickým vyšetřením byla zjištěna její infiltrace low-grade B-lymfomem, podle imunofenotypu splenického původu. Pomocí průtokové cytometrie z trepanobiopsie kostní dřeně byly detekovány B-lymfocyty s imunofenotypem CD19+CD20+CD22+CD23 slabě+FMC7 slabě+ CD5-CD38-kappa-lambda-. Molekulární vyšetření prokázalo klonální přestavbu IgH, IgK. Nález svědčil pro infiltraci kostní dřeně klonálními B buňkami.
Image 1. CT břicha s kontrastní látkou – venózní fáze 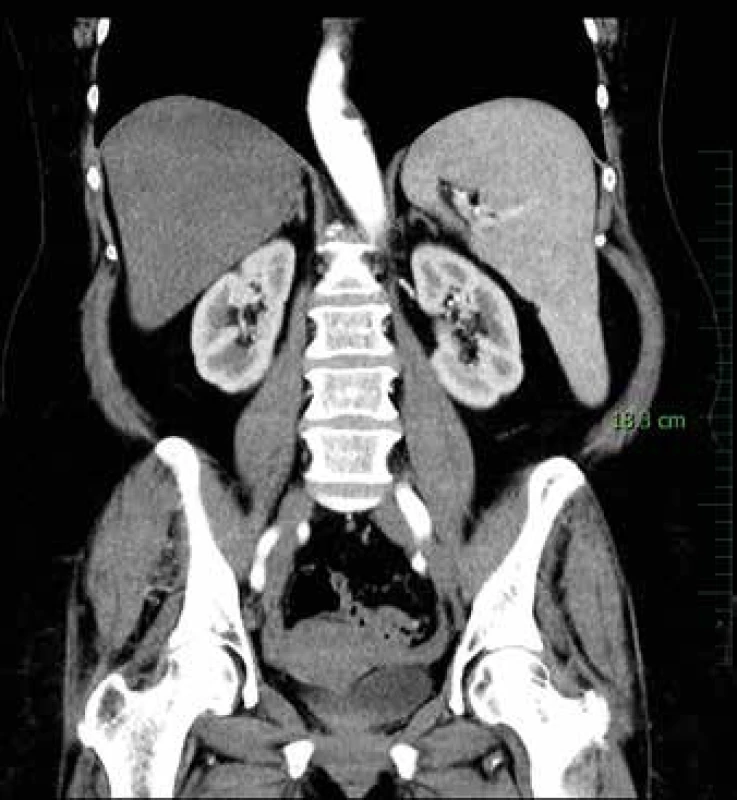
Na CT řezu v koronární rovině je patrna zvětšená slezina – v dlouhé ose 18 cm [9]. Subjektivně pacientka udávala velkou únavu, nehubla, nepotila se. S ohledem na recidivující angiodémy, nejspíše v důsledku získaného snížení C1-INH, byla indikována k léčbě lymfomu. Vzhledem k četným interním komorbiditám a v souladu s přáním pacientky nebyla provedena splenektomie. Zahájili jsme chemoterapii v kombinaci s biologickou léčbou v režimu R-COP (rituximab, cyklofosfamid, vinkristin, prednison). Tato terapie byla zvolena pro předpokládaný větší efekt kombinované léčby. Pacientka léčbu po celou dobu dobře tolerovala. Podle kontrolního CT po 6 cyklech chemoterapie již byla slezina normální velikosti a také velikost uzlin se normalizovala. Kontrolní histologické vyšetření kostní dřeně včetně vyšetření klonality a průtokové cytometrie po 6 cyklech chemoterapie neprokázalo infiltraci B - lymfomem. Nyní, 6 měsíců po ukončení léčby, je pacientka bez subjektivních obtíží a jsou plánována kontrolní CT.
Imunologické vyšetření po léčbě
Po skončení chemoterapie v září 2016 absolvovala pacientka kontrolu opět na imunologii. Angioedémy od zahájení hematologické léčby neměla a laboratorně došlo ke kompletní normalizaci laboratorních nálezů (tab. 5). Tento stav trval i při naší poslední kontrole koncem února 2017.
Table 5. Laboratorní nálezy u pacientky po léčbě lymfomu 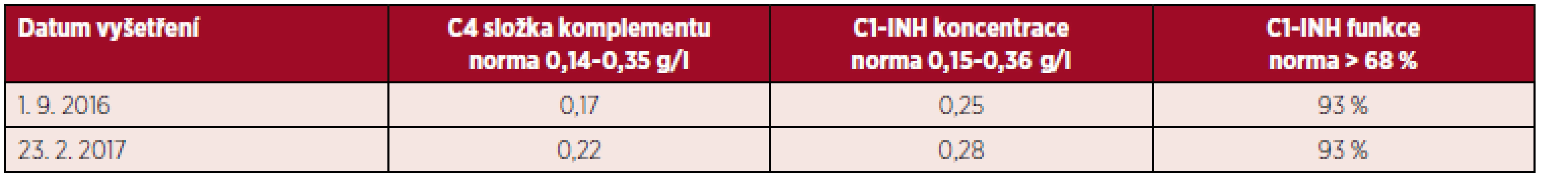
C1-INH-C1 inhibitor DISKUSE A ZÁVĚR
Získaný angioedém s deficitem C1 inhibitoru je vzácné onemocnění, které bývá velmi často asociováno s hematologickými onemocněními, zejména nádorovými. Studie publikované v zahraniční naznačují dobrý efekt léčby základního hematologického onemocnění na klinické projevy i laboratorní nálezy u pacientů s C1-INH-AAE, přičemž pravděpodobně nezáleží na konkrétní zvolené léčebné alternativě (splenektomie, monoterapie rituximabem nebo imunochemoterapie) [5, 7]. Stejný efekt jsme pozorovali i u naší pacientky. Vzhledem k tomu, že C1-INH-HAE je onemocnění potenciálně život ohrožující, je vhodné brát tuto komplikující přidruženou diagnózu také v úvahu při rozhodování o zahájení terapie hematologického onemocnění. Otázkou zůstává, zda bude efekt této léčby trvalý. Celosvětově zatím nejsou k dispozici dostatečné údaje, aby bylo možné tuto otázku spolehlivě zodpovědět.
Zajímavou skutečností popsanou v naší kazuistice je i velká variabilita laboratorních nálezů před zahájením terapie. Nicméně i tehdy, když byly koncentrace a funkce C1 inhibitoru zcela v normě, bylo prokazatelné nápadné snížení C4 složky komplementu svědčící pro konzumpční patogenezi při aktivaci klasické cesty komplementové kaskády. Tento parametr se normalizoval až po léčbě základního onemocnění.
Použité zkratky
ACE – angiotensin konvertující enzym
C1-INH – C1 inhibitor
C1-INH-AAE – získaný angioedém s deficitem C1 inhibitoru
C1-INH HAE – hereditární angioedém s deficitem C1 inhibitoru
CT – počítačová tomografie
FNM – Fakultní nemocnice v Motole
MASP – serinová protéza asociovaná s lektinem vážícím manózu
MGUS – monoklonální gamapatie nejasného významu
NHL – non-Hodgkinský lymfom
UZ – ultrazvuk
Podíl autorů na přípravě rukopisu
MS, JS –první verze textu a jeho revize
MS – imunologická problematika, úvod a závěr
JS – hematologická část
Čestné prohlášení autorů
Autorky práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Poděkování
Podpořeno MZ ČR – RVO, FN v Motole 00064203.
Doručeno do redakce dne 24. 4. 2017.
Přijato po recenzi dne 18. 5. 2017.
MUDr. Marta Sobotková
Ústav imunologie 2. LF a
FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: marta.sobotkova@fnmotol.cz
Sources
1. Hakl R, Kuklínek P. Hereditární angioedém. Postgraduální medicína 2013;1 : 86–89.
2. Kuklínek P, Hanzlíková J. Hereditární angioedém. Praha, Medical Tribune CZ, 2013; 74 s.
3. Cicardi M, Aberer W, Banerji A, et al. Classification, diagnosis, and approach to treatment for angioedema: consensus report from the Hereditary Angioedema International Working Group. Allergy 2014;5 : 602–616.
4. Zingale LC, Castelli R, Zanichelli A, Cicardi M. Acquired deficiency of the inhibitor of the first complement component: presentation, diagnosis, course, and conventional management. Immunol Allergy Clin North Am 2006;4 : 669–690.
5. Gobert D, Paule R, Ponard D, Levy P, et al. A nationwide study of acquired C1-inhibitor deficiency in France: Characteristics and treatment responses in 92 patients. Medicine (Baltimore) 2016;33:e4363.
6. Cugno M, Castelli R, Cicardi M. Angioedema due to acquired C1-inhibitor deficiency: a bridging condition between autoimmunity and lymphoproliferation. Autoimmun Rev 2008;2 : 156–159.
7. C astelli R, Wu MA, Arquati M, Zanichelli A, et al. High prevalence of splenic marginal zone lymphoma among patients with acquired C1 inhibtor deficiency. Br J Haematol 2016;6 : 902–908.
8. Castelli R, Zanichelli A, Cicardi M, Cugno M. Acquired C1-inhibitor deficiency and lymphoproliferative disorders: a tight relationship. Crit Rev Oncol Hematol 2013;87 : 323–332.
Labels
Allergology and clinical immunology Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2017 Issue 3-
All articles in this issue
- Nádor z blastických plazmocytoidních dendritických buněk: kazuistika a přehled literatury
- Cytomorfologie zralých CD5- pozitivních B-lymfoidních neoplazií
- Dlouhodobé výsledky léčby chronické myelomonocytární leukemie ve vybraných hematologických centrech
- Získaný angioedém s deficitem C1 inhibitoru u pacientky s B-lymfomem nízké malignity a efekt léčby základního onemocnění na projevy angioedému
- Idarucizumab: skúsenosti jedného centra
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Dlouhodobé výsledky léčby chronické myelomonocytární leukemie ve vybraných hematologických centrech
- Nádor z blastických plazmocytoidních dendritických buněk: kazuistika a přehled literatury
- Získaný angioedém s deficitem C1 inhibitoru u pacientky s B-lymfomem nízké malignity a efekt léčby základního onemocnění na projevy angioedému
- Cytomorfologie zralých CD5- pozitivních B-lymfoidních neoplazií
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

