-
Medical journals
- Career
Autologní transplantace kmenových buněk u Waldenströmovy makroglobulinemie
Authors: M. Kaščák 1; J. Ďuraš 1; M. Navrátil 1; R. Hájek 1,2,3
Authors‘ workplace: Klinika hematoonkologie, Fakultní nemocnice Ostrava 1; Lékařská fakulta, Ostravská univerzita, Ostrava 2; Babákova myelomová skupina, Ústav patologické fyziologie, Masarykova univerzita, Brno 3
Published in: Transfuze Hematol. dnes,22, 2016, No. 1, p. 28-38.
Category: Comprehensive Reports, Original Papers, Case Reports
Overview
Waldenströmova makroglobulinemie je vzácnou nevyléčitelnou klonální B lymfoproliferací s infiltrací kostní dřeně a IgM paraproteinemií. Klinickým průběhem se řadí k indolentním chorobám s mediánem přežití kolem 6 let. Standardními režimy první linie na bázi rituximabu je dosahováno celkových léčebných odpovědí kolem 80–90 % s mediánem délky odpovědi 3–4 roky. Vysokodávkovaná chemoterapie s autologní transplantací je účinná u pacientů s Waldenströmovou makroglobulinemií. Otázka správného načasování a výběru vhodného kandidáta autologní transplantace nebyla doposud spolehlivě zodpovězená. Neexistuje jednotný konsenzus nejvhodnějšího přípravného myeloablativního režimu. K nejčastějším patří vysokodávkovaný melfalan, kombinační režimy na bázi karmustinu nebo thiotepy a chemoterapie s celotělovým ozářením. Autologní transplantace je bezpečnou metodou s nízkou 1roční potransplantační úmrtností, obvykle nepřekračující 5 % i v populaci starších nemocných. V léčbě relapsu je pomocí transplantace dosahováno 80–90 % celkových léčebných odpovědí s kompletní remisí asi u 20 %, s mediánem trváním odpovědi 3–4 roky a mediánem celkového přežití přesahujícím 60 % po 5 letech. Autologní transplantaci je vždy vhodné zvážit u mladších pacientů v léčbě prvního chemosenzitivního relapsu s krátkým trváním remise (méně než 1–2 roky) a u skupiny vysokého rizika podle prognostického skórovacího systému. Očekávanou budoucností autologní transplantace je léčba časných stadií nemoci, v období maximální dosažené léčebné odpovědi, podobně jako je tomu dnes u mnohočetného myelomu. Práce shrnuje současný stav znalostí o použití autologní transplantace u pacientů s Waldenströmovou makroglobulinemií.
KLÍČOVÁ SLOVA:
Waldenströmova makroglobulinemie – autologní transplantace kmenových buněk – vysokodávkovaná chemoterapieÚVOD
Waldenströmova makroglobulinemie (WM) patří ke klonálním B-lymfoproliferativním onemocněním s intertrabekulární infiltrací kostní dřeně nádorovými buňkami s lymfoplazmocytární diferenciací a produkcí monoklonálního imunoglobulinu třídy IgM [1]. WM je podle konsenzu skupiny International Workshop on WM z roku 2007 samostatně definovanou klinicko-patologickou jednotkou odlišnou od dalších lymfoproliferací s produkcí IgM, jako je například lymfom marginální zóny, chronická B-lymfocytární leukemie či IgM mnohočetný myelom, které je nutné odlišit v rámci diferenciální diagnózy [2].
WM patří mezi vzácná onemocnění s incidencí 1 nemocného na 100 tisíc obyvatel [3, 4]. Častěji postihuje mužské pohlaví. Incidence stoupá s věkem s mediánem 64 let v době diagnózy. Jedna pětina diagnostikovaných je mladších než 60 let [5, 6].
Klinický obraz je mnohotvárný a je výsledkem nádorové infiltrace, vlastností paraproteinu a systémovými příznaky. V sestupném pořadí to jsou únava (70 %), anémie (40 %), B-symptomy (20-25 %), lymfadenopatie, hepatosplenomegalie, extralymfatické infiltráty (15–25 %), krvácivé projevy (20 %), neurologické projevy (20 %), hyperviskózní syndrom (15 %), Raynaudův fenomén (11 %), kryoglobulinemie (5 %), nemoc chladových aglutininů (5 %), amyloidóza (< 5 %) (7). WM má obvykle indolentní průběh s různě dlouhým bezpříznakovým obdobím a po zahájení léčby obdobími remisí a relapsů. Až tři čtvrtiny nemocných je v době diagnózy symptomatických a vyžaduje léčbu [8]. U zbylé části asymptomatických nemocných je 5leté riziko progrese až 59% [9]. Medián přežití ode dne diagnózy se pohybuje kolem 6 let [10].
WM je obvykle chemosenzitivní onemocnění reagující dobře na běžně používaná alkylační a nukleosidová cytostatika, monoklonální anti-CD 20 protilátku rituximab, proteasomové inhibitory, kortikosteroidy a jejich kombinace. Randomizované studie chybí, a proto nebyl doposud stanoven jednotný konsenzus při výběru nejvhodnější léčby. Nejpoužívanějšími režimy jsou kombinace cyklofosfamidu, dexametazonu s rituximabem (DRC), bendamustinu s rituximabem (BR), fludarabinu s rituximabem (FR) a fludarabinu, cyklofosfamidu s rituximabem (FCR). Volba režimu je individuální a řídí se biologickým stavem nemocného, přidruženými nemocemi a schopností podstoupit autologní transplantaci (AT) [11]. V léčbě relapsu jsou podobně jako v primoléčbě používané kombinace rituximabu a chemoterapie. Při výběru léčby je vhodné zohlednit klinické charakteristiky, jako je trvání léčebné odpovědi, agresivita nemoci, tolerance léčby, biologický stav léčeného a přidružené nemoci. V případě trvání předchozí léčebné odpovědi déle než 2 roky lze zvolit stejný režim jako v primoléčbě [10, 11]. V případě odpovědi kratší se volí režim alternativní [11].
První zkušenosti s AT u WM sahají do roku 1998. Formou kazuistiky byl popsán případ mladého 50letého muže neodpovídajícího na podanou konvenční chemoterapii. Jako přípravný režim byl použitý vysokodávkovaný melfalan v dávce 140 mg/m2. Po 60 dnech již nebyl paraprotein detekovatelný a po 11 měsících došlo k vymizení infiltrace kostní dřeně. Obraz kompletní remise přetrvával i 12 měsíců po provedené AT [12].
Obecně vyšší věk pacientů s WM se všemi svými komplikacemi limituje širší využití AT. Ve skupině mladších nemocných, v dobrém biologickém stavu s agresivnějším chováním nemoci a krátkým trváním léčebné odpovědi, představuje ale významnou léčebnou alternativu [11, 13].
V tomto přehledovém článku uvádíme problematiku vysokodávkované chemoterapie s autologní transplantací krvetvorných kmenových buněk u pacientů s WM.
HISTORIE AUTOLOGNÍ TRANSPLANTACE U WALDENSTRÖMOVY MAKROGLOBULINEMIE
Zatímco první AT byla provedena v roce 1989 u nemocného s chronickou myeloidní leukemií [14], u WM byla zdokumentována až v roce 1999 [12]. L. Yang et al. popsali v kazuistice případ 50letého muže nereagujícího na konvenční chemoterapii. Po přípravném režimu vysokodávkovaným melfalanem následovala restituce krvetvorby až po 5 týdnech. Opožděná restituce krvetvorby naznačuje, že se jednalo o neúčinný převod autotransplantátu. Nicméně léčba vedla ke kompletní remisi trvající přes 12 měsíců [12].
Ve stejném roce následovala pilotní studie 6 nemocných. Čtyři z nich byli transplantováni v situaci relapsu, zbylí dva po minimální indukční léčbě. Přípravným režimem byl vysokodávkovaný melfalan a v jednom případě jeho kombinace s celotělovým ozářením a v jednom případě tandemovou transplantací. Studie demonstrovala bezpečnost metody s rychlou restitucí krvetvorby (medián 11 dní), zvládnutelnou toxicitu a účinnost v podobě jedné kompletní remise a zbytku parciálních odpovědí [15].
Mezi roky 2001–2005 byly publikovány výsledky léčby 32 pacientů s WM léčených AT. Ve třech transplantačních centrech byly použity různé přípravné režimy jako vysokodávkovaný melfalan samotný a jeho kombinace s celotělovým ozářením, tandemová transplantace za použití vysokodávkovaného melfalanu, režim BEAM – karmustin, etoposid, cytarabin a melfalan. Bylo zaznamenáno jedno časné úmrtí. Léčebná odpověď byla dosažená u všech pacientů s 34% zastoupením kompletních remisí (11/32 pacientů) [16–18].
Tyto první zkušenosti s AT u pacientů s WM nastínily její bezpečnost a zvládnutelnou časnou toxicitu a vedly k dalším hlavně retrospektivním studiím z registrů kooperativních skupin. Podrobněji o nich pojednává následující část textu o studiích u nově diagnostikovaných a v léčbě relapsu.
MOBILIZACE A SEPARACE PERIFERNÍCH KMENOVÝCH BUNĚK
Základem úspěšného a bezpečného průběhu AT je sběr dostatečného množství progenitorových krvetvorných kmenových buněk (KB), potřebných pro kompletní a rychlé obnovení funkce kostní dřeně po myeloablativní chemoterapii. U AT je prokázaná souvislost mezi dávkou CD34+ buněk a rychlostí přihojení štěpu. Toto minimální množství je definováno počtem 2 x 106 CD34+ buněk na kg tělesné hmotnosti [19, 20]. Preferovaným zdrojem kmenových buněk je periferní krev před kostní dření [21]. Co se týče výběru mobilizačního (stimulačního) režimu, tady chybí jednotný konsenzus. Pro mobilizaci buněk lze použít kombinaci chemoterapie a granulocyty stimulující růstové faktory (G-CSF), nebo aplikaci samostatných růstových faktorů. K nejčastěji využívaným patří kombinace cyklofosfamidu v dávkách od 1,5 g/m2 po 6 g/m2 s následnou aplikací G-CSF v dávkách od 5 do 15 µg/kg/den [22]. Přidání chemoterapie v rámci mobilizace zvyšuje výtěžnost separace CD34+ buněk, ale za cenu zvýšeného výskytu febrilních neutropenií 25–75 % [23, 24].
Úspěšnost sběru KB je nepřímo ovlivněná počtem předchozích linií léčby a typem použitého léčebného režimu (tab. 1). Režimy obsahující nukleosidová cytostatika, jako je fludarabin, kladribin nebo alkylační cytostatikum chlorambucil, zejména při jeho dlouhodobém podávání, mají potenciál zhoršit separaci KB [11]. Je proto vhodné u možných kandidátů AT volit režimy neobsahující tato cytostatika a separaci provést včas. Ve studii Kyriakou et al. (2010) zkoumající AT v léčbě relapsu WM bylo nutné provést dva a více mobilizačních pokusů až u třetiny léčených [25]. Jedním z hlavních důvodů byla předchozí léčba fludarabinem a tento negativní efekt na mobilizaci byl popsán i v dalších studiích pacientů s WM [15, 26]. V přehledném článku Gertze et al. byl navržen koncept časné separace KB po první dosažené léčebné odpovědi a v době nejmenšího nádorového postižení, což může snížit počet mobilizačních pokusů [27].Přidání plerixaforu, parciálního agonisty chemokinového receptoru CXCR4, v kombinaci s G-CSF vede k výraznému zvýšení výtěžnosti separace CD34+ buněk [28]. Tento postup může pomoct v situacích obtížně mobilizovatelných pacientů.
Table 1. Vliv léčebných režimů na sběr KB podle doporučení National Comprehensive Cancer Network pro léčbu WM z roku 2015 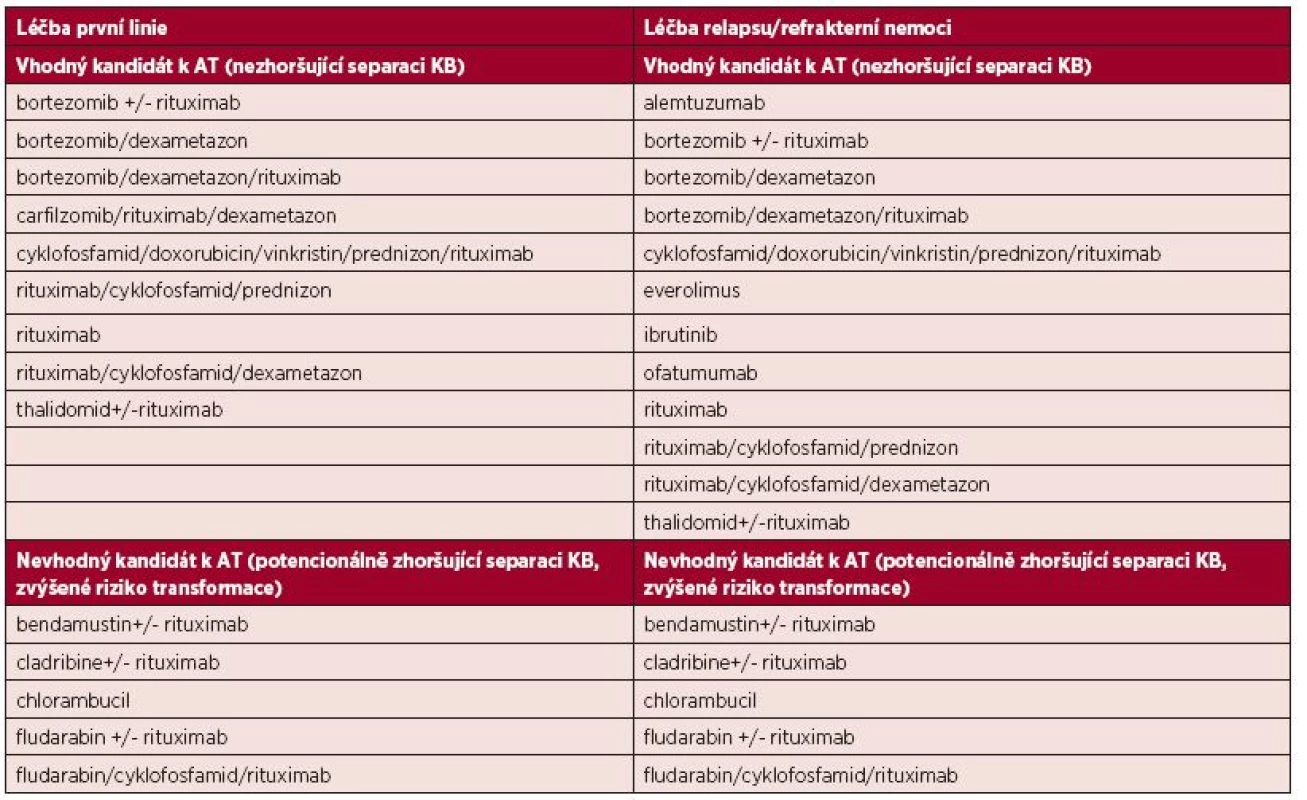
KB – krvetvorné kmenové buňky, AT – autologní transplantace VYSOKODÁVKOVANÁ CHEMOTERAPIE (MYELOABLATIVNÍ REŽIMY) U WALDENSTRÖMOVY MAKROGLOBULINEMIE
Koncept vysokodávkované chemoterapie je založen na principu léčebné odpovědi závislé na dávce. Subletálními dávkami chemoterapie či radioterapie tak lze překonat nepříznivé biologické chování nemoci.
Zatímco postavení vysokodávkované léčby s autologní transplantací v léčbě jednotlivých krevních nádorů je relativně dobře definováno na základě randomizovaných klinických studií, méně přehledná situace je při výběru přípravných myeloablativních režimů. Neexistuje klinická studie zkoumající účinnost a toxicitu jednotlivých myeloablativních režimů u pacientů s WM. V léčbě WM se používá chemoterapie, celotělové ozáření (TBI) a jejich kombinace. Často využívanými režimy jsou melfalan 100–200 mg/m2, BEAM (carmustin, cytarabin, etoposid, melfalan), cyklofosfamid (CY) a CY s TBI [25, 29].
Vysokodávkovaný melfalan definovaný myeloablativní dávkou (> 150 mg/m2) patří mezi nejčastěji používané přípravné režimy AT a používá se i v léčbě WM [30]. Na základě zkušeností u mnohočetného myelomu je hlavní pozorovanou nehematologickou toxicitou režimu mukozitida zažívacího traktu [31]. Intermediární dávky melfalanu (100 mg/m2) v porovnání s vysokými (200 mg/m2) jsou sice zatížené nižší gastrointestinální toxicitou, ale za cenu kratšího bezpříznakového období při porovnatelné potransplantační úmrtnosti (2,9 vs. 3,1 %) [31].
Hlavní cestou eliminace melfalanu jsou ledviny, a proto je renální insuficience nejvýznamnějším rizikovým faktorem pro rozvoj mukozitidy, nicméně při úpravě dávek na aktuální renální funkce je možné léčit i pacienty s terminálním ledvinovým selháním v dialyzačním programu bez zásadně vyšší toxicity [32].
Dalším přípravným režimem běžně využívaným v léčbě WM je režim BEAM (karmustin, etoposid, cytosinarabinosid, melfalan v dávce 140 mg/m2). Mukozitida je prakticky univerzální toxicitou tohoto režimu vyžadující často tlumení bolesti opiáty a parenterální výživu [33]. S podpůrnou terapií je potransplantační mortalita obvykle nízká a nepřekračuje 5 % v neselektované populaci pacientů s non-Hodgkinskými lymfomy [33].
Ve studii z registru EBMT (European Blood and Marrow Transplantation), publikované v roce 2010, zkoumající autologní transplantaci u 158 nemocných s WM mezi lety 1999–2005, byl u téměř poloviny léčených použit režim BEAM, u třetiny režimy založené na TBI. Rozdíly v toxicitě jednotlivých režimů nebyly popsány. Potransplantační mortalita (Non-Relaps Mortality – NRM) byla celkově nízká, kumulativně 3,8 % v 1. roce. Je porovnatelná s NRM ve studiích s vysokodávkovaným melfalanem a režimem BEAM v léčbě mnohočetného myelomu a non-Hodgkinských lymfomů [25, 31, 33]. V další ze studií z registru EBMT hodnotící výsledky od 201 pacientů byly jako přípravné režimy použity režim BEAM u 44 %, CY nebo melfalan spolu s TBI u 28 %, vysokodávkovaný melfalan u 4 % a jiné protokoly u 14 % případů. [29].
Závěrem otázka nejvhodnějšího přípravného režimu nebyla doposud zodpovězena, a proto je výběr myeloablativního režimu v kompetenci transplantačního centra podle jeho preferencí a zkušeností (tab. 2).
Table 2. Souhrnné výsledky vybraných retrospektivních studií a analýz z pohledu přípravného režimu 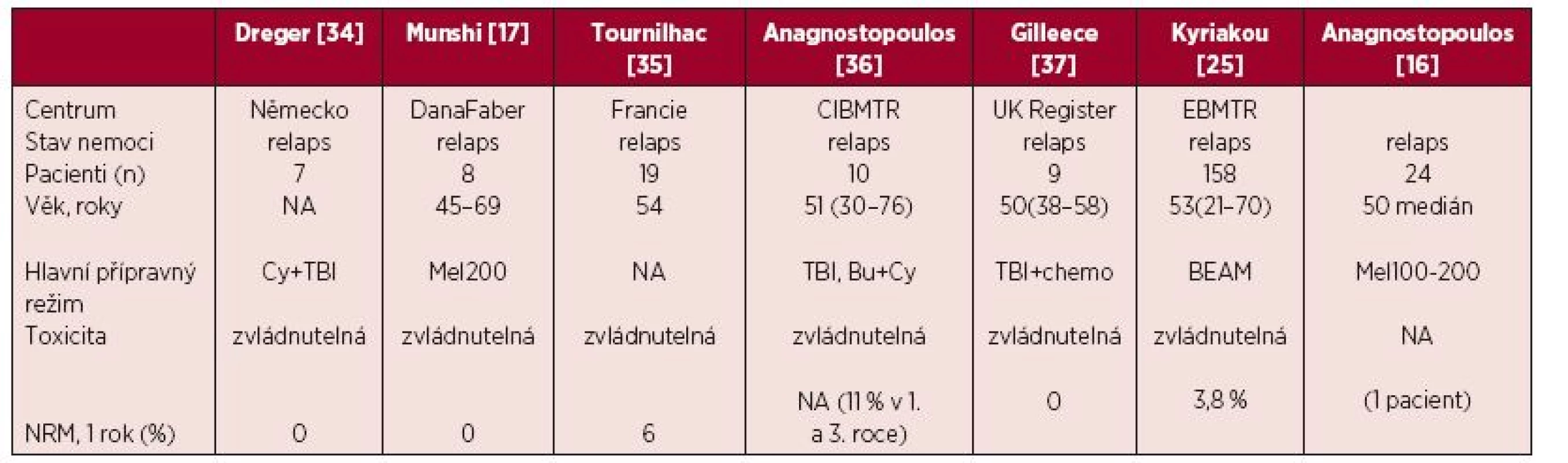
NA – neurčeno, Cy – cyklofosfamid, TBI – celotělové ozáření, Mel200 – melfalan 200 mg/m2, Bu + Cy – busulfan, cyklofosfamid, BEAM – karmustin, etoposid, cytosinarabinosid, melfalan v dávce 140 mg/m2, Mel100 – melfalan 100 mg/m2, NRM – potransplantační mortalita AUTOLOGNÍ TRANSPLANTACE V LÉČBĚ RELAPSU WALDENSTRÖMOVY MAKROGLOBULINEMIE
Doposud nebyly publikovány žádné prospektivní randomizované studie ozřejmující roli AT v léčbě nemocných s relabovanou či refrakterní WM. Nejrobustnější údaje jsou k dispozici z nadnárodních transplantačních registrů a registrů kooperativních skupin. Jedná se o retrospektivní data.
Bezpečnost vysokodávkované terapie v léčbě relapsu demonstrovala pilotní studie z roku 1999, Desikan et al. [15]. Šest pacientů (4 v situaci relapsu, 2 po minimální indukční léčbě) podstoupilo myeloablativní chemoterapii s přípravným režimem melfalan v dávce 140–200 mg/m2, z toho jeden tandemovou transplantaci a jeden celotělové ozáření. Pozorovaná potransplantační úmrtnost byla nulová a nehematologická toxicita stupně tři a čtyři byla přechodná a zvládnutelná. Všichni pacienti odpověděli na léčbu a nejdelší období remise trvalo přes 52 měsíců.
Ve stejném roce byla Dragerem publikována studie s přípravným režimem cyklofosfamid kombinovaným s TBI a podporou pomocí purifikovaného štěpu s deplecí B lymfocytů. Přes purifikaci transplantátu nebyly pozorované výsledky lepší než v předchozí práci [34].
V malé studii z roku 2001 podstoupilo transplantaci pět pacientů, čtyři pacienti s refrakterním relapsem a jeden pacient s primárně refrakterní nemocí. V prvních 100 dnech bylo zaznamenáno jedno časné úmrtí na cerebrovaskulární příčinu. Jeden pacient umřel v odstupu 37 měsíců po AT na sekundární akutní leukemii, zbylí dva pacienti byli v parciální remisi 20 a 96 měsíců po transplantaci [16]. Ve studii z roku 2003 celkem osm pacientů absolvovalo AT s přípravným režimem melfalan 140–200 mg/m2, ve dvou případech tandemově. Bylo dosaženo sedm parciálních (PR) a jedna kompletní remise (CR) s trváním odpovědi od 6 do 77 měsíců [17].
Ve vybraných 8 největších pracích publikovaných mezi roky 2002–2010 podstoupilo AT celkem 461 pacientů [17, 25, 29, 35–39]. Medián věku se pohyboval mezi 50–57 roky a nejstaršímu pacientovi bylo v době transplantace 76 let [36]. Transplantace nejčastěji následovala po 2 předchozích liniích léčby [17, 25, 29, 35–39] a medián doby od stanovení diagnózy do transplantace byl od 18 do 29 měsíců [25, 29, 38]. Převážná část pacientů byla transplantována v chemosenzitivní fázi nemoci [17, 25, 29, 35–39], minimálně 41–93 % odpovědělo na poslední linii léčby před AT [25, 38]. Nejčastějšími přípravnými režimy chemoterapie byly vysokodávkovaný melfalan a režim BEAM, dále kombinace celotělového ozáření (TBI) s cyklofosfamidem nebo melfalanem nebo samotné TBI [17, 25, 29, 39]. Preferovaným zdrojem kmenových buněk byla periferní krev [17, 25, 29, 35–39]. Hematologická toxicita byla zvládnutelná bez popsaného selhání přihojení štěpu [17, 25, 29, 35–39] s výjimkou popsaných případů opožděného přihojení u pacientů léčených fludarabinem v předchozí léčbě [17, 25]. Kritéria definující toxicitu AT nejsou ve studiích jednotná. Potransplantační mortalita byla 0–12,5 %, přičemž v nejreprezentativnějších studiích byla 3,8–6 % [17, 25, 29, 35, 37–39].
V uvedených pracích bylo pomocí AT dosaženo 87–100 % léčebných odpovědí [17, 25, 35, 38], se zastoupením 12–22 % kompletních remisí [17, 25]. Přežití bez progrese (PFS) po 3 letech bylo 54–65% [29, 36] a 33–40 % po 5 letech [25, 29]. Celkové přežití (OS) po 3 letech bylo 70–75% [29, 36] a 58–68% po 5 letech [25, 29, 39]. Pravděpodobnost relapsu po 5 letech byla pořád vysoká 52–55 % [25, 29] – tabulka 3.
Table 3. Výčet vybraných studií s použitím autologní transplantace v léčbě relapsu WM 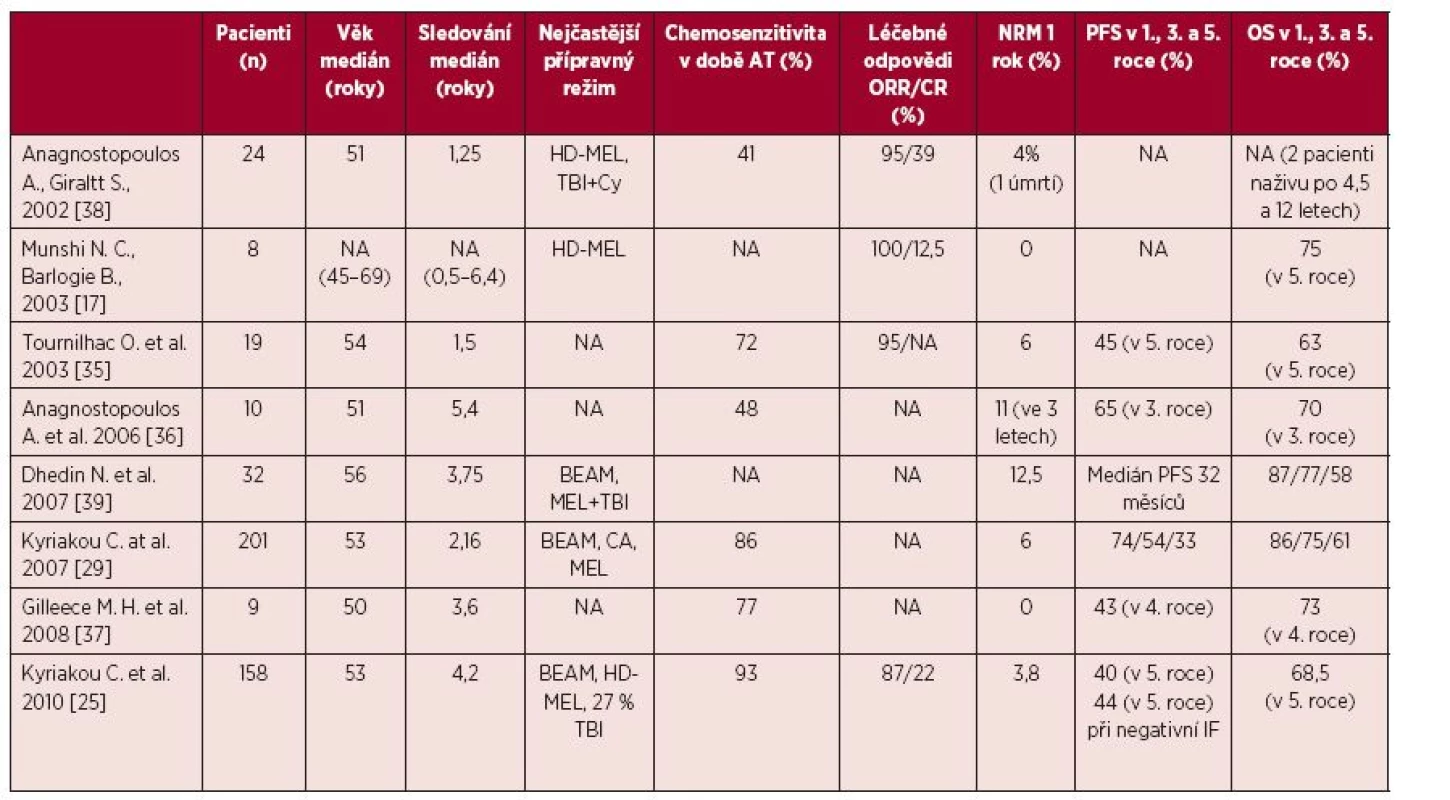
NA – neurčeno, Cy – cyklofosfamid, TBI – celotělové ozáření, HD-MEL – melfalan, Bu + Cy – busulfan, cyklofosfamid, BEAM – karmustin, etoposid, cytosinarabinosid, melfalan v dávce 140 mg/m2, Mel100 – melfalan 100 mg/m2, NRM – potransplantační mortalita, PFS – bezpříznakové přežití, OS – celkové přežití, IF – imunofixace Informace ze dvou největších studií z transplantačních registrů European Group for Blood and Marrow Transplantation (EBMT) z roku 2007 a 2010 přináší reálný pohled na AT v léčbě relapsu WM [25, 29].
Do retrospektivní analýzy z roku 2007 bylo zařazeno 201 pacientů s mediánem věku 53 let po 2 předchozích liniích léčby [29]. Většina měla v době transplantace chemosenzitivní nemoc. Jenom u 14 % byla AT provedená ve stadiu relapsu či refrakterní nemoci. Z přípravných režimů byl nejčastěji použitý režim BEAM, CY a MEL s TBI. Nejčastějším zdrojem štěpu byly periferní kmenové buňky. Úmrtnost na toxicitu přípravného režimu v prvním roce dosáhla 6 %. Medián sledování byl 26 měsíců. Pětina pacientů zemřela na progresi nemoci. Přežití bez progrese v 1., 3. a 5. roce bylo 74 %, 54 % a 33 % a celkové přežití po 5 letech 61 %.
Druhá analýza z roku 2010 zahrnuje 158 pacientů transplantovaných mezi roky 1991–2005 [25]. Medián věku pacientů byl 53 let. Třetina pacientů byla po 3 a více liniích léčby a 7 % bylo v době transplantace chemorezistentních k dosavadní léčbě. Až 93 % pacientů mělo chemosenzitivní nemoc. Z myeloablativních režimů byl nejčastěji použit režim BEAM u poloviny léčených, u třetiny byla provedeno TBI. Pozorovaná NRM byla nízká, a to 3,8 % v prvním roce. Hlavním nezávislým prediktorem NRM byl špatný biologický stav. Sekundární malignity (SM) vznikly celkem u deseti nemocných, jedna akutní myeloidní leukemie, 4 myelodysplastické syndromy, 1 melanom, 1 malobuněčný karcinom plic a další 2 solidní nádory. Kumulativní incidence SM byla 8,4% po 5 letech. Pro tři z nich byla SM hlavní příčinou úmrtí. Jediným nezávislým faktorem vzniku SM byla předchozí léčba fludarabinovými režimy. Celková léčebná odpověď dosáhla 87 % s vysokým zastoupením CR 22 % a 50 % velmi dobrých parciálních remisí (VGPR). Maximální efekt léčby se dostavil rychle v období 3 měsíců. Medián sledování byl 4,2 roku. V období publikace bylo naživu až 68 % nemocných, PFS bylo 61 % a 40 % po 3 letech a 5 letech. Nemocní, kteří dosáhli po AT kompletní remise s negativní imunofixací, měli daleko lepší PFS, až 71 % po 5 letech. V multivariační analýze bylo zjištěno výrazně horší PFS a OS u nemocných po více než 3 předchozích liniích léčby a v případě transplantace chemorezistentní nemoci.
Autologní transplantace u nově diagnostikované Waldenströmovy makroglobulinemie
Pozitivní výsledky dosažené autologní transplantací v léčbě relapsu pacientů s WM odstartovaly pilotní studie zkoumající její využití v časnějších fázích onemocnění. Je nutné upozornit, že studované soubory byly malé a doba sledování krátká [26, 40].
První studie z roku 2007 sledovala 12 mladých pa-cientů s mediánem 49 let, autologně transplantovaných po krátké indukční léčbě [40]. Čtyři pacienti absolvovali mobilizaci režimem dexametazon-BEAM, zbylých osm krátkou indukcí režimy CHOP, R-CHOP, nebo monoterapii chlorambucilem a fludarabinem, následovanou mobilizací. Myeloablativní léčba radiochemoterapií proběhla bez komplikací a u 5 pacientů následovala reinfuze purifikovaných štěpů s deplecí B lymfocytů. U dvou z devíti léčených bylo dosaženo negativní imunofixace, nicméně při mediánu sledování 69 měsíců nastal relaps u 6 pacientů. Medián doby do znovu zahájení léčby byl 82 měsíců.
Druhou studií zkoumající otázku AT v konsolidaci po indukční léčbě je studie Caravita et al. z roku 2009 [26]. Pět pacientů s mediánem 53 let podstoupilo indukční léčbu 3 cykly režimem R-CHOP a mobilizací pomocí cyklofosfamidu. Konsolidace vysokodávkovaným melfalanem provázela zvládnutelná toxicita bez úmrtí. Léčba vedla k dlouhodobé parciální remisi bez nutnosti znovu zahájení terapie po mediánu 66 měsíců sledování.
Podrobnější analýza subpopulace transplantovaných v první velmi dobré parciální remisi či první parciální remisi v retrospektivní studii Kyriakou et al. (2010) ukazuje lepší PFS a OS. Bezpříznakové období a celkové přežití po pěti letech bylo 51% a 77% v porovnání s výsledky v celé skupině s PSF 41% a OS 68%. [25].
Na posledním 8. ročníku mezinárodního workshopu Waldenströmovy makroglobulinemie IWWM 2014 v Londýně byly prezentovány aktualizované retrospektivní výsledky z transplantačního registru EBMT od 615 pacientů s WM po AT. Výsledky naznačují delší PFS a nižší výskyt relapsů u časně transplantovaných ve stadiu maximální dosažené léčebné odpovědi [41].
Existují obavy pozdní toxicity v podobě zvýšené incidence sekundárních malignit a doposud nezodpovězené otázky načasování a výběru vhodných kandidátů. Bude proto potřeba dalších studií s delším obdobím sledování.
POROVNÁNÍ VYSOKODÁVKOVANÉ CHEMOTERAPIE S AUTOLOGNÍ TRANSPLANTACÍ S KONVENČNÍ LÉČBOU
Přímé srovnání standardní léčby s AT v časných stadiích WM nebylo doposud publikováno. Možné je jenom nepřímé srovnání výsledků konvenční léčby s výsledky prací zkoumající AT. WM se obecně vyznačuje dobrou chemosenzitivitou. Širokou skupinou režimů kombinací rituximabu a alkylačních cytostatik, rituximabu a alkylačního cytostatika s antracyklinem, rituximabu a proteasomového inhibitoru nebo thalidomidu lze v první linii léčby dosáhnout 70–90 % léčebných odpovědí [42–46].
Málo toxickým a velmi dobře tolerovaným indukčním režimem kombinací rituximabu, cyklofosfamidu a dexametazonu (DRC) lze navodit až 83 % celkových léčebných odpovědí a 7 % CR [43]. V roce 2012 byla aktualizovaná studie hodnotící režim DRC. Při mediánu sledování více než 6 let byl medián PFS 35 měsíců a medián doby do další léčby 51 měsíců. Medián celkového přežití byl 95 měsíců a přežití s výjimkou jiných příčin jako progrese WM či komplikace léčby dokonce 104 měsíců [47].
Dalším příkladem vysoce aktivního indukčního režimu je bendamustin, rituximab (BR). Dlouhodobé trvání remisí demonstrovala studie Rummela et al. v roce 2013, kde při mediánu sledování 45 měsíců bylo dosaženo signifikantně vyššího mediánu PFS v ramenu BR v trvání 69,5 měsíce, v porovnání s 28,5 měsíci v ramenu R-CHOP [48].
Tyto výsledky podtrhuje konsenzus IWWM-7 z roku 2014, podle kterého je preferovaným indukčním režimem DRC, v situacích většího nádorového postižení, režim BR. Původní antracyklinové režimy jako R-CHOP (rituximab, cyklofosfamid, doxorubicin, vincristin a prednizon) a fludarabinové režimy jako je FR (fludarabin, rituximab) nebo F-CR (fludarabin, cyklofosfamid, rituximab) nejsou z důvodu vyšší toxicity doporučenými režimy první linie [49].
Ve studii Drager, Schmitz z roku 2007 zkoumající roli AT v konsolidaci po krátké indukční léčbě byl medián PFS 69 měsíců, což je prakticky identický výsledek dosažený režimem bendamustin, rituximab při PFS 69,5 měsíce ve studii Rummel et al. 2013 [40, 48].
Nicméně existují důkazy z retrospektivních analýz, že zařazení AT časněji do léčby WM může být prospěšné. Ve skupině pacientů transplantovaných v první velmi dobré parciální remisi či první parciální remisi bylo dosaženo lepší PFS i OS v 5 letech, ve srovnání s celou skupinou transplantovanou převážně v období relapsu (51 % a 77 % versus 41 % a 68 %) [25]. Předběžné výsledky z registru EBMT, prezentovaných na 8. ročníku mezinárodního workshopu IWWM v Londýně v roce 2014, naznačují lepší PFS a nižší výskyt relapsů u nemocných transplantovaných časně ve stadiu první maximální dosažené léčebné odpovědi [41].
Lze polemizovat o budoucí roli AT v konsolidaci po nejlepší dosažené odpovědi indukční léčby, podobně jako je tomu dnes u mnohočetného myelomu. Nicméně tato otázka nebyla doposud vyjasněná, a proto ji lze zvažovat jenom v rámci kontrolovaných klinických studií.
Odlišná situace je v léčbě relabované WM. Většina nemocných v průběhu své nemoci zažije nevyhnutně relaps a vyžádá si další léčbu. Léčba se řídí délkou předchozí léčebné odpovědi, agresivitou nemoci, předchozím použitým režimem. Obecně probíhá léčba alternativních chemoimunoterapií na bázi anti-CD 20 protilátky rituximabu [49]. V případě, kdy bylo trvání předchozí léčebné odpovědi více než 12 měsíců, lze zopakovat režim původní. Toto doporučení podporují výsledky studie Dimpoulos et al. z roku 2007 [47].
Obecně jsou dosažené výsledky léčby relapsu horší, s nižším zastoupením remisí, PFS bývá typicky kratší, přesto u mnohých pacientů s trváním i několika let. Příkladem je využití bortezomibu v léčbě relapsu s celkovými léčebnými odpověďmi dosahujícími 60 % při použití v monoterapii a 70–80 % v kombinaci s rituximabem [50].
Možnosti záchranné léčby kombinací bortezomibu s rituximabem demonstrují výsledky studie fáze 2. Parciální remisi dosáhlo 9 z 10 pacientů s relabovaným WM a léčebná odpověď u 4 z nich přetrvávala přes 2 roky [51]. Dalším příkladem je léčba založená na bendamustinu, která je vysoce účinná. U 30 léčených byla celková léčebná odpověď 83,3 % s 5 VGPR a 20 PR s mediánem PFS 13 měsíců [52].
Novinkou v léčbě je ibrutinib – inhibitor Brutonovy tyrosinkinázy – schválený v USA i Evropě v roce 2015 pro léčbu relapsu i v primoléčbě. V historii WM se jedná vůbec o první schválené léčivo přímo pro tuto diagnózu. V registrační studii Treon et al. (2015) bylo monoterapií ibrutinibem dosaženo až 90,5 % celkových léčebných odpovědí s odhadovanou dvouletou PFS 69,1 % a celkovým přežitím 95,2 % [53].
Potenciál navodit hluboké a trvalé léčebné odpovědi s cílem překonat nepříznivý vývoj relapsu WM pomocí vysokodávkované léčby byl studován v několika retrospektivních studiích [15, 17, 25, 34, 36, 38]. Značná část léčených byla po několika liniích léčby nebo s nemocí rezistentní k poslední terapii, přesto se dosažené léčebné odpovědi pohybovaly mezi 80–90 % se zastoupením v CR, kolem 20 %, pětiletým PFS mezi 40 % a 100 % a OS mezi 70–100 %. Při 1roční NRM kolem 5 % a nepřekračující obvykle 10 % a předpokládaném mediánu bezpříznakového přežití kolem 3,5–4 let v publikovaných studiích. AT lze považovat za přiměřeně bezpečnou a účinnou metodu v léčbě relapsu v porovnání se standardní léčbou.
POSTAVENÍ AUTOLOGNÍ TRANSPLANTACE V DOPORUČENÝCH LÉČEBNÝCH POSTUPECH A MOŽNÝ POTENCIÁL S OHLEDEM NA NOVÉ LÉČEBNÉ MOŽNOSTI
WM je indolentní lymfoproliferativní nemoc s přežitím v horizontu let, a proto je hlavním cílem léčby navodit dlouhodobou remisi s úlevou od symptomů. Prognóza jednotlivých nemocných se ale může výrazně lišit. Je důležité identifikovat jednotlivce, u kterých lze očekávat výrazně horší přežití při léčbě imunochemoterapií a nabídnout jim alternativní léčebnou strategii. Pro tyto účely slouží mezinárodní prognostický skórovací systém IPSSWM (International Prognostic Scoring System for WM) a hladina laktát dehydrogenázy (LDH) [54] – tabulka 4.
Table 4. International Prognostic Index (ISSWM) [54] ![International Prognostic Index (ISSWM) [54]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/c7bd0352b9a94fb6aef7e123c1af27fc.jpg)
Hgb – hemoglobin, Beta-2MG – beta-2-mikroglobulin Skupina nemocných s vysokým rizikem dle IPSSWM a zvýšenou hladinou LDH má s konvenční léčbou výrazně horší prognózu s odhadovaným mediánem přežití méně než 2 roky [55].
V přehledném článku zkoumajícím otázku transplantace u WM byl navržen algoritmus založený na rizikové stratifikaci podle IPSSWM a LDH a klinickém chovaní nemoci. AT doporučují autoři v léčbě chemosenzitivního relapsu u nemocných s nízkým IPSSWM při trvání první remise méně než 2 roky, dále ve skupině se středním a vysokým rizikem podle IPSSWM po méně než třech liniích předchozí léčby [56].
Konsenzuální evropské doporučení ESMO z roku 2013 i doporučení Britské skupiny z r. 2014 prezentují AT jako validní alternativu léčby chemosenzitivního relapsu agresivně probíhajících případů [11, 57].
V nejnovějších doporučeních IWWM-7 z roku 2014 není postavení AT jasně definováno a chybí její zakomponování do léčebné strategie. Je navrženou alternativou k jiné záchranné léčbě u vybraných pacientů s chemosenzitivním relapsem ne více než po 3 liniích léčby, případně jako součást primární léčby u vybraných nemocných s vysokým rizikem podle IPSSWM a zvýšeným LDH [11].
V roce 2014 vypracovala Česká myelomová skupina ve spolupráci s Kooperativní lymfomovou skupinou první jednotné doporučení léčby WM. AT je doporučována v léčbě chemosenzitivního relapsu u mladších nemocných v dobrém klinickém stavu s krátkou dobou trvání první remise (méně než 2 roky) [58].
Doporučení skupiny National Comprehensive Cancer Network (NCCN) pro rok 2015 uvádí AT jenom jako jednu z možností v léčbě relapsu WM u vybraných nemocných. Nicméně celý koncept doporučení NCCN klade velký důraz na takový výběr iniciální léčby, který není potencionálně toxický pro krevní kmenové buňky a který by mohl negativně ovlivnit budoucí separaci kmenových buněk.
ZÁVĚR
Vysokodávkovaná chemoterapie s autologní transplantací je proveditelnou metodou i u nemocných s Waldenströmovou makroglobulinemií, typicky u pacientů vyššího věku s velmi nízkou potransplantační mortalitou. I přes chybějící potenciál AT vyléčit toto indolentní lymfoproliferativní onemocnění lze jejím použitím dosáhnout v léčbě relapsu dlouhodobých léčebných odpovědí s očekávaným trváním 3–4 let. Konvenční záchranná chemoterapie nepřináší vždy dostatečně dlouhé období remise a také není bez přidružené toxicity a komplikací. Výsledky jsou obzvlášť nepříznivé ve skupině vysoce rizikových nemocných podle skórovacího systému IPSSWM. Vysoké riziko dle IPSSWM a zvýšená hladina laktát dehydrogenázy pomáhají identifikovat rizikového nemocného s obzvlášť nepříznivou prognózou. To je cílová skupina, kde jsou nutné alternativní léčebné postupy, jakou je i autologní transplantace. Posledních několik let přineslo ohromné poznatky o biologii této nemoci, což se odrazilo v souboru nových účinných léků. Ty jsou ale mnohokrát dostupné jenom v rámci klinických studií. Naproti tomu je vysokodávkovaná chemoterapie s autologní transplantací okamžitě dostupnou alternativou. Obecně horší výsledky lze očekávat u pacientů s chemorezistentní nemocí, významně předléčených po více než třech liniích léčby a v horším biologickém stavu. V takových situacích je nutné přísně zvážit její indikaci. V případě, že je AT zvažována jako druhá linie léčby, je výběr chemoimunoterapie první linie zásadní. Je důležité vyvarovat se režimů typicky zhoršujícím mobilizaci periferních kmenových buněk, což vede nejenom k obtížnější a nákladnější mobilizaci, ale i k prokazatelně vyššímu výskytu oddálené toxicity v podobě sekundárních malignit. Zajímavou alternativou je kolekce a kryokonzervace periferních kmenových buněk bezprostředně po první dosažené remisi nemoci, podobně jako je tomu u mnohočetného myelomu.
Delší bezpříznakové období a nižší riziko relapsu pozorované v registrech EBMT u pacientů transplantovaných při první nejlepší dosažené odpovědi naznačují možnou budoucnost autologní transplantace. Podobně jako je tomu u příbuzných monoklonálních gamapatií – posun do role konsolidace u vybraných pacientů. V pozadí nových léků se stává role autologní transplantace ještě méně přehlednou. Zda získá své místo v roli konsolidace v časných fázích léčby nebo zůstane na místě záchranné léčby, o tom rozhodnou až další studie. Je možné hledat analogii u jiných podobných gamapatií, např. mnohočetného myelomu. Zde je v éře dostupnosti mimořádně účinných nových léků zpochybňována role AT, k čemuž bylo iniciováno několik randomizovaných klinických studií fáze III. Avšak ani v jedné se doposud nepodařilo prokázat, že by provedení AT nebylo v primoléčbě přínosem. Jde o bezpečnou a především krátkodobou a intenzivní léčebnou metodu, jejíž NRM je ve vyspělých centrech pod 1 %. Je možné se oprávněně domnívat, že indikace AT u WM v primoléčbě by mohla být podobně přínosná. O její bezpečnosti nepochybujeme. Velmi důležitá je aktivní mezinárodní spolupráce, zapojovaní se do společných registrů a léčba pacientů v rámci klinických studií s cílem zlepšit znalosti o této raritní nemoci.
Podíl autorů na přípravě rukopisu
MK – napsání rukopisu
JĎ, MN, RH – revize rukopisu
Poděkování
Autoři děkují paní Mgr. Ivaně Klvaňové (Gymnázium a Střední průmyslová škola elektrotechniky a informatiky, Frenštát pod Radhoštěm, příspěvková organizace) za jazykovou korekci textu. Tato práce vznikla za přispění Ministerstva zdravotnictví ČR pod grantovým číslem RVO – FNOs/2015.
Čestné prohlášení autorů
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Doručeno do redakce dne 15. 8. 2015.
Přijato po recenzi dne 21. 9. 2015.
prof. MUDr. Roman Hájek, CSc.
Klinika hematoonkologie
Fakultní nemocnice Ostrava
17. listopadu 1790
708 52 Ostrava - Poruba
e-mail: roman.hajek@fno.cz
Sources
1. Owen RG, Treon SP, Al-Katib A, et al. Clinicopathological definition of Waldenstrom’s macroglobulinemia: consensus panel recommenda-tions from the Second International Workshop on Waldenstrom’s Macroglobulinemia. Semin Oncol 2003; 30 : 110–115.
2. Swerdlow S. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues, 4th ed. International Agency for Research on Cancer: Lyon, France, 2008, p. 194.
3. Groves FD, Travis LB, Devesa SS, et al. Waldenström’s macroglobulinemia: incidence patterns in the United States, 1988–1994. Cancer 1998; 82 : 1078–1081.
4. Phekoo KJ, Jack RH, Davies E, et al. The incidence and survival of Waldenström’s macroglobulinaemia in South East England. Leuk Res 2008; 32 : 55–59.
5. Ghobrial IM, Fonseca R, Gertz MA, et al. Prognostic model for disease-specific and overall mortality in newly diagnosed symptomatic patients with Waldenstrom macroglobulinaemia. Br J Haematol 2006; 133 : 158–164.
6. Wang H, Chen Y, Li F, et al. Temporal and geographic variations of Waldenstrom macroglobulinemia incidence: a large population-based study. Cancer 2012; 118 : 3793–3800.
7. Treon SP. How I treat Waldenström macroglobulinemia. Blood 2009; 114 : 2375–2385.
8. Dimopoulos MA, Kyle RA, Anagnostopoulos A, et al. Diagnosis and management of Waldenstrom’s macroglobulinemia. J Clin Oncol 2005; 23 : 1564–1577.
9. Kyle RA, Benson JT, Larson DR, et al. Progression in smoldering Waldenstrom macroglobulinemia: long-term results. Blood 2012; 119 : 4462–4466.
10. Ansell SM, Kyle RA, Reeder CB, et al. Diagnosis and management of Waldenström macroglobulinemia: Mayo stratification of macroglobulinemia and risk-adapted therapy (mSMART) guidelines. Mayo Clin Proc 2010; 85 : 824–833.
11. Owen RG, Pratt G, Auer RL, et al. Guidelines on the diagnosis and management of Waldenström macroglobulinaemia. Br J Haematol 2014; 165 : 316–333.
12. Yang L, Wen B, Li H, et al. Autologous peripheral blood stem cell transplantation for Waldenstrom’s macroglobulinemia. Bone Marrow Transplant 1999; 24 : 929–930.
13. Treon SP. How I treat Waldenström macroglobulinemia. Blood 2015; 126 : 721–732.
14. Brito-Babapulle F, Bowcock SJ, Marcus RE, et al. Autografting for patients with chronic myeloid leukaemia in chronic phase: peripheral blood stem cells may have a finite capacity for maintaining haemopoiesis. Br J Haematol 1989; 73 : 76–81.
15. Desikan R, Dhodapkar M, Siegel D, et al. High-dose therapy with autologous haemopoietic stem cell support for Waldenström’s macroglobulinaemia. Br J Haematol 1999; 105 : 993–996.
16. Anagnostopoulos A, Dimopoulos MA, Aleman A, et al. High-dose chemotherapy followed by stem cell transplantation in patients with resistant Waldenstrom’s macroglobulinemia. Bone Marrow Transplant 2001; 27 : 1027–1029.
17. Munshi NC, Barlogie B. Role for high-dose therapy with autologous hematopoietic stem cell support in Waldenstrom’s macroglobulinemia. Semin Oncol 2003; 30 : 282–285.
18. Fassas A, Barlogie B, Ward S, et al. High-dose treatment (HDT) and autologous stem cell transplant (ASCT) in Waldenstrom’s macroglobulinemia (WM) patients (pts): A single center experience. ASCO Meet Abstr 2005; 23 : 6661.
19. Akhtar S, Weshi AE, Rahal M, et al. Factors affecting autologous peripheral blood stem cell collection in patients with relapsed or refractory diffuse large cell lymphoma and Hodgkin lymphoma: a single institution result of 168 patients. Leuk Lymphoma 2008; 49 : 769–778.
20. Perea G, Sureda A, Martino R, et al. Predictive factors for a successful mobilization of peripheral blood CD34+ cells in multiple myeloma. Ann Hematol 2001; 80 : 592–597.
21. Gratwohl A, Baldomero H, Schmid O, et al. Change in stem cell source for hematopoietic stem cell transplantation (HSCT) in Europe: a report of the EBMT activity survey 2003. Bone Marrow Transplant 2005; 36 : 575–590.
22. Sheppard D, Bredeson C, Allan D, et al. Systematic review of randomized controlled trials of hematopoietic stem cell mobilization strategies for autologous transplantation for hematologic malignancies. Biol Blood Marrow Transplant 2012; 18 : 1191–1203.
23. Watanabe H, Watanabe T, Suzuya H, et al. Peripheral blood stem cell mobilization by granulocyte colony-stimulating factor alone and engraftment kinetics following autologous transplantation in children and adolescents with solid tumor. Bone Marrow Transplant 2006; 37 : 661–668.
24. Gojo I, Guo C, Sarkodee-Adoo C, et al. High-dose cyclophosphamide with or without etoposide for mobilization of peripheral blood progenitor cells in patients with multiple myeloma: efficacy and toxicity. Bone Marrow Transplant 2004; 34 : 69–76.
25. Kyriakou C, Canals C, Sibon D, et al. High-dose therapy and autologous stem-cell transplantation in Waldenstrom macroglobulinemia: the Lymphoma Working Party of the European Group for Blood and Marrow Transplantation. J Clin Oncol 2010; 28 : 2227–2232.
26. Caravita T, Siniscalchi A, Tendas A, et al. High-dose therapy with autologous PBSC transplantation in the front-line treatment of Waldenstrom’s macroglobulinemia. Bone Marrow Transplant 2009; 43 : 587–588.
27. Gertz MA, Reeder CB, Kyle RA, et al. Stem cell transplant for Waldenström macroglobulinemia: an underutilized technique. Bone Marrow Transplant 2012; 47 : 1147–1153.
28. Flomenberg N, Devine SM, Dipersio JF, et al. The use of AMD3100 plus G-CSF for autologous hematopoietic progenitor cell mobiliza-tion is superior to G-CSF alone. Blood 2005; 106 : 1867–1874.
29. Kyriakou C, Canals C, Taghipour G, et al. Autologous stem cell transplantation (ASCT) for patients with Waldenstrom’s macroglobulinaemia: an analysis of 201 cases from the European Bone Marrow Transplant Registry (EBMT) [abstract]. Haematologica 2007; 92 (S2): 228.
30. Shaw PJ, Nath CE, Lazarus HM. Not too little, not too much-just right! (Better ways to give high dose melphalan). Bone Marrow Transplant 2014; 49 : 1457–1465.
31. Palumbo A, Bringhen S, Bruno B, et al. Melphalan 200 mg/m2 versus melphalan 100 mg/m2 in newly diagnosed myeloma patients: a prospective, multicenter phase 3 study. Blood 2010; 115 : 1873–1879.
32. Raab MS, Breitkreutz I, Hundemer M, et al. The outcome of autologous stem cell transplantation in patients with plasma cell disorders and dialysis-dependent renal failure. Haematologica 2006; 91 : 1555–1558.
33. Caballero MD, Rubio V, Rifon J, et al. BEAM chemotherapy followed by autologous stem cell support in lymphoma patients: analysis of efficacy, toxicity and prognostic factors. Bone Marrow Transplant 1997; 20 : 451–458.
34. Dreger P, Glass B, Kuse R, et al. Myeloablative radiochemotherapy followed by reinfusion of purged autologous stem cells for Waldenström’s macroglobulinaemia. Br J Haematol 1999; 106 : 115–118.
35. Tournilhac O, Leblond V, Tabrizi R, et al. Transplantation in Waldenstrom’s macroglobulinemia – the French experience. Semin Oncol 2003; 30 : 291–296.
36. Anagnostopoulos A, Hari PN, Pérez WS, et al. Autologous or allogeneic stem cell transplantation in patients with Waldenstrom’s macroglobulinemia. Biol Blood Marrow Transplant 2006; 12 : 845–854.
37. Gilleece MH, Pearce R, Linch DC, et al. The outcome of haemopoietic stem cell transplantation in the treatment of lymphoplasmacytic lymphoma in the UK: a British Society Bone Marrow Transplantation study. Hematol Amst Neth 2008; 13 : 119–127.
38. Anagnostopoulos A, Giralt S. Stem cell transplantation (SCT) for Waldenstrom’s macroglobulinemia (WM). Bone Marrow Transplant 2002; 29 : 943–947.
39. Dhedin N, Tabrizi R, Bulabois PE, Le Gouill S, Coiteux V, Dartigeas C et al. Hematopoietic stem cell transplantation (HSCT) in Waldenstrom macroglobulinemia (WM): update of the French experience in 54 cases. Haematologica 2007; 92 (S): 228.
40. Dreger P, Schmitz N. Autologous stem cell transplantation as part of first-line treatment of Waldenström’s macroglobulinemia. Biol Blood Marrow Transplant 2007; 13 : 623–624.
41. Kyriakou C. Optimal timing for stem cell transplantation (SCT) in Waldenstrom macroglobulinemia. International Workshop for Waldenstrom Macroglobulinemia, London 2014. Dostupné na www: http://www.wmworkshop.org/conferences/london-2014/170-conferences/london-2014/822.
42. Treon SP, Ioakimidis L, Soumerai JD, et al. Primary therapy of Waldenström macroglobulinemia with bortezomib, dexamethasone, and rituximab: WMCTG clinical trial 05-180. J Clin Oncol 2009; 27 : 3830–3835.
43. Dimopoulos MA, Anagnostopoulos A, Kyrtsonis MC, et al. Primary treatment of Waldenström macroglobulinemia with dexamethasone, rituximab, and cyclophosphamide. J Clin Oncol 2007; 25 : 3344–3349.
44. Ioakimidis L, Patterson CJ, Hunter ZR, et al. Comparative outcomes following CP-R, CVP-R, and CHOP-R in Waldenström’s macroglobulinemia. Clin Lymphoma Myeloma 2009; 9 : 62–66.
45. Treon SP, Tripsas CK, Meid K, et al. Carfilzomib, rituximab, and dexamethasone (CaRD) treatment offers a neuropathy-sparing approach for treating Waldenström’s macroglobulinemia. Blood 2014; 124 : 503–510.
46. Treon SP, Soumerai JD, Branagan AR, et al. Thalidomide and rituximab in Waldenstrom macroglobulinemia. Blood 2008; 112 : 4452–4457.
47. Dimopoulos MA, Roussou M, Kastritis E, et al. Primary treatment of Waldenstrom’s macroglobulinemia with dexamethasone, rituximab and cyclophosphamide (DRC): Final analysis of a phase II study. Blood 2012; 120(21): Abstract 438.
48. Rummel MJ, Niederle N, Maschmeyer G, et al. Bendamustine plus rituximab versus CHOP plus rituximab as first-line treatment for patients with indolent and mantle-cell lymphomas: an open-label, multicentre, randomised, phase 3 non-inferiority trial. Lancet 2013; 381 : 1203–1210.
49. Dimopoulos MA, Kastritis E, Owen RG, et al. Treatment recommendations for patients with Waldenström macroglobulinemia (WM) and related disorders: IWWM-7 consensus. Blood 2014; 124 : 1404–1411.
50. Chen CI, Kouroukis CT, White D, et al. Bortezomib is active in pa-tients with untreated or relapsed Waldenstrom’s macroglobulinemia: a phase II study of the National Cancer Institute of Canada Clinical Trials Group. J Clin Oncol 2007; 25 : 1570–1575.
51. Agathocleous A, Rohatiner A, Rule S, et al. Weekly versus twice weekly bortezomib given in conjunction with rituximab, in patients with recurrent follicular lymphoma, mantle cell lymphoma and Waldenström macroglobulinaemia. Br J Haematol 2010; 151 : 346–353.
52. Treon SP, Hanzis C, Tripsas C, et al. Bendamustine therapy in pa-tients with relapsed or refractory Waldenström’s macroglobulinemia. Clin Lymphoma Myeloma Leuk 2011; 11 : 133–135.
53. Treon SP, Tripsas CK, Meid K, et al. Ibrutinib in previously treated Waldenström’s macroglobulinemia. N Engl J Med 2015; 372 : 1430–1440.
54. Morel P, Duhamel A, Gobbi P, et al. International prognostic scoring system for Waldenstrom macroglobulinemia. Blood 2009; 113 : 4163–4170.
55. Kastritis E, Kyrtsonis M-C, Hadjiharissi E, et al. Validation of the International Prognostic Scoring System (IPSS) for Waldenstrom’s macroglobulinemia (WM) and the importance of serum lactate dehydrogenase (LDH). Leuk Res 2010; 34 : 1340–1343.
56. Bachanova V, Burns LJ. Hematopoietic cell transplantation for Waldenström macroglobulinemia. Bone Marrow Transplant 2012; 47 : 330–336.
57. Buske C, Leblond V, Dimopoulos M, et al. Waldenstrom’s macroglobulinaemia: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2013; 24 Suppl 6: vi155–159.
58. Adam Z, Hájek R, Krejčí M, et al. Diagnostika a léčba Waldenströmovy makroglobulinemie: souhrn doporučení 2014. Transfuze Hematol dnes 2014; 20(Suppl): 5–22.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2016 Issue 1-
All articles in this issue
- Prognostické faktory u chronické myeloidní leukemie: můžeme kombinací získat více?
- Analýza vztahu poměru volných lehkých řetězců (FLC-r, FreeliteTM), párů těžkých/lehkých řetězců imunoglobulinu (HLC-r, HevyliteTM) v séru a výsledků multiparametrické průtokové cytometrie plazmocytů k „progression free survival“u mnohočetného myelomu
- Autologní transplantace kmenových buněk u Waldenströmovy makroglobulinemie
- Konsenzuální doporučení Českého národního hemofilického programu (ČNHP) pro zajištění chirurgických a invazivních výkonů u pacientů s hemofilií
- Konsenzuální doporučení Českého národního hemofilického programu (ČNHP) pro diagnostiku a léčbu pacientů s vrozenou hemofilií a s inhibitorem FVIII/FIX
- Chronická myeloidní leukemie – standardizace molekulárního monitorování hladiny transkriptů BCR-ABL1 v České republice
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Prognostické faktory u chronické myeloidní leukemie: můžeme kombinací získat více?
- Chronická myeloidní leukemie – standardizace molekulárního monitorování hladiny transkriptů BCR-ABL1 v České republice
- Konsenzuální doporučení Českého národního hemofilického programu (ČNHP) pro zajištění chirurgických a invazivních výkonů u pacientů s hemofilií
- Analýza vztahu poměru volných lehkých řetězců (FLC-r, FreeliteTM), párů těžkých/lehkých řetězců imunoglobulinu (HLC-r, HevyliteTM) v séru a výsledků multiparametrické průtokové cytometrie plazmocytů k „progression free survival“u mnohočetného myelomu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

