-
Medical journals
- Career
Analýza vztahu poměru volných lehkých řetězců (FLC-r, FreeliteTM), párů těžkých/lehkých řetězců imunoglobulinu (HLC-r, HevyliteTM) v séru a výsledků multiparametrické průtokové cytometrie plazmocytů k „progression free survival“u mnohočetného myelomu
Authors: V. Ščudla 1,3; P. Lochman 2; M. Novák 3; T. Pika 3; J. Minařík 3; K. Langová 4
Authors‘ workplace: III. interní klinika – nefrologická, revmatologická a endokrinologická, Lékařská fakulta Univerzity Palackého a Fakultní nemocnice v Olomouci 1; Oddělení klinické biochemie, Fakultní nemocnice v Olomouci 2; Hemato-onkologická klinika, Fakultní nemocnice a Lékařská fakulta Univerzity Palackého v Olomouci 3; Ústav lékařské biofyziky, Lékařská fakulta Univerzity Palackého v Olomouci 4
Published in: Transfuze Hematol. dnes,22, 2016, No. 1, p. 14-27.
Category: Comprehensive Reports, Original Papers, Case Reports
Overview
Úvod:
Vyšetření hladin volných lehkých řetězců (FLC), nověji i párů těžkých/lehkých řetězců imunoglobulinu (HLC) a analýza plazmocytů s pomocí multiparametrické průtokové cytometrie (MFC) obohatily tradiční standardní algoritmus laboratorních testů u mnohočetného myelomu (MM). Cílem studie bylo zhodnocení vztahu modifikovaných indexů FLC-r (poměr involved-FLC/uninvolved FLC κ a λ) a HLC-r (poměr involved-HLC/uninvolved-HLC), výskytu plazmocytů s normálním (N-PC) a aberantním imunofenotypem (A-PC) včetně jejich poměru (A/N-PC-r), indexu klonality plazmocytů a stratifikačních modelů založených na hodnotě indexu HLC-r k délce PFS (interval od zahájení léčby do progrese nebo úmrtí).Soubor a metody:
V celém souboru 163 nemocných s MM, rozděleném na soubor léčený konvenční terapií (KT) a soubor léčený vysoce dávkovanou chemoterapií s podporou autologních periferních kmenových buněk (VDT/ATKB) byly vyšetřeny modifikované indexy FLC-r (FreeliteTM) a HLC-r (HevyliteTM) a imunofenotyp i monoklonalita plazmocytů κ/λ s pomocí MFC. Ke stratifikaci souborů do 3 rizikových skupin, byly použity vedle standardního stážovacího systému podle ISS (International Staging System) stratifikační model podle Aveta-Loiseaua (AL-SS) a podle Ludwiga (L-SS).Výsledky:
Analýza prokázala na rozdíl od indexu FLC-r statisticky významný vztah hodnot HLC-r k délce PFS v celkovém souboru (p = 0,016) a v souboru léčeném VDT/ATKB (p = 0,026), dokumentovaný významně odlišnými mediány a průběhy křivek PFS. Nebyl prokázán vztah hodnot N-PC, A-PC, indexu A/N-PC-r a indexu monoklonality plazmocytů (κ/λ nebo λ/κ PC-r) k PFS. Analýza celkového souboru MM prokázala při použití modelů podle L-SS, v menší míře i podle AL-SS statisticky významný vztah jednotlivých rizikových skupin k PFS (p = 0,001 a p = 0,024), nedosahující ale významnosti standardních stážovacích systémů podle ISS (p < 0,0001) a D-S (p = 0,005). Obdobně jako stratifikace podle AL-SS a L-SS vyzněla i vlastní modifikace ISS (OL-SS), využívající jako cut-off rizikových skupin hodnot mediánů modifikovaného HLC-r, vypočtených jako poměr i-HLC/u-HLC separátně v celém souboru a v souborech s IgG a IgA typem MM (p = 0,001).Závěr:
Byl prokázán statisticky významný vztah modifikovaného indexu HLC-r (i-HLC/u-HLC, HevyliteTM) k PFS, nikoliv ale modifikovaného indexu FLC-r (FreeliteTM) a výskytu plazmocytů s abnormálním nebo normálním imunofenotypem včetně jejich poměru i patologického indexu monoklonality vyšetřené s pomocí MFC. Nově navržené stratifikační modely rizikovosti MM (1-3) podle AL-SS, L-SS a OL-SS, založené na hodnotě HLC-r prokázaly vesměs významný vztah k PFS, nikoliv ale významnější, nežli standardní stážovací systém dle ISS. Analyzované, nově zkoncipované stratifikační modely proto nejsou z hlediska PFS vhodné k zavedení do běžné klinické praxe..KLÍČOVÁ SLOVA:
mnohočetný myelom – volné lehké řetězce imunoglobulinu – páry těžkého/lehkého řetězce imunoglobulinu – multiparametrická průtoková cytometrie – prognostická stratifikace – interval do progrese myelomu (PFS)ÚVOD
Pokroky v diagnostice a léčbě mnohočetného mye-lomu (MM) přinášejí stále vyšší nároky na poznání klíčových biologických vlastností nemoci, výsledku spletité mozaiky vztahů nádorové tkáně, mikroprostředí kostní dřeně a celého organismu. Přesná kvantifikace monoklonálního imunoglobulinu (MIg) s přesným rozlišením monoklonálního od polyklonálního imunoglobulinu (PIg), včetně zhodnocení hloubky imunoparézy jsou důležité pro volbu léčby, hodnocení léčebné odezvy a prognózy MM [1, 2, 3, 4]. Standardní diagnostická a stratifikační kritéria MM zahrnují vedle vyšetření koncentrace MIg (SPE, elektroforéza bílkovin séra) a jeho izotypu (IFE, imunofixační elektroforéza) rovněž vyšetření sérových hladin volných lehkých řetězců imunoglobulinu (FLC, FreeliteTM) včetně jejich poměru (FLC-r), sloužící taktéž k hodnocení hloubky a trvání léčebné odezvy [1, 3, 4, 5, 6, 7]. Nespolehlivost SPE a její nízká senzitivita v případě oligosekreční a IgA formy MM, zkreslující vliv změn hematokritu, objemu plazmy [8] a odlišný katabolismus jednotlivých tříd MIg [9] vedl k vypracování vysoce senzitivní turbidimetrické nebo nefelometrické techniky HevyliteTM, umožňující pomocí vysoce specifických protilátek přesné stanovení hladin párů těžkých/lehkých řetězců Ig (HLC-κ a HLC - λ) v séru [1, 3, 5, 6]. HevyliteTM metoda přinesla separátní stanovení sérových hladin „involved-HLC“ (i-HLC, tj. MIg vytvářeného myelomovými buňkami) a „uninvolved HLC“ (u-HLC, tj. PIg téhož izotypu produkovaného normálními plazmocyty) s výpočtem jejich poměru, tj. indexu HLC-r [1, 3, 6]. HevyliteTM technika zlepšila rozpoznání a monitorování léčebné odezvy včetně hodnocení minimální zbytkové nemoci, časné podchycení relapsu/progrese a zřejmě i prognózy MM s vypracováním nových stratifikačních modelů [10, 11, 12, 13].
Předložené sdělení se soustředilo na zhodnocení vztahu délky PFS k ukazatelům plazmocelulární sekrece, tj. indexů FLC-r (FreeliteTM), a HLC-r (HevyliteTM) a vybraných parametrů plazmocytů kostní dřeně (KD) vyhodnocených pomocí multiparametrické průtokové cytometrie (MFC), jmenovitě k zastoupení normálních (N-PC) a aberantních plazmocytů (A-PC) včetně jejich poměru (A/N-PC-r) v kostní dřeni (KD) a ke stupni klonality plazmatických buněk (κ/λ, resp. λ/κ/-PC-r) vyhodnocených při diagnóze MM. Cílem analýzy bylo rovněž posouzení použitelnosti tzv. modifikovaných indexů FLC-r a HLC-r, vypočtených z poměru i-FLC/u-FLC, resp. i-HLC/u-HLC. Náplní studie bylo taktéž zhodnocení významu nově zkoncipovaných stratifikačních modelů MM podle Aveta-Loiseaua a Ludwiga, jež nahradily ve stážovacím systému podle „International Staging System“ (ISS) albumin indexem HLC-r z hlediska vztahu k délce PFS [10, 11, 12, 14, 15].
SOUBOR NEMOCNÝCH A METODY
Studie vychází z analýzy 163členného souboru s IgG a IgA typem MM vyšetřeného při diagnóze nemoci, splňující diagnostická kritéria „International Myeloma Working Group“ (IMWG) – tabulka 1 [4, 16]. K dosažení homogenity souboru bylo vyřazeno 14 nemocných s asymptomatickým MM nevyžadujícím léčbu a 11 pacientů léčených pouze alkylačními látkami. Celkový soubor se symptomatickou formou MM byl rozdělen na soubor netransplantabilních nemocných léčených konvenční terapií (KT), tj. standardními režimy s kombinací chemoterapeutik (melfalan, cyklofosfamid nebo adriablastin), kortikosteroidů (dexametazon, prednizon), imunomodulačních přípravků (thalidomid, lenalidomid) a/nebo inhibitorů proteozomu (bortezomib, carfilzomib) a na soubor transplantabilních nemocných léčených navíc vysoce dávkovanou terapií s podporou autologních periferních kmenových buněk (VDT/ATKB) – viz tabulka 1 [4]. Séra zmražená na -78 °C byla uložena v biobance OKB a HOK FN v Olomouci, koncentrace MIg byla vyšetřena SPE přístrojem Sebia Hydrasy pomocí skeneru Epson 1680, IFE soupravou Hydragel 4 IF. Hladiny FLC byly vyšetřeny soupravami Freelite SPA Plus κ-free (rozmezí 3,3–19,4 mg/l) a Freelite SPA Plus λ-free (5,7–26,3 mg/l) s výpočtem indexu FLC-r, tj. poměru FLC-κ/ FLC-λ (0,26–1,65) [1, 3, 6]. Koncentrace HLC v séru byla vyšetřena turbidimetrem SPA Plus (The Binding Site) soupravami Hevylite Human: IgG-κ (3,84–12,07 g/l), IgG-λ (1,91–6,74 g/l), index IgG HLC-r z poměru IgG-κ /IgG-λ (1,12–3,21); hodnoty IgA-κ (0,57–2,08 g/l), IgA-λ (0,44–2,04 g/l), index IgA HLC-r z poměru IgA-κ/IgA-λ (0,78–1,94) [1, 3]. Na rozdíl od standardních kritérií, založených na výpočtu indexů FLC-r a HLC-r stabilně z poměru FLC-κ/FLC-λ, respektive HLC-κ /HLC-λ, vedoucí u nemocných s lehkým řetězcem (LŘ) λ k získání nízkých, prakticky obtížně interpretovatelných hodnot, byl použit pro výpočet modifikovaných indexů FLC-r a HLC-r vždy poměr i-FLC/u-FLC a i-HLC/u-HLC, tj. hodnota „involved“ typu jako čitatel (např. v případě i-HLC-λ poměr i-HLC-λ/u-HLC-κ). Jde o princip použitý v případě FLC-r již v některých předchozích studiích [17, 18] a zejména recentních IMWG („International Myeloma Working Group“) revidovaných diagnostických kritériích MM (biomarker malignity FLC-r = i-FLC/u-FLC ≥ 100) [19]. Takto modifikované indexy FLC-r a HLC-r umožnily nejen přímé vzájemné porovnání obou indexů, ale i komparaci s indexy plazmocytů vyšetřených MFC v kostní dřeni (KD), tj. s A/N-PC-r (poměr plazmocytů s aberantním/normálním imunofenotypem) a κ/λ, respektive λ/κ PC-r (poměr monoklonálních, tj. mye-lomových/polyklonálních, tj. normálních plazmocytů v KD). K MFC byl použit průtokový cytometr BD FACS Canto II s aplikací osmibarevných protokolů na bázi konsorcia Euroflow [20] se sestavami protilátek k hodnocení exprese znaků: CD38,CD138, CD45, CD56, CD19, CD20, CD117, CD27 a intracytoplazmatické detekce LŘ κ nebo λ (Biosciences, nebo Exbio Praha). Akviziční gate CD38+/CD138+ vyžadoval analýzu nejméně 1500 plazmocytů: normální plazmocyty (N-PC) exprimovaly imunofenotyp CD19+CD56-, abnormální (A-PC) aberantní imunofenotyp CD19-CD56+, případně CD19-CD56 - nebo CD19+CD56+ [21, 22, 23]. Diagnostickou hranicí A-PC bylo ≥ 95 % plazmocytů s aberantním imunofenotypem [24]. Hodnoty β2-mikroglobulinu (β2-M) byly vyšetřeny metodou ELISA (< 2,3 mg/l), hodnoty Hb, albuminu a kreatininu standardními postupy. K stratifikaci MM byl použit stážovací systém podle Durieho-Salmona (D-S) a „International Staging System“ (ISS) [4, 14]. V intencích cílů studie byly analyzovány stratifikační modely se zařazením indexu HLC-r dle Aveta-Loiseaua (AL-SS) a podle Ludwiga (L-SS), třídící nemocné do 3 rizikových skupin. AL-SS [10, 11]: riziková skupina 1 („low risk“): β2-M < 3,5 a HLC-r 0,01 - 200; skupina 2 („intermediate risk“): β2-M ≥ 3,5 nebo HLC-r < 0,01, eventuálně > 200; skupina 3 („high risk“): současná přítomnost β2-M ≥ 3,5 a HLC-r < 0,01 nebo > 200 (12,13,14). Stratifikační model podle Ludwiga (12): riziková skupina 1 („low risk“): β2-M < 3,5 a HLC-r 0,022 – 45; skupina 2 („intermediate risk“): β2-M ≥ 3,5 nebo HLC-r < 0,022, eventuálně > 45; skupina 3 („high risk“): současná přítomnost β2-M ≥ 3,5 a HLC-r < 0,022 nebo > 45. PFS (časový interval od zahájení terapie do progrese nebo úmrtí) byl vypočten podle IMWG kritérií [4, 25]. Zařazení do studie bylo vázáno na podpis informovaného souhlasu, design studie byl schválen etickou komisí FN v Olomouci.
Table 1. Základní charakteristiky celé sestavy nemocných s mnohočetným myelomem, souboru léčeného chemoimunoterapií (KT) a souboru léčeného vysoce dávkovanou chemo - imunoterapií s podporou autologních periferních kmenových buněk (VDT/ATKB) 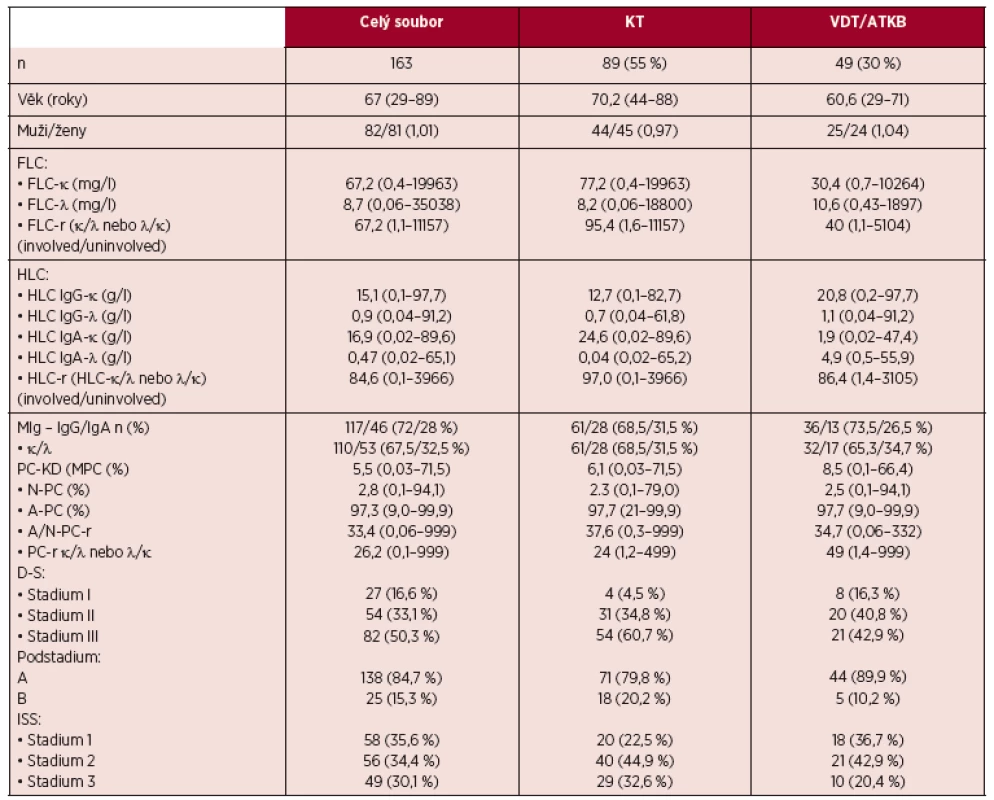
KT – konvenční terapie (chemo-imunoterapie), VDT/ATKB – vysoce dávkovaná chemo-imunoterapie s podporou autologních periferních krvetvorných buněk, n – počet nemocných, FLC – volné lehké řetězce imunoglobulinu („free light chain“), FLC-r – poměr sérových hladin „involved/uninvolved“ volných lehkých řetězců imunoglobulinu, HLC – pár těžkých/lehkých řetězců imunoglobulinu („immunoglobulin heavy/light chain pair“), HLC-r – poměr sérových hladin páru těžkých/lehkých „involved/uninvolved“ řetězců imunoglobulinu, („involved/uninvolved HLC-κ/HLC-λ ratio“), MIg – monoklonální imunoglobulin, PC-KD – plazmocyty v kostní dřeni, MFC – multiparametrická průtoková cytometrie, N-PC – plazmocyty s normálním imunofenotypem, A-PC – plazmocyty s aberantním imunofenotypem, A/N-PC-r – poměr výskytu plazmocytů s abnormálním/normálním imunofenotypem, κ/λ nebo λ/ PC-r – poměr monoklonálních/ polyklonálních plazmocytů v kostní dřeni vyšetřených s pomocí MFC, D-S – stážovací systém podle Durieho-Salmona, ISS – „International Staging System“. Získaná data byla analyzována pomocí statistického software IBM SPSS Statistics 22. Normalita dat byla posouzena s pomocí Shapiro-Wilkova testu. Rozdíly v PFS mezi vyčleněnými skupinami byly vyšetřeny s pomocí křivek přežití podle Kaplana-Meiera a log-rank-testu. Všechny testy byly prováděny na hladině statistické významnosti p < 0,05.
VÝSLEDKY
Statistická analýza byla provedena separátně v souboru s KT, VDT/ATKB a celkovém souboru nemocných s MM (KT + VDT/ATKB). Medián PFS 89členného souboru netransplantabilních nemocných léčených KT byl 21 měsíců, pravděpodobnost setrvání bez progrese byla v 1.–3. roce 70,9 %, 43,1 % a 38,8 %, zatímco v 49členném souboru léčeném kombinovanými režimy zahrnující působky s biologickým účinkem a VDT/ATKB byl me-dián PFS 40 měsíců s pravděpodobností 1–4letého setrvání bez progrese v 89,1 %, 83,1 %, 77,2 % a 57,9 %. Z těchto důvodů byly hodnoceny soubory léčené KT a navíc i VDT/ATKB samostatně.
Analýza vztahu FLC-r k PFS
Analýza vztahu indexu FLC-r k PFS při cut-off odpovídajícím mediánům jednotlivých souborů vyzněla ve všech třech souborech statisticky nevýznamně (tab. 2), odlišně nevyzněla ani separátní analýza nemocných s IgG a IgA typem MM. Nesignifikantně vyzněl vztah FLC-r k PFS i po rozdělení jednotlivých souborů na nemocné s hodnotou vysoce abnormální (> 100 a < 0,01) vs. lehce abnormální (≥ 0,01 až ≤ 100), tj. s použitím kritérií doporučených ve studii věnované asymptomatické formě MM [26]. Ve všech analyzovaných souborech vyzněl statisticky nevýznamně vztah k PFS při použití jednotné hodnoty cut-off indexu FLC-r ≥ 100, viz kritéria malignity revidovaných diagnostických kritérií MM [19], přestože mediány i křivky PFS se v celkové sestavě KT+ VDT/ATKB a v souboru léčeném KT zřetelně lišily (viz tab. 2), a to zejména v případě izotypu IgA (36 vs. 18 měsíců).
Table 2. Vztah PFS („progression free survival“) k FLC-r (FreeliteTM), HLC-r (HevyliteTM) a vybraným parametrům multiparametrické průtokové cytometrie plazmocytů u mnohočetného myelomu vyšetřeného při diagnóze nemoci 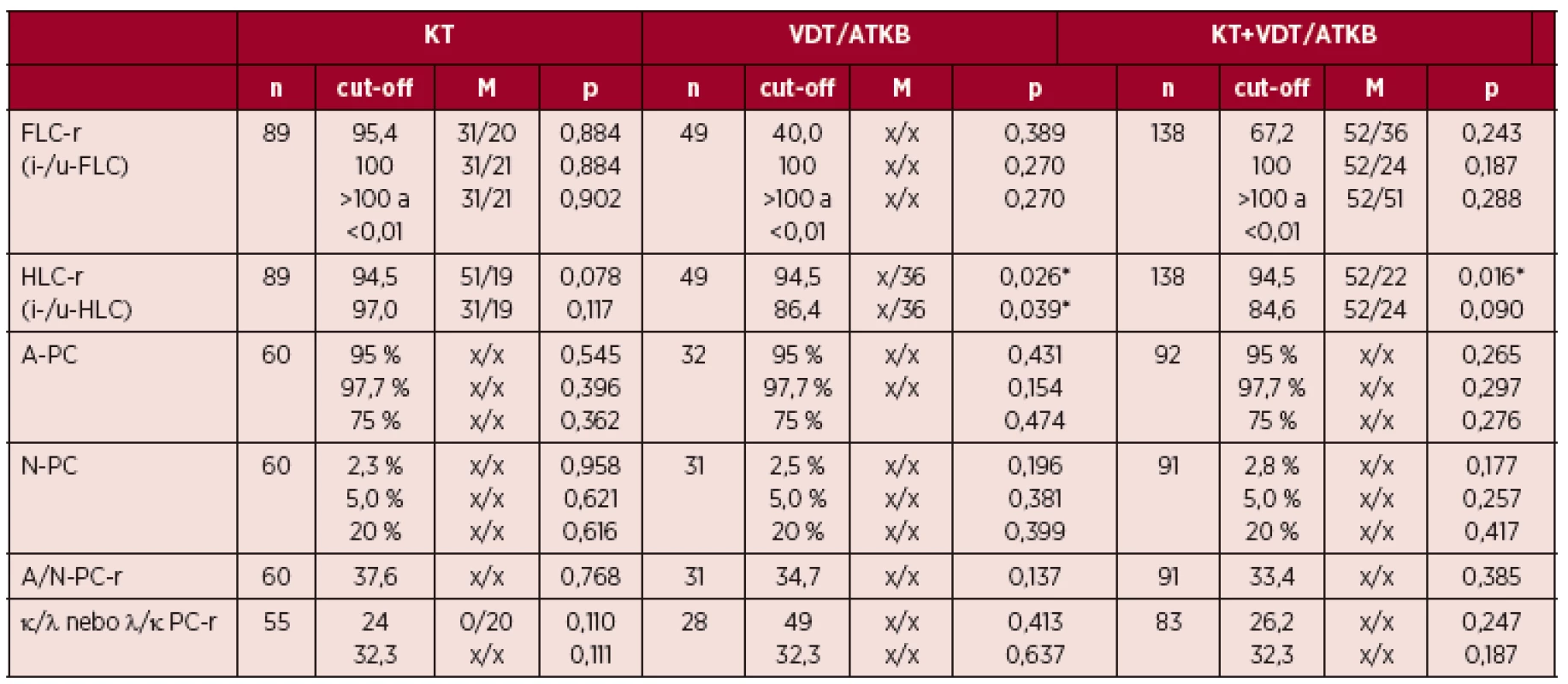
n – počet nemocných, M – medián trvání nemoci od diagnózy do progrese nebo úmrtí, p – index statistické významnosti, * – signifikantní vztah, PFS – interval do progrese nemoci („progression free interval“), FLC-r – poměr hladin volných lehkých řetězců imunoglobulinu v séru κ/λ, HLC-r – poměr sérových hladin páru těžkých/lehkých řetězců imunoglobulinu, KT – konvenční chemo-imunoterapie, VDT/ATKB – vysoce dávkovaná chemo-imunoterapie s podporou transplantace autologních periferních krvetvorných buněk, A-PC – abnormální plazmocyty (abnormální imunofenotyp vyšetřený s pomocí multiparametrické průtokové cytometrie, MFC), N-PC – normální plazmocyty (normální imunofenotyp vyšetřený s pomocí MFC), A/N-PC-r – poměr abnormálních/normálních plazmocytů vyšetřených s pomocí MFC, PC-r (κ/λ nebo λ/κ) – poměr výskytu monoklonálních/polyklonálních plazmocytů v kostní dřeni vyšetřených MFC, x – doposud nevyhodnotitelná délka mediánu intervalu do progrese nemoci Analýza vztahu HLC-r k PFS
Analýza vztahu HLC-r s cut-off odpovídajícím mediánům dílčích souborů, respektive mediánu naší předchozí studie vyzněla v souboru s KT přes výrazně diferentní mediány a průběhové charakteristiky křivek PFS, a to i při rozčlenění podle izotypů IgG a IgA nesignifikantně (viz tab. 2). V souboru léčeném VDT/ATKB byl zjištěn statisticky významný rozdíl v délce PFS nemocných s rozdílnými hodnotami indexu HLC-r, doložený významnými rozdíly mediánů (36 měsíců vs. medián nedosažen) a křivek PFS, jež se ale vytratil při rozčlenění podle izotypu IgG a IgA (p = 0,153 a 0,090). Statisticky významný rozdíl v délce PFS byl vyjádřen v případě vyhodnocení HLC-r v celém souboru MM (KT + VDT/ATKB), doložený významně odlišnými mediány a křivkami PFS (viz tab. 2, obr. 1-A). V případě izotypu IgA byl přes chybějící statistickou významnost vztah HLC-r k PFS mnohem výraznější než u izotypu IgG (p = 0,061 vs. 0,625, obr. 1-B).
Multiparametrická průtoková cytometrie
Při analýze plazmocytů z aspirátu KD provedené pomocí MFC bylo zjištěno, že zastoupení plazmocytů s normálním imunofenotypem (N-PC) nemělo při použití cut-off (2,3 %, 2,5 % a 2,8 %), odpovídající zjištěným mediánům v žádném souboru statisticky významný vztah k PFS, přestože křivky PFS se při cut-off 2,8 podstatně lišily (obr. 1-C) a vyznačovaly se výrazným trendem k vzájemně významně odlišnému vztahu. Nevýznamně vyzněla i analýza, která v souladu s výsledky předchozích studií použila jako cut-off hodnoty 5 % a 20 % N-PC [27] (viz tab. 2). Nepřínosně vyzněla rovněž analýza vztahu výskytu aberantních plazmocytů (A-PC) k PFS přes použití tří odlišných cut-off, tj. 95 %, 75 % a 97,7 % (hodnota mediánu), přestože křivky PFS byly zejména v případě cut-off 75 % v celkové sestavě a v obou souborech léčených KT i VDT/ASCT zřetelně odlišné (obr. 1-D) a vyjadřovaly vzájemně značně diferentní trend. Analýza vztahu poměru zastoupení plazmocytů s aberantním/normálním imunofenotypem (index A/N-PC) neprokázala při cut-off odpovídajícímu mediánu významný vztah k PFS, i když obdobně jako při analýze N-PC a A-PC křivky PFS naznačovaly nápadný trend k významně diferentnímu vzájemnému vztahu (obr. 1-E). Analýza vztahu mezi indexem monoklonality plazmocytů (κ/ λ, respektive λ/κ PC-r) a PFS vyzněla ve všech analyzovaných souborech a přes použití dvou odlišných cutt-off statisticky nevýznamně (viz tab. 2), i když podle průběhových charakteristik křivek v celé sestavě a v souboru léčeném KT opět s dobře patrným trendem vztahu k PFS (obr. 1-F).
Image 1. Výsledky Kaplanovy-Meierovy analýzy vztahu vybraných ukazatelů mnohočetného myelomu k délce intervalu od zahájení léčby do progrese nebo úmrtí (PFS, „progression free survival“). 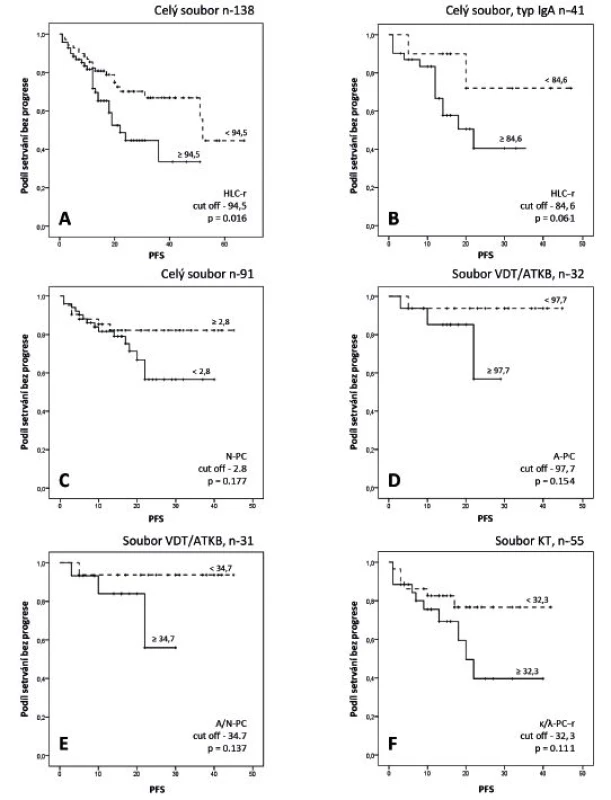
A – křivky PFS, vyjadřující vztah HLC-r (poměr páru „involved/uninvolved“ těžkého/lehkého řetězce imunoglobulinu, HevyliteTM) k PFS v celém souboru nemocných s mnohočetným myelomem (MM) léčených konvenční terapií (KT) a/nebo vysoce dávkovanou chemoterapií s podporou transplantace autologních kmenových buněk (VDT/ATKB); B – vztah HLC-r k PFS v celém souboru nemocných s IgA izotypem MM; C – vztah zastoupení N-PC (plazmocyty kostní dřeně s normálním imunofenotypem vyšetřené s pomocí multiparametrické průtokové cytometrie, MFC) k PFS v celém souboru MM; D – vztah zastoupení A-PC (myelomové plazmocyty s aberantním imunofenotypem vyšetřené MFC) v souboru léčeném VDT/ ATKB; E – vztah indexu A/N-PC (poměr plazmocytů s aberantním/normálním imunofenotypem vyšetřeném MFC) k PFS v souboru léčeném VDT/ ATKB; F – vztah indexu monoklonality plazmocytů, tj. κ/λ event. λ/κ -PC-r k PFS v souboru léčeném KT. Stratifikace MM
Analýza vztahu výsledků v současnosti nejčastěji používané stratifikace podle ISS [14] k trvání PFS vyzněla ve všech třech souborech statisticky významně a byla doložena odlišnými mediány a křivkami PFS (tab. 3, obr. 2-A). Statisticky významný vztah byl prokázán v celé sestavě rovněž při použití tradičního stážovacího systému podle D-S (p = 0,005). Stratifikace podle AL-SS [10, 11] vyzněla z hlediska PFS významně s výrazně odlišnými mediány a křivkami PFS všech tří rizikových skupin pouze v celkové sestavě nemocných (obr. 2-B), nikoliv v dílčích souborech léčených KT a VDT/ATKB, a to přes zřetelně odlišné mediány a křivky PFS 1.–3. rizikové skupiny (viz tab. 3, obr. 2-C). V případě stratifikace podle L-SS [12] byl zjištěn vysoce významný vztah (p = 0,001) k PFS, podepřený velmi odlišnými mediány a křivkami PFS v celkovém souboru (obr. 2-D) a v souboru léčeném KT (viz tab. 3). Rozčlenění celkového souboru podle vlastní modifikace ISS stážování (OL-SS), v němž byly nahrazeny hodnoty albuminu hodnotami modifikovaného indexu HLC-r, odpovídajícími mediá-nům izotypu IgG (68,8), IgA (592,0) a IgG+ IgA (94,5) vyzněla statisticky vysoce významně (p = 0,001), s výrazně odlišnými mediány a průběhy křivek PFS v celém souboru MM (viz tab. 3, obr. 2-E). Statisticky významně vyznělo i rozdělení nemocných do tří rizikových skupin v případě IgA (p = 0,021, obr. 2-F), nikoliv IgG izotypu MM (p = 0,074). Přes statistickou významnost v souboru s KT neprokázal OL-SS schopnost odlišení PFS v rizikové kategorii 2 vs. 3 a statistický význam v souboru léčeném VDT/ATKB (viz tab. 3).
Table 3. Srovnání vztahu PFS („progression free survival“) k výsledkům stratifikace mnohočetného myelomu** 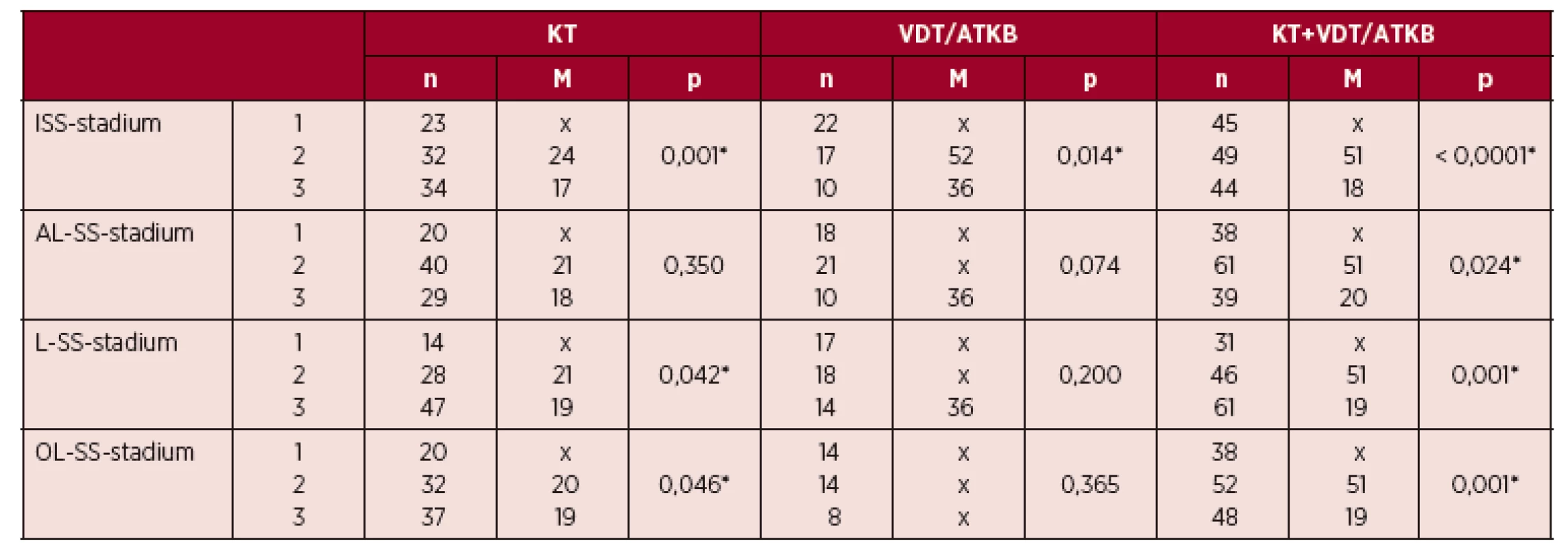
**S použitím standardních stážovacích systémů podle Durieho-Salmona [4] a „International Staging Alveta Index“ [14] a nově vypracovaných stratifikačních modelů podle Aveta-Loiseaua [10, 11], Ludwiga [12] a stratifikačního systému Olomouc s využitím poměru párů „involved/uninvolved HLC“ (HLC-r, HevyliteTM) n – počet nemocných, M – medián trvání nemoci od diagnózy do progrese nebo úmrtí, p – index statistické významnosti,* statisticky signifikantní vztah, PFS – interval do progrese nemoci („progression free survival“), HLC-r – poměr páru sérových hladin těžkých/lehkých řetězců imunoglobulinu, KT – konvenční terapie, VDT/ATKB – vysoce dávkovaná chemoterapie s podporou transplantace autologních periferních krvetvorných buněk, D-S – stážovací systém dle Durieho-Salmona, ISS – „International Staging System“, AL-SS – stratifikační systém dle Avet-Loiseaua, L-SS – stratifikační systém podle Ludwiga, OL-SS – stratifikační systém Olomouc, x – doposud nevyhodnotitelná délka mediánu intervalu do progrese nemoci Image 2. Výsledky Kaplanovy-Meierovy analýzy z hlediska PFS v souborech nemocných s MM vyhodnocených pomocí čtyř stratifikačních systémů 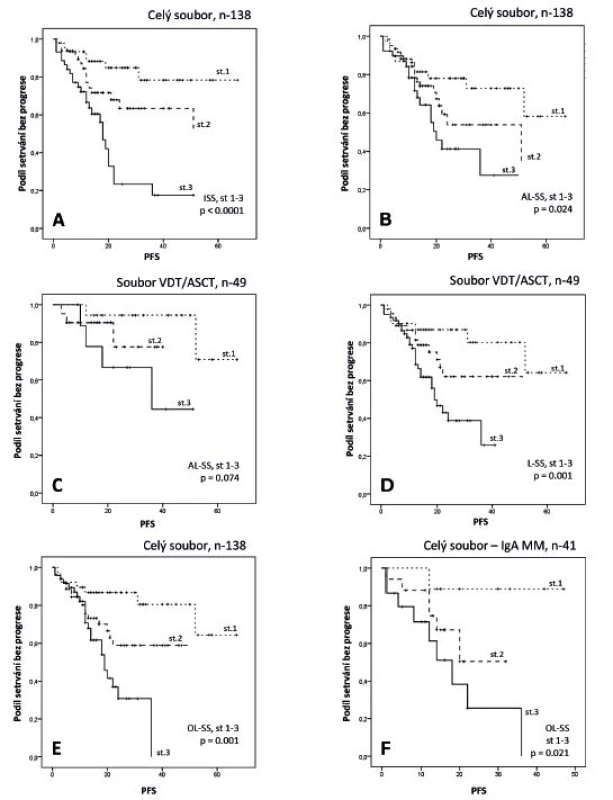
A – křivky PFS stadií 1–3 v celém souboru MM vyhodnoceném podle ISS („International Staging System“) [14]; B – křivky PFS v celém souboru vyhodnoceném podle AL-SS (stážovací systém podle Aveta- Luiseaua) [10, 11]; C – křivky PFS v souboru léčeném vysoce dávkovanou chemoterapií s podporou transplantace autologních kmenových buněk (VDT/ATKB) vyhodnoceném podle AL-SS; D – křivky PFS v celkovém souboru vyhodnoceném podle L-SS (stratifikace podle Ludwiga) [12]; E – křivky PFS v celkovém souboru, vyhodnoceném podle OL-SS (stratifikační systém Olomouc); F – křivky PFS v celkovém souboru nemocných s IgA typem MM vyhodnocené podle OL-SS v souboru s IgA typem MM DISKUSE
Současná analýza výsledků vyšetření MFC, FreeliteTM a HevyliteTM byla vyvolána snahou o srovnání významu „buněčné“ stránky myelomového procesu (zastoupení N-PC, A-PC, indexu A/N-PC a klonality plazmatických buněk) a stránky „sekretorické“ (indexy FLC-r a HLC-r) k PFS u MM. Reálná použitelnost PFS v naší sestavě byla ověřena vysoce signifikantním vztahem PFS ve všech analyzovaných souborech při použití standardní stratifikace podle ISS. Analýza potvrdila signifikantní význam modifikovaného indexu HLC-r v celém souboru a v souboru léčeném VDT/ATKB, zatímco přes odlišnost mediánů a křivek PFS nikoliv v souboru léčeném KT. Vztah indexu HLC-r k délce PFS byl zaznamenán již v pilotní studii Bradwella, v níž rozdíly v délce PFS se u IgG, nikoliv u IgA MM prohloubily při posunu mezních hodnot na < 0,01 až > 200 [15]. Ve shodě s naším závěrem vyzněly i další studie [10, 15, 28, 29, 30] včetně těch, které prokázaly navíc vztah indexu HLC-r k intervalu do progrese (TTP) [31], k rychlosti nástupu progrese [32], k celkovému přežití (OS), k zastoupení klonálních plazmocytů v KD, k hodnotám Hb, albuminu, β2-M a FLC-r [2, 15, 31, 33, 34]. V případě IgG typu MM korelují vysoké hodnoty HLC s transformací asymp-tomatické formy MM ve formu symptomatickou [35]. Časná normalizace hodnot HLC a FLC je nezávislým předpovědním faktorem rychlé a hluboké odezvy na antimyelomovou léčbu, provázená dlouhým trváním PFS [32, 36]. Bylo zjištěno, že cytogenetické změny typu del:13, t(4;14) a monoalelické delece lokusu p53 (17p13) se vyznačují méně významným vztahem k PFS nežli hodnoty HLC-r [15]. V případě kompletní remise po VDT/ATKB bylo pozorováno v případě vzestupu u-HLC prodloužení PFS [37]. V případě MGUS (monoklonální gamapatie nejistého významu) je z hlediska predikce maligní transformace i těsnosti korelace se stratifikací do 4 rizikových skupin rozhodující hloubka suprese u-HLC [38, 39, 40]. Přes absenci plně vyjádřené statistické významnosti byl v naší studii zjištěn na rozdíl od Bradwella [15] trend k odlišným mediánům a křivkám PFS u IgA nežli u IgG typu MM, což odpovídá popisovaným rozdílům v patobiologii obou izotypů a doporučením některých autorů o vhodnosti metody HevyliteTM, především u IgA typu MM. Vyšetření HLC obchází na rozdíl od SPE analytickou interferenci IgA izotypu MIg s komigračními proteiny (např. s transferinem, haptoglobinem a C3 složkou komplementu), modifikující vliv změn hematokritu a objemu plazmy na koncentraci MIg a odlišnou dynamiku produkce a degradace MIg u IgG a IgA typu MM [3, 13, 15, 34]. Prognostický potenciál modifikovaného indexu HLC-r (i-HLC/u-HLC stejné třídy) je výslednicí kompozitní informace o výši MIg, vyjadřující nálož myelomových buněk a zejména o stupni suprese u-HLC, odrážející redukci normálních plazmocytů v KD [3, 15]. Na odlišné izotypově specifické supresi u-HLC se pravděpodobně podílí odlišné ovlivnění „niche“ mikroprostředí KD v závislosti na proliferaci IgG vs. IgA typu myelomových buněk [15, 38]. Na významnějším vztahu HLC k prognóze MM oproti MIg se uplatňuje i větší přesnost HevyliteTM techniky, podložená použitím imunoesejí specifických pro molekuly Ig-κ a Ig-λ [1, 3, 15]. Výsledky naší analýzy prokázaly, že v předpovědi PFS se osvědčilo použití modifikovaného výpočtu HLC-r (i-HLC/u-HLC), neboť na rozdíl od standardní praxe, používající konstantně poměr HLC-κ/HLC-λ [1, 3, 6, 28] jsou v případě modifikovaného indexu HLC-r získávány jen kladné hodnoty, takže odpadá nepraktická manipulace s velmi nízkými hodnotami ztěžujícími analýzu a vyžadujícími stanovení separátních limitů pro nemocné s LŘ-κ a λ [10, 15, 28]. Na rozdíl od významného přínosu vyšetření HLC-r vyznělo vyhodnocení vztahu FLC-r k PFS ve všech třech souborech a s použitím různých cut-off nevýznamně, i když v celkové sestavě nemocných a s IgA izotypem MM naznačovaly zřetelně odlišné mediány a křivky PFS tendenci k statisticky diferentnímu vztahu. Statisticky nevýznamný vztah FLC-r k PFS byl zaznamenán i při použití cut-off > 100 a < 0,01, tj. hodnot FLCr doporučených jako indikátorů zahájení léčby u asymptomatické formy MM [26]. Chybění vztahu FLC-r a/nebo hladin FLC k OS zaznamenaly ale i některé předchozí studie [2, 41]. Ve studii Ludwiga byl zjištěn, stejně jako v naší analýze, vyšší přínos indexu HLC-r nežli FLC-r, neboť normalizace HLC-r měla ve srovnání s FLC-r užší vztah k PFS [2]. Jiné studie ovšem prokázaly statisticky významný vztah FLC-r k OS [18, 42], včetně zvýšení vztahu stážování podle ISS k OS po přidání indexu FLC-r [43]. Jednoznačný praktický přínos FLC vyplývá ze zařazení mezi IMWG kritéria „stringentní“ KR, schopnosti detekce fenoménu „FLC escape“ jako výrazu klonální heterogenity a nepříznivé prognózy MM [7, 25, 44] i průkazu vztahu vysokých hladin FLC k pokročilosti MM vyhodnocené podle ISS a SWOG („South West Oncology Group“) [45]. Vysoké hodnoty FLC v séru > 100 000 mg/l jsou provázeny agresivním průběhem MM s vysokou mortalitou [46], vysoké hodnoty FLC a FLC-r jsou rovněž prognostickým faktorem evoluce asymptomatické formy MM ve formu symptomatickou [47]. Ze statisticky nevýznamného vztahu FLC-r k PFS v naší i v některých dalších studiích je zřejmé, že k jeho prognostickému uplatnění je zapotřebí řada dalších vlivů, např. porucha renální funkce, zvolená terapie aj. MFC jako perspektivní, stále využívanější technika poskytuje pružnou informaci o změnách v plazmocelulárním kompartmentu MM v kterékoliv fázi nemoci a na podkladě odhalených imunofenotypických aberací odlišení nádorového klonu (A-PC) od normálních plazmocytů (N-C) [21, 23]. Procentuální zastoupení plazmatických buněk a jejich aberantních i normálních forem jsou podle dosavadních zpráv nezávislým prognostickým faktorem s dopadem na PFS i OS [21, 23, 27]. Naše analýza ale neprokázala přes použití odlišných cut-off (2,8 %, 5 % a 20 %) v žádném souboru statisticky významný vztah počtu N-PC k PFS, i když nápadná průběhová odlišnost křivek PFS korespondovala spíše se závěrem, že nemocní s > 5% výskytem N-PC v KD se vyznačují příznivější odezvou k léčbě a delším trváním PFS. Je uváděno, že tato skupina nemocných s MM se vyznačuje nižším výskytem rizikových cytogenetických změn, příznivější konstelací prognostických faktorů (Hb, plazmocyty KD, výše MIg), nižším výskytem imunoparézy, příznivějšími výsledky VDT/ATKB a především delším trváním PFS, takže představuje specifickou skupinu MM s unikátními biologickými vlastnostmi a s prodlouženým OS [21, 27]. Nevýznamně vyzněl – na rozdíl od předchozích analýz – vztah výskytu A-PC k PFS, a to přes použití 3 odlišných cut-off (97,7 %, 95 % a 75 %) a odlišnost křivek PFS. S významným vztahem k délce PFS se nesetkalo ani použití indexu A/N-PC (cut-off odpovídal mediánu poměru A/N-PC naší sestavy), přestože obdobně jako v případě N-PC a A-PC byly přítomny zřetelně odlišné křivky PFS. Nepotvrdil se rovněž úvodní předpoklad, že délka PFS bude rezonovat s hodnotou indexu monoklonality plazmocytů (index κ/λ, resp. λ/κ PC-r podle exprese LŘ), i když křivky PFS se v celé sestavě nápadně lišily. Chybění statistické významnosti může spočívat ve volbě neoptimálního cut-off (použit medián souborů), nedostatečné kohortě nemocných, různorodosti terapie a dalších vlivů. O heterogenním postavení FLC, HLC a MFC v hodnocení hloubky léčebné odezvy vypovídají výsledky studie, porovnávající výsledky všech tří technik [48].
V průběhu 40letého období od sestavení prvního stratifikačního systému MM Duriem a Salmonem bylo navrženo více než 30 stážovacích systémů odvozených od stále sofistikovanějších prognostických faktorů v naději na stále účelnější prognostickou stratifikaci MM, umožňující výběr účelné, individuálně pojaté léčby [49]. Stratifikační model podle Mayo Clinic (mSMART), založený na výsledcích cytogenetické (FISH) analýzy, TC systém vycházející z exprese cyklinu D1–3 a typu IgH translokace stejně jako model rizikovosti založený na genové expresní analýze se v praxi neprosadily. Většina ostatních stratifikačních systémů byla odvozena od pilotního systému Batailleho [50] a používala vedle β2-M další parametr, např. propidium-iodidový proliferační index plazmocytů, morfologii myelomových buněk, hladinu některého z cytokinů, index FLC-r, markery kostního obratu, výsledky MR (magnetická rezonance) nebo FDG-PET/CT (fluorodeoxyglukózová-pozitronová emisní tomografie/počítačová tomografie) a řadu dalších ukazatelů [49]. Od roku 2003 standardně zavedená stratifikace podle ISS se dočkala revize (R-ISS) rozšířením dosavadních kritérií o výsledky iFISH analýzy a hodnotu laktátdehydrogenázy (LDH) v séru [51]. Naše studie se věnovala analýze dvou nových stratifikačních rizikových modelů, v nichž vedle β2-M figuruje jako další kritérium index HLC-r [52]. Stratifikace podle AL-SS prokázala pouze v celém souboru MM statisticky významný vztah rizikových skupin 1–3 k PFS, prognosticky významněji vyzněl model podle L-SS s vysoce signifikantním vztahem rizikových skupin 1–3 k PFS v celém souboru a hraničně v souboru s KT. Výborný stratifikační potenciál indexu HLC-r byl popsán i ve studii Bradwella, který s pomocí totožných kritérií jako v AL-SS prokázal významný vztah k PFS a kratší PFS v 3. rizikové kategorii oproti ISS [15]. Námi ověřený vztah modifikovaného indexu HLC-r k PFS nás přiměl k ověření jeho použitelnosti v rámci vlastního stratifikačního modelu, kde hodnota cut-off odpovídala v souladu s rozdílnostmi mezi IgG a IgA izotypem MM mediánům HLC-r v IgG a IgA podsouborech v celém souboru MM [15, 34, 53, 54]. Kritéria olomouckého stratifikačního modelu (OL-SS): riziková skupina („low risk“) 1 - β2-M < 3,5 a HLC-r < 94,5 (u IgG MM < 68,8, u IgA < 592); skupina 2 („intermediate risk“): β2-M ≥ 3,5 nebo HLC-r ≥ 94,5 (u IgG MM ≥ 68,8 a u IgA ≥ 592); skupina 3 („high risk“): současná přítomnost β2-M ≥ 3,5 a HLC-r ≥ 94,5 (u IgG MM ≥ 68,8, u IgA ≥ 592). Z analýzy vyplynulo, že vztah OL-SS k PFS vyzněl v jednotlivých rizikových skupinách v celkovém souboru MM a v souboru léčeném KT téměř stejně jako stratifikace podle L-SS a v souboru léčeném VDT/ATKB dokonce významněji. Z komplexního srovnání všech 5 analyzovaných stratifikačních systémů ovšem vyplynulo, že standardní stážovací systém podle ISS prokázal ve všech třech námi analyzovaných souborech poněkud významnější vztah k PFS než stážovací modely podle AL-SS, L-SS a OL-SS, takže využití těchto nově sestavených modelů v klinické praxi se nejeví z hlediska PFS účelné.
ZÁVĚR
Vyšetření HLC (HevyliteTM) je přínosnou, i když komplementární metodou překonávající limitace většiny konvenčních technik, poskytující oproti hodnotě MIg hlubší informaci o biologických vlastnostech plazmocelulárního kompartmentu včetně hloubky specifické imunoparézy u IgG a IgA typu MM. Z předložené studie vyplývá, že na rozdíl od FLC-r (FreeliteTM) a od výskytu abnormálních, normálních plazmocytů a jejich vzájemného poměru (A/N-PC-r) a indexu monoklonality (κ/λ, resp. λ/κ PC-r) vyšetřené s pomocí MFC poskytuje výpočet modifikovaného indexu HLC-r ( i-HLC/u-HLC, HevyliteTM) rychlou, kvantitativní a dynamickou informaci o poměru hladin myelomového/normálního imunoglobulinu, vyznačující se navíc i statisticky významným vztahem k PFS. Index HLC-r je tedy vhodným, snadno dostupným nositelem prognostické informace, vyjadřující reálné nebezpečí progrese MM. Vzhledem k tomu, že všechny tři nové stratifikační modely, tj. AL-SS, L-SS a OL-SS, založené na hodnotách indexu HLC-r neprokázaly ve srovnání se standardním ISS systémem těsnější vztah k PFS, nelze je považovat za přínosné obohacení dosavadního spektra stratifikačních postupů používaných v klinické praxi.
Seznam použitých zkratek
AL-SS – stratifikační systém podle Aveta--Loiseaua
A-PC – abnormální plazmocyt
A/N-PC-r – poměr abnormálních/normálních plazmocytů
ATKB – autologní transplantace kmenových buněk
D-S – stážovací systém podle Durieho-Salmona
FDG-PET/CT – fluorodeoxyglukózová-pozitronová emisní tomografie/počítačová tomografie
FLC – volné lehké řetězce imunoglobulinu („free light chains of immunoglobulin“)
FLC-r – poměr lehkých řetězců séra κ/λ („ratio of immunoglobulin free light chains“)
IFE – imunofixační elektroforéza
Ig – imunoglobulin
ISS – „International Staging System“
HLC – pár těžkých/lehkých řetězců imunoglobulinu („immunoglobulin heavy/light chain pairs“)
HLC-r – poměr párů těžkých/lehkých řetězců immunoglobulinu („immunoglobulin heavy//light chain ratio“)
i-HLC – „involved-heavy/light chain immunoglobulin“
IMWG – „International Myeloma Working Group“
KD – kostní dřeň
KT – konvenční terapie
L-SS – stážovací systém podle Ludwiga
LŘ – lehký řetězec
M – medián trvání choroby od diagnózy do progrese nebo úmrtí (medián délky „progression free survival“)
MFC – multiparametrická průtoková cytometrie
MGUS – monoklonální gamapatie nejistého původu („monoclonal gammopathy of undetermined significance“)
MIg – monoklonální imunoglobulin
MM – mnohočetný myelom
MR – magnetická rezonance
N-PC – normální plazmocyt
OL-SS – stážovací systém Olomouc
OS – celkové přežití
PC-κ/λ-r – poměr plazmocytů typu κ/λ
PFS – interval od zahájení léčby do progrese nebo úmrtí („progression free survival“)
PIg – polyklonální imunoglobulin
SPE – elekroforéza proteinů séra
TC – stratifikační systém založený na zhodnocení typu IgH translokace a typu i hodnotách cyklinu D1-D3
u-HLC – „uninvolved heavy/light chain immunoglobulin“
VDT – vysoce dávkovaná terapie
X – doposud nevyhodnotitelná délka me-diánu intervalu do progrese nemoci
Podíl autorů na přípravě rukopisu
VŠ – příprava podkladů pro statistiku a sestavení rukopisu
PL – biochemické vyšetření (FreeliteTM a HevyliteTM)
MN – vícebarevná průtoková cytometrie plazmocytů
TP, JM – zpracování klinických dat pacientů
KL – statistická analýza
Poděkování
Publikace vznikla za podpory grantové studie IGA MZ ČR NT/12451/5.
Čestné prohlášení autorů
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Doručeno do redakce dne 27. 10. 2015.
Přijato po recenzi dne 10. 12. 2015.
prof. MUDr. Vlastimil Ščudla, CSc.
III. interní klinika NRE a Hemato-onkologická klinika LF UP a FN v Olomouci
I. P. Pavlova 6
779 00 Olomouc
e-mail: vlastimil.scudla@fnol.cz
Sources
1. Bradwell AR, Harding SJ, Fourrier NJ, et al. Assessment of monoclonal gammopathies by nephelometric measurement of individual immunoglobulin κ/λ ratios. Clin Chemistry 2009; 55 : 1646–1655.
2. Ludwig H, Milosavljevic D, Zojer N, et al. Immunoglobulin heavy/light chain ratios improve paraprotein detection and monitoring, identify residual disease and correlate with survival in multiple myeloma patients. Leukemia 2013; 27 : 213-219.
3. The Binding Site Group Ltd, editor. Serum free light chain analysis plus Hevylite. 7 th ed. Birmingham: The Binding site Ltd, 2015.
4. Hájek R, Adam Z, Ščudla V, et al. Doporučení České myelomové skupiny 2012: Diagnóza a léčba mnohočetného myelomu. Transfuze Hematol dnes 2012; 18 : 5-89.
5. Keren DF. Heavy/light-chain analysis of monoclonal gammopathies. Clin Chemistry 2009; 55 : 1606–1608.
6. Katzmann JA, Kyle RA, Benson J, et al. Screening panels for detection of monoclonal gammopathies. Clin Chemistry 2009; 55 : 1517–1522.
7. Dispenzieri A, Kyle RA, Merlini G, et al. International Myeloma Working Group guidelines for serum-free light chain analysis in multiple myeloma and related disorders. Leukemia 2009; 23 : 215–224.
8. Alexanian R. Blood volume in monoclonal gammopathy. Blood 1997; 49 : 301–307.
9. Akilesh S, Christianson GJ, Roopenian DC, Shaw AS. Neonatal FcR expression in bone marrow-derived cell functions to protect serum IgG from catabolism. J Immunol 2007; 179 : 4580–4588.
10. Avet-Loiseau H, Harousseau JL, Moreau P, et al. Heavy/light chain specific immunoglobulin ratios at presentation are prognostic for progression free survival in the IFM 2005-01 Myeloma Trial. Blood 2009; 114 : 722.
11. Avet-Loiseau H, Mirbahai L, Harousseau JL, et al. Serum immunoglobulin heavy/light chain ratios are independent risk factors for predicting progression free survival in multiple myeloma. Haematologica 2010; 95 : 395.
12. Ludwig H, Faint J, Zojer N, Bradwell AR. Serum heavy/light chain and free light chain measurements provide prognostic information, allow creation of a prognostic model and identify clonal changes (clonal tiding) through the course of multiple myeloma. Blood 2011; 118 : 1244.
13. Ščudla V, Pika T, Minařík J. Význam vyšetření párů těžkých/lehkých řetězců imunoglobulinu (HevyliteTM) u mnohočetného myelomu. Trans Hematol dnes 2014; 12 : 107–116.
14. Greipp PR, San Miguel JF, Fonseca R, et al. Development of an International prognostic index (IPI) for myeloma: report of the International Myeloma Working Group. Hemat J 2003; 4 (Suppl 1): S 42–43.
15. Bradwell AR, Harding S, Fourrier N, et al. Prognostic utility of intact immunoglobulin Ig´kappa/Ig´lambda ratios in multiple myeloma patients. Leukemia 2013; 27 : 202–207.
16. International Myeloma Working Group criteria for the classification of monoclonal gammopathies, multiple myeloma and related disorders: a report of the International Myeloma Working Group. Brit J Haematol 2003; 121 : 749–757.
17. Larsen JT, Kumar SK, Dispenzieri A, et al. Serum free light chain ratio as a biomarker for high-risk smoldering multiple myeloma. Leukemia 2013; 27 : 941–946.
18. Kyrtsonis MCH, Theodoros P, Vassilakopoulos TP, et al. Prognostic value of serum free light chain ratio at diagnosis in multiple myeloma. Brit J Haematol 2007; 137 : 240–243.
19. Rajkumar SV, Dimopoulos MA, Palumbo A, et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol 2014; 15 : 538–548.
20. Rawstron AC, Orfao A, Beksac M, et al. Report of the European Myeloma Network on multiparametric flow cytometry in multiple myeloma and related disorders. Haematologica 2008; 93 : 431–438.
21. Paiva B, Almeida J, Perez-Andres M, et al. Utility of flow cytometry immunophenotyping in multiple myeloma and other clonal plasma cell-related disorders. Cytometry Part B (Clin Cytometry) 2010; 78 : 239–252.
22. Říhová L, Varmužová T, Zarbochová O, et al. Průtoková cytometrie u monoklonálních gamapatií. Klin Onkol 2011 b; (Suppl 1:S24-29).
23. Kovářová L, Hájek R. Prognostický význam imunofenotypizace plazmocytů u monoklonální gamapatie nejistého významu a nemocných s mnohočetným myelomem. Klin Biochem metab2011; 19(40):96-100.
24. Perez-Persona E, Vidriales M-B, Mateo G, et al. New criteria to identify risk progression in monoclonal gammopathy of undetermined significance and smoldering multiple myeloma based on multiparameter flow cytometry analysis of bone marrow plasma cells. Blood 2007; 110 : 2586–2592.
25. Durie BGM, Harousseau JL, Miguel JS, et al. International uniform response criteria for multiple myeloma. Leukemia 2006; 20 : 1467–1473.
26. Ghobrial IM, Landgren O. How I treat smoldering multiple myeloma. Blood 2014; 124 : 3380–3388.
27. Paiva B, Vidriales MB, Mateo G, et al. The persistence of immunophenotypically normal residual bone marrow plasma cells at diagnosis identifies a good prognostic subgroup of symptomatic multiple myeloma patients. Blood 2009; 114 : 4369–4372.
28. Gaiser FA. Importance of the Hevylite-assay in the diagnosis and the relapse respectively progress control in multiple myeloma. Dostupné na www: http://www.freidok.uni-freiburg.de/volltexte/9848/.
29. Harding S, Young P, Di Fazio, et al. Intact immunoglobulin heavy/light chain paired assays. Biochem Clin 2013; 37 : 365–369.
30. Harutyunyan NH, Vardanyan S, Ghermezi M, et al. Levels of uninvolved and involved immunoglobulin predict clinical status and progres-sion free survival for multiple myeloma patients. J Hematol Reports 2015; 7 (Suppl. 1): 25.
31. Koulieris E, Panayiotidis P, Harding SJ, et al. Ratio of involved/uninvolved immunoglobulin quantification by HevyliteTM assay: clinical and prognostic impact in multiple myeloma. Exp Hematol Oncol 2012; 1 : 9–15.
32. Lopez-Anglada L, Cueto-Felqueroso C, Mateos MV, et al. Potential prognostic value of heavy-light chains ratio in symptomatic multiple myeloma. J Hematol Reports 2015; 7 (Suppl. 1): 27.
33. Batinic J, Perič Z, Šegulja D, et al. Immunoglobulin heavy/light chain analysis enhances the detection of residual disease and monitoring of multiple myeloma patients. Croat Med J 2015; 56 : 263–271.
34. Scudla V, Lochman P, Pika T, et al. Relationship of differences in immunoglobulin heavy/light chain pairs (HevyliteTM), selected laboratory parameters and stratification systems in different immunochemical types of multiple myeloma. Biomed Pap Med Fac Univ Palacky Olomouc 2015; 159: (in press). Doi:10.5507/bp.2015.032 (Epub ahead of print).
35. Maisnar V, Pour L, Pika T, et al. The significance of Hevylite test for determination of prognosis in patients with asymptomatic multiple myeloma-the results of a new CMG project. Clin Lymphoma Myeloma Leukemia 2015; 15 (Suppl. 3): e120, P0–072.
36. Hari P, D´Souza A, Pasquini M, et al. Prognostic value of pre-transplant complete remission by free light chain and heavy/light chain ratios vs. conventional criteria-long term results of the BMT CTN 0102 study. J Hematol Reports 2015; 7 (Suppl. 1): 24–25.
37. Tovar N, Fernandez de Larrea C, Elena M, et al. Prognostic impact of serum immunoglobulin heavy/light chain ratio in patients with multiple myeloma in complete remission after autologous stem cell transplantation. Biol Blood Marrow Transpl 2012; 18 : 1076–1079.
38. Katzmann JA, Clark R, Kyle RA, et al. Suppression of uninvolved immunoglobulins defined by heavy/light chain pair suppression is a risk factor for progression of MGUS. Leukemia 2013; 27 : 208–212.
39. Espino M, Medina S, Blanchard MJ, et al. Involved/uninvolved immunoglobulin ratio identifies monoclonal gammopathy of undetermined significance patients at high risk of progression to multiple myeloma. Brit J Haematol 2014; 164 : 752–755.
40. Pika T, Lochman P, Sandecka V, et al. Immunoparesis in MGUS – Relationship of uninvolved immunoglobulin pair suppression and polyclonal immunoglobulin levels to MGUS risk categories. Neoplasma 2015; 62 : 827–832.
41. Mead GP, Carr-Smith HD, Drayson MT, et al. Serum free light chains for monitoring multiple myeloma. Brit J Haematol 2004; 126 : 348–354.
42. Drayson M, Begum G, Basu S, et al. Effects of paraprotein heavy light chain types and free light chain load on survival in myeloma: an analysis of patients receiving conventional - dose chemotherapy in Medical Research Council UK multiple myeloma trials. Blood 2006; 108 : 2013–2019.
43. Snozek CL, Katzmann JA, Kyle RA, et al. Prognostic value of the serum free light chain ratio in newly diagnosed myeloma: proposed incorporation into the International staging system. Leukemia 2008; 22 : 1933–1937.
44. Brioli A, Giles H, Pawlyn Ch, et al. Serum free immunoglobulin light chain evaluation as a marker of impact from intraclonal heteroge-neity on myeloma outcome. Blood 2014; 123 : 3414–3419.
45. Pika T, Zemanová M, Minařík J, et al. Vztah sérových hladin volných lehkých řetězců imunoglobulinu ke stupni pokročilosti mnohočetného myelomu. Transfuze Hematol dnes 2007; 13 : 12–15.
46. Stadtmauer EA, Wang J, Offin MD. Very high serum free light chain concentrations (Above 10 000 mg/l) predict high early mortality from multiple myeloma. J Hematol Reports 2015; 7 (Suppl. 1): 29.
47. Kastritis E, Terpos E, Moulopoulos L, et al. Extensive bone marrow infiltration and abnormal free light chain ratio identifies patients with asymptomatic myeloma at high risk for progression to symptomatic disease. Leukemia 2013; 27 : 947–953.
48. Matsue K, Sugihara H, Nishida Y, et al. Heterogeneity of IMWG defined response assessed by FLC assay, multicolor flow cytometry, and heavy/light chain analysis. Clin Lymphoma Myeloma Leukemia 2013; 13: P-203a.
49. Scudla V, Zemanova M, Minarik J, et al. International prognostic index (IPI) – a critical comparison with five multiple myeloma staging systems in the group of 270 patients treated by conventional chemotherapy. Neoplasma 2006; 53 : 277–284.
50. Bataille R, Grenier J, Sany J. Beta2-microglobulin in myeloma: optimal use for staging, prognosis and treatment - a prospective study of 160 patients. Blood 1984; 63 : 468–476.
51. Palumbo A, Avet-Loiseau H, Oliva S et al. Revised International staging system for multiple myeloma: A report from International Myeloma Working Group. J Clin Oncol 2015; 33 : 2863–2869.
52. Koulieris E, Maltezas D, Eytychia N, et al. Impact of novel M - component based biomarkers on to progression free survival after treatment in intact immunoglobulin in multiple myeloma. Blood 2012; 120 : 2927.
53. Katzmann JA, Willrich MAV, Kohlhagen MC, et al. Monitoring IgA multiple myeloma: immunoglobulin heavy/light chain assays. Clin Chemistry 2015; 61 : 360–367.
54. Boyle EM, Fouquet G, Guidez S, et al. IgA kappa/IgA Lambda heavy/light chain assessment in the management of patients with IgA myeloma. Cancer 2014; 120 : 3952–3957.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2016 Issue 1-
All articles in this issue
- Prognostické faktory u chronické myeloidní leukemie: můžeme kombinací získat více?
- Analýza vztahu poměru volných lehkých řetězců (FLC-r, FreeliteTM), párů těžkých/lehkých řetězců imunoglobulinu (HLC-r, HevyliteTM) v séru a výsledků multiparametrické průtokové cytometrie plazmocytů k „progression free survival“u mnohočetného myelomu
- Autologní transplantace kmenových buněk u Waldenströmovy makroglobulinemie
- Konsenzuální doporučení Českého národního hemofilického programu (ČNHP) pro zajištění chirurgických a invazivních výkonů u pacientů s hemofilií
- Konsenzuální doporučení Českého národního hemofilického programu (ČNHP) pro diagnostiku a léčbu pacientů s vrozenou hemofilií a s inhibitorem FVIII/FIX
- Chronická myeloidní leukemie – standardizace molekulárního monitorování hladiny transkriptů BCR-ABL1 v České republice
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Prognostické faktory u chronické myeloidní leukemie: můžeme kombinací získat více?
- Chronická myeloidní leukemie – standardizace molekulárního monitorování hladiny transkriptů BCR-ABL1 v České republice
- Konsenzuální doporučení Českého národního hemofilického programu (ČNHP) pro zajištění chirurgických a invazivních výkonů u pacientů s hemofilií
- Analýza vztahu poměru volných lehkých řetězců (FLC-r, FreeliteTM), párů těžkých/lehkých řetězců imunoglobulinu (HLC-r, HevyliteTM) v séru a výsledků multiparametrické průtokové cytometrie plazmocytů k „progression free survival“u mnohočetného myelomu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

