-
Medical journals
- Career
Retransfuzní systém s dvojitou integrovanou filtrací – parametry kvality produktu
Authors: Š. Maříková 1; L. Řehořová 1,5; R. Mizera 2; L. Walterová 3; I. Ouhrabková 4; R. Procházková 1,5
Published in: Transfuze Hematol. dnes,20, 2014, No. 4, p. 117-124.
Category: Comprehensive Reports, Original Papers, Case Reports
Overview
Úvod.
Retransfuzní systém umožňuje sběr krve pacienta z operačního pole pomocí odvodných drénů a její zpětnou transfuzi. Cílem práce bylo stanovení kvalitativních a kvantitativních změn biologických parametrů krve shromážděné pomocí retransfuzního systému a ověření bezpečnosti pro pacienta.Materiál a metoda.
Hodnoceny byly standardní parametry jakosti přípravku, které byly porovnány se souborem erytrocytů bez buffy-coatu resuspendovaných (EBR), markery buněčného poškození erytrocytu, které byly porovnány s historickým souborem erytrocytů z aferézy resuspendovaných (EAR) a koagulační parametry. Ke statistickému hodnocení byl použit Shapiro-Wilk test, neparametrický Mann-Whitney test a parametrický dvouvýběrový t-test. Statistická významnost byla posouzena na hladině p < 0,05.Výsledky.
Hodnoty hemoglobinu a hematokritu byly u retransfuze významně nižší v porovnání s EBR (Hb 93 ± 24 g/l v. 197 ± 10 g/l; Ht 0,28 ± 0,07 v. 0,59 ± 0,03; p < 0,001). Retransfuze vůči EBR vykázala významně vyšší příměs leukocytů (11,9 ± 4,0 × 109/l v. 2,2 ± 1,3 × 109/l; p < 0,001) a vyšší hladinu volného hemoglobinu splňující požadavek na jakost (0,42 ± 0,14 % v. 0,34 ± 0,17 %; p < 0,05). Hladina kalia, LDH a laktátu v retransfuzích byla významně vyšší než u EAR na začátku skladování (p < 0,001), ale významně nižší v porovnání s EAR na konci skladování. Retransfuze vykázaly významně nižší hodnoty pH proti EAR na začátku skladování (p < 0,001) a významně vyšší pH ve srovnání s EAR na konci skladování (p < 0,001). Hladina triacylglycerolů v přípravku byla zvýšená (2,21 ± 0,85 mmol/l). Hodnoty PT, APTT, TT a fibrinogenu byly neměřitelné. Hladina D-dimerů byla výrazně zvýšená (> 10 mg/l FEU) a hladina ATIII snížená (42,6 ± 7,4 %). Bakteriální kontaminace nebyla prokázána.Závěr.
Retransfuze má proti EBR přibližně poloviční obsah hemoglobinu, není tedy plnohodnotným ekvivalentem erytrocytových koncentrátů. Procento hemolýzy v erytrocytární mase splňuje požadavky na standardní erytrocytový přípravek. Zvýšená hladina kalia a LDH souvisí s destrukcí erytrocytů. Vzhledem k neměřitelným hodnotám koagulačních testů a hladině fibrinogenu retransfuze nemá substituční vliv na plazmatickou koagulaci. Otázka trombogenicity retransfuzí není zcela zodpovězena a zasluhuje další zkoumání. Na základě zjištěných výsledků se jeví retransfuze pro pacienta jako relativně bezpečná.Klíčová slova:
retransfuze, retransfuzní systém, erytrocyty bez buffy coatu resuspendované, erytrocyty z aferézy resuspendovanéÚvod
Operace náhrady kolenního kloubu je spojena se značnými ztrátami krve a transfuze jsou často nezbytné. Alogenní krevní transfuze s sebou nesou celou řadu potencionálních rizik. Jednou z možností, jak se vyhnout rizikům spojeným s výskytem infekčních a imunologických komplikací provázejících transfuze cizí krve, je využití retransfuzních systémů (1, 2, 3, 4, 5, 6, 7). Výhodou tohoto postupu je i snížení nákladů na erytrocytové transfuzní přípravky během ortopedických operací (2, 3, 8). Dalším důvodem k použití retransfuzních systémů je jejich jednoduché použití. Literatura uvádí nízký počet potransfuzních reakcí v souvislosti s podáním nepromyté krve získané sběrem z operačního pole (5, 6, 9). Nevýhodou využití retransfuze může být potenciální riziko sekundární mikrobiální kontaminace (10). K dalším nevýhodám patří nízký hematokrit (Ht), vyšší obsah volného hemoglobinu a různé kontaminanty v nepromytých retransfuzích (leukocyty, lipidové částice, fragmenty kostí, nádorové buňky, mediátory zánětu a další) (11, 12). Dalším problémem je kvalitativní i kvantitativní variabilita, která znemožňuje využití kontroly jakosti dle standardů transfuzní medicíny. V úvahu je třeba vzít i individuální hladinu kontaminantů a individuální kompenzační kapacitu příjemce, což jsou vlivy, které znesnadňují obecné stanovení bezpečného objemu transfundované nepromyté krve (13). Mezi kontraindikace retransfuze patří nádorová onemocnění, bakteriální infekce, hematologická onemocnění, jaterní nebo ledvinové selhání (6, 14).
Pooperační retransfuze při využití retransfuzního systému s integrovaným filtrem spočívá ve sběru krve z operačního pole pomocí odvodných drénů a její zpětné podání pacientovi po přefiltrování. Zpětný převod je realizován do šesti hodin od začátku sběru, avšak literatura uvádí i možnost sběru a převodu mezi šestou a dvanáctou hodinou. V tomto případě nebyl zjištěn významný rozdíl v parametrech kvality krve s výjimkou vyšší hladiny interleukinu-6, což může mít za následek zvýšené riziko nehemolytické febrilní potransfuzní reakce (11). Retransfuze může být provedena za pomoci celé řady retransfuzních systémů, které se mohou lišit systémem filtrace (15), promytím či nepromytím krve před podáním pacientovi (6, 12, 13, 16), systémem sání z drénů (9) a koncentrováním či nekoncentrováním sbírané krve. Literatura uvádí retransfuzní systémy pracující na principu jednoduché (5, 11) nebo dvojité filtrace (17), integrované filtry slouží k odstranění makroagregátů, fragmentů buněk, úlomků kostní tkáně a mikroagregátů. Některé systémy obsahují deleukotizační filtry nebo je možné použití přídavných leukoredukčních filtrů (15). Současně lze využít systémy sloužící k promytí krve po sběru z drénů, jejichž princip je založen na filtraci, centrifugaci a promytí fyziologickým roztokem. Výsledným produktem tohoto postupu jsou promyté erytrocyty (6, 12, 13, 16, 17). Proti tomu aplikace nepromyté krve není alternativou erytrocytových transfuzních přípravků vzhledem k nižšímu obsahu hemoglobinu (6). Většina systémů uváděná v literatuře využívá konstantní sací tlak během sběru krve z operačního pole (5, 11). Signifikantní rozdíl v procentu hemolýzy na in vitro modelu byl zjištěn při použití retransfuzních systémů s odlišným systémem sání. Použití zařízení s variabilním tlakem sání významně snižuje procento hemolýzy v porovnání se systémem pracujícím za konstantního tlaku (9). Další možností je přidání antikoagulantu do krve ve sběrném vaku, což ovšem není nutné vzhledem ke konsumpci fibrinu (5, 18).
V průběhu sběru a skladování mohou krevní buňky podléhat metabolickým změnám, dochází k aktivaci koagulační kaskády. Při posouzení těchto změn byly v literatuře hodnoceny markery buněčného poškození erytrocytu jako procento hemolýzy erytrocytové masy, hodnota pH, hladina draslíku (K+), laktátdehydrogenázy (LDH) a laktátu (5, 6, 10, 11, 13, 17). Dále byly zkoumány koagulační parametry (PT, APTT, TT, D-dimery, AT III, fibrinogen) s cílem zjistit stupeň aktivace koagulace a spotřeby koagulačních faktorů (17, 18, 19). S ohledem na bezpečnost pro pacienta byly hodnoceny parametry jako obsah hemoglobinu (Hb), kontaminace leukocyty a trombocyty, sterilita (5, 6, 10, 11, 13, 16, 17). Navíc bylo v některých studiích provedeno vyšetření triacylglycerolů (TAG) s cílem zjistit míru kontaminace krve lipidovými částicemi (5, 11).
Materiál a metoda
Cílem prospektivní studie bylo stanovení kvalitativních a kvantitativních změn biologických parametrů krve shromážděné pomocí retransfuzního systému a ověření bezpečnosti pro pacienta.
V prospektivní studii byl použit autotransfuzní systém ATS Bulb Set (10705, Redax, Poggio Rusco, Itálie) ve standardní verzi s dvojitou integrovanou filtrací. První 200mikronový filtr je umístěn v silikonové sběrné baňce o objemu 400 ml, druhý 40mikronový je vestavěn ve sběrném transfuzním vaku o objemu 1000 ml. Dvojitá filtrace zaručuje separaci makroagregátů i mikroagregátů před transfuzí a není tedy nutné využití dalších přídavných filtrů. Kontinuální drenáž rány je zaručena automatickým převodem krve ze sběrné baňky do transfuzního vaku po gravitačním spádu. Tento set generuje počáteční podtlak o hodnotě -50 mmHg (6,6 kPa) a poté pracuje při tlaku okolo – 30 mmHg (4 kPa). Krev se shromažďuje do sběrného vaku maximálně do pěti hodin od připojení a zpětný převod krve musí být proveden do 6 hodin od počátku sběru. Obrázek 1 znázorňuje retransfuzní set ATS Bulb Set ve verzi s pružinou ve sběrné baňce.
Image 1. Retransfuzní set ATS Bulb Set (verze s pružinou v odběrné baňce). 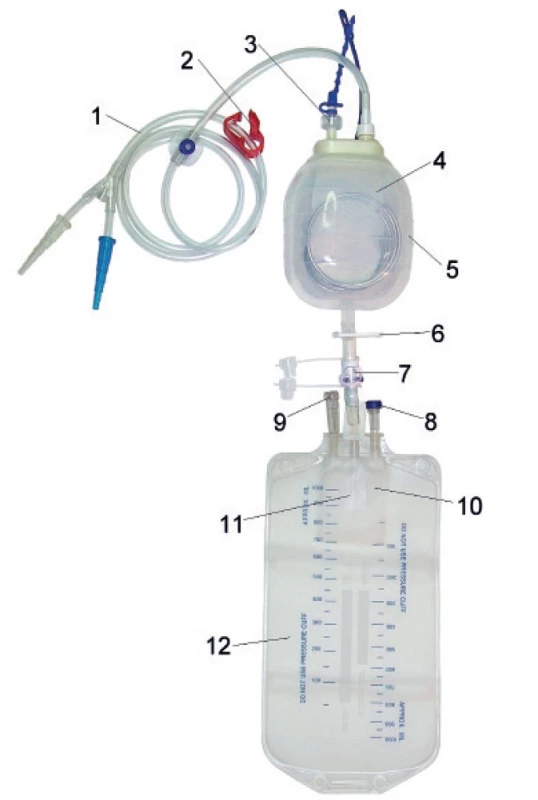
1 – drenážní trubice pacienta, 2 – svorka, 3 - jednosměrný ventil, 4 – makroagregátový filtr, 5 – silikonová baňka, 6 – výstupní svorka, 7 – připojení autotransfuzní jednotky, 8 – víčko pro diagnostiku proniknutelné injekční jehlou, 9 – konektor s membránou proniknutelnou injekční jehlou (pro připojení infuzního setu), 10 – mikroagregátový filtr, 11 – zpětný ventil, 12 – autotransfuzní jednotka (sběrný vak). Zkoumaný soubor se skládal z 30 pacientů, kteří podstoupili operaci výměny kolenního kloubu. Ve skupině bylo 14 žen a 16 mužů ve věku 47 až 84 let. Ve všech případech byla pooperační retransfuze zajištěna stejným typem autotransfuzního systému.
Vzorky pro vyšetření byly odebrány ze sběrného transfuzního vaku po šesté hodině od zahájení sběru krve pacienta. Vzorek pro stanovení parametrů kvality produktu byl odebrán do zkumavky s K3EDTA (BD Vacutainer 367863, Becton, Dickinson and Company, New Jersey, USA) a vzorek pro vyšetření koagulačních parametrů do zkumavky na citrát sodný (BD Vacutainer 363048, Becton, Dickinson and Company, New Jersey, USA). Vzorky pro vyšetření hemolýzy, pH a hladiny K+, LDH, laktátu a TAG byly odebrány do suchých zkumavek bez aditiv (Vacuette 454 229, Greiner Bio-One, Krems Münster, Rakousko) a dále zpracovány centrifugací 5 minut při 2249 g na laboratorní centrifuze Jouan C 3.12 (Jouan S. A., Francie). Vyšetření byla provedena ze získaného supernatantu. Z transfuzního vaku byly odebrány vzorky na zkoušku sterility, která byla provedena přímým očkováním do tekutých živných půd s pravidelnou kontrolou růstu mikroorganismů. Do thioglykolátové půdy byly přeneseny vzorky k průkazu anaerobních a aerobních bakterií při teplotě 36 °C až 38 °C, do půdy ze sójového a kaseinového hydrolyzátu při 20 °C k průkazu plísní a kvasinek a při 36 °C až 38 °C k průkazu aerobních bakterií.
Parametry jakosti retransfuze byly porovnány se souborem EBR na začátku skladování. Procento hemolýzy bylo porovnáno s hodnotami u EBR na konci skladování. Markery buněčného poškození byly porovnány s historickým souborem EAR (20, 21) na začátku a na konci skladování. Ke statistickému hodnocení byl po-užit Shapiro-Wilk test, neparametrický Mann-Whitney test a parametrický dvouvýběrový t-test. Statistická významnost byla posouzena na hladině p < 0,05.
Výsledky
Hodnocení bylo provedeno u všech 30 retransfuzí.
Objem krve sesbírané z operačního pole pomocí retransfuzního systému do pěti hodin od jeho připojení se pohyboval od 250 ml do 800 ml (průměr: 532,7 ml ± 181,3 ml; medián: 500,0 ml). Ve skupině pacientů zařazených do studie nebyla po zpětné reinfuzi zaznamenána žádná potransfuzní reakce.
Porovnání základních parametrů jakosti (obsah Hb, Ht, kontaminace leukocyty a trombocyty, procento hemolýzy) retransfuzí a EBR je uvedeno v tabulce 1 a v grafu 1. Hodnoty Hb a Ht u retransfuzí byly významně nižší v porovnání s EBR (p < 0,001). Retransfuze vůči EBR vykázala významně vyšší příměs leukocytů a trombocytů (p < 0,001). Hladina volného hemoglobinu byla vyšší v porovnání s EBR na konci skladování (p < 0,05), ale stále splňovala požadavek na jakost erytrocytového transfuzního přípravku dle Vyhl. 143/2008 Sb. (procento hemolýzy < 0,8 %). V souboru třiceti vzorků retransfuzí se procento hemolýzy pohybovalo od 0,24 % do 0,77 %, hraniční procento hemolýzy bylo zjištěno ve dvou případech (0,70 % a 0,77 %).
Table 1. Porovnání parametrů kvality retransfuze a EBR. 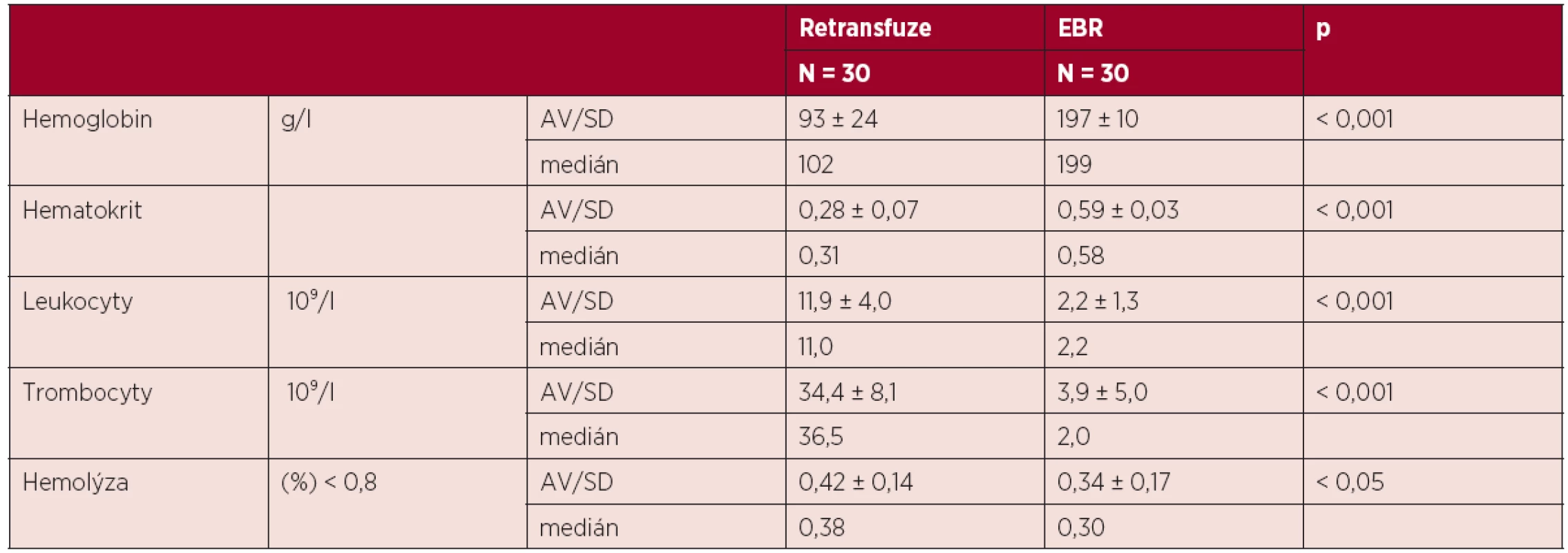
Legenda: EBR: erytrocyty bez buffy coatu resuspendované, p: statistická významnost Graph 1. Porovnání parametrů kvality retransfuze a EBR. 
Porovnání hladiny draslíku, LDH, laktátu a hodnot pH retransfuzí a EAR na začátku a na konci skladování přehledně uvádí tabulka 2 a graf 2. Koncentrace draslíku v retransfuzích byla významně vyšší než u EAR na začátku skladování (p < 0,001), ale na konci skladování byla hladina draslíku významně nižší (p < 0,001). Hladina LDH a laktátu retransfuzí byla v porovnání s EAR na začátku skladování také významně vyšší (p < 0,001), avšak hodnoty těchto parametrů u retransfuzí byly významně nižší (p < 0,001) proti EAR na konci skladování. Hodnota pH retransfuzí byla významně nižší proti pH EAR na začátku skladování (p < 0,001) a pohybovala se od 7,23 do 7,41. Hodnoty pH retransfuzí byly významně vyšší (p < 0,001) v porovnání s pH EAR na konci skladování.
Table 2. Porovnání markerů buněčného poškození erytrocytu retransfuze a EAR na začátku a konci skladování. 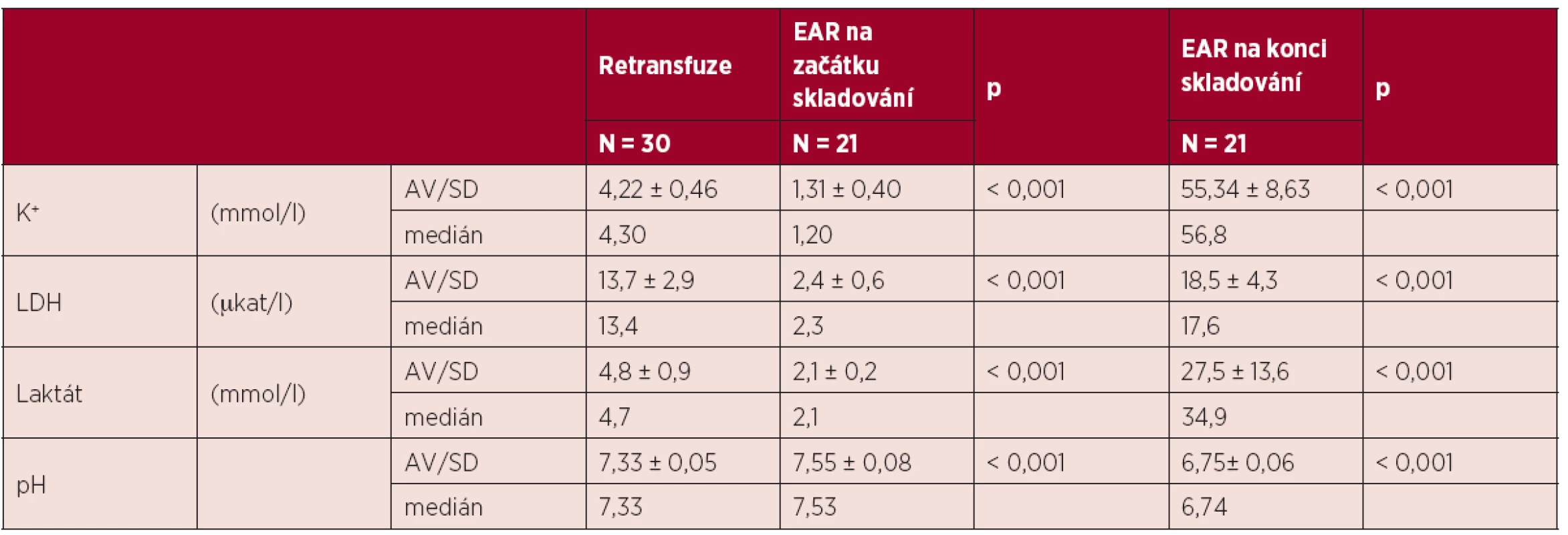
Legenda: EAR: erytrocyty z aferézy resuspendované, p: statistická významnost Graph 2. Porovnání markerů buněčného poškození erytrocytu retransfuze a EAR na začátku a na konci skladování. 
Hladina triacylglycerolů v přípravku byla zvýšená (2,21 ± 0,85 mmol/l) v porovnání s fyziologickými hodnotami. Hodnoty PT, APTT, TT a fibrinogenu byly neměřitelné. Hladina fibrinogenu byla pod hranicí detekce, PT a APTT byl delší než 300 s a TT delší než 180 s. Hladina D-dimerů byla výrazně zvýšená (> 10 mg/l FEU) v porovnání s fyziologickými hodnotami a hladina ATIII byla snížená (42,6 ± 7,4 %) vůči fyziologickým hodnotám. Bakteriální kontaminace krve odebrané retransfuzním systémem nebyla prokázána ani v jednom případě.
Diskuse
Retransfuze má ve shodě s literaturou proti EBR přibližně poloviční obsah hemoglobinu, není tedy plnohodnotným ekvivalentem erytrocytových transfuzních přípravků. Ze studií vyplývá, že erytrocyty v retransfuzích nemají významné morfologické abnormality a jejich osmotická fragilita i energetický metabolismus jsou normální (6, 10, 16, 22).
Statisticky významně vyšší počet leukocytů a trombocytů v retransfuzích vůči EBR je dán tím, že během výroby EBR je většina leukocytů a trombocytů odstraněna s buffy-coatem. Významně zvýšená kontaminace leukocyty proti standardnímu erytrocytovému přípravku by mohla pro pacienta znamenat riziko vzhledem k jejich možné degradaci a aktivaci (10, 13, 23). Vysoký obsah cytokinů uvolňujících se při rozpadu leukocytů by mohl zvýšit riziko potransfuzní reakce (10, 23). Z výše uvedeného důvodu je v praxi možné využít retransfuzní systém s leukoredukčním filtrem nebo přídavný leukoredukční filtr, avšak při porovnání v literatuře nebyl u pacientů po operaci zjištěn klinicky významný rozdíl v počtu leukocytů, hladině cytokinů a sérových proteinů akutní fáze (15). V porovnání s literárními zdroji byl počet leukocytů v našem souboru vyšší (5, 6, 11, 17). Literární zdroje uvádějí počet trombocytů buď nižší (6), srovnatelný (17), nebo i vyšší (5, 11) proti námi zjištěným hodnotám. Velký rozptyl obsahu trombocytů i leukocytů má pravděpodobně souvislost s použitým retransfuzním systémem.
V literatuře je s ohledem na vyšší hemolýzu nepromyté krve sbírané z operačního pole pomocí retransfuzního systému doporučena reinfuze maximálně 1000 ml až 1500 ml (10, 16). Námi zjištěné procento hemolýzy retransfuzí splňuje požadavky na standardní erytrocytový přípravek, mimo to bylo v praxi aplikováno maximální množství 800 ml. Z tohoto důvodu nepovažujeme hemolýzu u retransfuzí za riziko pro pacienta. Přesto vzhledem k výskytu hraničních výsledků u některých vzorků ze souboru (dva vzorky ze třiceti) pokládáme za vhodné zařazení namátkové kontroly procenta hemolýzy při operacích, kde je retransfuzní systém používán.
Významně vyšší hladina draslíku v retransfuzích proti EAR na začátku skladování může souviset s chirurgickým výkonem, během kterého dochází k rozpadu buněk a k uvolnění elektrolytů (13). Retransfuze mají významně nižší koncentraci draslíku proti EAR na konci skladování, u kterých během skladování dochází k významnému zvýšení hladiny kalia (20).
Retransfuze vykazuje významně vyšší hladinu LDH v porovnání s EAR na začátku skladování. LDH je přítomna v cytoplazmě buněk mnoha tkání, dochází k jejímu uvolnění při tkáňovém poškození a její vysoká hladina může být následkem chirurgického výkonu (10). Současně může být dle literárních zdrojů souvislost se zvýšeným procentem hemolýzy (10, 13), které ale v naší studii nebylo zjištěno.
U retransfuzí byla zjištěna významně vyšší hladina laktátu proti EAR na začátku skladování a byl prokázán statisticky významný rozdíl hodnot pH, kdy retransfuze vykazovaly významně nižší hodnotu pH v porovnání s EAR na začátku skladování. Hodnoty pH u retransfuzí se pohybovaly v rozmezí 7,2 až 7,4. Zvýšená koncentrace laktátu a související snížená hodnota pH odpovídá údajům z literatury (11, 17). Retransfuze dále vykázaly významně nižší hladinu laktátu a významně vyšší hodnotu pH v porovnání s EAR na konci skladování, u kterých v průběhu skladování došlo k významnému vzestupu hladiny laktátu a snížení pH (20).
Domníváme se, že zvýšená hladina K+ a LDH velmi pravděpodobně souvisí s destrukcí erytrocytů a buněk tkání během chirurgického výkonu a není způsobena alterací erytrocytů retransfuzním setem.
Zvýšená hladina TAG může být interpretována tak, že došlo k jejich uvolnění při destrukci buněk během chirurgického výkonu (11). V porovnání s ojedinělý-mi daty ze studií byla námi zjištěná hodnota vyšší přibližně o jednu třetinu (5, 11), což může být pravděpodobně způsobeno i rozdílností jednotlivých retransfuzních systémů. Interpretace je obtížná vzhledem k tomu, že hladina TAG může být ovlivněna i skladbou probandů zařazených do studie, u kterých nejsou známé údaje o hodnotách TAG před chirurgickým výkonem (věkové rozložení našeho souboru 47–84 let, medián 66 let).
Vzhledem k neměřitelným hodnotám PT, APTT, TT a hladině fibrinogenu retransfuze nemá substituční vliv na plazmatickou koagulaci z důvodu nepřítomnosti koagulačních faktorů (17, 18).
Vysoká hladina D-dimerů ve vzorcích krve ze sběrného vaku retransfuzního setu je pravděpodobně způsobena fibrinolýzou způsobenou chirurgickým výkonem (18, 19). Operace výměny kolenního kloubu vyvolává aktivaci koagulace a fibrinolýzy trvající po dobu až 30 dnů po operaci. Není však prokázáno, že by využití retransfuzního systému vedlo ke klinicky významné koagulopatii a jeví se tedy jako relativně bezpečné pro pacienty (18, 19). S ohledem na sporé údaje z literárních zdrojů není otázka trombogenicity retransfuzí zcela zodpovězena a zasluhuje další zkoumání.
Hladina AT III byla výrazně snížená proti fyziologickým hodnotám a současně byla přibližně o polovinu nižší než hodnota ze studie zabývající se koagulací nepromyté krve k retransfuzi (18).
V průběhu studie a současně z celkového počtu 128 retransfuzí za rok 2012 nebyla u žádného pacienta zaznamenána potransfuzní reakce po aplikaci krve z tohoto autotransfuzního systému. Literární zdroje také neuvádí zvýšený počet potransfuzních reakcí po aplikaci retransfuzí, ovšem je otázkou, nakolik mohou být údaje ovlivněny systémem hlášení a zachytitelností reakce v této souvislosti.
Sterilita byla vyšetřována stejným postupem jako u standardních transfuzních přípravků. Vzhledem k aplikaci retransfuze do šesti hodin od začátku sběru je riziko kontaminace významně redukováno.
Argumentem pro využití retransfuzních systémů bývá také snížení nákladů na erytrocytové transfuzní přípravky během ortopedických operací (2, 3, 8). Při porovnání ceny retransfuzního setu s cenou 1 T.U. autologního erytrocytového přípravku byly v našem případě náklady srovnatelné, při porovnání s 1 T.U. EBR nebyla úspora významná, pohybovala se v řádu cca 200 Kč. Dalším hlediskem je již zmíněný nižší obsah hemoglobinu v retransfuzích (přibližně poloviční), avšak při porovnání průměrného obsahu hemoglobinu na průměrný transfundovaný objem jsou standardní autologní přípravky a retransfuze srovnatelné. Na tomto místě je třeba zdůraznit, že transfundovaný objem retransfuzí v našem souboru byl velmi variabilní (250 ml až 800 ml) a stejně tak i obsah Hb (24,9 g/TD až 92,8 g/TD).
Závěr
Retransfuze má proti EBR přibližně poloviční obsah hemoglobinu, není tedy plnohodnotným ekvivalentem erytrocytových transfuzních přípravků. Procento hemolýzy splňuje požadavky na standardní erytrocytový přípravek. Vzhledem k výskytu hraničních výsledků u některých vzorků ze souboru by bylo vhodné provádění namátkových kontrol procenta hemolýzy při ortopedických operacích, kde je retransfuzní systém používán. Domníváme se, že zvýšená hladina K+ a LDH pravděpodobně souvisí s destrukcí erytrocytů a buněk tkání během chirurgického výkonu a není způsobena alterací erytrocytů retransfuzním setem. Vzhledem k neměřitelným hodnotám PT, APTT, TT a hladině fibrinogenu retransfuze neovlivňuje plazmatickou koagulaci z důvodu nepřítomnosti koagulačních faktorů. Otázka trombogenicity retransfuzí není zcela zodpovězena a zasluhuje další zkoumání. V průběhu studie a současně z celkového počtu 128 retransfuzí za rok 2012 nebyla u žádného pacienta zaznamenána potransfuzní reakce po aplikaci krve z tohoto autotransfuzního systému. Na základě zjištěných výsledků se jeví retransfuze pro pacienta jako relativně bezpečná při jejím správném použití.
Podíl autorů na rukopisu
Š. M. – příprava studie, organizace odběru vzorků, napsání rukopisu
L. Ř. – příprava studie, připomínkování rukopisu
R. M. – organizace odběru vzorků
L. W. – zajištění vyšetření vzorků, připomínkování rukopisu
I. O. – zajištění vyšetření vzorků
R. P. – návrh studie, připomínkování rukopisu, konečná kontrola rukopisu
Poděkování:
Autoři děkují laborantkám z transfuzního oddělení, oddělení klinické biochemie, oddělení klinické hematologie KNL, a.s. a pracovníkům z neurochirurgicko-ortopedické JIP, KNL, a.s. za spolupráci při zajištění sběru vzorků a vyšetření laboratorních parametrů. Dále autoři děkují Mgr. Haně Kolářové za statistické zpracování dat.
Studie je podpořena Fondem Vědecké rady KNL, a.s. pod číslem VR 120307.
Doručeno do redakce: 8. 8. 2014
Přijato po recenzi: 8. 10. 2014
Mgr. Šárka Maříková
Transfuzní oddělení
Krajská nemocnice Liberec, a.s.
Baarova 15
460 63 Liberec
sarka.marikova@nemlib.cz
Sources
1. Habler O. Indication for transfusion in orthopedic surgery. Transfusion Alternatives in Transfusion Medicine 2006; 8 : 17-28.
2. Rao VK, Dyga R, Bartels Ch, Waters JH. A cost study of postoperative cell salvage in the setting of elective primary hip and knee arthroplasty. Transfusion 2012; 52 : 1750-1760.
3. Moonen AFCM, Knoors NT, Van Os JJ, Verburg AD, Pilot P. Retransfusion of filtered shed blood in primary total hip and knee arthroplasty: prospective randomized clinical trial. Transfusion 2007; 47 : 379-384.
4. Rosencher N, Kerkkamp HEM, Macheras G, et al. Ortopedic surgery transfusion hemoglobin european overview (OSTHEO) study: blood management in elective knee and hip arthroplasty in Europe. Transfusion 2003; 43 : 459-469.
5. Handel M, Winkler J, Hörnlein RF, Northoff H, Heeg P, Sell S. Influence of acid-citrate-dextrose anticoagulant on blood quality in retransfision systems after total knee arthroplasty. Arch Ortop Trauma Surg 2002; 122 : 269-273.
6. Muñoz M, Slappendel R, Thomas D. Laboratory characteristics and clinical utility of post-operative cell salvage: washed or unwashed blood transfusion. Blood Transfusion 2011; 9 : 248-61.
7. Jones HW, Savage L, White C, et al. Postoperative autologous blood salvage drains – Are they useful in primary uncemented hip and knee arthroplasty? A prospective study of 186 cases. Acta Orthopaedica Belgica 2004; 70 : 466-473.
8. Muñoz M, Ariza D, Campos A, Martín-Mantañez E, Pavía J. The cost of post-operative shed blood salvage after total knee arthroplasty: an analysis of 1 093 consecutive procedures. Blood Transfusion 2013; 11 : 260-271.
9. Yazer MH, Waters JH, Elkin KR, Rohrbaugh ME, Kameneva MV. A comparison of hemolysis and red cell mechanical fragility in blood collected with different cell salvage suction devices. Transfusion 2008; 48 : 1188-1191.
10. Muñoz M, García-Vallejo JJ, Ruiz MD, Romero R, Olalla E, Sebastián C. Transfusion of post-operative shed blood: laboratory characteristics and clinical utility. Eur Spine J 2004; 13 (Suppl. 1): S107-S113.
11. Handel M, Winkler J, Hörnlein RF, Northoff H, Heeg P, Sell S. Time-related changes of collected shed blood in autologous retransfusion after total knee arthroplasty. Arch Ortop Trauma Surg 2001; 121 : 557-560.
12. Liumbruno GM, Waters JH. Unwashed shed blood: should we transfuse it? Blood Transfusion 2011; 9 : 241-245.
13. Hansen E, Pawlik M. Reason against the retransfusion of unwashed wound blood. Transfusion 2004; 44 : 45S-53S.
14. Waters JH. Indication and contraindications of cell salvage. Transfusion 2004; 44 : 40S-44S.
15. Muñoz M, Cobos A, Compos A, Ariza D, Muñoz E, Gómez A. Impact of postoperative shed blood transfusion, with or without leucotyte reduction, on acute-phase response to surgery for total knee replacement. Acta Anesthesiol Scand 2005; 49 : 1182-1190.
16. Muñoz M, Campos A, Muñoz E, et al. Red cell salvage in ortopedic surgery. Transfusion Alternatives in Transfusion Medicine 2006; 8 : 41-51.
17. Sinardi D, Marino A, Chillemi S, Irrera M, Labruto G, Mondello E. Composition of the blood sampled from surgical drainage after join arthroplasty: quality of return. Transfusion 2000; 45 : 202-207.
18. Guan Z, Jiang J, Wang N. Research on coagulation of unwashed shed blood after total knee replacement in chinese patients. Artificial Cells, Blood Substitutes and Biotechnology 2008; 36 : 51-62.
19. Muñoz M, García-Erce JA, Cuenca J, Solano VM. Course of D-dimer concentrations after total knee replacement surgery: effect of allogenic and unwashed drainage blood transfusion. Transfusion Alternatives in Transfusion Medicine 2006; 8 : 135-141.
20. Procházková R, Andrýs C, Krejsek J, Bláha M. Erytrocyty z aferézy – zhodnocení markerů apoptózy u přípravků ze dvou separátorů. Transfuze a hematologie dnes, 14, 2008; 4 : 159-165.
21. Procházková R. Multikomponentní aferetické odběry krve. Brno, Tribun EU 2009; 88 s.
22. Ley JT, Yazer MH, Waters JH. Hemolysis and red blood cell mechanical fragility in shed blood after total knee arthroplasty. Transfusion 2012; 52 : 34-38.
23. Stachura A, Król R, Poplawski T, et al. Transfusion of intra-operative autologous whole blood: influence on complement activation and interleukin formation.Vox Sanq 2011; 100 : 239-246.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2014 Issue 4-
All articles in this issue
- Farmakokinetika jako nástroj k optimalizaci léčby osob s hemofilií
- Phase IV open-label study of the efficacy and safety of deferasirox after allogeneic stem cell transplantation
- Význam vyšetření párů těžkých/lehkých řetězců imunoglobulinu (Hevylite™) u mnohočetného myelomu
- Retransfuzní systém s dvojitou integrovanou filtrací – parametry kvality produktu
- Činnost transfuzní služby v České republice v období 1989–2013
- Indikátory kvality Českého národního registru dárců dřeně za rok 2013 a srovnání s předchozími roky
- The prognostic significance of early treatment response in pediatric relapsed acute myeloid leukemia: results of the international study Relapsed AML 2001/01
- Direct oral anticoagulants compared with vitamin K antagonists for acute venous thromboembolism: evidence from phase 3 trials
- A novel integrated cytogenetic and genomic classification refines risk stratification in pediatric acute lymphoblastic leukemia
- Tacrolimus/sirolimus vs tacrolimus/methotrexate as GVHD prophylaxis after matched, related donor allogeneic HCT
- Factors that predict thrombosis in relatives of patients with venous thromboembolism
- Outcome of aplastic anemia in adolescence: a survey of the Severe Aplastic Anemia Working Party of the European Group for Blood and Marrow Transplantation
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Význam vyšetření párů těžkých/lehkých řetězců imunoglobulinu (Hevylite™) u mnohočetného myelomu
- Činnost transfuzní služby v České republice v období 1989–2013
- Retransfuzní systém s dvojitou integrovanou filtrací – parametry kvality produktu
- Farmakokinetika jako nástroj k optimalizaci léčby osob s hemofilií
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

