-
Medical journals
- Career
Jsme oprávněni řadit nemocné s dvěma samostatnými buněčnými klony a to s delecí 5q a s trizomií 8 jako podskupinu myelodysplastického syndromu typu 5q - syndromu?
: R. Neuwirtová 1; Z. Zemanová 2; J. Březinová 3; M. Beličková 3; P. Dvořák 4; A. Oltová 7; A. Jonášová 1; J. Čermák 3; D. Šponerová 3; J. Ullrichová 5; Z. Mašková 6; L. Červinek 7; Y. Smělíková 8; V. Vozobulová 9; E. Polonyová 10; M. Svoboda 11; K. Michalová 2
: I. interní klinika – klinika hematologie, Všeobecná fakultní nemocnice (VFN), 1. lékařská fakulta Univerzity Karlovy Praha 1; Centrum nádorové cytogenetiky, ÚLBLD, VFN Praha 2; Ústav hematologie a krevní transfuze Praha 3; Ústav lékařské genetiky, FN Plzeň 4; Oddělení klinické hematologie (OKH), Masarykova nemocnice Ústí nad Labem 5; OKH, Fakultní Thomayerova nemocnice Praha 6; Interní hematoonkologická klinika, FN Brno 7; OKH, Nemocnice Kroměříž 8; I. interní klinika, FN Plzeň 9; OKH, Nemocnice Karlovy Vary 10; OKH, Nemocnice Jindřichův Hradec 11
: Transfuze Hematol. dnes,20, 2014, No. 1, p. 25-31.
: Comprehensive Reports, Original Papers, Case Reports
Mezi 106 pacienty s myelodysplastickým syndromem (MDS) typu 5q - syndromu jsme našli 11 nemocných, kteří odpovídali kritériím tohoto syndromu, ale měli vedle klonu s del(5q) navíc další nepříbuzný klon s trizomií 8. Šlo vždy o ženy. U deseti pacientek byl klon del(5q) větší než klon +8. Tyto pacientky dlouhodobě žijí a žádná netransformovala do akutní myeloidní leukemie (AML). Pouze jedna pacientka s dvojnásobně větším klonem +8 než del(5q) zemřela. Dvě z našich nemocných jsou úspěšně léčeny lenalidomidem, lékem s vysokým procentem účinnosti u 5q - syndromu. Domníváme se, že naše klinické pozorování nás opravňuje zařadit našich jedenáct nemocných se dvěma nepříbuznými klony 5q - a +8, jako podskupinu 5q - syndromu a očekávat u nich stejnou prognózu a podobný efekt léčby jako u typického 5q - syndromu. Současně je tato práce připomenutím, že při biklonalitě u MDS je nutno posuzovat velikost klonu s předpokladem, že větší klon bude ovlivňovat prognózu pacienta. U pacientů s klinickými a laboratorními příznaky 5q - syndromu a s nálezem trizomie 8 pod hranicí “cut off“ je indikované opakované cytogenetické vyšetření v delším časovém intervalu.
Klíčová slova:
5q - syndrom, biklonalita, del(5q)-trizomie 8Úvod
Van den Berghe už v roce 1974 stanovil kritéria pro diagnózu refrakterní anémie s delecí dlouhého ramene chromozomu 5 (1). Tento podtyp myelodysplastických syndromů (MDS) nazýváme 5q minus syndrom, dle WHO klasifikace MDS z r. 2002 určen jako samostatný podtyp MDS (2). Nezbytná kritéria pro diagnózu 5q - syndromu jsou: izolovaná delece dlouhých ramen chromozomu 5 – del(5q), makrocytární anémie, normální nebo zvýšené počty destiček, megakaryocyty s nelobulizovaným jádrem, počet blastů ve dřeni menší než 5 %. Dále se ve většině případů setkáváme s chudší erytropoézou a mírnou periferní neutropenií. Pro tento syndrom je typická vysoká převaha žen. 5q - syndrom má nejvíce konzistentní klinický obraz v jinak heterogenní skupině chorob řazených do MDS. V naší starší analýze MDS nemocných s izolovanou del(5q) proto bylo snadné vytřídit pacienty s 5q - syndromem (3). Zarazilo nás ale, že mezi těmito pacienty, naprosto splňujícími kritéria 5q - syndromu, jsme u několika nemocných kromě klonu s del(5q) nalezli další nepříbuzný buněčný klon se 47 chromozomy a s trizomií chromozomu 8.
Položili jsme si tedy otázku, zda jsme oprávněni nemocné s dvěma uvedenými nepříbuznými klony del(5q) a +8 považovat za podskupinu velmi blízkou 5q - syndromu a očekávat u nich stejně příznivou prognózu a možnost indikovat novou léčbu lenalidomidem jako u typického 5q - syndromu.
Pacienti a metody
Mezi 106 pacienty s 5q - syndromem z devíti hematologických pracovišť jsme našli při prvním vyšetření kostní dřeně u 17 nemocných vedle klonu s del(5q) samostatné buňky s trizomií 8. U 18. nemocné se objevil statisticky významný +8 klon až při třetím vyšetření dřeně po třech letech. Všech 18 nemocných splňovalo kritéria pro 5q - syndrom až na to, že při cytogenetickém vyšetření vedle klonu s delecí dlouhého ramene chromozomu 5 byly u nich nalezeny cytogeneticky nepříbuzné (unrelated) buňky s trizomií 8. Vždy šlo o ženy. Podle prognostického skóre (IPSS) byli pacienti řazeni do skupiny s nízkým rizikem. Nemocní pocházejí z devíti hematologických pracovišť.
Data nemocných jsme zpracovali dotazníkovou akcí; opakovaně jsme si ověřili data u jejích ošetřujících hematologů – členů České MDS skupiny a s cytogenetiky probírali cytogenetické nálezy vyšetřených pacientů.
Konvenční cytogenetická analýza
Buňky získané aspirací dřeně jsme kultivovali 24 hodin v médiu RPMI 1640 s 10% fetálním telecím sérem. Cytogenetické preparáty jsme připravili standardním způsobem za použití kolcemidu, hypotonického roztoku a fixace (metanol/kyselina octová 3 : 1). K obarvení chromozomů jsme použili Wrightovo barvivo (G-pruhy). Analyzovali jsme alespoň 20 mitóz u každého pacienta, pokud byly na preparátu přítomny. Mikroskopické preparáty jsme hodnotili pomocí světelného mikroskopu Zeiss AX10 Imager A1. Ke zpracování karyotypu jsme použili počítačovou analýzu obrazu se softwarem IKAROS od firmy MetaSystems (MetaSystems GmbH, Altlussheim, Německo). Nalezené klonální aberace jsme popsali podle mezinárodní cytogenetické nomenklatury (ISCN 2013).
Fluorescenční in situ hybridizace
K potvrzení intersticiální delece dlouhých ramen chromozomu 5 jsme použili metodu interfázní FISH (I-FISH) s dvoubarevnou lokus specifickou sondou pro oblast 5q31 (Vysis LSI 5p15/5q31DNA Probe, Abbott Molecular). Pro ověření přítomnosti klonu s trizomií 8 jsme použili centromerickou sondu pro tento chromozom od stejného výrobce (vždy v kombinaci s rozdílně značenou kontrolní sondou). Při aplikaci DNA sond jsme postupovali podle návodů doporučovaných výrobcem. U každého vzorku jsme hodnotili minimálně 200 interfázních jader. Na základě vyšetření kontrolního souboru 10 zdravých dárců, jsme stanovili hranici „cut-off value“ (tj. dělícího bodu, podle kterého jsou nálezy klasifikovány jako pozitivní, resp. negativní) pro detekci delecí/monozomií na 5 % a pro detekci trizomií na 2,5 %.
Vyšetření mutace TP53
Pro určení mutačního stavu genu TP53 byla analyzována DNA z mononukleárních buněk kostní dřeně (KD) pacientů. Pro detekci mutací byla použita metoda sekvenace nové generace, konkrétně ultra hluboké resekvenování PCR amplikonů v systému GS Junior (Roche Applied Science). Amplifikace byla provedena s použitím FastStart High-Fidelity PCR systému a primery pro exony 4-11, navrženými v rámci studie výzkumného konsorcia IRON-II (European LeukemiaNet). Amplikonová knihovna byla dále amplifikována pomocí emulzní PCR dle doporučení výrobce. Data byla analyzována s použitím GS Variant Analyzer Software 2.5.3 (Roche Applied Science).
Výsledky
U osmnácti nemocných s klinickým obrazem 5q - syndromu jsme nalezli dva typy buněk s rozdílným karyotypem, jednak klon se 46 chromozomy a delecí 5q a dále samostatné (nepříbuzné) buňky se 47 chromozomy a trizomií chromozomu 8. Velikost buněčného klonu s trizomií 8 jsme ověřili metodou I-FISH a prokázali jsme, že u sedmi nemocných šlo pouze o neklonální aberaci (nález pod hranicí „cut-off“).
U jedenácti pacientek jsme potvrdili přítomnost nepříbuzného klonu s trizomií 8, jak ukazuje tabulka 1, ve které porovnáváme velikost obou klonů u jednotlivých nemocných ve vyšetření I-FISH. Klon s del(5q) byl u deseti pacientek větší než klon s trizomií 8, pouze u pacientky č. 6 byl rozsah klonu s trizomií 8 téměř dvakrát větší než klon s del(5q). U většiny pacientek byla odebírána dřeň opakovaně v průběhu řady měsíců až let. Velikost klonů se měnila v závislosti na terapii (pacientka č. 4 a 7), u ostatních se významně neměnila až na pacientku č. 6; komentář k této pacientce uvádíme v odstavci o prognóze. U deváté nemocné se objevil malý klon +8 až po třech letech, při prvním vyšetření měla pacientka prokázanou jen deleci 5q. Když jsme ale zpětně vyšetřili materiál ze vstupního vzorku dřeně metodou I-FISH pro detekci trizomie 8, prokázali jsme přítomnost buněk s trizomií 8 ve velmi nízkém procentu analyzovaných buněk. Tento malý klon dále mírně narůstal, takže po třech letech dosáhl velikosti 4,5 % interfázních jader a v dalších letech se stabilizoval kolem 10 % (tab. 1). U pacientky č. 11 chybí materiál na vyšetření rozsahu klonu s trizomií 8 pomocí I-FISH při prvním vyšetření, ale po 4 letech se už spolehlivě prokazuje přítomnost obou klonů.
Pro ilustraci uvádíme na obrázku 1 výsledky cytogenetické a molekulárně cytogenetické analýzy nepříbuzných buněčných klonů u pacientky č. 5 (obr. 1).
1. Výsledky cytogenetické a molekulárně cytogenetické analýzy nepříbuzných buněčných klonů u pacientky č. 5: (a) Karyotyp s prokázanou delecí del(5)(q13q33) (klon A) získaný konvenční G-pruhovací technikou. (b) Rozsah delece dlouhých ramen chromozomu 5 v klonu A byl ověřen metodou mBAND (použitá sonda XCyte 5, MetaSystems). (c) Velikost patologického buněčného klonu s delecí 5q (klon A) byla ověřena metodou I-FISH (červeně značená oblast 5q31, zeleně značená kontrolní oblast 5p15.2; použitá sonda Vysis LSIEGR1(5q31)/ D5S23,D5S721(5p15), Abbott Molecular). (d) Konvenční karyotyp klonu B s prokázanou trizomií chromozomu 8. (e) Karyotyp buňky s trizomií chromozomu 8 (klon B) analyzovaný metodou mFISH (sonda 24XCyte, MetaSystems). (f) Velikost nepříbuzného buněčného klonu s trizomií chromozomu 8 (klon B) byla ověřena metodou I-FISH s centromerickými sondami pro chromozom 8 (červený signál) a 7 (zelený signál). Buňky s trizomií 8 jsou označeny šipkami (sonda Vysis CEP 8/7). 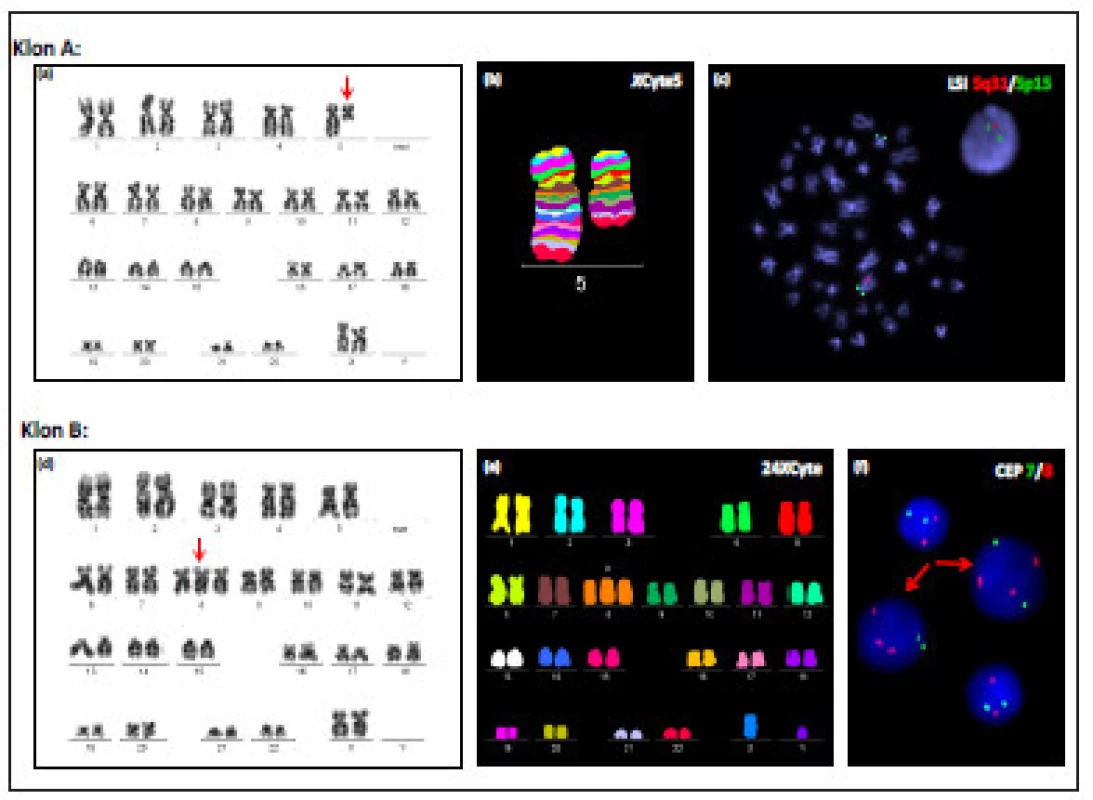
Klinická data a významná vstupní laboratorní data všech jedenácti pacientek jsou uvedena v tabulce 2, odpovídají kritériím 5q - syndromu s výjimkou normálního MCV pacientky č. 8. Jak ukazuje další tabulka 3, průměrné hodnoty dat našich nemocných se neliší od průměrů dat nemocných s čistým 5q - syndromem s normálním počtem destiček nebo s trombocytemií, jak jsme je publikovali v původní práci z roku 2009 v časopise Transfuze a Hematologie dnes (3).
Průběh onemocnění, prognóza a zmínka o terapii u jedenácti pacientek se dvěma nepříbuznými klony ukazuje, že k datu sepsání tohoto sdělení všechny pacientky až na nemocnou č. 6 žijí, vykazují benigní průběh typický pro 5q - syndrom, žádná netransformovala do akutní myeloidní leukemie (AML). Délka života je uvedena v tabulce 3. Všechny pacientky byly dependentní na transfuzích a žádná neodpovídala na erytropoetin. Zajímavé je, že pacientka č. 1 po období tří let přestala potřebovat transfuze bez zvláštní terapie. Přetrvávající vysoký feritin byl u ní vysvětlen pozitivitou mutace HFE genu ale bez klinických příznaků hemochromatózy. Patrně náhodné je, že i pacientka č. 4 má hemochromatózu se snědým zbarvením kůže, ale jinak bez dalších klinických příznaků. Tato pacientka po opakované imunosupresivní terapii cyklosporinem A spolu s prednizonem přestala být závislá na transfuzích. V závislosti na terapii se u ní snižovala velikost klonu s del(5q). Pacientce č. 7 jsme rovněž zkoušeli podávat zmíněnou imunosupresivní terapii, ale pro nesnášenlivost pacientka odmítla v této terapii pokračovat. Proto jsme zahájili podávání lenalidomidu. Po čtyřech cyklech lenalidomidu (Revlimid Celgene) se červený krevní obraz znormalizoval. Po půl roce byla kontrolována dřeň a cytogenetické vyšetření, které ukázalo významné zmenšení klonu s del(5q), ale nárůst klonu s +8. Pacientka č. 9 je trvale dependentní na transfuzích, při podávání chelátoru železa (Exjade Novartis) se udržuje feritin v mezích 1000–1200 µg/l. Uvažuje se u ní o transplantaci kmenových buněk (pacientka má kompatibilního bratra) nebo o indikaci lenalidomidu. Lenalidomidem byla léčena také pacientka č. 10, která po něm dosáhla klinickou a hematologickou remisi. Výsledky kontrolního cytogenetického vyšetření nejsou u ní zatím k dispozici.
Pacientka č. 6 je jediná, u které při diagnóze převládal klon s trizomií 8 nad klonem s delecí 5q (40,1 % versus 22 %; tab. 1). Liší se ale i tím, že je nejstarší a jde u ní o refrakterní anémii s věnečkovými sideroblasty. Průběh její choroby byl stabilní dva roky, kdy splňovala kritéria 5q - syndromu a dostávala transfuze. Během dalšího roku se intervaly mezi transfuzemi zkracovaly, klesaly počty destiček, objevovaly se časté infekce. Je otázka, zda se na nepříznivém klinickém průběhu podílela převaha +8 klonu nad del(5q). Tato zdánlivě logická a líbivá spekulace byla oslabena po dalším vyšetření dřeně dva a půl roku od diagnózy v době zhoršení klinického stavu, kdy došlo k významnému nárůstu klonu s delecí 5q (76,5 %) a naopak zmenšení klonu s trizomií 8 (7,2 %), (tab. 1). Aniž by se objevily známky leukemizace, pacientka po čtyřech měsících zemřela pod obrazem sepse. Vyloučili jsme u ní mutaci TP53, která by se mohla podílet na nepříznivém průběhu onemocnění.
1. Výsledky prvního a opakovaných vyšetření karyotypu a I-FISH. 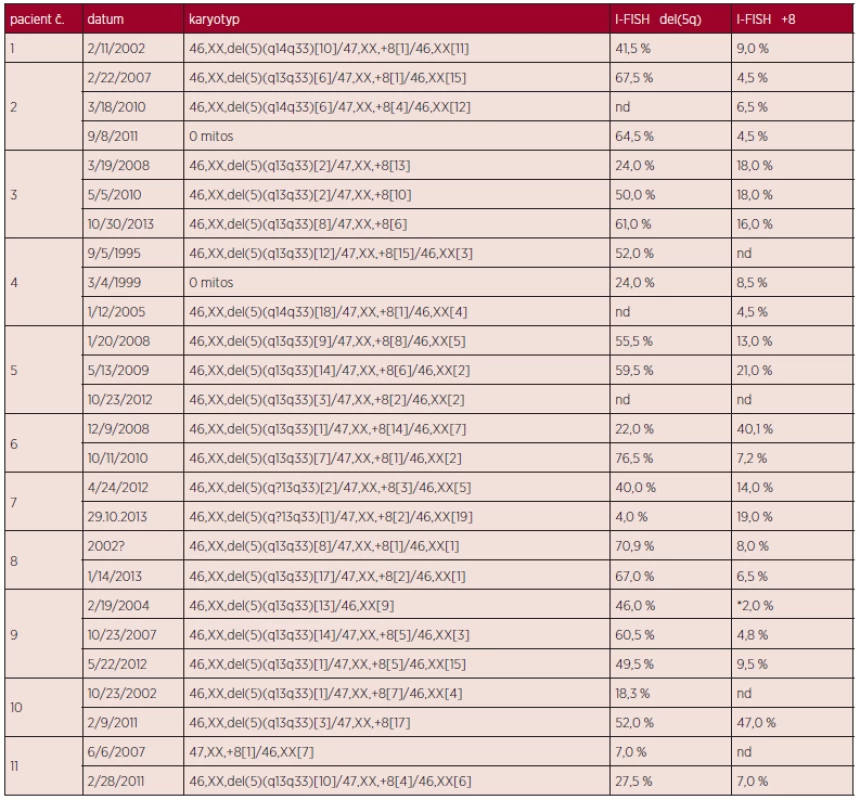
*vyšetřeno po 2 letech; nd - vyšetření nebylo provedeno Diskuse
5q - syndrom je dobře klinicky i laboratorně popsaná podjednotka MDS spojená s nízkým rizikem, s benigním průběhem a převážným výskytem u žen. Základním cytogenetickým nálezem je izolovaná delece dlouhého ramene 5. chromozomu.
Naše pozorování 11 případů žen s klinickým obrazem 5q - syndromu, u kterých jsme našli vedle klonu del(5q) i samostatný klon s trizomií chromozomu 8, nás opravňuje navrhnout zařadit tyto nemocné jako podskupinu 5q - syndromu, protože splňují tatáž diagnostická kritéria, která platí pro typický 5q - syndrom jen s výjimkou cytogenetického nálezu. Domníváme se, že je to zejména tehdy, kdy je klon s del(5q) větší a klon s trizomií 8 menší.
Naše pacientky se zmíněnými dvěma nepříbuznými klony – až na jednu nemocnou – mají stejně příznivou prognózou, jaká je typická pro 5q - syndrom. Pouze pacientka č. 6 dva roky imponovala jako 5q - syndrom, třetí rok se však začal její klinický stav horšit a zemřela v sepsi. Na špatné prognóze se mohl také podílet vysoký věk nemocné. Jako jediná ze všech nemocných však měla klon s trizomií 8 větší než klon s del(5q). Z jednoho případu převahy klonu s trizomií 8 nad klonem s del(5q) nelze dělat prognostické závěry. Nicméně by toto pozorování mělo být podnětem k tomu všímat si u biklonálních nemocných velikosti obou klonů a jejich vzájemného poměru a možného vlivu na klinický průběh onemocnění.
Co se týče terapie, zatím dvě nemocné (č. 7 a 10) jsme léčili lenalidomidem. Odpověděly na něj pozitivně, jak je typické pro skoro 80 % nemocných s 5q - syndromem (4, 5). U nemocné č. 4 jsme indikovali imunosupresivní terapii, na kterou opakovaně velmi dobře zareagovala, což může mít souvislost s klonem s trizomií 8. Evelyne Sloand zdůrazňuje úspěch imunosupresivní terapie u svých nemocných s MDS a trizomií 8. chromozomu (6). Klasický 5q - syndrom na imunosupresivní terapii neodpovídá.
2. Klinická a laboratorní data. 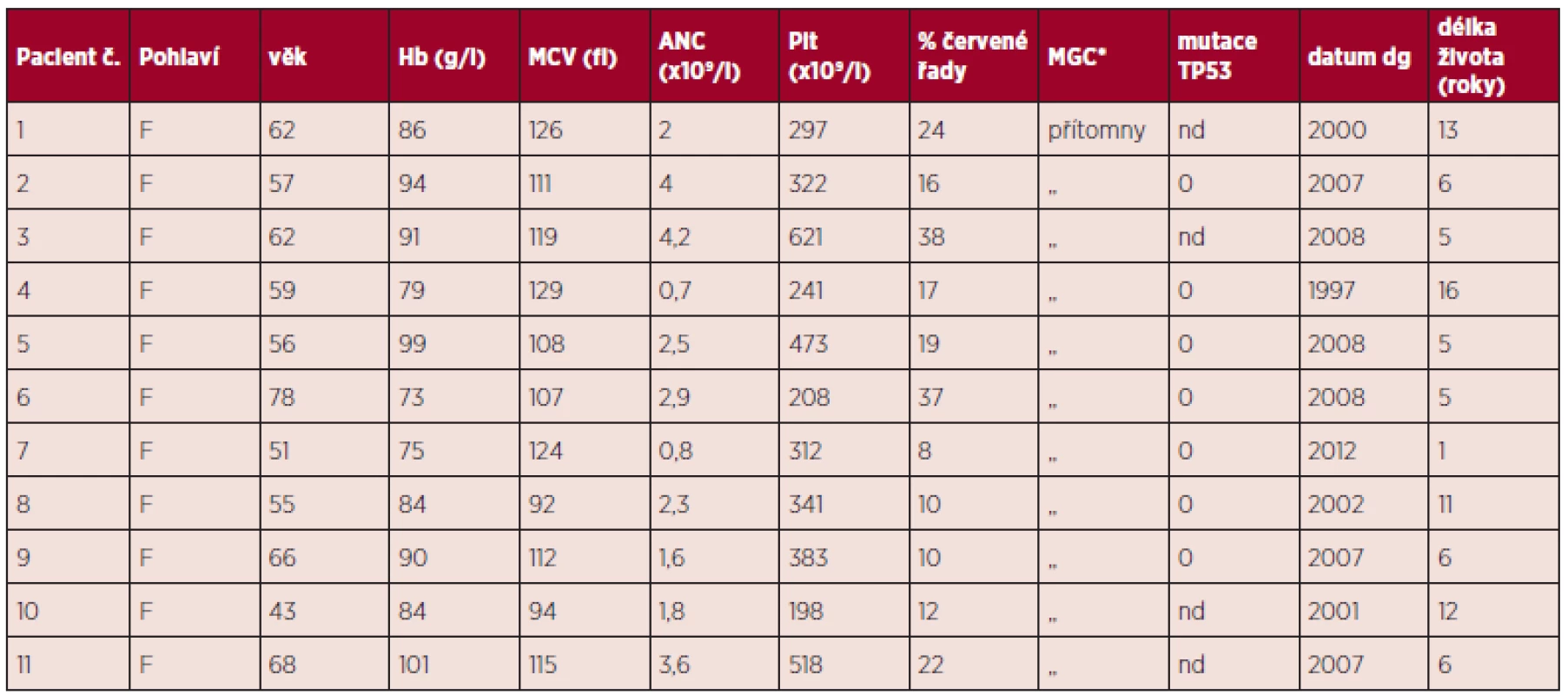
*hypolobulizované MGC, typické pro 5q- syndrom Vysvětlivky: Hb - hemoglobin; MCV - střední objem erytrocytu; ANC - absolutní počet neutrofilů; Plt - počet trombocytů; MGC - megakaryocyty; dg - diagnóza. V naší sestavě nemocných s obrazem 5q - syndromu tvoří 10 % nemocní s dvěma nepříbuznými klony del(5q) a trizomií 8. Výskyt tedy není výjimečně vzácný. Nicméně kompatibilitu klinického průběhu biklonálních pacientů s 5q - syndromem, frekvenci jejich výskytu, užitečnost opakovaného cytogenetického vyšetření, význam vzájemné velikosti obou klonů a zvláštnosti terapie této skupiny nemocných je nutno ověřit na podstatně větším počtu pacientů. Pokusíme se iniciovat takovou studii v rámci European LekemiaNet. Potvrdí-li se naše pozorování, pak teprve mohou být tito biklonální pacienti zařazeni do samostatné podskupiny 5q - syndromu.
3. Srovnání pacientů s 5q- syndromem (1a,b) a pacientů s del(5q) a +8 (2). 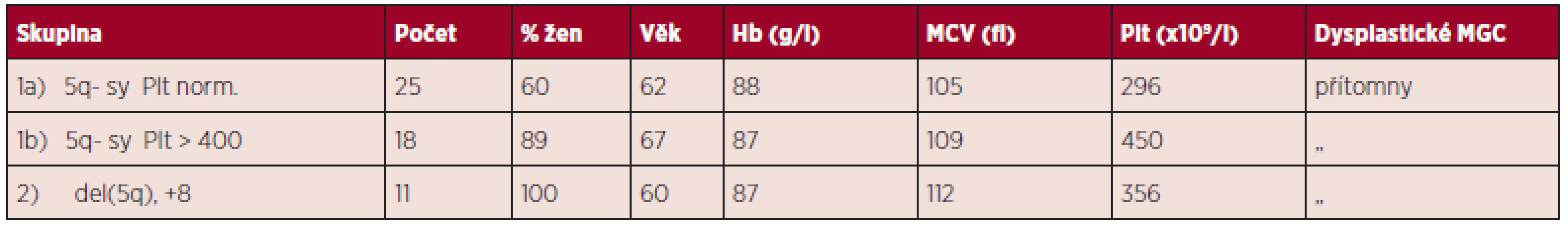
Vysvětlivky: Hb - hemoglobin; MCV - střední objem erytrocytu; Plt - počet trombocytů; MGC - megakaryocyty; 5q- sy - 5q- syndrom; Plt norm. - normální počet trombocytů Několik poznámek k výskytu samostatných klonů
Výskyt dvou či více nepříbuzných klonů není u onkohematologických chorob běžný jev. V dostupné literatuře jsou popisovány dva samostatné klony nejčastěji u MDS (7, 8, 9, 10, 11) a to častěji u sekundárního než u primárního MDS (12, 13). Dva nezávislé klony se vyskytují relativně často u AML, méně často u chronických myeloproliferativních chorob, ještě vzácněji u lymfoproliferací a myelomu a zcela ojediněle u akutní lymfatické leukemie (11, 14, 15). Výskyt pacientů s MDS se dvěma nepříbuznými klony se pohybuje kolem 5 % (7, 9, 16).
Mezi aberacemi nejčastěji nalezenými v nepříbuzných klonech dominuje del(5q) a trizomie 8. Z dalších aberací jsou uváděny: del(20q), trizomie 21, 22, 11, 19, dále -7, -Y a některé další ojedinělé aberace. Zajímavá je práce uvádějící dva klony s odlišnou delecí dlouhého ramene 5. chromozomu (17).
Z novější literatury je to zejména práce Julie Schanz a spol. (16), která uvádí 13,7 % nemocných se dvěma klony 5q - a +8 z celkového počtu 95 případů s biklonalitou. Autoři však neuvádějí, u jak velkého počtu nemocných s MDS byly tyto případy zjištěny.
Je otázka, v jakém časovém sledu dochází ke vzniku nepříbuzných klonů. Normálně se předpokládá, že onkohematologické choroby jsou monoklonální, takže přirozeně by se měl vynořit druhý klon později, (např. díky genové nestabilitě). Tomu však nenasvědčuje nález většiny autorů ani naše sestava, kde většina pacientů přichází s průkazem obou klonů už v samém začátku. Během doby může velikost druhého menšího klonu narůstat. Na základě zkušenosti s naší pacientkou č. 9 i č. 11 je indikované opakované cytogenetické vyšetření i u těch pacientů, kde trizomie 8 v prvním vyšetření je pod hranicí „cut off“.
Zcela vzácně se popisuje výskyt tří a více samostatných klonů u jednoho nemocného (16). Pozoruhodné je, zatím bez vysvětlení, že v převážné většině případů uvádějí autoři v nepříbuzných klonech jen jednu chromozomální aberaci/per klon, což souhlasí i s naším pozorováním. Považujeme za důležité také posuzovat velikost nepříbuzných klonů a jejich vzájemný poměr, protože lze předpokládat, že větší klon bude ovlivňovat klinický obraz. Vliv velikosti klonu pro klinický průběh i u monoklonálních případů MDS zdůrazňuje Mallo a spol. (s výjimkou případů s patologií chromozomu 7, kdy i malý klon je spojen s nepříznivou prognózou) (19).
Co se týče literárních dat o prognóze nemocných s MDS a dvěma různými samostatnými klony, většina autorů na rozdíl od nás přisuzuje těmto nemocným špatnou prognózu, dokonce i hrozbu transformace do AML (7, 8, 9, 11, 18). Naopak Julie Schanz a spolupracovníci (16) u svých 13 MDS nemocných s klony 5q - a +8 uvádějí, že tito pacienti měli příznivou prognózu, nelišící se od jejich pacientů s izolovaným del(5q). Je tedy možné, že jsou srovnatelní s našimi pacientkami.
Závěr
Případy MDS s biklonalitou del(5q) a +8 nejsou ojedinělé; mezi našimi pacienty s typickým 5q - syndromem tvoří 10 %. Vždy šlo o ženy. Deset pacientek mělo větší klon s del(5q) než klon +8. Pouze u jedné pacientky dominoval klon 8 a je otázka, zda tím nebyla ovlivněna nepříznivá prognóza této nemocné. Příznivá prognóza u ostatních pacientek a pozitivní odpověď na lenalidomid byla srovnatelná s prognózou i terapií nemocných s klasickým 5q - syndromem. Domníváme se, že nemocní se dvěma klony, a to dominujícím klonem del(5q) a druhým menším klonem +8, mohou být diagnostikováni jako podskupina velmi blízká 5q - syndromu s předpokladem stejně příznivé prognózy a podobného terapeutického postupu.
Poděkování
Tato publikace vznikla za podpory projektů PRVOUK 27/LF1/1, RVO-VFN646165 a IGA MZ ČR NT 13836-4/2012.
Podíl autorů na přípravě rukopisu
R. N. – příprava rukopisu, kontrola a schválení finální verze
Z. Z. – podíl na zpracování rukopisu a schválení finální verze
K. M. – schválení finální verze
Z. Z., J. B., P. D., A. O. – zpracování cytogenetických nálezů pacientů
M. B. – molekulárně genetické vyšetření
A. J., J. Č., D. Š., J. U., Z. M., L. Č., Y. S., V. V., E. P., M. S. – zpracování klinických dat pacientů
Doručeno do redakce: 15. ledna 2014
Přijato po recenzích: 17. března 3014
Doc. MUDr. Radana Neuwirtová, CSc.
l. interní klinika – klinika hematologie
VFN a 1. LF UK Praha
U Nemocnice 2
128 08 Praha 2
e-mail: radana.neuwirtova@vfn.cz
Sources
1. Van den Berghe H, Cassiman JJ, David G, et al. Distinct haematological disorder with deletion of long arm of no. 5 chromosome. Nature 1974; 251 : 437-438.
2. Vardiman JW, Harris NL, Brunning RD. The world health organization (WHO) clasification of the myeloid neoplasms. Blood 2002; 100 : 2292-2302.
3. Neuwirtová R, Jonášová A, Čermák J, et al. Analýza nemocných s myelodysplastickým syndromem (MDS) s delecí dlouhého ramene 5. choromozomu (del(5q)), sledovaných Českou MDS pracovní skupinou. Význam pro diagnostické zařazení a určení prognózy. Transfuze Hematol Dnes 2009; 15 : 204-209.
4. List A, Dewals G, Bennett J, et al. Lenalidomide in the myelodysplastic syndrome with chromosome 5q deletion. N Eng J Med 2006; 355(14): 1456-1465.
5. Jonášová A. Myelodysplastický syndrom – pokrok v léčbě v 21. stolení. Vnitř Lék 2013; 59 : 635-640.
6. Sloand EM, Mainwaring L, Fuhrer M. Preferential suppresion of trisomy 8 compared with normal hemopoietic cell growth by autologous lymphocytes in patients with trisomy 8 myelodysplastic syndrome. Blood 2005; 105 : 841-851.
7. Heim S, Mitelman F. Cytogenetically unrelated clones in hematological neoplasms. Leukemia 1989; 3 : 6-8.
8. Kobayashi H, Kaneko Y, Maseki N, Sakurai M. Karyotypical unrelated clones om acute leukemias and myelodysplastic syndromes. Cancer Genet Cytogenet 1990; 47 : 171-178.
9. Musilová J, Michalová K, Zemanová Z, Březinová J. Multiple unrelated clones in myelodysplastic syndrome and in acute myeloid leukemia. Cancer Genet Cytogenet 1996; 88 : 141-143.
10. Han JY, Kim KH, Kwon HC, et al. Unrelated clonal chromosome abnormalities in myelodysplasic syndromes and acute myeloid leukemias. Cancer Genet Cytogenet 2002; 132 : 156-158.
11. Han JY, Theil KS, Hoeltge G. Frequencies and characterization of cytogenetically unrelated clones in various hematologic malignancies: seven years of experiences in a single institution. Cancer Genet Cytogenet 2006; 164 : 128-132.
12. Heim S. Cytogenetic findings in primary and secundary MDS. Leuk Res 1992; 16 : 43-46.
13. Pedersen-Bjergaard J, Timshel S, Andersen MK, et al. Cytogenetically unrelated clones in therapy-related myelodysplasia and acute myeloid leukemia: Experience from the Copenhagen series updated to 180 consecutive cases. Genes Chromosomes Cancer 1998; 23 : 337-349.
14. Johansson B, Billström R, Broberg K, et al. Cytogenetic polyclonality in hematologic malignancies. Genes Chromosomes Cancer 1999; 24 : 222-229.
15. Davidsson J, Paulsson K, Johansson B. Multicolor fluorescence in situ hybridization characterization of cytogenetically polyclonal hematologic malignancies. Cancer Genet Cytogenet 205; 163 : 180-183.
16. Schanz J, Fischer S, Haferlach C, et al. Unrelated clones in myelodysplastic syndromes and acute myeloid leukemia – characterization and prognostic relevance. Abstract 4022. ASH Annual Meeting Abstracts 2010; 116 : 1639.
17. Braulke F, Schanz J, Steffens R, et al. Two different del(5q) clones in a patient with myelodysplastic syndrome Leuk Lymphoma 2011; 52 : 1811-1814.
18. Furuya T, Morgan R, Standberg AA. Cytogenetic biclonality in malignant hematologic disorders. Cancer Genet Cytogenet 1992; 62 : 25-28.
19. Mallo M, Luno E, Sanzo C, et al. Clinical impact of the clone size in MDS cases with monosomy 7 or 7q deletion, trisomy 8, 20q deletion and loss of Y chromosome. Leuk Res 2011; 35 : 834-836.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2014 Issue 1-
All articles in this issue
- Optimal process for searching for adult unrelated volunteer donors in unrelated donor registries
- Toxoplasma and immunodeficiency
- Introduction of the treatment with recombinant FVIII has not increased the inhibitor incidence rate in Czech PUPs with haemophilia A
- Are we justified to classify patients with two unrelated clones with del(5q) and trisomy 8 as a subgroup of myelodysplastic syndrome of the type of 5q- syndrome?
- TP53 deletion in patients with multiple myeloma and monoclonal gammopathy of undetermined significance - molecular cytogenetic analysis of 84 patients
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Toxoplasma and immunodeficiency
- TP53 deletion in patients with multiple myeloma and monoclonal gammopathy of undetermined significance - molecular cytogenetic analysis of 84 patients
- Are we justified to classify patients with two unrelated clones with del(5q) and trisomy 8 as a subgroup of myelodysplastic syndrome of the type of 5q- syndrome?
- Optimal process for searching for adult unrelated volunteer donors in unrelated donor registries
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

