-
Medical journals
- Career
Maligní nádory vzniklé po úspěšné léčbě akutní myeloidní leukemie u dospělých nemocných: dlouhodobé zkušenosti jednoho pracoviště
: T. Szotkowski 1; Z. Šustková 2; J. Vrbková 3; J. Hubáček 1; L. Raida 1; P. Rohoň 1; A. Kuba 1; R. Szotkowská 1; Z. Pikalová 1; K. Sičová 1; M. Jarošová 1; E. Faber 1; T. Papajík 1; K. Indrák 1
: Hemato-onkologická klinika, Lékařská fakulta Univerzity Palackého Olomouc 1; Interní hematologická a onkologická klinika, Fakultní nemocnice Brno-Bohunice 2; Ústav molekulární a translační medicíny, Lékařská fakulta Univerzity Palackého Olomouc 3
: Transfuze Hematol. dnes,19, 2013, No. 4, p. 210-214.
: Comprehensive Reports, Original Papers, Case Reports
Úvod.
Současná kurativní léčba akutní myeloidní leukemie je založena na intenzivní chemoterapii a transplantaci krvetvorných buněk s nezanedbatelným rizikem závažných nežádoucích účinků, včetně leukemogenních a kancerogenních.Cíl.
Cílem práce bylo zhodnotit výskyt a typ maligních nádorů zjištěných u nemocných po úspěšné léčbě akutní myeloidní leukemie.Metodika práce.
Retrospektivní analýza souboru 256 nemocných s akutní myeloidní leukemií, diagnostikovaných na Hemato-onkologické klinice v Olomouci v období 1996-2008, kteří byli léčeni intenzivní chemoterapií a dosáhli kompletní remise onemocnění.Výsledky.
Druhý maligní nádor se po úspěšné léčbě akutní myeloidní leukemie vyskytl u 11 nemocných (4,3 %). Pozorovaná věkově standardizovaná incidence těchto nádorů, 8,29/1000 osobo-roků, 95% CI = (2,99; 13,58), se významně nelišila od incidence malignit v populaci. Příčinou smrti se druhý nádor stal u 5 nemocných.Klíčová slova:
akutní myeloidní leukemie, kurativní léčba, druhá malignitaÚvod
Současná kurativní léčba akutní myeloidní leukemie (AML) je založena na intenzivní chemoterapii, na kterou u rizikových či relabujících nemocných navazuje transplantace krvetvorných buněk (HSCT) (1). Obě léčebné modality jsou spojeny s nezanedbatelným rizikem vážných nežádoucích účinků včetně leukemogenních a kancerogenních. S narůstající účinností protinádorové léčby a prodlužováním života nemocných vzrůstá i riziko jejich pozdních komplikací. Sekundární malignity včetně myelodysplastického syndromu (MDS) patří k těm nejzávažnějším, i když relativně vzácným komplikacím léčby (2–5).
Soubor nemocných, metodika práce
V hodnoceném období (leden 1996 – prosinec 2008) byla na našem pracovišti diagnostikována AML (podle aktuálně platné klasifikace) u 573 pacientů. Jednalo se o 277 mužů a 296 žen s mediánem věku 60 (rozmezí 18–89) let. S kurativním záměrem bylo léčeno 376 (65,6 %) nemocných s mediánem věku 54 (18–80) let.
Z nich 256 (tedy 68,1 %) dosáhlo kompletní remisi (KR). Medián věku této skupiny byl 52 (18–73) let, délka sledování 34 (1,6–201) měsíců. Pouze chemoterapií bez transplantace bylo léčeno 179 (70 %) nemocných, 77 (30 %) bylo transplantováno. Z nich 22 podstoupilo autologní transplantaci a 56 alogenní HSCT (1 nemocná byla po autologní transplantaci transplantována alogenně).
Tento soubor 256 nemocných, kteří dosáhli KR, byl retrospektivně analyzován. Data byla analyzována k 1. 1. 2013.
K datu analýzy žilo celkem 92 nemocných (tj. 35,9 % z nemocných, kteří dosáhli KR a 24,4 % z celkového počtu kurativně léčených nemocných) v trvající kompletní remisi AML.
Výpočet věkově standardizované incidence maligních nádorů po léčbě AML byl prováděn zvyklým způsobem s užitím 95% intervalu spolehlivosti (6).
Výsledky
Druhé maligní onemocnění bylo diagnostikováno v časovém odstupu 10–106 (medián 30) měsíců od stanovení diagnózy AML u 11 nemocných (tj. 4,3 %), 6 žen a 5 mužů. Věk těchto nemocných při diagnóze AML byl 24–62 (medián 49) let. Z nich 7 bylo léčeno pouze chemoterapií, 1 nemocná podstoupila autologní transplantaci a 3 nemocní byli léčeni alogenní HSCT.
Jednalo se o 3 případy myelodysplastického syndromu typu refrakterní anémie s excesem blastů II (MDS-RAEB II), 2 případy T-lymfoblastického lymfomu (T-LBL), 2 případy melanomu a po 1 případu sekundární AML, B-nehodgkinského lymfomu s izolovaným postižením centrálního nervového systému (B-NHL CNS), karcinomu ledviny a karcinomu slinivky břišní.
U všech 3 nemocných, u kterých vznikl myelodysplastický syndrom, byla AML léčena pouze chemoterapií – u dvou nebyla vzhledem k příznivé prognóze transplantace v 1. linii léčby indikována a jedné nemocné nebyl nalezen dárce. Zmínění dva nemocní byli pro MDS transplantováni alogenně, třetí nemocná byla léčena chemoterapií. Dlouhodobě přežívá (v kompletní remisi obou malignit) pouze nemocná primárně léčená pro akutní promyelocytární leukemii, která podstoupila alogenní transplantaci.
Obě nemocné s T-lymfoblastickým lymfomem byly léčeny intenzivní chemoterapií. Jedna zemřela na infekční komplikace spojené s touto léčbou a druhá podstoupila autologní HSCT, po níž žije v remisi obou malignit – v době analýzy 5 let po transplantaci.
Oba nemocní s melanomem byli v době diagnózy tohoto nádoru 3, resp. 19 měsíců po alogenní HSCT. Melanom byl lokalizovaný na jedno kožní ložisko, bez metastatického postižení. Léčeni byli pouze chirurgicky (excize). Oba tito nemocní žijí dlouhodobě v remisi obou maligních onemocnění (7 a 9 let).
U jedné nemocné byl na našem pracovišti zaznamenán výskyt 2 různých akutních myeloidních leukemií. Primární AML s inv(16) (p13.1;q22) byla léčena intenzivní chemoterapií, sekundární t-AML s přestavbou 11q23 byla diagnostikována necelý rok po ukončení této léčby, v trvající molekulární remisi primárního onemocnění.
Celkem 5 nemocných žije v remisi obou nádorových onemocnění (se sekundární AML, T-LBL, MDS-RAEB II a oba nemocní s melanomem), 1 zemřela na komplikace léčby T-LBL a 4 zemřeli na progresi druhé malignity (nemocný s CNS lymfomem, karcinomem pankreatu a oba nemocní s MDS RAEB II v progresi do AML). Nemocný s renálním karcinomem v době analýzy pokračoval v léčbě tohoto onemocnění.
Přehledně jsou základní údaje o jednotlivých nemocných včetně zaznamenaných komplikací uvedeny v tabulce 1.
1. Přehled nemocných s dalším maligním nádorem, vzniklým po léčbě AML. 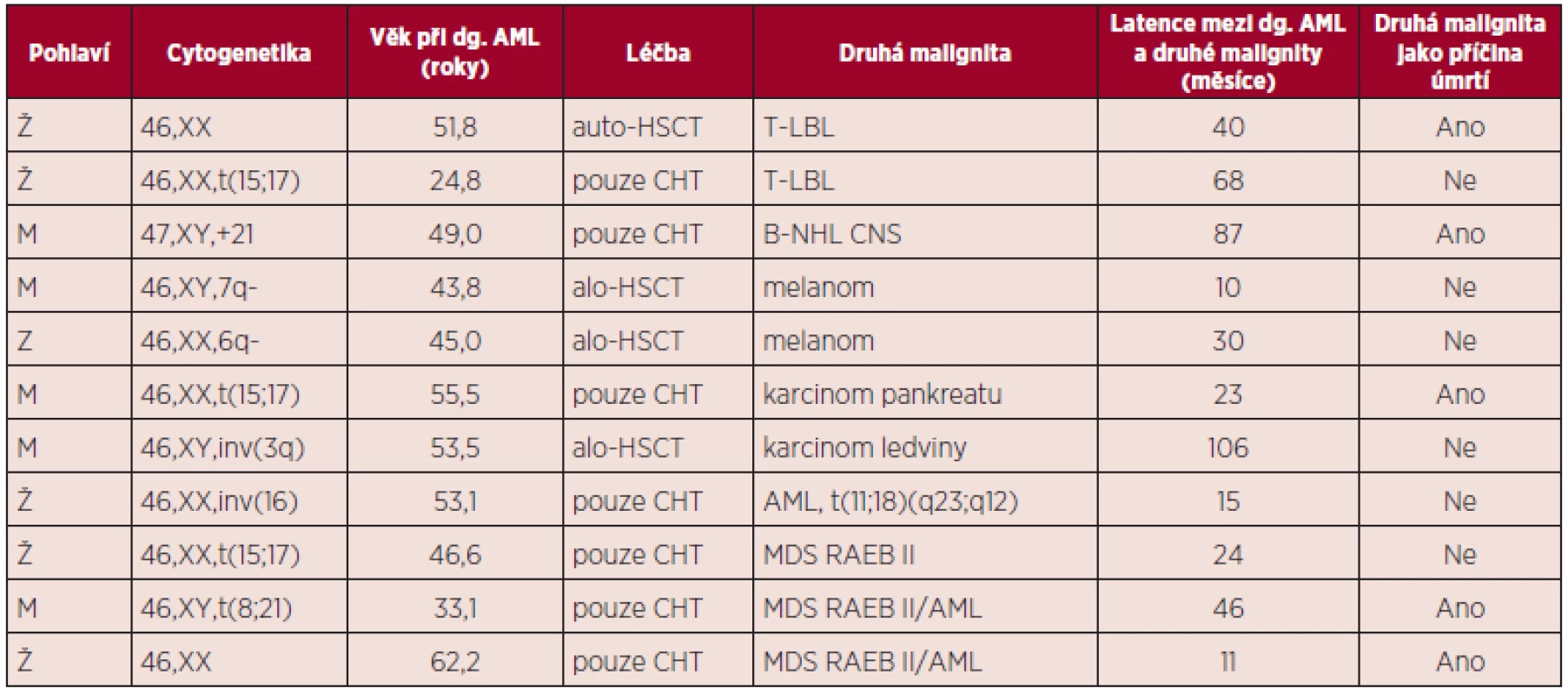
CHT – chemoterapie Hrubá incidence druhé malignity činí 9,89/1000 osobo-roků, 95% CI = (4,05; 15,74), věkově standardizovaná pak 8,29/1000 osobo-roků, 95% CI = (2,99; 13,58).
Diskuse
Léčba mnoha druhů maligních onemocnění doznala v posledních desetiletích významného pokroku. Byly objeveny a do rutinní klinické praxe zavedeny nové protinádorové léky, velký rozvoj podpůrné péče umožnil zavedení velmi intenzivních chemoterapeutických protokolů, rozšiřují se možností a zlepšují výsledky HSCT. Všechny zmiňované aspekty se projevují narůstajícím počtem nemocných dosahujících dlouhodobé remise maligního onemocnění. Podle údajů amerického National Cancer Institute Surveillance, Epidemiology and End Results (NCI SEER) se počty pacientů s vyléčeným nádorovým onemocněním za posledních 40 let ztrojnásobily, tito vyléčení dnes tvoří 3,5 % obyvatel USA (7).
Každá léčba však s sebou přináší i jistá rizika. Nejen protinádorové, ale také četné podpůrné léky používané v hematoonkologii jsou poměrně toxické. Výskyt řady nežádoucích účinků je omezen na období bezprostředně následující po podání léku – např. myelotoxicita většiny cytostatik, nefroxicita či hepatotoxicita četných antibiotik či antimykotik.
Zřejmě nejzávažnější je potenciálně kancerogenní a leukemogenní působení řady cytostatik. Vznik, latence, frekvence a subtyp solidních nádorů po léčbě jiných maligních onemocnění je závislý na typu základního onemocnění a jeho léčbě. Publikována byla data týkající se např. Hodgkinova lymfomu (8, 9), nehodgkinských lymfomů (10), mnohočetného myelomu (7), nemocných po HSCT (11), akutní (12, 13) i chronické myeloidní leukemie (14).
Na druhé straně, ne všechny zdravotní komplikace vznikající po cytotoxické léčbě musí nutně s touto léčbou souviset. Některé je možné vysvětlit prostým očekávaným výskytem této komplikace v populaci jinak zdravých jedinců daným její incidencí. Některé „komplikace“ mohou také souviset s genetickou predispozicí nemocných pro určitá onemocnění. Velmi přehledně jsou možné vlivy terapie, primární choroby, predispozice jedince, event. vliv prostředí na vznik sekundárních malignit diskutovány kolektivem švédských autorů na již zmíněném velkém souboru nemocných s mnohočetným myelomem (7).
V našem souboru nemocných patří k onemocněním, které zřejmě nesouvisí s léčbou AML karcinom pankreatu. Jednalo se o případ 55letého muže, který byl úspěšně léčen pro akutní promyelocytární leukemii a v odstupu 23 měsíců od stanovení diagnózy APL byl zjištěn karcinom, který vedl poměrně záhy (za 4 měsíce) ke smrti nemocného v trvající remisi leukemie. Vzhledem k poměrně krátkému intervalu mezi zjištěním obou malignit, faktu že rizikové faktory vzniku karcinomu pankreatu neobsahují prodělanou cytotoxickou terapii a chybějícími literárními údaji o případech sekundárního tumoru pankreatu (sekundárními jsou zde míněny tumory jiného původu metastazující do pankreatu) toto onemocnění považujeme spíše za duplicitu.
Podobně považujeme za spíše duplicitní dva případy maligního melanomu. Oba nemocní byli v době vzniku tohoto nádoru po alogenní HSCT provedené v rámci léčby prognosticky nepříznivé AML, onemocnění bylo lokalizované na jedno ložisko, které bylo podle obou nemocných na kůži přítomno již delší dobu (u jednoho nemocného podle cíleného dotazování jistě, u druhého pravděpodobně již před transplantací), bez přítomnosti metastáz, byli léčeni chirurgicky (široká excize), bez další terapie. Spíše než kancerogenní účinky terapie AML by zde naopak bylo možné předpokládat příznivý vliv alogenní HSCT navozeného imunologického dohledu v eliminaci rizika vzniku metastáz, byť literární údaje hodnotící vliv HSCT na sekundární výskyt či naopak léčbu metastazujícího melanomu nejsou jednotné (11, 15, 16). Tito nemocní nebyli léčeni interferonem, žijí v trvající remisi obou malignit.
Naopak nepochybně s prodělanou chemoterapií nemocné s AML s inv(16) (p13.1;q22) souvisí vznik t-AML s přestavbou 11q23 – primární léčba obsahovala inhibitory topoizomerázy II (etoposid, mitoxantron), t-AML vznikla s krátkou latencí od jejího ukončení a přítomna byla i specifická genetická změna – přestavba MLL genu.
Velmi vzácnou sekundární malignitou, alespoň podle literárních údajů, je T-lymfoblastický lymfom. Na našem pracovišti jsme toto onemocnění diagnostikovali u 2 nemocných po léčbě AML, případ jedné z nich byl již publikován (17).
Relativně častým subtypem primárního onemocnění byla APL – po její léčbě jsme zaznamenali vznik 3 maligních onemocnění (tj. 27,3 %) – karcinom slinivky břišní, prekurzorový T-LBL a MDS-RAEB II. Nemocných s APL přitom bylo 40, tvořili tedy 7 % všech nemocných s AML a 15,6 % kurativně léčených nemocných dosahujících po indukci kompletní remisi. Nemocný s karcinomem pankreatu na následky progrese tohoto onemocnění zemřel, zbývající dvě nemocné žijí v remisi obou malignit – první po autologní, druhá po alogenní HSCT.
Zajímavé jsou velmi podobné výsledky zjištěné věkově standardizované incidence druhých maligních nádorů v analyzované skupině nemocných s AML a v již publikované analýze velkého souboru nemocných z registrů CAMELIA a INFINITY s chronickou myeloidní leukemií, léčených inhibitory tyrozinových kináz (14). Tato incidence je dokonce mírně nižší u nemocných po léčbě AML. Při porovnání s incidencí maligních nádorů v populaci pak nebyl autory citované práce (14) zjištěn statisticky významný rozdíl. Toto porovnání lze alespoň přibližně aplikovat i na náš soubor nemocných, sledovaných a léčených v přibližně stejném období. Nezjištění významně vyšší incidence následných malignit u nemocných léčených intenzivní chemoterapií je překvapivé. Podobně ale vyznívá i závěr z další, již před delší dobou publikované práce týkající se nemocných s AML (13). Po terapii AML bychom očekávali vyšší incidenci dalších maligních nádorů už jen proto, že přinejmenším některá z těchto onemocnění jsou zjevně způsobená touto léčbou (zmíněná t-AML a MDS RAEB II). Vysvětlení tohoto výsledku zatím chybí.
Závěr
Cílem této práce je upozornit na možný výskyt dalších maligních nádorů, ať již sekundárních malignit či duplicit, u nemocných po úspěšné léčbě akutní myeloidní leukemie. Vzniku těchto komplikací obvykle není možné předejít, je proto nutné nemocné trvale dispenzarizovat a případný vznik komplikace včasně zachytit.
Poděkování
Práce byla podpořena granty VZ MSMT CR 6198959205 a IGA UP LF-2013-004.
Podíl autorů při přípravě rukopisu
S. T. – příprava a zpracování rukopisu
Š. Z. – sběr dat a příprava rukopisu
V. J. – statistické zpracování – výpočet věkově standardizované incidence
H. J., R. L., R.P., K.A., S.R., P.Z., S.K. – spolupráce při sběru dat a připomínkování rukopisu
P. T., J. M., F. E., I. K. – kritická revize rukopisu
Doručeno do redakce: 16. 5. 2013
Přijato po recenzi: 2. 12. 2013
MUDr. Tomáš Szotkowski, Ph.D.
Horní lán 1257/51
779 00 Olomouc
e-mail: Tomas.Szotkowski@fnol.cz
Sources
1. Döhner H, Estey EH, Amadori S, et al. Diagnosis and management of acute myeloid leukemia in adults: recommendations from an international expert panel, on behalf of the European LeukemiaNet. Blood 2010; 115(3): 453-474.
2. Abdallah A, Weber-Nordt RM, Körbling M, Haas R, Ho AD. Long-term outcome in acute myelogenous leukemia autografted with mafosfamide-purged marrow in a single institution: adverse events and incidence of secondary myelodysplasia. Bone Marrow Transplantation 2002; 30 : 15-22.
3. Bennett JM, Young ML, Andersen JW, Cassileth PA, Tallman MS, Paietta E, Wiernik PH, Rowe JM. Long-Term Survival in Acute Myeloid Leukemia. Cancer Supplement 1997; 80(11): 2205-2209.
4. Scott Baker K, Ness KK, Weisdorf D, Francisco L, Sun C-L, Forman S, Bhatia S. Late Effects in Survivors of Acute Leukemia Treated with Hematopoietic Cell Transplantation: a Report from the Bone Marrow Transplant Survivor Study Leukemia 2010; 24(12): 2039-2047.
5. Lobe I, Rigal-Huguet F, Vekhoff A, et al. Myelodysplastic syndrome after acute promyelocytic leukemia: the European APL group experience. Leukemia 2003; 17(8): 1600-1604.
6. Esteve J, Benhamou E, Raymond L. Statistical methods in cancer research. Volume IV. Descriptive epidemiology. IARC Sci Publ. 1994; (128): 1-302.
7. Thomas A, Mailankody S, Korde N, Kristinsson SY, Turesson I, Landgren O. Second malignancies after multiple myeloma: from 1960s to 2010s. Blood 2012; 119 : 2731-2737.
8. Mauch PM, Kalish LA, Marcus KC, et al. Longterm survival in Hodgkin’s disease relative impact of mortality, second tumors, infection, and cardiovascular disease. Cancer J 1995; 1(1): 33-42.
9. Swerdlow AJ, Barber JA, Hudson GV, et al. Risk of second malignancy after Hodgkin’s disease in a collaborative British cohort: the relation to age at treatment. J Clin Oncol 2000; 18(3): 498-509.
10. Bari A, Marcheselli L, Marcheselli R, Liardo EV, Pozzi S, Ferri P, Sacchi S. Therapy-related myeloid neoplasm in non-hodgkin lymphoma survivors. Mediterr J Hematol Infect Dis 2011; 3(1): e2011065. Epub 2011 Dec 20.
11. Curtis RE, Rowlings PA, Deeg HJ, et al. Solid cancers after bone marrow transplantation. NEJM 1997; 336(13): 897-904.
12. Leung W, Ribeiro RC, Hudson M, et al. Second malignancy after treatment of childhood acute myeloid leukemia. Leukemia 2001; 15(1): 41-45.
13. de Nully Brown P, Hoffmann T, Hansen OP, et al. Long-term survival and development of secondary malignancies in patients with acute myeloid leukemia treated with aclarubicin or daunorubicin plus cytosine arabinoside followed by intensive consolidation chemotherapy in a Danish national phase III trial. Danish Society of Haematology Study Group on AML. Leukemia 1997; 11(1): 37-41.
14. Voglova J, Muzik J, Faber E, et al. Incidence of second malignancies during treatment of chronic myeloid leukemia with tyrosine kinase inhibitors in the Czech Republic and Slovakia. Neoplasma 2011; 58(3): 256-262.
15. Zeiser R, Schnitzler M, Andrlova H, Hellige T, Meiss F. Immunotherapy for malignant melanoma. Curr Stem Cell Res Ther 2012; 7(3): 217-228.
16. Kurokawa T, Fischer K, Bertz H, Hoegerle S, Finke J, Mackensen A. In vitro and in vivo characterization of graft-versus-tumor responses in melanoma patients after allogeneic peripheral blood stem cell transplantation. Int J Cancer 2002; 101(1): 52–60.
17. Szotkowski T, Jarosova M, Faber E, et al. Precursor T-lymphoblastic lymphoma as a secondary malignancy in a young patient after successful treatment of acute promyelocytic leukemia. Onkologie 2009; 32 : 513–515.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2013 Issue 4-
All articles in this issue
- The issue of pregnant women with BCR/ABL negative myeloproliferative neoplasms
- Malignant tumours in adult patients after successful treatment of acute myeloid leukemia: long-term experience at the Department of Hemato-Oncology in Olomouc
- Phlebotomy and therapeutic apheresis in the treatment of polyglobulia
- Influence of processing of platelet lysate at selected of platelets factors
- Stability of coagulation factors in thawed plasma
- Blood cell storage lesion
- Antithrombin
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Phlebotomy and therapeutic apheresis in the treatment of polyglobulia
- Antithrombin
- Stability of coagulation factors in thawed plasma
- Blood cell storage lesion
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

