-
Medical journals
- Career
Odběry dárcovských lymfocytů od nepříbuzných dárců Českého národního registru dárců dřeně (ČNRDD) v letech 1999 – 2010
: D. Lysák 1; M. Hrabětová 1; A. Jungová 1; T. Svoboda 1; Navrátilová J.1ihash2 ,2 ,2
: Hematologicko-onkologické oddělení FN Plzeň, Český národní registr dárců dřeně 1
: Transfuze Hematol. dnes,17, 2011, No. 4, p. 165-170.
: Comprehensive Reports, Original Papers, Case Reports
Analyzovali jsme soubor 45 nepříbuzných dárců, kterým byly v odběrovém centru Českého národního registru dárců dřeně odebrány v průběhu let 1999 – 2010 dárcovské lymfocyty. Při sledování vývoje počtu odběrů v čase byl patrný vzestupný trend v posledních 3 letech. Odběr lymfocytů byl požadován především pro pacienty s akutními leukemiemi, chronickou myeloidní leukemií a nehodgkinskými lymfomy (44 %, 18 % a 16 % všech odběrů). Imunoterapie pomocí dárcovských lymfocytů byla nejčastěji indikována pro hematologický či molekulárně genetický relaps (57 % a 16 %) nebo přetrvávající smíšený chimerismus po transplantaci (16 % odběrů). Odběr lymfocytů byl realizován s mediánem 8,4 (1,2–81,8) měsíců po prvním odběru kostní dřeně nebo periferních kmenových buněk. Odebrané množství odpovídalo 0,9 (0,1 – 5,0) x 108 CD3+ buněk na kilogram hmotnosti příjemce. Opakované darování lymfocytů bylo žádáno pouze pro jediného příjemce. Množství získaných CD3+ buněk v aferézním produktu korelovalo s hladinou leukocytů (r = 0,427, p = 0,0031) a hladinou mononukleárních buněk v periferní krvi dárce před odběrem (r = 0,511, p = 0,0003). Nežádoucí reakce se v průběhu odběru vyskytly pouze u 9 % dárců a ve všech případech se jednalo o klinicky nezávažné události. Odběr dárcovských lymfocytů představuje bezpečný a minimálně zatěžující způsob darování. Imunoterapie s využitím dárcovských lymfocytů umožňuje řešit řadu komplikací po alogenní transplantaci hemopoetických kmenových buněk. V souvislosti s rozvojem nemyeloablativních přípravných režimů, zvýšeným porozuměním potransplantační imunologické interakci atd. lze předpokládat zvyšující se požadavky na darování lymfocytů od původního dárce kmenových buněk i v příštích letech.
Klíčová slova:
dárcovské lymfocyty, aferéza, nežádoucí reakce, dárciÚvod
Infuze dárcovských lymfocytů (DLI) je jednou ze základních metod imunoterapie po alogenní transplantaci hemopoetických kmenových buněk. Přestože původně byly DLI indikovány především u nemocných s relapsem chronické myeloidní leukemie, v současné době se využívají u celé řady dalších hematologických malignit, jako jsou mnohočetný myelom, akutní leukemie nebo nehodgkinské lymfomy. S rozvojem nemyeloablativních transplantací se oblasti použití DLI výrazně rozšířily. Vedle léčby potransplantačního relapsu nebo progrese onemocnění jsou aplikovány pacientům s přetrvávajícím smíšeným chimerismem či minimální reziduální nemocí. Pacientům transplantovaným pro vysoce rizikovou malignitu nebo s použitím transplantátu s deplecí T-lymfocytů mohou být DLI podávány dokonce profylakticky (1, 2).
Počet odběrů DLI od zdravých dárců má celosvětově vzestupný trend (3). Podle statistiky EBMT byla v roce 2009 tato forma imunoterapie použita u 16 % pacientů, kteří podstoupili alogenní transplantaci (4). Registry dárců jsou proto častěji žádány transplantačními centry o druhé darování nestimulovaných leukocytů. V porovnání s odběrem periferních kmenových buněk (PBSC) není potřeba dárce mobilizovat pomocí G-CSF a k získání dostatečné dávky lymfocytů zpravidla postačuje také kratší aferéza. Odběr nestimulovaného aferézního produktu tedy představuje pro dárce menší zátěž s nižším rizikem nežádoucích reakcí (5, 6). Po opakovaných odběrech DLI nebo u dárců, kteří jsou odebíráni krátce po darování PBSC, lze někdy pozorovat přechodnou lymfocytopenii (5, 7). Tento potenciální dlouhodobý efekt darování lymfocytů je sledován v rámci dlouhodobé dispenzarizace dárců.
Provedli jsme retrospektivní analýzu druhých darování provedených u dárců Českého národního registru dárců dřeně (ČNRDD) v období 1999 – 2010 se zaměřením na odběry dárcovských lymfocytů. Cílem studie bylo vyhodnotit indikace pro požadavek na darování DLI, vývoj odběrů v čase, kvalitu nestimulovaných aferézních produktů a nežádoucí reakce u dárců v souvislosti s odběrem.
Soubor dárců
Analyzovali jsme soubor 45 (26 mužů a 19 žen) nepříbuzných dárců hemopoetických krvetvorných buněk, kteří podstoupili v období 1999–2010 druhé darování a byly jim odebrány nestimulované dárcovské lymfocyty. Registr dárců má pro druhé darování stanoven jednotný postup. Indikace k odběru DLI zahrnují relaps základního onemocnění, adoptivní imunoterapii u nemyeloablativních transplantací a léčbu potransplantačních lymfoproliferací. Každá žádost o odběr musí být individuálně posouzena skupinou tří nezávislých expertů, kteří vyhodnotí možný přínos pro daného pacienta a zároveň riziko pro dárce. Na základě jejich doporučení může být teprve dárce uvolněn k odběru. Všichni dárci, kteří vyslovili souhlas s darováním DLI, podstoupili předodběrové laboratorní vyšetření podobně jako před původním odběrem hematopoetických kmenových buněk. Péče o dárce v době odběru a při následné dispenzarizaci se řídila standardy ČNRDD resp. WMDA (World Marrow Donor Association).
Dárcovské lymfocyty byly odebírány metodou aferézy z periferní krve. Zpracovány byly 2 (medián, 1,3–3,3) objemy krve dárce. Jako antikoagulant byl použit roztok ACD-A v poměru 1 : 10–1 : 14 v plné krvi. Odběry byly provedeny na kontinuálních separátorech COBE Spectra (Caridian BCT, Lakewood, CO, USA). Jako prevence citrátové toxicity byla prováděna suplementace kalcia do návratové linky. Většina odběrů byla provedena cestou kontralaterálních předloketních žil. Centrální žilní katétr do femorální žíly bylo nutné zavést pouze u 13 % dárců. Ve standardech registru je doporučena dávka 1,0 x 108 CD3+ buněk/kg hmotnosti příjemce jako minimální množství CD3 pozitivních buněk, které by mělo být odebráno, pokud je to technicky možné a pokud není transplantačním centrem požadováno jinak. Zároveň je preferována co nejmenší zátěž pro dárce, takže všem dárcům byla provedena pouze jedna aferéza. Základní informace o dárcích jsou sumarizovány v tabulce 1.
1. Charakteristika dárců a aferézních produktů. 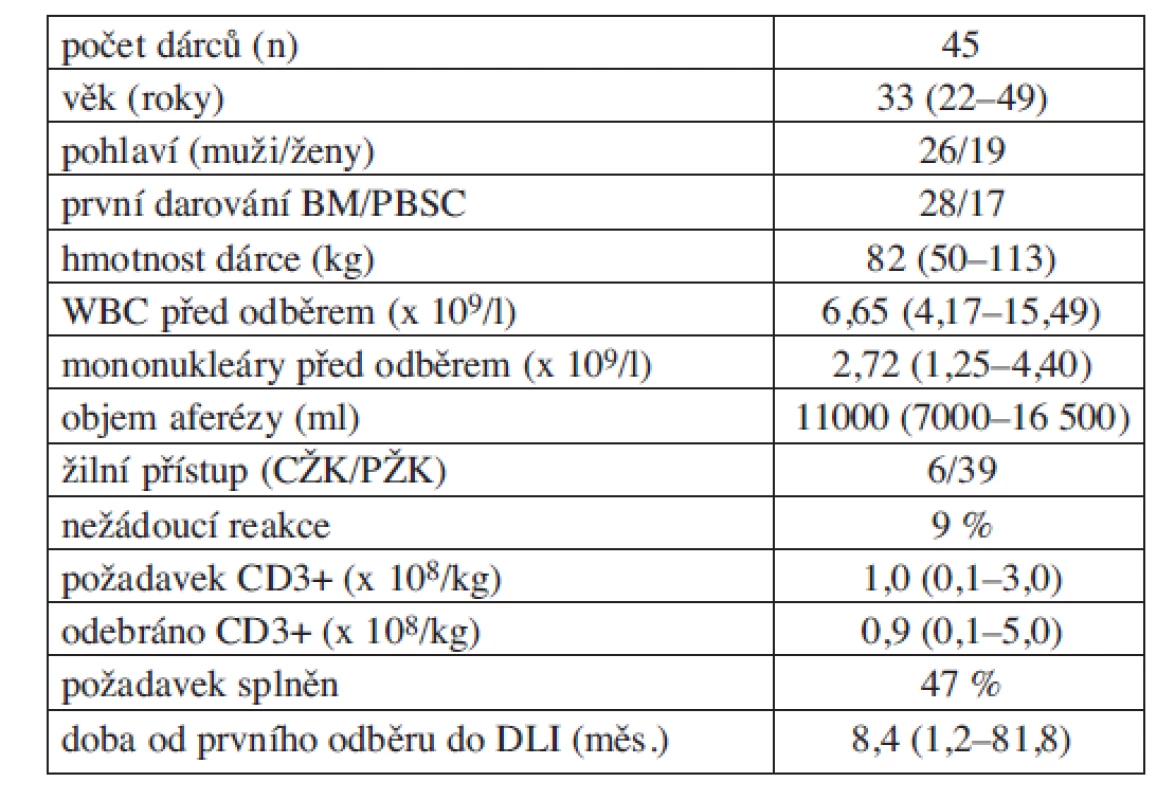
mediány; BM – kostní dřeň; PBSC – periferní kmenové buňky Pro statistické vyhodnocení proměnných, které ovlivňují množství odebraných CD3+ buněk, byla využita Spearmanova korelační analýza a výsledky byly graficky vyjádřeny lineární regresí. Vzájemný vztah jednotlivých proměnných byl dále testován multivariantní analýzou. Statistické hodnocení bylo provedeno pomocí software Statistica 98 Edition (StatSoft, Inc., Tulsa, OK, USA).
Výsledky
V rozmezí let 1999 až 2010 provedl Český národní registr dárců dřeně celkem 45 odběrů dárcovských lymfocytů. Porovnání vývoje žádostí o odběr v čase ukázalo, že odběrů DLI začalo přibývat od roku 2005 a po přechodném poklesu je v posledních třech letech opět jasně patrný vzestupný trend (graf 1). Nejčastějšími diagnózami u pacientů, pro které bylo druhé darování požadováno, byly akutní leukemie (44 %), chronická myeloidní leukemie (18 %) a nehodgkinské lymfomy (16 %). Jako nejčastější indikaci k podání DLI uváděla transplantační centra hematologický (57 %) nebo molekulárně genetický (16 %) relaps malignity nebo perzistující smíšený chimerismus (16 %). Detaily viz graf 2. Požadovaná dávka CD3+ lymfocytů odpovídala 1,0 (medián, 0,1–3,0) x 108/kg hmotnosti příjemce. Odebrat se podařilo množství 0,9 (medián, 0,1–5,0) x 108/kg. Požadovaného množství CD3+ lymfocytů bylo dosaženo u 47 % odběrů. Pouze u jediného dárce byl ze strany transplantačního centra žádán další odběr DLI.
1. Vývoj počtu odběrů DLI v období 1999 – 2010. 
Vývoj počtu provedených odběrů dárcovských lymfocytů v období 1999 – 2010. Vzestup odběrů v roce 2005 souvisí se zvýšeným počtem odběrů PBSC provedených v tomto období. Graf 2a. a 2b. Diagnózy a indikace pro podání DLI. 
a. Diagnózy pacientů, pro něž byly požadovány odběry DLI. Dominují akutní leukemie a MDS (55 % odběrů). b. Indikace pro odběr DLI uvedené transplantačními centry v žádostech o druhé darování. Podskupina ostatní zahrnuje: virová encefalitida, selhání štěpu. MC – smíšený chimerismus, MG/CG – cytogenetický/molekulárně genetický relaps, MRD – přetrvávající minimální reziduální nemoc. Medián doby mezi původním odběrem kostní dřeně nebo periferních kmenových buněk a odběrem DLI dosáhl v celém souboru 8,4 měsíce (1,2–81,8). Zhruba třetina odběrů DLI byla však provedena do 6 měsíců a další třetina mezi 6.–12. měsícem od původního odběru hematopoetických kmenových buněk. 70 % resp. 54 % odběrů v těchto časových obdobích se uskutečnilo pro pacienty s akutní leukemií nebo pokročilým myelodysplastickým syndromem. Po více než dvou letech od původního darování byly dárcovské lymfocyty indikovány častěji pro chronická onemocnění typu chronické myeloidní nebo lymfatické leukemie nebo mnohočetný myelom (blíže viz graf 3).
2. Doba od prvního darování do odběru DLI. 
Procento odběrů DLI provedených v daných časových obdobích mezi prvním darováním hemopoetických kmenových buněk a druhým darováním DLI; medián 8,4 měsíce (1,2 – 81,8). Snažili jsme se definovat, jaké proměnné ze strany dárce ovlivňují množství CD3+ buněk odebraných při aferéze, aby případně na jejich základě bylo možné průběh aferézy lépe plánovat s ohledem na požadované množství lymfocytů. Ukázalo se, že množství odebraných T-lymfocytů (x 108) koreluje statisticky významně s hladinou leukocytů (x 109/l; r = 0,427, p = 0,0031) a zejména s hladinou mononukleárních buněk (lymfocyty + monocyty) v periferní krvi dárce před odběrem (x 109/l; r = 0,511, p = 0,0003). Tyto dva parametry krevního obrazu také významně korelovaly mezi sebou (r = 0,800, p < 0,0001). Závislost výtěžku na objemu zpracované krve nebyla potvrzena. Regresní křivky viz graf 4. a 5. Pomocí multivariantní analýzy jsme prokázali, že hladina mononukleárních buněk v periferní krvi před odběrem je nezávislým faktorem určujícím kvalitu nestimulovaného aferézního produktu, tedy množství odebraných T-lymfocytů (beta = 0,51, p = 0,0136). Ostatní testované proměnné (hladina leukocytů před odběrem a objem zpracované krve) neměly na tento parametr statisticky významný vliv.
3. Závislost množství odebraných CD3+ lymfocytů na hladině WBC před aferézou. 
Množství CD3+ lymfocytů (x108/kg) v aferézním produktu koreluje s hladinou leukocytů v periferní krvi dárce před odběrem (x 109/l; r = 0,427, p = 0,0031); y = (3,97391)*x + (36,78175). 4. Závislost množství odebraných CD3+ lymfocytů na hladině mononukleárních buněk před aferézou. 
Množství CD3+ lymfocytů (x 108/kg) v aferézním produktu koreluje s hladinou mononukleárních buněk v periferní krvi dárce před odběrem (x 109/l; r = 0,511, p = 0,0003); y = (16,8537)*x + (19,1138). Nežádoucí reakce vzniklé v souvislosti s odběrem byly zaznamenány pouze u 9 % dárců (citrátová toxicita, nauzea, kolapsový stav). Ve všech případech se jednalo o reakce mírné, které nebránily dokončení odběru v plánované délce. Nedošlo k rozvoji žádné závažné nebo neočekávané události u dárce.
Diskuse
Relaps onemocnění představuje hlavní příčinu úmrtí pacientů po alogenní transplantaci (www.cibmtr.org). Jedním z možných léčebných postupů je posílení reakce štěpu proti nádoru, zprostředkované aloreaktivními T-lymfocyty, pomocí redukce imunosupresivní léčby nebo podáním infuze dárcovských lymfocytů (1). DLI nabízejí účinný léčebný postup pro část nemocných s relapsem nebo refrakterním onemocněním po alogenní transplantaci. Nejlepšího efektu dosahuje infuze DLI u pacientů s chronickou myeloidní leukemií, kde lze očekávat až 90 % odpovědí. Pravděpodobnost odpovědi na léčbu pak u dalších diagnóz klesá od nehodgkinských lymfomů přes mnohočetný myelom až po akutní leukemie a pohybuje se do 40 – 50 %, většinou v kombinaci s cytoredukční chemoterapií (1, 8).
V naší retrospektivní analýze jsme vyhodnotili odběry dárcovských lymfocytů u 45 nepříbuzných dárců, kteří byli odebráni v období 1999–2010. Vzestup počtu odběrů DLI jsme zaznamenali zejména v posledních letech. Tento trend pravděpodobně souvisí s rostoucím počtem nemyeloablativních transplantací, u kterých je potransplantační imunoterapie nezřídka indikována k ovlivnění perzistujícího smíšeného chimerismu nebo minimální reziduální nemoci. Tento vývoj potvrzují i údaje EBMT, které uvádějí za rok 2009 podání dárcovských lymfocytů u cca 40 % pacientů transplantovaných s nemyeloablativním přípravným režimem (4).
Optimální strategie pro aplikaci DLI, její načasování, dávka či kombinace s cytotoxickou terapií není stále sjednocena. Požadavek na odběr DLI se může objevit za různě dlouhou dobu od odběru prvního transplantátu v závislosti na typu malignity, indikaci k DLI atd. (1, 7). V našem souboru byly přibližně dvě třetiny DLI odebrány v prvním roce po prvním darování a to zejména pro pacienty s akutními leukemiemi nebo MDS.
Doporučená dávka CD3+ buněk není taktéž zcela jasná a dávkování se pohybuje v širokém rozmezí 1 x 106/kg až 1 x 108/kg jednorázově nebo častěji v režimu eskalujících dávek (1, 8). Jedna aferéza tedy zpravidla postačuje k získání potřebné dávky CD3+ buněk v množství odpovídajícím přibližně 1 x 108/kg (9). Tuto cílovou dávku se nám podařilo naplnit u 51 % odběrů, požadavek transplantačního centra byl splněn u 47 % odběrů. Vzhledem k tomu, že darování lymfocytů není spojené s potřebou mobilizace a lze jej opakovat, upřednostnili jsme co největší snížení nepohodlí pro dárce (jedna aferéza, ambulantní výkon, nízká zátěž citrátem) před snahou o maximální výtěžek. Opakovaný odběr DLI byl proveden pouze u jediného dárce, ve všech ostatních případech včetně odběrů s nesplněným požadavkem transplantačního centra, nebyla další aferéza nutná.
Frekvence nežádoucích reakcí byla při odběru DLI nižší, než je obvyklé při odběrech periferních kmenových buněk. Absence mobilizace filgrastimem, eventuálně i kratší aferéza znamenaly snížení výskytu komplikací na 9 % oproti 20–80 % udávaným při stimulovaných odběrech periferních kmenových buněk (10, 11), respektive 59 % komplikací, které jsme pozorovali sami u našich dárců PBSC.
Aferézy zejména opakované nebo provedené v relativně krátkém časovém odstupu mohou být spojené s určitou cytoredukcí a přechodným snížením hladiny trombocytů a lymfocytů. Lymfocytopenie může být u některých dárců, v závislosti na době od prvního darování, přítomná už před odběrem DLI jako důsledek předchozího odběru PBSC. V našem souboru jsme nepozorovali před odběrem snížení hladiny mononukleárních buněk pod normální hodnoty, nebyl rozdíl mezi dárci kostní dřeně a PBSC. Ovšem medián doby od prvního odběru byl přibližně 8 měsíců a téměř dvě třetiny dárců podstoupily při prvním darování odběr kostní dřeně, který je spojen s menším rizikem přetrvávají leukocytopenie, takže se diskrétní změny hladiny leukocytů nemusely projevit.
Bezprostředně po odběru DLI dochází k dalšímu poklesu lymfocytů o 10–30 % oproti hodnotám před aferézou (5, 12). Opakované aferézy mohou indukovat určitou lymfocytopenii až u 50 % dárců (7, 13). Rizikovými faktory poklesu hladiny lymfocytů jsou vyšší věk dárce a předchozí odběr PBSC (7). Někteří autoři pozorovali prolongované snížení lymfocytů nebo jejich frakcí po odběru DLI s poklesem o přibližně 20 % při kontrole za 6 měsíců, respektive za dva roky po odběru. Všechny tyto změny však byly statisticky nevýznamné při srovnání se vstupními hodnotami před aferézou (12). Naše retrospektivní analýza bohužel neumožnila hodnocení vývoje hladin lymfocytů po odběru pro neúplnost dat.
Pokles lymfocytů lze tedy vnímat jako jediný potenciální dlouhodobý účinek darování DLI. Tato změna v krevním obraze dárce ovšem nemá žádný klinický dopad, ani nenavozuje u dárce imunodeficitní stav (13). Přesto jsou stanovena pravidla pro frekvenci darování a dispenzarizaci dárců po odběru DLI s cílem nepřetěžovat dárce. ČNRDD po odběru DLI dočasně vyřazuje dárce na dobu jednoho roku (pokud interval mezi prvním darováním a DLI je < 6 měsíců) nebo na dobu 6 měsíců (pokud je interval mezi odběry > 6 měsíců). Nicméně každá žádost o druhé darování se posuzuje individuálně a je v kompetenci skupiny nezávislých expertů a vedoucího lékaře registru uvolnit dárce k dalšímu odběru pro stejného příjemce i před uplynutím tohoto období.
Někteří autoři popisují vztah mezi parametry dárce nebo aferézy a množstvím odebraných CD3+ buněk. Objem zpracované krve koreluje s počtem odebraných lymfocytů a umožňuje odhadovat minimální množství zpracované krve nezbytné k získání cílové dávky (5, 6). Jiné práce uvádějí souvislost mezi hladinou leukocytů nebo mononukleárních buněk v periferní krvi před aferézou a množstvím CD3+ lymfocytů v aferézním produktu (14). Podobnou souvislost jsme pozorovali i v našem souboru, kdy hlavním nezávislým prediktorem kvality buněčného koncentrátu byla hladina mononukleárních buněk v periferní krvi. Nezávislý vliv objemu aferézy jsme naopak nepotvrdili. Nicméně tento fakt může být ovlivněn řadou okolností jako dlouhý časový horizont hodnoceného období, během kterého se měnila softwarová verze odběrového zařízení, široké rozmezí objemů a doby trvání aferézy, kdy se může různým způsobem uplatnit „recruitment“ lymfocytů během odběru atd.
Závěr
Odběr lymfocytů od zdravého dárce představuje bezpečný způsob darování, s nízkým rizikem komplikací. Přes vývoj v oblasti biologických léků, který vede k přehodnocení indikace alogenní transplantace u některých hematologických malignit, počet alogenních transplantací neklesá (1). Transplantační postup zůstává jedinou nadějí v případě onemocnění s vysokým rizikem relapsu. Objevují se nové indikace, zvyšuje se počet nemyeloablativních transplantací. Imunoterapie v různé podobě se stává stále důležitější součástí transplantační léčby. Lepší pochopení transplantační imunologie a imunitní rekonstituce po transplantaci by nám v budoucnu mělo umožnit vyvolat reakci štěpu proti nádoru bez zvýšení morbidity a mortality spojené s reakcí štěpu proti hostiteli. Východiskem této imunoterapie jsou a budou lymfocyty nebo jiné hematopoetické buňky dárce.
MUDr. Daniel Lysák, PhD
Hematologicko-onkologické oddělení
Fakultní nemocnice Plzeň
Alej Svobody 80
304 60 Plzeň
email: lysak@fnplzen.cz
Sources
1. Tomblyn M, Lazarus HM. Donor lymphocyte infusions: the long and winding road: how should it be traveled? Bone Marrow Transplant 2008; 42 : 569-579.
2. Marks DI, Lush R, Cavenagh J, et al. The toxicity and efficacy of donor lymphocyte infusions given after reduced-intensity conditioning allogeneic stem cell transplantation. Blood 2002; 100 : 3108-3114.
3. Bolan CD, Hartzman RJ, Perry EH, et al. Donation activities and product integrity in unrelated donor allogeneic hematopoietic transplantation: experience of the National Marrow Donor Program. Biol Blood Marrow Transplant 2008; 14 : 23-28.
4. Baldomero H, Gratwohl M, Gratwohl A, et al. The EBMT activity survey 2009: trends over the past 5 years. Bone Marrow Transplant 2011; 46 : 485-501.
5. Sato H, Shiobara S, Yasue S, Chuhjo T, Nakao S. Lymphocyte collection for donor leucocyte infusion from normal donors: estimation of the minimum processed blood volume and safety of the procedure. Vox Sang 2001; 81 : 124-127.
6. Shaz B, Goodarzi K, Malynn E, Uhl L. Improved strategy for mononuclear cell collection for donor lymphocyte infusions. Transfusion 2006; 46 : 1044-1048.
7. Nicolini FE, Wattel E, Michallet AS, et al. Long-term persistent lymphopenia in hematopoietic stem cell donors after donation for donor lymphocyte infusion. Exp Hematol 2004; 32 : 1033-1039.
8. Deol A, Lum LG. Role of donor lymphocyte infusions in relapsed hematological malignancies after stem cell transplantation revisited. Cancer Treat rev 2010; 36 : 528-538.
9. Körbling M, Giralt S, Khouri I, et al. Donor lymphocyte apheresis for adoptive immunotherapy compared with blood stem cell apheresis. J Clin Apher 2001; 16 : 82-87.
10. Pulsipher MA, Chiphakdithai P, Miller JP, et al. Adverse events among 2408 unrelated donors of peripheral blood stem cells: results of prospective trial from the National Marrow Donor Program. Blood 2009; 113 : 3604-3611.
11. Leitner GC, Baumgartner K, Kalhs P, et al. Regeneration, health status and quality of life after rhG-CSF-stimulated stem cell collection in healthy donors: a cross-sectional study. Bone Marrow Transplant 2009; 43 : 357-363.
12. Strasser EF, Zimmermann R, Weisbach V, Ringwald J, Zingsem J, Eckstein R. Mononuclear cell variability and recruitment in non-cytokine stimulated donors after serial 10-liter leukapheresis procedures. Transfusion 2005; 45 : 445-452.
13. Kolf CM, Bolan CD, Wesley RA, Browning JN, Feitman SF. Sustained decrease in lymphocyte counts in serial long-term leukapheresis donors. Transfusion 2003; 43: S94-040D.
14. Arat M, Önder A, Gürman G, et al. The impact of granulocyte colony stimulating factor at content of donor lymphocytes collected for cellular immunotherapy. Trans Apher Sci 2004; 30 : 9-15.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2011 Issue 4-
All articles in this issue
- Long-term outcome and lineage-specific chimerism in 194 patients with Wiskott-Aldrich syndrome treated by hematopoietic cell transplantation in the period 1980-2009: an international collaborative study
- Combination of pegylated IFN-α2b with imatinib increases molecular response rates in patients with low- or intermediate-risk chronic myeloid leukemia
- Predicting complete cytogenetic response and subsequent progression-free survival in 2060 patients with CML on imatinib treatment: the EUTOS score
- Randomized, double-blind trial of fluconazole versus variconazole for prevention of invasive fungal infection after allogeneic hematopoietic cell transplantation
- Reduced-intensity conditioning therapy with busulfan, fludarabine, and antithymocyte globulin for HLA-haploidentical hematopoietic cell transplantation in acute leukemia and myelodysplastic syndrome
- Secondary solid cancers after allogeneic hematopoietic cell transplantation using busulfan-cyclophosphamide conditioning
- Successful allogeneic hematopoietic stem cell transplantation for GATA2 deficiency
- Testing G-CSF responsiveness predicts the individual susceptibility to infection and consecutive treatment in recipients of high-dose chemotherapy
- The impact of therapy-related acute myeloid leukemia (AML) on outcome in 2853 adult patients with newly diagnose AML
- Treosulfan-based conditioning regiments for hematopoietic stem cell transplantation in children with primary immunodeficiency: United Kingdom experience
- High success rate of hematopoietic cell transplantation regardless of donor source in children with very high-risk leukemia
- NK-cell enteropathy: a benign NK-cell lymphoproliferative disease mimicking intestinal lymphoma: clinicopathologic features and follow-up in a unique case series
- Norovirus gastroenteritis causes severe and lethal complications after chemotherapy and hematopoietic stem cell transplantation
- Prognosis of children with mixed phenotype acute leukemia treated on the basis of consistent immunophenotypic criteria
- Donor lymphocyte collections from unrelated donors of the Czech National Marrow Donors Registry (ČNMDR) between 1999 and 2010
- Bone marrow microenvironment and its role in the pathogenesis of leukaemia
- Serum levels of immunoglobulin free light chains in monoclonal gammopathy of undetermined significance and their contribution to stratification and monitoring
- A phase 2 study of the safety and efficacy of rituximab with plasma exchange in acute acquired thrombotic thrombocytopenic purpura
- Bone mineral density in adult survivors of childhood acute leukemia: impact of hematopoietic stem cell transplantation and other treatment modalities
- Effect of stem cell source on outcomes after unrelated donor transplantation in severe aplastic anemia
- Late MRD response determines relapse risk overall and in subsets of childhood T-cell ALL: results of the AIEOP-BFM-ALL 2000 study
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Bone marrow microenvironment and its role in the pathogenesis of leukaemia
- Donor lymphocyte collections from unrelated donors of the Czech National Marrow Donors Registry (ČNMDR) between 1999 and 2010
- Serum levels of immunoglobulin free light chains in monoclonal gammopathy of undetermined significance and their contribution to stratification and monitoring
- Randomized, double-blind trial of fluconazole versus variconazole for prevention of invasive fungal infection after allogeneic hematopoietic cell transplantation
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


