-
Medical journals
- Career
Proteomická analýza solubilních proteinů důležitých u dětské leukemie
Authors: M. Kováč 1,2; D. Petráčková 3; S. Bezoušková 3; V. Pelková 1,2; M. Vášková 1,2; E. Mejstříková 1,2; T. Kalina 1,2; J. Weiser 3; J. Starý 3; O. Hrušák 1,2
Authors‘ workplace: CLIP – Childhood Leukemia Investigation Prague, 2Klinika dětské hematologie a onkologie, UK 2. LF a FN v Motole, Praha, 3Mikrobiologický ústav AV ČR, Praha 1
Published in: Transfuze Hematol. dnes,16, 2010, No. 4, p. 218-222.
Category: Comprehensive Reports, Original Papers, Case Reports
Overview
Některé klinické symptomy u akutní leukemie (AL) mohou vznikat v důsledku působení solubilních faktorů secernovaných leukemickými buňkami do mikroprostředí kostní dřeně. Na druhé straně jsou leukemické buňky často závislé na mikroprostředí hostitele, takže většina leukemických buněk podlehne apoptóze během prvních dnů v in vitro podmínkách. I tento podpůrný vliv na leukemické buňky může být zprostředkován solubilními faktory. Většina pozornosti se logicky soustřeďuje na maligní buňky, a tak složení solubilních faktorů může být neprávem opomíjeno. Vyšetřovali jsme proteiny v kostní plazmě dětí s akutní lymfoblastickou leukemií (ALL), které mohou být zodpovědné za agresivitu ALL blastů nebo za mikroprostředím zprostředkované přežívání ALL buněk.
Plazma z kostní dřeně a periferní krve byla analyzovaná pomocí proteinové array a dvojrozměrné elektroforézy (2-DE). Metodou proteinové array jsme detekovali 23 proteinů, jejichž koncentrace byla signifikantně odlišná u pacientů a kontrolních vzorků. Z kostní plazmy jsme před provedením 2-DE depletovali 12 abundatních proteinů pomocí afinitní chromatografie. Tím se nám podařilo zvýšit počet spotů, které jsme analyzovali pomocí softwaru PDQuest.Klíčová slova:
akutní lymfoblastická leukemie, proteinová array, dvojrozměrná elektroforéza 2-DE, proteinÚvod
Leukemie, maligní onemocnění lymfoidních anebo myeloidních progenitorových buněk, je nejčastěji se vyskytující malignita u dětí. Nejběžnějším typem je akutní lymfoblastická leukemie (ALL), která tvoří 75–80 % všech dětských leukemií, zbývající subtypy pocházejí z myeloidní linie (1). Zlepšení chemoterapie, spolu s přibývajícími poznatky o biologickém chování leukemických buněk, vedlo k vysokému snížení mortality. Nejmodernější léčbou se podaří zachránit 75 % dětí s ALL. V současné době je cílem hematologie definovat příčinu selhání léčby, ke které dochází u 20 % ALL a zároveň zvýšit antileukemický účinek terapie.
ALL je heterogenní onemocnění charakterizované klonální expanzí transformovaných hematopoetických buněk, které se diferencují do T nebo B řady (1). Dominantní formu dětských ALL tvoří B – prekurzorové leukemie.
Maligní transformace leukemických lymfoblastů je spojena s chromozomálními abnormalitami, aberantní genovou expresí a abnormálně exprimovanými povrchovými molekulami (2). Každý ze dvou nejčastějších genetických podtypů tvoří asi čtvrtinu dětských ALL. Jsou to přítomnost fúzního genu TEL-AML1, jako důsledek translokace t(12;21), a vysoká hyperdiploidie, kdy počet chromozomů je zvýšen na 51 až 65 (3). Oba genotypy jsou asociovány s dobrou prognózou (2). Méně časté genetické translokace u ALL spojené se špatnou prognózou, jsou přítomnost fúzního genu BCR-ABL a MLL-AF4 (1).
Leukemická buňka zásadně ovlivňuje pacienta, což vede ke známým základním klinickým a laboratorním projevům (potlačení nemaligní krvetvorby, ovlivnění metabolismu, změny metabolismu kostí apod.). Na druhou stranu jsou leukemické buňky samy závislé na hostiteli, takže u významného procenta pacientů s akutní lymfoblastickou leukemií (ALL) buňky podlehnou apoptóze a nekróze bezprostředně po převedení do podmínek in vitro (4–6).
Faktory zodpovědné za přežívání leukemických buněk nejsou dosud známy. Publikovaná data ukazují supresivní efekt molekul přítomných v plazmě u dospělých s akutní myeloidní leukemií na růst hematopoetických progenitorových buněk. Tento efekt byl potlačen protilátkami proti TNF alfa a adiponectinu (7).
K zjištění důležitosti solubilních faktorů u ALL jsme používali dvě proteomické metody: dvojrozměrnou elektroforézu (2-DE) a proteinovou array. Pomocí těchto technik jsme hledali proteiny, jejichž hladina se významně liší v plazmě kostní dřeně dětí při diagnóze ALL a u kontrolní skupiny. Takové molekuly mohou sloužit jako diagnostické znaky leukemií, nebo jako potenciální terapeutické cíle, bude-li se jednat o molekuly významně podporující přežívání leukemických buněk.
Materiál a metody
Pacienti
V naší bance plazmy kostní dřeně uchováváme diagnostické vzorky dětí s ALL (vzorky leukemické kostní plazmy, LKP) a kontrolní vzorky (KKP), odebrané od pacientů bez známek maligního onemocnění více než 1 rok po transplantaci kostní dřeně. Všechny vzorky byly získány po informovaném souhlasu. Ve snaze pokrýt široké změny v proteomickém profilu jsme vzorky použité na 2-DE smíchali od 5 dětí s ALL se třemi hlavními genotypickými podtypy (hyperdiploidie, TEL-AML1, a bez fúze a hyperdiploidie) a srovnávali je s KKP smíchanou od 5 kontrolních pacientů. Vzorky na cytokinovou array jsme testovali jednotlivě. Pomocí cytokinové array jsme testovali jinou kohortu 15 LKP a 9 KKP než pomocí 2-DE. Periferní krev jsme získali od 5 zdravých dospělých dobrovolných dárců.
Zpracování vzorků
LKP a KKP byla získána jako horní supernatant po gradientové centrifugaci na roztoku Ficoll Paque Plus (GE Healthcare Bio-Sciences) při 500 g při 4 °C, po dobu 35 min. Ihned po centrifugaci a odsátí byl materiál uložen při -80 °C. Po rozmražení jsme do vzorků použitých na 2-DE přidávali směs inhibitorů proteáz a vzorky jsme použili opakovaně. Na cytokinovou array jsme použili vzorky jednorázově bez přidání proteázových inhibitorů.
Cytokinová array
Pro zjištění profilu solubilních proteinů jsme použili cytokinový kit (RayBio Human Cytokine antibody array V map) od firmy RayBiotech, Inc. Testovali jsme 15 LKP, 9 KKP a 5 plazem z periferní krve. Na každé membráně je navázáno 79 protilátek proti cytokinům. Po přidání 1 ml kostní plazmy na membránu s protilátkami jsme vzorky inkubovali při laboratorní teplotě. Následovala inkubace se směsí biotinylovaných protilátek a streptavidinem, po které jsme detekovali chemiluminiscenční signál pomocí CCD kamery na přístroji FluorChem FC2 od firmy Alpha Innotech. Optickou denzitu signálu jsme analyzovali pomocí softwaru AlphaEase FC.
Imunodeplece
Vysoce abundantní proteiny ve vzorcích kostní plazmy jsme depletovali pomocí kitu Proteomelab Ig Y-12 (Beckman Coulter). Kit obsahuje kolonky s purifikovanými kuřecími protilátkami, které jsou kovalentně konjugované s polymerními kuličkami. Protilátky vážou 12 abundantních proteinů v lidské plazmě, kterými jsou albumin, IgG, transferin, fibrinogen, IgA, α2-makroglobulin, IgM, α1-antitrypsin, haptoglobin, α1-glykoprotein, apolipoprotein A1, apolipoprotein A2. Tyto proteiny představují až 96 % všech plazmatických proteinů, čímž činí identifikaci minoritních biologických markerů obtížnou.
Po imunodepleci jsme nízce abundantní proteiny vysráželi v TCA (kyselina trichloroctová) o finální koncentraci 6 % s 0,01 % deoxycholátem sodným 45 minut při laboratorní teplotě. Vzorky jsme rozpustili v rehydratačním roztoku (7 mol/l močovina, 2 mol/l thiourea, 4 % CHAPS, 1 % w/v DTT, 1 % Pharmalyte pH 3–10 /GE Healthcare/) a uchovávali při -80 °C.
Dvojrozměrná elektroforéza (2-DE)
Na gelový proužek s imobilizovaným pH gradientem o rozsahu pH 3–10 jsme nanesli 200 μg plazmatických proteinů v rehydratačním roztoku (viz Imunodeplece), převrstvili minerálním olejem a rehydratovali přes noc. Izoelektrickou fokusaci (1. rozměr 2-DE) jsme provedli na přístroji Multiphor II (GE Healthcare) při 45 kVh. Proužky byly před analýzou v druhém rozměru ekvilibrovány v pufru ve složení 50 mmol/l Tris HCl pH 6,8, 6 mol/l močovina, 30 % glycerol, 10 % SDS (dodecylsulfát sodný) a 0,2 % DTT (dithiotreitol) po dobu 15 min. Následně byly přeneseny do pufru, který byl stejného složení avšak místo DTT obsahoval 0,25% Iodoacetamid. Pro dělení v druhém rozměru v přítomnosti SDS jsme použili 10 % polyakryamidový gel o rozměrech 18x20 cm. Dělení ve druhém rozměru pak probíhalo v zařízení Millipore Investigator Unit (Millipore Corporation, Inc.). Elektroforetická analýza probíhala podle protokolu doporučeného výrobcem zařízení. Ve všech experimentech jsme při analýze v softwaru PDQuest porovnávali 4 nezávislé gely LKP (1gel = 1 vzorek LKP od 5 pacientů) a 4 nezávislé gely KKP (1gel = 1 směsný vzorek KKP od 5 kontrolních pacientů bez známek ALL). Rozdíly mezi LKP a KKP jsme vyhodnotili pomocí softwaru PDQuest.
Barvení proteinů
Proteiny jsme vizualizovali barvením pomocí stříbra (ProteoSilver stain kit, Sigma-Aldrich), pro kvantitativní analýzu pomocí softwaru PDQuest pak fluorescenční barvou Sypro Ruby (Sypro Ruby, Invitrogen). Fluorescenčně barvené gely jsme analyzovali ve snímacím zařízení Molecular Imager™ FX (Bio-Rad) při rozlišení 100 μm.
Výsledky
Proteinový profil leukemické (LKP) a kontrolní kostní plazmy (KKP) a plazmy z periferní krve metodou cytokinové array
Metodou lidských cytokinových protilátkových arrayí jsme otestovali koncentraci 79 proteinů (cytokinů, chemokinů a dalších sekretovaných faktorů). Zjišťovali jsme koncentraci u LKP (n = 15), u KKP (n = 9) a plazmy z periferní krve zdravých osob (n = 5). Detekovali jsme 23 proteinů se signifikantně rozdílnou koncentrací mezi LKP a KKP (p < 0,05). Všechny nalezené rozdílně zastoupené proteiny měly vyšší hladinu exprese u pacientů (tab. 1). Vzhledem k vysokému množství pozorování je možné, že některé ze zjištěných rozdílů jsou významné díky náhodě. V Tabulce 1 je proto označen rozdíl jako „možný“, pokud byla hodnota p nižší než 0,05, ale vyšší než 0,000633, což je požadovaná hladina významnosti po Bonferroniho korekci (odpovídá hodnotě 0,05/n, kde n je počet pozorování = 79). V případech, kde jsme zjistili možný rozdíl koncentrace, je nutno rozdíly potvrdit nebo vyvrátit jinou nezávislou metodou. Statistické významnosti s Bonferroniho korekcí dosáhly rozdíly v koncentraci proteinů LIF a TIMP-1. Nepozorovali jsme žádné signifikantní rozdíly mezi plazmou z kostní dřeně a plazmou z periferní krve.
Table 1. Proteiny se signifikantně vyšší expresí v LKP podle cytokinové arraye. 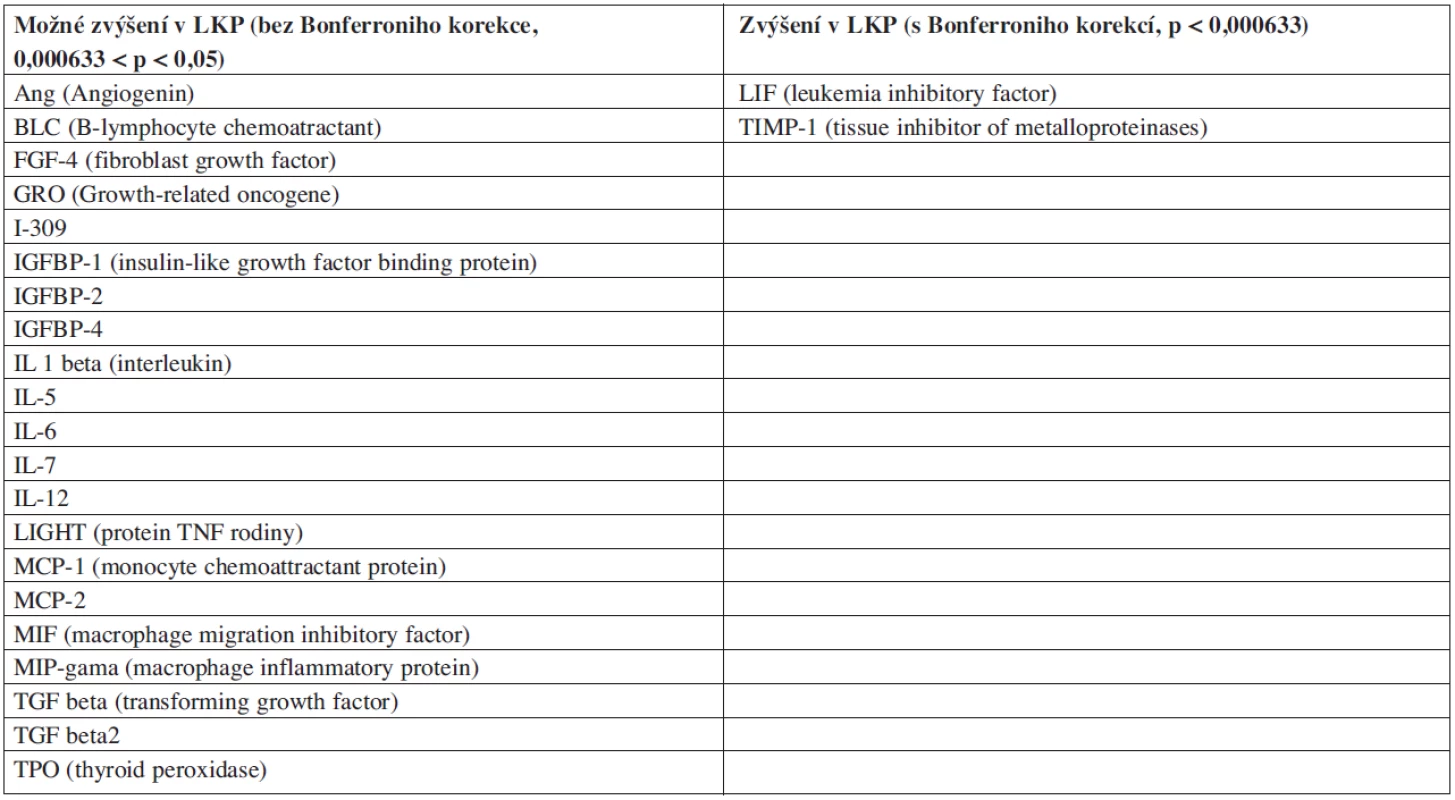
Dvojrozměrná elektroforéza (2-DE)
Složení proteomu kostní plazmy (KP)
Relativně malý počet (10–15) proteinů (především albuminu) tvoří více než 90 % všech proteinů KP. Tato skutečnost ztěžuje detekci a separaci proteinů vyskytujících se v plazmě v nízkých koncentracích. Proto bylo nutno tyto majoritní proteiny odstranit.
Abundantní protein jsme odstranili imunochromatograficky. Tato technika zlepšila separaci proteinů při dvojrozměrné elektroforéze a výrazně zvýšila množství proteinových skvrn (obr. 1 a obr. 2) a ulehčí následnou identifikaci minoritních plazmatických proteinů s potenciálně důležitým biologickým účinkem.
Image 1. Reprezentativní 2-DE gel KKP a LKP (KKP a LKP vznikly smícháním 5 individuálních vzorků) před deplecí abundantních proteinů. Na gelu jsme identifikovali 264 skvrn (průměrný počet skvrn vyhodnocený na Master gelu). Dominantní skvrna představuje největší plazmatický protein albumin. Gel barvený Sypro-ruby. 
Image 2. 2-DE gel proteinů KKP a LKP po depleci albuminu a dalších majoritních proteinů. Gel barvený Sypro-ruby. Imunodeplece výrazně zvýšila množství minoritních proteinů ve srovnání s obr. 1. Počet identifikovaných skvrn stoupl na 393 (průměrný počet skvrn vyhodnocený na Master gelu). 
Rozdíly mezi LKP a KKP po depleci
Gely po 2-DE jsme analyzovali pomocí PDQuest 7.3.1 softwaru (Bio-Rad). Na gelu jsme rozlišili 393 proteinových skvrn, což je průměrný počet skvrn na tzv. Master gelu (gel vytvořený v softwaru PDQuest po analýze gelů LKP a KKP), přičemž bez deplece jsme rozlišili na Master gelu jen asi 260 skvrn. Intenzita (odpovídající koncentraci) 16 skvrn ze 393 byla signifikantně rozdílná při porovnání mezi LKP a KKP.
Srovnání výsledků s expresními profily
V závěrečné části jsme srovnávali expresi LIF a TIMP-1 s jejich již publikovanými expresními profily, tedy s expresí na úrovni mRNA. Ve všech vybraných studiích byl použit stejný typ čipu, což nám umožnilo jednotlivé studie navzájem srovnat. Porovnávali jsme leukemické buňky (8) s nemaligními B-prekurzory (9) a s nesortovanými buňkami kostní dřeně (10) (obr. 3a, b). Exprese TIMP1 je u B-prekurzorové ALL vyšší než u B prekurzorů, ale nižší než u nesortovaných buněk kostní dřeně. Exprese LIF je u B-prekurzorové ALL nižší u B prekurzorů i u nesortovaných buněk kostní dřeně.
Image 3. a. Graf znázorňuje expresi TIMP1 přepočítanou podle dostupných dat z expresních profilů (reference zmíněny v textu). 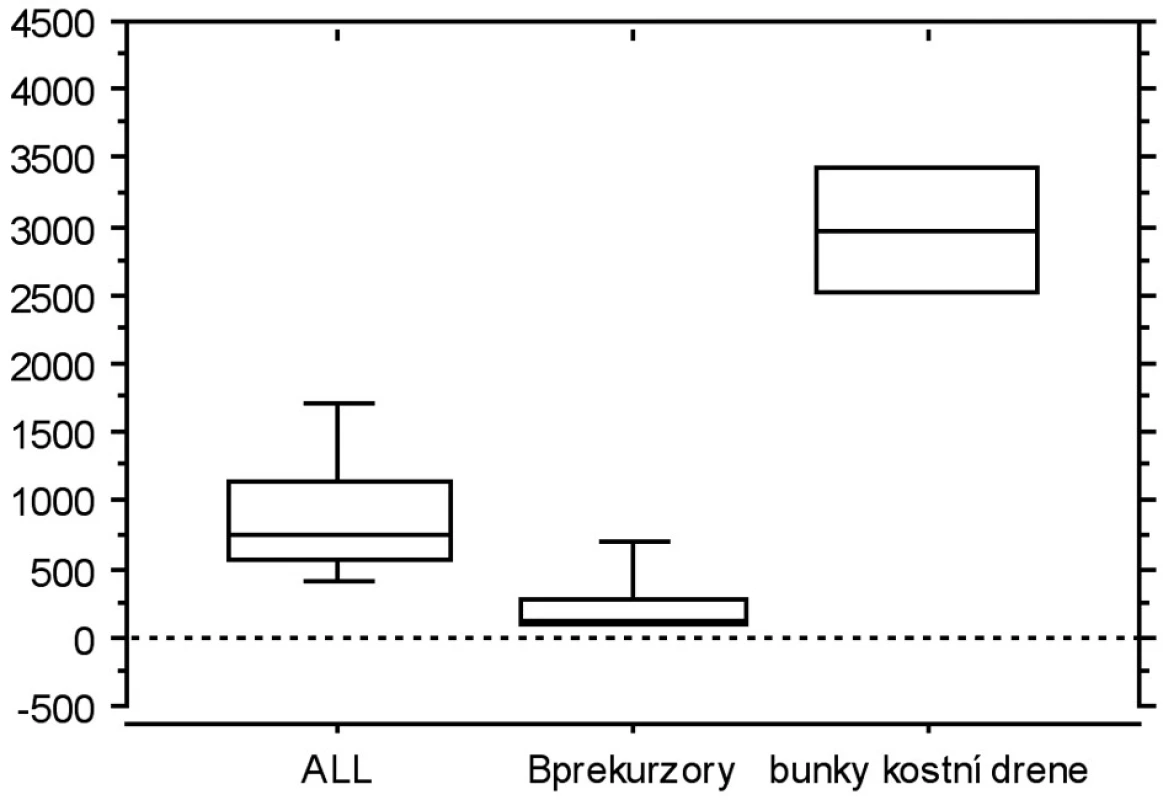
Obr. 3b. Graf znázorňuje expresi LIF přepočítanou podle dostupných dat z expresních profilů (reference zmíněny v textu). 
Diskuse
Hlavním cílem této studie bylo nalézt solubilní proteiny důležité u ALL. Analyzovali jsme proteinový profil kostní plazmy KP pocházející od dětí při diagnóze B-prekurzorové ALL a KP dětí rok a více po transplantaci kostní dřeně, jako kontrolní skupiny. KP je bohatým zdrojem proteinů pocházejících přímo z mikroprostředí kostní dřeně; přestože se při standardní diagnostice nevyšetřuje, proteom KP nejlépe reprezentuje procesy probíhající v tomto mikroprostředí na úrovni solubilních molekul.
Používali jsme 2 nezávislé metody: proteinovou array a dvojrozměrnou elektroforézu (2-DE). Pomocí proteinové array jsme stanovili profil solubilních proteinů jako jsou cytokiny, chemokiny a růstové faktory. Tato metoda je vysoce citlivá a dokáže stanovit proteiny přítomné ve vzorcích i ve velmi nízkých koncentracích. 2-DE patří mezi nejlepší separační techniky a díky nezávislosti na předchozí informaci může objevit i molekuly, jejichž význam dosud nebyl objeven. Proteiny se při 2-DE dělí na základě izoelektrického bodu pI, a molekulové hmotnosti. Použili jsme systém 2-DE, který umožňuje zachytit proteiny větší než 10 kD. Většina cytokinů a chemokinů má molekulovou hmotnost nižší než 10 kD, takže pro stanovení těchto proteinů jsme použili proteinovou array, jejíž výsledky diskutujeme níže.
Abychom získali vyšší koncentraci důležitých minoritních plazmatických proteinů a zlepšili proteinovou separaci, upravovali jsme kostní plazmu před 2-DE pomocí 2 technik. První z nich, frakcionace plazmy pomocí ZOOM IEF Fractionator (Invitrogen), nedosáhla reprodukovatelných výtěžků a míry separace proteinů (data neukázána). Proto jsme pro další experimenty využili imunodepleci pomocí Proteomelab IgY-12 systému, která se ukázala jako nejvhodnější. Pomocí této techniky se nám podařilo zvýšit počet identifikovaných skvrn a nalézt rozdíly v koncentraci mezi LKP a KKP.
Metodou proteinové array jsme stanovili 23 proteinů, které vykazovaly signifikantně vyšší expresi u pacientů než u kontrolní skupiny. Vysoké statistické významnosti dosáhly rozdíly zjištěné u proteinů LIF a TIMP-1. LIF je polyfunkční glykoprotein ovlivňující tkáně i bez jakékoliv zjevné souvislosti s leukemií nebo krvetvorbou. Základní funkce této obdivuhodně pleiotropní molekuly překračují rámec maligní i nemaligní krvetvorby: Mezi jeho funkce patří stimulace proliferace a diferenciace některých hematopoetických buněk (zejména trombocytů), ne zcela potvrzený inhibiční účinek na myeloidní leukemické buňky, ale i umožnění implantace blastocysty, udržení totipotence embryonálních kmenových buněk, stimulace osteoblastů i osteoklastů, stimulace produkce adrenokortikotropního hormonu (ACTH) a jiné (11). LIF může být produkován různými buňkami, jako jsou fibroblasty, T-lymfocyty, osteoblasty, stromální buňky a některé druhy nádorových buněk (12). Stromální buňky, jako jedny z buněk produkujících LIF, jsou součástí extracelulární matrix (ECM), která vytváří dynamickou síť tvořenou převážně kolagenem, fibronektinem, lamininem a proteoglykanem (13). Zvýšená exprese LIF v LKP může být nejen důsledkem produkce této molekuly leukemickými buňkami, ale hlavně produkce nemaligními buňkami kostní dřeně (stromální buňky). Tomuto tvrzení odpovídají také data z expresních profilů, podle kterých je LIF méně exprimován u leukemií ve srovnání s nemaligními buňkami kostní dřeně a s B-prekurzory. LIF by tak mohl být jedním s faktorů, umožňujících leukemickým buňkám dobře přežívat v mikroprostředí kostní dřeně, na rozdíl od in vitro podmínek, kde leukemické buňky často podléhají apoptóze (5).
Protein TIMP1 patří mezi důležité inhibitory matrixových metaloproteináz (MMPs). Kromě toho TIMP1 potencuje erytroidní aktivitu, podporuje buněčný růst různých typů buněk, jako jsou fibroblasty a hemato-lymfoidní buňky (13–15). Zjistili jsme vyšší koncentrace TIMP1 v LKP u ALL. TIMP signifikantně vyšší koncentrace byla předtím prokázána v krvi jak u pacientů s ALL, tak i s AML (16), stejně jako u lymfomů a u normálních aktivovaných B-buněk (17). Na základě přepočítání dostupných expresních dat jsme zjistili, že leukemické buňky mají nižší expresi TIMP1 než nemaligní buňky kostní dřeně, ale vyšší expresi než B-prekurzory. Podobně jako LIF může být také TIMP1 ve velké míře produkovaný právě nemaligními buňkami kostní dřeně, ale důležitou roli v produkci LIF mohou mít také leukemické buňky.
Data získaná z proteomické analýzy otevírají nový pohled na patofyziologii dětských leukemií a poskytují pohled nikoliv na úrovni mRNA, ale solubilních proteinů, což je významné, protože tyto dvě hladiny mezi sebou často nekorelují. Připravujeme identifikaci rozdílně exprimovaných proteinů a ověření identifikovaných proteinů nalezených v této studii pomocí metody ELISA, případně jiných proteomických technik. Biologický účinek přítomnosti jednotlivých proteinů začínáme testovat v podmínkách in vitro. Uvedené poznatky mohou přispět k nalezení nových cílů léčby dětských leukemií.
Doručeno do redakce: 23. 11. 2009
Přijato po recenzi: 1. 2. 2010
Práce byla podpořena grantem IGA NR9531-3.
Mgr. Martin Kováč
Klinika dětské hematologie a onkologie
UK v Praze 2. LF a FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: martin.kovac@fnmotol.cz
Sources
1. Pui CH, Robison LL, Look AT. Acute lymphoblastic leukaemia. Lancet 2008; 371 : 1030-1043.
2. Schultz KR, Pullen DJ, Sather HN, et al. Risk - and response-based classification of childhood B-precursor acute lymphoblastic leukemia: a combined analysis of prognostic markers from the Pediatric Oncology Group (POG) and Children’s Cancer Group (CCG). Blood 2007; 109 : 926-935.
3. Zelent A, Greaves M, Enver T. Role of the TEL-AML1 fusion gene in the molecular pathogenesis of childhood acute lymphoblastic leukaemia. Oncogene 2004; 23 : 4275-4283.
4. Ito C, Kumagai M, Manabe A, et al. Hyperdiploid acute lymphoblastic leukemia with 51 to 65 chromosomes: a distinct biological entity with a marked propensity to undergo apoptosis. Blood 1999; 93 : 315-320.
5. Nishii K, Katayama N, Miwa H, et al. Survival of human leukaemic B-cell precursors is supported by stromal cells and cytokines: association with the expression of bcl-2 protein. Br J Haematol 1999; 105 : 701-710.
6. Nishigaki H, Ito C, Manabe A, et al. Prevalence and growth characteristics of malignant stem cells in B-lineage acute lymphoblastic leukemia. Blood 1997; 89 : 3735-3744.
7. Iversen PO, Wiig H. Tumor necrosis factor alpha and adiponectin in bone marrow interstitial fluid from patients with acute myeloid leukemia inhibit normal hematopoiesis. Clin Cancer Res 2005; 11 : 6793-6799.
8. Ross ME, Zhou X, Song G, et al. Classification of pediatric acute lymphoblastic leukemia by gene expression profiling. Blood 2003; 102 : 2951-2959.
9. van Zelm MC, van der Burg M, de Ridder D, et al. Ig gene rearrangement steps are initiated in early human precursor B cell subsets and correlate with specific transcription factor expression. J Immunol 2005; 175 : 5912-5922.
10. Su AI, Wiltshire T, Batalov S, et al. A gene atlas of the mouse and human protein-encoding transcriptomes. Proc Natl Acad Sci U S A 2004; 101 : 6062-6067.
11. Metcalf D. The unsolved enigmas of leukemia inhibitory factor. Stem Cells 2003; 21 : 5-14.
12. Metcalf D. The leukemia inhibitory factor (LIF). Int J Cell Cloning 1991; 9 : 95-108.
13. Murate T, Hayakawa T. Multiple functions of tissue inhibitors of metalloproteinases (TIMPs): new aspects in hematopoiesis. Platelets 1999; 10 : 5-16.
14. Hayakawa T, Yamashita K, Ohuchi E, Shinagawa A. Cell growth-promoting activity of tissue inhibitor of metalloproteinases-2 (TIMP-2). J Cell Sci 1994; 107 ( Pt 9): 2373-2379.
15. Stetler-Stevenson WG, Bersch N, Golde DW. Tissue inhibitor of metalloproteinase-2 (TIMP-2) has erythroid-potentiating activity. FEBS Lett 1992; 296 : 231-234.
16. Lin LI, Lin DT, Chang CJ, Lee CY, Tang JL, Tien HF. Marrow matrix metalloproteinases (MMPs) and tissue inhibitors of MMP in acute leukaemia: potential role of MMP-9 as a surrogate marker to monitor leukaemic status in patients with acute myelogenous leukaemia. Br J Haematol 2002; 117 : 835-841.
17. Guedez L, Courtemanch L, Stetler-Stevenson M. Tissue inhibitor of metalloproteinase (TIMP)-1 induces differentiation and an antiapoptotic phenotype in germinal center B cells. Blood 1998; 92 : 1342-1349.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2010 Issue 4-
All articles in this issue
- Súčasná klasifikácia, diagnostika a prognóza primárnych monoklonových gamapatií (paraproteinémií)
- Výsledky liečby pacientov v chronickej fáze chronickej myelocytovej leukémie na HOK v Olomouci v rokoch 2000-2009: prognostický význam Sokalovho indexu a ELN kritérií
-
Radioterapie u folikulárního lymfomu.
Stará historie v nové perspektivě? - Proteomická analýza solubilních proteinů důležitých u dětské leukemie
- Vliv dárcovství krve na zásoby železa u dárců: porovnání dvojité erytrocytaferézy a dárcovství plné krve
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Súčasná klasifikácia, diagnostika a prognóza primárnych monoklonových gamapatií (paraproteinémií)
- Vliv dárcovství krve na zásoby železa u dárců: porovnání dvojité erytrocytaferézy a dárcovství plné krve
-
Radioterapie u folikulárního lymfomu.
Stará historie v nové perspektivě? - Výsledky liečby pacientov v chronickej fáze chronickej myelocytovej leukémie na HOK v Olomouci v rokoch 2000-2009: prognostický význam Sokalovho indexu a ELN kritérií
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

