-
Medical journals
- Career
Detekce poškození genu TP53 u pacientů s chronickou lymfocytární leukemií
: B. Kantorová; J. Pavlíček; R. Plachý; T. Papajík; M. Jarošová
: Hemato-onkologická klinika FN a LF UP v Olomouci
: Transfuze Hematol. dnes,16, 2010, No. 2, p. 71-77.
: Comprehensive Reports, Original Papers, Case Reports
Chronická lymfocytární leukemie (CLL) patří v mnoha západních zemích mezi nejčastěji se vyskytující maligní lymfoproliferativní onemocnění starších dospělých. Prognóza tohoto heterogenního onemocnění je založena na řadě klinických a biologických markerů. Významným prognostickým markerem CLL je také detekce poškození genu TP53. Práce přináší výsledky retrospektivní analýzy výskytu změn v genu TP53 u souboru 72 pacientů s CLL. Pomocí přímého sekvenování a analýzy křivek tání s vysokým rozlišením (hrMCA) byly změny genu TP53 detekovány u 46 (64 %) vyšetřených pacientů. Přímým sekvenováním exonů 2-10 kódujícící oblasti genu TP53 bylo u 45 (62 %) pacientů nalezeno 59 změn. Po vyloučení polymorfismů bylo mezi těmito změnami u 20 (28 %) pacientů identifikováno 23 mutací. Jednalo se o substituce (83 % mutací) a delece (17 % mutací). Funkčním důsledkem substitucí byly záměnové (90 %), nesmyslné (5 %) a tiché mutace (5 %). Mutace byly z 91 % lokalizovány v DNA-vazebné doméně (exony 5-8) genu TP53. 87 % mutací bylo detekováno u pacientů s rizikovým onemocněním. Byl prokázán statisticky významný vztah mezi výskytem mutací v genu TP53 a delecí 17p (P < 0,000001). Byla také pozorovaná korelace mezi přítomností mutací v genu TP53 a stadiem onemocnění podle Bineta (P = 0,027). Pomocí hrMCA analýzy DNA-vazebné oblasti genu TP53 (exony 5-8) bylo u 26 (36 %) pacientů detekováno 32 nespecifických PCR produktů. Ve srovnání s přímým sekvenováním je tato metodika citlivější a také méně časově a laboratorně náročná. Problematická standardizace hrMCA ovšem prozatím znemožňuje její rutinní využití při detekci změn genu TP53 u pacientů s CLL.
Klíčová slova:
gen TP53, chronická lymfocytární leukemie, přímé sekvenování, analýza křivek tání s vysokým rozlišenímÚvod
Chronická lymfocytární leukemie (CLL) je na západní polokouli nejčastěji diagnostikovanou leukemií dospělé populace. Heterogenní klinický průběh a odlišné biologické vlastnosti onemocnění u jednotlivých pacientů představují závažný problém při volbě optimální léčby. Ačkoliv je v dnešní době u CLL známo mnoho prognostických markerů, u řady z nich chybí standardizovaná detekční metodika (1, 2, 3).
Gen TP53 kóduje významný nádorový supresor, podílející se zejména na regulaci buněčného cyklu. Ztráta funkce proteinu p53 byla pozorována u mnoha solidních tumorů a hematologických malignit (IARC TP53 Database, 2008 R13). Gen TP53 se nachází na krátkém rameni chromozomu 17, v pruhu 17p13.1. Delece této genové oblasti patří mezi významné nepříznivé prognostické markery CLL (4, 5). Nejčastěji detekovanými změnami genu TP53 jsou substituce, lokalizované zejména v DNA-vazebné doméně. Jejich funkčním důsledkem bývají zpravidla záměnové mutace. U řady nádorových onemocnění včetně CLL je výskyt mutací v genu TP53 spojen s nepříznivou prognózou (6, 7).
V současné době je stanovení změn v genu TP53 založeno především na přímém sekvenování, které je však značně časově a laboratorně náročné a je nahrazováno jinými detekčními přístupy (7, 8, 10–12, 18). Řada pracovišť pro určení genových změn a zejména substitucí využívá analýzy křivek tání s vysokým rozlišením (hrMCA) (9–12). Cílem této práce bylo stanovit význam rutinního vyšetření genu TP53 pomocí analýzy hrMCA u pacientů s CLL jako alternativní metody k přímému sekvenování.
Metodika
Charakteristika pacientů
Vyšetřovaný soubor tvořilo 72 pacientů s CLL, kteří byli diagnostikováni a léčeni v letech 2000–2008 na HOK FN a LF UP v Olomouci. Věk pacientů v době diagnózy se pohyboval v rozmezí 35–81 let (medián 58 let). Do souboru bylo zahrnuto 26 žen a 46 mužů. Stadium onemocnění podle Bineta bylo známo u 67 pacientů. V době odběru biologického materiálu se 44 (66 %) těchto pacientů nacházelo v pokročilém stadiu onemocnění (Binet B/C). Pomocí FISH analýzy byly u 63 (88 %) ze 72 vyšetřených pacientů detekovány následující cytogenetické abnormality: 13q - (51 % pacientů, zpravidla v kombinaci s 11q - a/nebo 17p-), 11q - (42 % pacientů), 17p - (25 % pacientů), +12 (6 % pacientů), 6q - (3 % pacientů), 2p+ (4 % pacientů), komplexní karyotyp (3 % pacientů). Mutační status genu IgVH byl určen u 70 pacientů, přičemž nemutovaný stav genu IgVH byl prokázán u 52 (74 %) pacientů.
Vyšetřovaný pacientský soubor byl z hlediska porovnání četnosti výskytu mutací v genu TP53 v závislosti na charakteru onemocnění rozdělen na dvě skupiny. První skupinu (skupina A) tvořilo 38 pacientů s rizikovou CLL (kombinace nepříznivých chromozomových změn a/nebo nemutovaného stavu genu IgVH). Do druhé skupiny (skupina B) bylo zahrnuto 34 pacientů, kteří byli vybráni náhodně, bez ohledu na stadium a klinický průběh onemocnění (klinická a laboratorní charakteristika souboru pacientů viz tab. 1).
1. Klinická a laboratorní charakteristika vyšetřovaných pacientů s CLL. 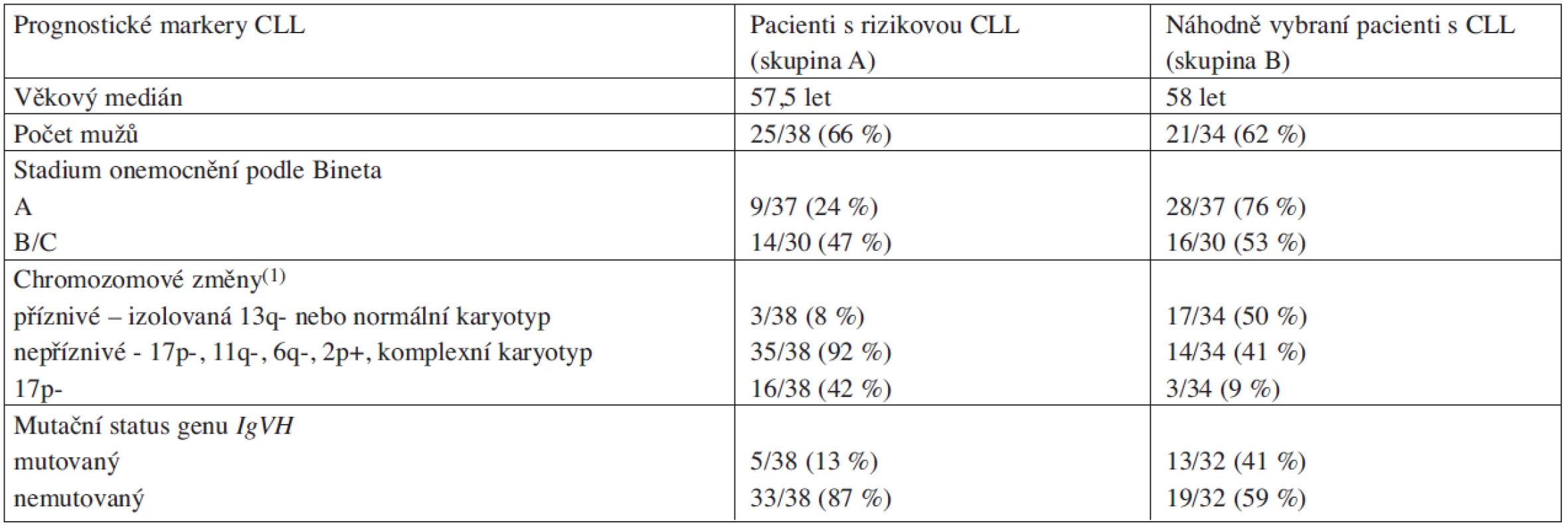
(1)nezařazena +12 z důvodu nejednoznačného prognostického významu Izolace DNA, RNA a přepis do cDNA
Biologický materiál tvořily DNA a RNA izolované z leukocytů, mononukleárních buněk a buněk CD19+ periferní krve, případně kostní dřeně pacientů. Pro izolaci DNA byly použity fenol-chloroformová extrakce (13) a Wizard® Genomic DNA Purification Kit (Promega). RNA byla získána pomocí TRIZOL Reagent (Invitrogen) nebo fenol-chloroformovou extrakcí s guanidin izothiokyanátem (14). Reverzní transkripcí byla z izolované pacientské RNA obdržena cDNA (15).
Přímé sekvenování
Výchozím materiálem pro přímé sekvenování byly pacientské cDNA a DNA. Na úrovni cDNA byla pomocí primerů TP53 F/R (16) amplifikována oblast exonů 2–10 genu TP53 (délka PCR produktu 1150 bp). Reakce probíhala za následujících podmínek: 94 °C 4 min. (1x); 94 °C 40 s, 57 °C 40 s, 72 °C 2,15 min. (35x); 72 °C 10 min. (1x) (2720 Thermal Cycler; Applied Biosystems). Účinnost amplifikace byla ověřena na 1–2% agarózovém gelu a purifikované PCR produkty (QIAquick® Gel Extraction Kit; Qiagen) sloužily jako templát pro sekvenační PCR (BigDye® Terminator v 1.1. Cycle Sequencing Kit; Applied Biosystems).
Analýza DNA byla použita při ověření výsledků metody hrMCA. Pomocí specifických primerů (10) byly amplifikovány oblasti exonů 5, 6, 7, 8 genu TP53 (délka PCR produktů 285, 258, 219 a 287 bp). Reakce probíhaly za stanovených podmínek (2720 Thermal Cycler; Applied Biosystems) (10). PCR produkty byly přímo použity pro sekvenační PCR (BigDye® Terminator v 1.1. Cycle Sequencing Kit; Applied Biosystems).
PCR produkt velikosti 1150 bp byl amplifikován pomocí forward primerů TP53 F1, TP53 F2 (16) a TP53 F3 (5´-CTCTGACTGTACCACCATCCAC-3´). PCR produkty odpovídající exonům 5, 6, 7, 8 byly resekvenovány v obou směrech za použití specifických primerů (10). Sekvenační PCR probíhala za standardních podmínek (AlphaTM Unit Block Assembly for DNA Engine® Systems; BIO-RAD). Sekvenační PCR produkty byly purifikovány podle standardní etanolové metody nebo pomocí komerčního kitu Agencourt® CleanSEQ (Beckmann Coulter Company).
Sekvence byly analyzovány na ABI PRISM® 3100 Genetic Analyzer (Applied Biosystems) a vyhodnoceny pomocí Sequencing Analysis Software v5.3.1 (Applied Biosystems). Revidované sekvence byly v programu Biology Workbench 3.2. (SDSC) porovnány se sekvencemi referenčními (NCBI GenBank®: NM_000546.3, NC_000017: c7531642-7512445; www.ncbi.nlm.nih.gov). Detekované sekvenční změny byly charakterizovány pomocí programu MUT-TP53 (http://p53.free.fr/). Funkční důsledek mutací byl určen na základě IARC TP53 Database, 2008 R13 (www-p53.iarc.fr).
Analýza křivek tání s vysokým rozlišením (hrMCA)
Výchozím materiálem pro analýzu hrMCA byla DNA pacientů. Pro amplifikaci oblasti exonů 5, 6, 7, 8 (délka PCR produktů 136 bp, 190 bp, 222 bp, 200 bp, 245 bp) byly použity specifické páry primerů. Exon 5 byl rozdělen na dva úseky (označené exon 5a a exon 5b) a amplifikován pomocí dvou párů primerů (10). Podmínky reakce byly optimalizovány na základě doporučení výrobce (LightCycler® 480 Real-Time PCR System; Roche Applied Science). Vyhodnocení křivek tání a určení teplot tání PCR produktů bylo provedeno pomocí LightCycler® 480 Software 1.5.0 (Roche Applied Science).
Statistické analýzy
Korelace mezi přítomností mutací, případně polymorfismů v genu TP53 a stadiem CLL podle Bineta byla stanovena pomocí Chí-kvadrát testu. Za použití Fisherova exaktního testu byl určen vztah mezi výskytem mutací v genu TP53 a pohlavím, delecí 17p, případně mutačním statutem genu IgVH (MedCalc Statistical Software 10.3; MedCalc Software). Statisticky významný vztah mezi proměnnými byl prokázán, pokud bylo P < 0,05.
Výsledky
Ve vyšetřovaném souboru 72 pacientů byly pomocí přímého sekvenování a analýzy hrMCA detekovány změny genu TP53 celkem u 46 (64 %) pacientů.
Pomocí přímého sekvenování oblasti kódující sekvence genu TP53 (exony 2-10) bylo nalezeno 59 změn u 45 (62 %) pacientů. Mezi těmito změnami bylo u 33 (46 %) pacientů určeno 36 polymorfismů následujících typů: c.108G>A, P36P; c.215G>C, R72P; c.639A>G, R213R. Kromě polymorfismů bylo v genu TP53 u 20 (28 %) pacientů detekováno 23 mutací. Jednalo se o substituce (83 % mutací) a delece (17 % mutací). Substituce byly příčinou vzniku záměnových (90 %), nesmyslných (5 %) a tichých mutací (5 %). V rámci záměnových mutací byly identifikovány také tzv. hot spot mutace, lokalizované v kodonech 236, 237, 272 a 273 (charakteristika pacientů z hlediska záchytu mutací viz tab. 2, 3). Detekované mutace se nacházely v oblasti DNA-vazebné domény genu TP53, odpovídající exonům 5–8 (91 % mutací) a v exonu 4 (9 % mutací). 87 % mutací bylo nalezeno u pacientů s rizikovým onemocněním (skupina A). U náhodně vybrané skupiny pacientů s CLL (skupina B) bylo v genu TP53 identifikováno 13 % mutací, přičemž se jednalo pouze o delece.
Věkový medián 20 pacientů s detekovanou mutací genu TP53 byl 59,5 let. 14 (70 %) pacientů tvořili muži, zbývajících 6 (30 %) ženy. Ve skupině pacientů s mutací genu TP53 se jich 14 (74 %) nacházelo v pokročilém stadiu CLL (Binet B/C). Stadium A onemocnění podle Bineta bylo prokázáno u 5 (26 %) pacientů. Mezi pacienty s detekovanou mutací genu TP53 byly zaznamenány následující cytogenetické změny: 17p - u 17 (85 %) pacientů, 13q - u 11 (55 %) pacientů, 11q - u 2 (10 %) pacientů, +12 u 1 (5 %) pacienta, 2p+ u 1 (5 %) pacienta, komplexní karyotyp u 1 (5 %) pacienta. U 16 (80 %) pacientů s prokázanou mutací genu TP53 byl určen nemutovaný stav genu IgVH. Mutovaný stav genu IgVH byl stanoven u 4 (20 %) pacientů.
Na základě statistické analýzy byla prokázána korelace mezi přítomností mutací v genu TP53 a delecí 17p (P < 0,000001) a také mezi výskytem mutací v genu TP53 a stadiem CLL podle Bineta (P = 0,027). Nebyl prokázán vztah mezi přítomností mutací v genu TP53 a pohlavím (P = 0,591) a také nebyla potvrzena souvislost mezi výskytem mutací v genu TP53 a mutačním statutem genu IgVH (P = 0,559). Statisticky významná nebyla ani korelace mezi stadiem onemocnění podle Bineta a polymorfismem c.215G>C, R72P v genu TP53 (P = 0,503).
Pomocí hrMCA analýzy exonů 5, 6, 7 a 8 genu TP53 bylo u 26 (36 %) pacientů detekováno 32 nespecifických PCR produktů (viz tab. 2, 3). 75 % těchto PCR produktů bylo určeno u pacientů s rizikovou CLL (skupina A). Zbývajících 25 % aberantních PCR produktů bylo nalezeno u náhodně vybraného souboru pacientů (skupina B).
2. Charakteristika pacientů s rizikovou CLL (skupina A) z hlediska výskytu mutací v genu TP53 určených přímým sekvenováním a aberantních PCR produktů detekovaných analýzou hrMCA. 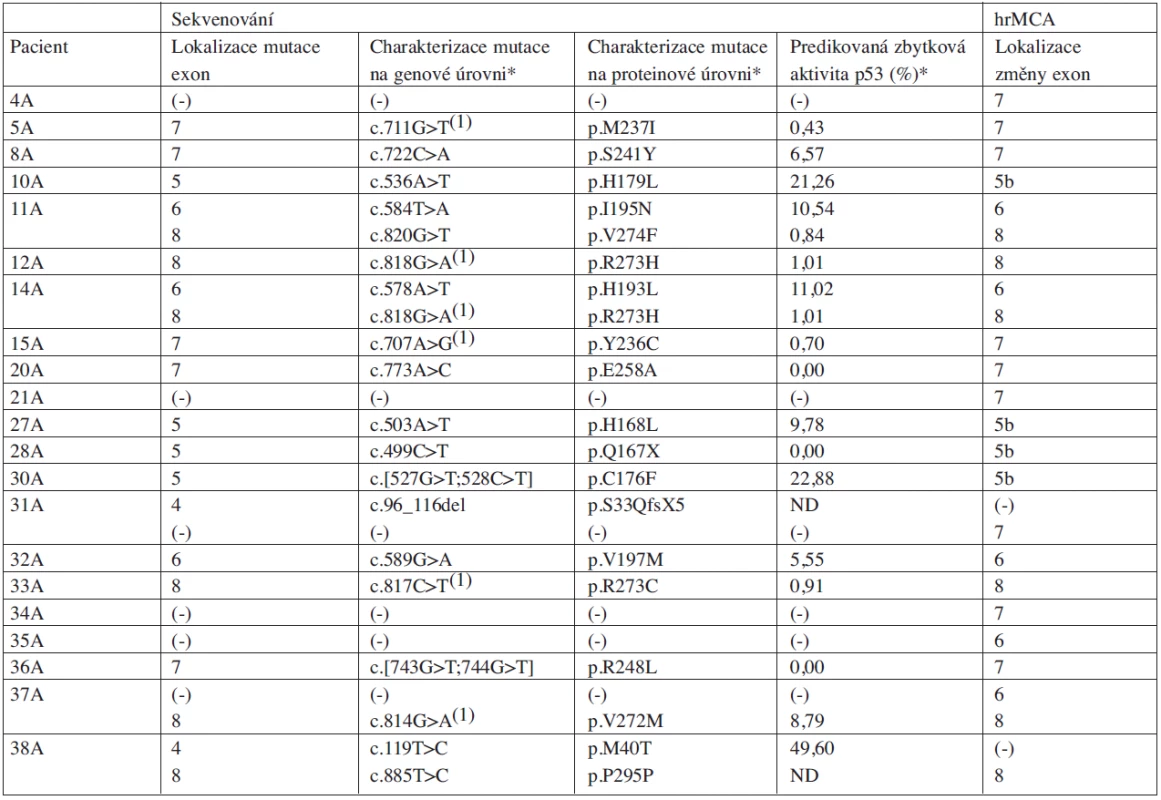
Vysvětlivky: (1) „hot spot” mutace; (-) nepřítomnost sledovaného znaku; ND nedostupná data; * mutační charakterizace pomocí programu MUTTP53 a IARC TP53 Database, 2008 R13 3. Charakteristika náhodně vybraných pacientů s CLL (skupina B) z hlediska výskytu mutací v genu TP53 určených přímým sekvenováním a aberantních PCR produktů detekovaných analýzou hrMCA. 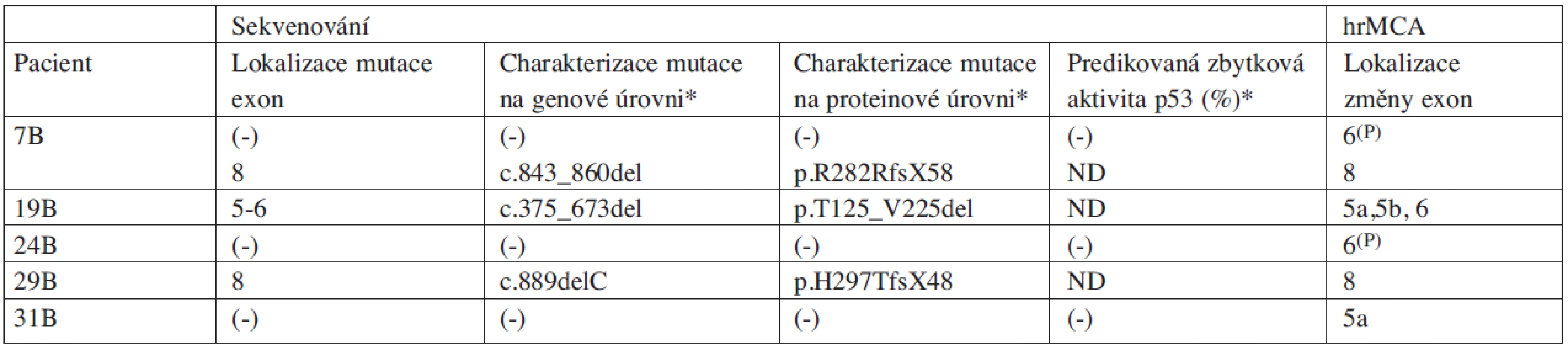
Vysvětlivky: (P) pravděpodobný nález polymorfismu c.639A>G, R213R; (-) nepřítomnost sledovaného znaku; ND nedostupná data; * mutační charakterizace pomocí programu MUT-TP53 a IARC TP53 Database, 2008 R13 Mezi nespecifickými a standardními PCR produkty nebyly pozorovány významné rozdíly ve stanovených teplotách tání (viz tab. 4). Všechny aberantní PCR produkty byly určeny podle odlišných profilů (amplituda a/nebo tvar) příslušných křivek tání.
4. Mediány teplot tání PCR produktů stanovené pomocí analýzy hrMCA. 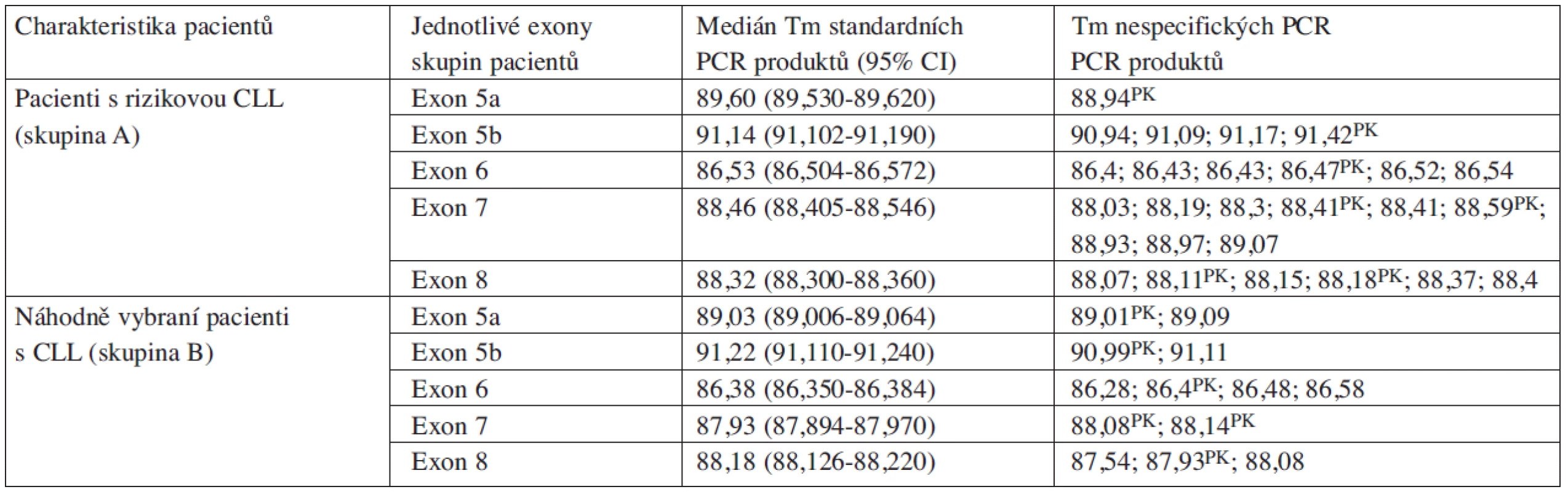
Vysvětlivky: PK pozitivní kontrola; CI konfidenční interval; Tm teploty tání Diskuse
Přítomnost mutací v genu TP53 je nepříznivým prognostickým markerem řady lidských nádorových onemocnění. Mnoho současných studií potvrdilo klinický význam sledování poškození genu TP53 také u pacientů s CLL (7, 8, 17). Často se však liší v používané detekční metodice (4, 7, 18). Standardním přístupem, rutinně využívaným pro určení změn genu TP53 je přímé sekvenování. Tato metoda je však v současnosti do určité míry nahrazována jinými přístupy (7, 12). Důvodem je zejména časová, laboratorní náročnost a také poměrně nízká citlivost přímého sekvenování (10, 17). Při detekci genových změn u pacientů s CLL je možné citlivost sekvenační analýzy zvýšit použitím genetického materiálu izolovaného z leukemických B-lymfocytů (CD19+ buněk). Stanovení změn v kódující oblasti genu TP53 na úrovni cDNA umožňuje snížit laboratorní náklady. Při použití tohoto přístupu je možné detekovat také alternativní transkripty genu TP53, které mohou být prognosticky významné (18, 19). Z důvodu minimalizace laboratorních nákladů je navíc řada pracovišť zaměřena pouze na analýzu oblasti DNA-vazebné domény, kde je lokalizováno zhruba 94 % dosud publikovaných mutací genu TP53 (IARC TP53 Database, 2008 R13). Také v našem případě byla většina mutací genu TP53 (91 %) detekována v DNA-vazebné doméně (exony 5-8). Nález prognosticky nepříznivých změn mimo tuto oblast ovšem současně prokázal význam analýzy celé genové sekvence (6).
Mutace v genu TP53 jsou běžně detekovány u 10–15 % pacientů s CLL. Nárůst jejich výskytu je přitom zpravidla pozorován u pacientů s rizikovým onemocněním, intenzivně léčených a v pokročilém stadiu CLL (7, 8, 17). Tuto skutečnost prokázaly také naše výsledky, kdy byly mutace genu TP53 nalezeny u 20 (28 %) vyšetřených pacientů, a to převážně s rizikovou CLL.
Nejčastěji identifikovanými změnami genu TP53 jsou substituce, které tvoří u pacientů s CLL přibližně 82 % všech mutací (IARC TP53 Database, 2008 R13). U našeho souboru bylo zastoupení těchto mutací obdobné, vyskytovaly se v 83 %, a to pouze u pacientů s rizikovou CLL. Substituce detekované v genu TP53 jsou zpravidla příčinou záměnových mutací. U pacientů s CLL se jejich četnost pohybuje kolem 89 % (IARC TP53 Database, 2008 R13). Také u našeho souboru pacientů byly funkčním důsledkem substitucí nejčastěji záměnové mutace, které tvořily 90 % těchto změn. Mezi nimi byly identifikovány rovněž tzv. hot spot mutace, které jsou zpravidla spojeny s klinicky agresivním průběhem CLL (6). Ve vyšetřovaném souboru byly „hot spot” mutace lokalizovány v kodonech 236, 237, 272 a 273, které často podléhají mutacím nejen u pacientů s CLL, ale také u řady dalších nádorových onemocnění. Všechny detekované substituce s výjimkou c.885T>C, p.P295P u pacienta č. 38A jsou popsány v literatuře (podle IARC TP53 Database, 2008 R13). Kromě substitucí byly u vyšetřovaných pacientů nalezeny také delece, které však tvořily pouze 17 % mutací, což je v souladu s publikovanými daty (7, 17). Tyto delece byly pozorovány zejména u náhodně vybraných pacientů a nebyly dosud literárně popsané (podle IARC TP53 Database, 2008 R13).
Zbytková aktivita proteinu p53, predikovaná na základě výsledků funkčního testu FASSAY (IARC TP53 Database, 2008 R13), se u naší skupiny pacientů s detekovanou mutací genu TP53 pohybovala v rozmezí 0,00 – 49,60 %. V případě „hot spot” mutací, které jsou typické pro progresivní charakter onemocnění, se jednalo o hodnoty 0,43 – 8,79 %. Je nutno podotknout, že se tyto hodnoty týkají především skupiny pacientů s rizikovou CLL, protože přesný funkční důsledek určených delecí není prozatím znám. Krátké delece identifikované u pacientů č. 31A, 7B a 29B vedly k posunu čtecího rámce, vzniku STOP kodonu a následně zkráceného proteinu. Lze předpokládat, že největší vliv na omezení funkce proteinu p53 bude mít delece detekovaná u pacienta č. 31A (riziková CLL). Na rozdíl od delecí zasahujících exon 8 u pacientů č. 7B a 29B je její začátek lokalizován v exonu 4 genu TP53 a záhy vede ke vzniku STOP kodonu. U pacienta č. 19B byla v DNA-vazebné doméně, která je nezbytná pro vazbu proteinu na promotory cílových genů, nalezena delece exonů 5 a 6 genu TP53. Přesnou lokalizaci této rozsáhlé mutace na DNA úrovni se však dosud nepodařilo určit. Na základě těchto výsledků je zřejmé, že detekované mutace vedly ke značnému omezení funkce proteinu p53. Zároveň bylo potvrzeno, že mutace genu TP53 stanovené u pacientů s rizikovou CLL měly většinou více nepříznivý důsledek na proteinovou funkci ve srovnání s mutacemi detekovanými u náhodně vybraného souboru pacientů.
Poškození genu TP53 je zpravidla pozdní událostí ve vývoji CLL. Vyskytuje se zejména u pacientů v pokročilé fázi onemocnění, s nepříznivými chromozomovými změnami a také nemutovaným stavem genu IgVH (17). V našem případě se v pokročilém stadiu CLL (Binet B/C) nacházelo 14 (74 %) pacientů s mutací genu TP53. V souladu s publikovanými daty (7,17) byla u většiny, a to 17 (85 %) vyšetřených pacientů s mutací genu TP53 detekována delece 17p. U zbývajících 3 (15 %) pacientů byly zaznamenány delece 11q a 13q. Recentní publikace uvádějí, že ačkoliv je přítomnost mutací v genu TP53 bez výskytu 17p - u pacientů s CLL poměrně vzácná, je také spojena s nepříznivou prognózou (7, 17). Nemutovaný stav genu IgVH byl stanoven u 16 (80 %) pacientů s mutací genu TP53. I když je zvýšený výskyt nemutovaného stavu genu IgVH u pacientů s prokázanými mutacemi genu TP53 literárně popsaný (7, 17), u našeho souboru je zřejmě podmíněn cíleným výběrem analyzovaných pacientů.
Kromě mutací byly v genu TP53 nalezeny u 33 (46 %) vyšetřených pacientů také polymorfismy. Nejčastěji se jednalo o substituci c.215G>C, R72P. Tato nukleotidová varianta je u pacientů s CLL často detekována, avšak její význam na prognózu onemocnění nebyl dosud potvrzen (20, 21), co ukázaly rovněž naše výsledky. Prognostický význam polymorfismů c.639A>G, R213R (20) a c.108G>A, P36P není u CLL dostatečně prostudován. V našem případě nebyl určen z důvodu nízkého počtu vstupních dat.
Na základě statistické analýzy byl u vyšetřených pacientů prokázán vztah mezi výskytem mutací v genu TP53 a stadiem CLL podle Bineta (P = 0,027) a také mezi přítomností mutací v genu TP53 a delecí 17p (P < 0,000001). Tyto výsledky jsou v souladu s publikovanou literaturou (17). Statisticky významná korelace mezi výskytem mutací v genu TP53 a mutačním statutem genu IgVH nebyla prokázána (P = 0,559). Pravděpodobným důvodem je výše zmíněný selektivní výběr pacientů a tím zkreslení výsledku statistické analýzy.
Pro stanovení změn genu TP53 je používána řada metodik. Kromě přímého sekvenování a FISH analýzy, prováděných standardně na řadě pracovišť, se v současné době dostávají do popředí další detekční přístupy. Jedná se zejména o funkční analýzu (FASSAY) (18, 22), denaturační vysoce účinnou kapalinovou chromatografii (DHPLC) (7, 17, 23), metodu MLPA (24) a také hrMCA (10–12). V našem případě byla ke stanovení změn v genu TP53 použita analýza hrMCA. Přednostmi této metodiky jsou zejména vysoká citlivost a jednoduché provedení, díky čemu je v současnosti využívána řadou laboratoří při mutační analýze (9), včetně detekce změn genu TP53 u pacientů s nádorovým onemocněním prsu (10–12).
Pomocí hrMCA analýzy oblasti DNA-vazebné domény (exony 5-8) genu TP53 bylo u 26 (36 %) vyšetřených pacientů nalezeno 32 nespecifických PCR produktů. Ve srovnání s přímým sekvenováním dané oblasti bylo navíc detekováno 7 aberantních PCR produktů. Příčinou je pravděpodobně větší citlivost analýzy hrMCA (10,12). Vzhledem k tomu, že nebylo možné na základě naměřených teplot tání odlišit standardní a nespecifické PCR produkty, analýza se opírala pouze o vyhodnocení profilu křivek tání. Ačkoliv je tento přístup využíván při mutační analýze řadou laboratoří (10–12), naše zkušenosti poukazují na velkou subjektivnost hodnocení a tedy možnost rozdílné interpretace získaných výsledků. Standardizace metodiky hrMCA je navíc znesnadněna problematickou volbou vhodných pozitivních kontrol. Mutace v genu TP53 totiž u většiny pacientů s CLL představují sekundární změny s výskytem na různých genových místech (IARC TP53 Database, 2008 R13). Z výsledků naší práce vyplývá, že využití hrMCA pro rutinní detekci změn genu TP53 u pacientů s CLL není zatím vhodné.
Závěr
Práce potvrdila nepříznivý význam výskytu mutací v genu TP53 u pacientů s CLL. Analýza kódující oblasti genu TP53 odhalila mutace u 20 (28 %) vyšetřených pacientů, a to převážně s rizikovým onemocněním. Kromě mutací popsaných v literatuře byly v genu TP53 nalezeny také dosud nepublikované změny. Jednalo se o substituci c.885T>C, p.P295P a všechny detekované delece (podle IARC TP53 Database, 2008 R13). Určené mutace mají prokazatelný význam na proteinové úrovni. Vliv polymorfismů genu TP53 na prognózu CLL nebyl potvrzen. Ačkoliv je přímé sekvenování standardní metodou pro určení změn v genu TP53, je nezbytné optimalizovat další detekční přístupy.
Mgr. Barbara Kantorová
Hemato-onkologická klinika FN a LF UP Olomouc
I. P. Pavlova 6
775 20 Olomouc
e-mail: barborakantorova@seznam.cz
Práce byla realizována s podporou grantů IGA NR 9484-3 a MSM 619 895 92 05.
Doručeno do redakce: 7. 12. 2009
Přijato po recenzi: 25. 2. 2010
Sources
1. Montserrat E. New prognostic markers in CLL. Hematology 2006 : 279-284.
2. Oscier D, Fegan C, Hillmen P, et al. Guidelines on the diagnosis and management of chronic lymphocytic leukaemia. British Journal of Haematology 2004; 125 : 294-317.
3. Dighiero G. Chronic lymphocytic leukemia: CLL biology and prognosis. Hematology 2005 : 278-284.
4. Döhner H, Fischer K, Bentz M, et al. p53 gene deletion predicts for poor survival and non-response to therapy with purine analogs in chronic B-cell leukemias. Blood 1995; 85 : 1580-1589.
5. Stilgenbauer S, Döhner K, Bentz M, Lichter P, Döhner H. Molecular cytogenetic analysis of B-cell chronic lymphocytic leukemia. Annals of Hematology 1998; 76 : 101-110.
6. Petitjean A, Mathe E, Kato S, et al. Impact of mutant p53 functional properties on TP53 mutation patterns and tumor phenotype: lessons from recent developments in the IARC TP53 Database. Human Mutation 2007; 28 : 622-629.
7. Dicker F, Herholz H, Schnittger S, et al. The detection of TP53 mutations in chronic lymphocytic leukemia independently predicts rapid disease progression and is highly correlated with a complex aberrant karyotype. Leukemia 2009; 23 : 117-124.
8. Thornton P D, Gruszka-Westwood A M, Hamoudi R A, et al. Characterisation of TP53 abnormalities in chronic lymphocytic leukaemia. The Hematology Journal 2004; 5 : 47-54.
9. Wittwer C T, Reed G H, Gundry C N, Vandersteen J G, Pryor J R. High resolution genotyping by amplicon melting analysis using LCGreen. Clinical Chemistry 2003; 49 : 853-860.
10. Krypuy M, Ahmed A A, Etemadmoghadam D, et al. High resolution melting for mutation scanning of TP53 exons 5-8. BioMed Central Cancer 2007; 7 : 168-181.
11. Bastien R, Lewis T B, Hawkes J E, et al. High-throughput amplicon scanning of the TP53 gene in breast cancer using High-resolution fluorescent melting curve analyses and automatic mutation calling. Human Mutation 2008; 29 : 757-764.
12. Garritano S, Gemignani F, Voegele C, et al. Determining the effectiveness of High Resolution Melting analysis for SNP genotyping and mutation scanning at the TP53 locus. BioMed Central Genetics 2009; 10 : 5-16.
13. Kunkel LM, Smith KD, Boyer SH, et al. Analysis of human Y-chromosome-specific reiterated DNA in chromosome variants. Proceedings of the National Academy of Sciences of the United States of America 1997; 74 : 1245-1249.
14. Chomczynski P, Sacchi N. Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Analytical Biochemistry 1987; 162 : 156-159.
15. Sambrook J, Russell D W. Molecular Cloning: a laboratory manual. Cold Spring Harbor Laboratory Cold Spring Harbor, New York, 2001.
16. Malcikova J, Smardova J, Pekova S, et al. Identification of somatic hypermutations in the TP53 gene in B-cell chronic lymphocytic leukemia. Molecullar Immunology 2008; 45 : 1525-1529.
17. Zenz T, Kröber A, Scherer K, et al. Monoallelic TP53 inactivation is associated with poor prognosis in chronic lymphocytic leukemia: results from a detailed genetic characterization with long-term follow-up. Blood 2008; 112 : 3322-3329.
18. Trbusek M, Malcikova J, Smardova J, et al. Inactivation of p53 and deletion of ATM in B-CLL patients in relation to IgVH mutation status and previous treatment. Leukemia 2006; 20 : 1159-1161.
19. Pekova S, Cmejla R, Smolej L, Kozak T, Spacek M, Prucha M. Identification of a novel, transactivation-defective splicing variant of p53 gene in patients with chronic lymphocytic leukemia. Leukemia Research 2008; 32 : 395-400.
20. Kochethu G, Delgado J, Pepper Ch, et al. Two germ line polymorphisms of the tumor suppressor gene p53 may influence the biology of chronic lmphocytic leukaemia. Leukemia Research 2006; 30 : 1113-1118.
21. Lahiri O, Harris S, Packham G, Howell M. p53 pathway gene single nucleotide polymorphisms and chronic lymphocytic leukemia. Cancer Genetics and Cytogenetics 2007; 179 : 36-44.
22. Flaman J-M, Frebourg T, Moreau V, et al. A simple p53 functional assay for screening cell lines, blood, and tumors. Proceedings of the National Academy of Sciences of the United States of America 1995; 92 : 3963-3967.
23. Keller G, Hartmann A, Mueller J, Höfler H. Denaturing high pressure liquid chromatography (DHPLC) for the analysis of somatic p53 mutations. Laboratory Investigation 2001; 81 : 1735-1737.
24. Coll-Mulet L, Santidrian A F, Cosialls A M, et al. Multiplex ligation-dependent probe amplification for detection of genomic alterations in chronic lymphocytic leukaemia. British Journal of Haematology 2008; 142 : 793-801.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2010 Issue 2-
All articles in this issue
- Treatment of relapsed and refractory Hodgkin lymphoma
- Short morphometric notes to the heterogeneity of lymphocytes in the peripheral blood („a minireview“ with own original results)
- The effect of high-dosed chemotherapy with support of autologous stem cell transplantation on proliferative and apoptotic characteristics of plasma cells
- Úspěšný odběr periferních krvetvorných buněk u pacientky s chronickou myeloidní leukemií léčenou nilotinibem. Kazuistika
- Global assessment of haemostagic function - part I. Thrombin generation test
- The detection of TP53 mutations in chronic lymphocytic leukemia
- Pre-cooled gel sleeves as a useful tool for preparation of the hematopoietic stem cells before cryoconservation
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Treatment of relapsed and refractory Hodgkin lymphoma
- Global assessment of haemostagic function - part I. Thrombin generation test
- The detection of TP53 mutations in chronic lymphocytic leukemia
- Short morphometric notes to the heterogeneity of lymphocytes in the peripheral blood („a minireview“ with own original results)
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

