-
Medical journals
- Career
Adaptorové molekuly PAG, NTAL a LAT ve fyziologických lymfocytárních prekurzorech a u dětských leukemií
Authors: K. Švojgr 1,2; T. Burjanivová 1,2; M. Vášková 1,2; T. Kalina 1,2; T. Brdička 3; T. Kačerová 3; J. Starý 2; J. Trka 1,2; J. Zuna 1,2
Authors‘ workplace: CLIP – Childhood Leukaemia Investigation Prague 1; Klinika dětské hematologie a onkologie UK 2. LF a FN, v Motole, Praha 2; Oddělení molekulární imunologie, Ústav molekulární genetiky AV ČR, Praha 3
Published in: Transfuze Hematol. dnes,15, 2009, No. 2, p. 107-113.
Category: Comprehensive Reports, Original Papers, Case Reports
Overview
Transmembránové adaptorové proteiny nemají enzymatickou nebo kinázovou funkci, ale jsou zapojeny do přenosu signálu z buněčného povrchu do buněčného jádra. Na zvířecím modelu vede změna exprese adaptorové molekuly PAG k obrazu leukemie. V této studii byly vyšetřovány adaptorové molekuly PAG, LAT a NTAL ve fyziologických lymfocytárních prekurzorech a na souboru 75 diagnostických vzorků dětské akutní lymfoblastické leukemie (ALL). Byla analyzována exprese těchto molekul na mRNA úrovni (metodou kvantitativní reverzně-transkriptázové polymerázové řetězové reakce) a na úrovni proteinu (pomocí průtokové cytometrie). V průběhu fyziologické lymfocytární maturace se hladina některých adaptorů signifikantně mění mezi jednotlivými stadii. V různých podtypech ALL je možno sledovat odlišnou dynamiku exprese jednotlivých molekul, zejména TEL/AML1 pozitivní pacienti jsou charakterizováni unikátním profilem exprese. Hladina NTAL při diagnóze T-ALL je prognosticky významným faktorem predikujícím odpověď na iniciální léčbu kortikosteroidy. Tento jev se podařilo potvrdit i v in vitro experimentu – při inkubaci s kortikoidy je procento přežívajících buněk vyšší u nativní linie T-buněčné leukemie než u stejné linie s transfekovaným genem NTAL.
Klíčová slova:
akutní lymfoblastická leukemie, adaptorové proteiny, nádorová imunita, prognózaÚvod
Akutní lymfoblastická leukemie (ALL) je nejčastějším maligním onemocněním dětského věku. Každoročně je v České republice diagnostikováno přibližně 65 nových případů této nemoci. Přestože se převážná část pacientů vyléčí a dlouhodobě žije v 1. kompletní remisi, stále u 20 až 25 % případů dochází k relapsu ALL. Asi 85 % ALL vzniká z B lymfocytárních prekurzorů (BCP), zbytek (15 %) jsou T-ALL. Ve většině případů je leukemie spojena se známými genetickými aberacemi – například t(12;21), hyperdiploidie, t(9;21), t(4;11), mutace NOTCH genů, p53 a p16. Přesto ani etiopatogeneze leukemií se známým genetickým podkladem není stále zcela objasněna.
PAG, LAT a NTAL patří do skupiny transmembránových adaptorových proteinů (TRAPs). TRAPs mohou hrát důležitou roli v etiopatogenezi ALL. Tyto molekuly jsou klíčovými mediátory signalizačních kaskád lymfocytů a jejich abnormální funkce ovlivňuje proliferaci a diferenciaci buněk. Do současné doby bylo identifikováno 7 TRAPs, přičemž 4 jsou přítomny v membránových mikrodoménách – tzv. raftech (1). “Lipidové rafty” (též označované jako GEMs – Glycolipid-Enriched Membrane Microdomains), jsou submikroskopické okrsky membrány obohacené o cholesterol a sfingolipidy s unikátním proteinovým složením. Mají zásadní roli v signalizaci buňky přes imunoreceptory (2).
PAG (“Phosphoprotein associated with glycosphingolipid enriched microdomains”), též nazývaný Csk-binding protein (Cbp), váže tyrosin kinázu Csk, a tím umožňuje její roli hlavního negativního regulátora Src kináz (3). V periferních klidových T lymfocytech vede relativně vysoký status fosforylace PAG k potlačení některých Src kináz (Lck a Fyn). V průběhu počáteční fáze aktivace T lymfocytu přes T receptor (TCR) dojde k redukci PAG-Csk vazby a tím eliminaci inhibice Lck a Fyn působené Csk (4). Současná studie potvrzuje, že pro správnou inhibiční funkci musí být PAG lokalizován v “lipidovém raftu” (5). Naproti tomu v B lymfocytech aktivace (cross-link) B receptoru (BCR) vede ke zvýšené fosforylaci PAG (6). To pravděpodobně potvrzuje fakt, že v B lymfocytech jsou Src kinázy zapojeny spíše v negativní regulaci signalizace. PAG je vysoce exprimován v proliferujících buňkách germinálních center folikulárního lymfomu (7). Baumgartner ukázal možnou spojitost mezi genem PAG a leukemií. U skotu indukuje parazit Theileria parva “leukemický” obraz krvetvorby snížením fosforylace PAG. Po odstranění parazita chemoterapeutiky dojde k opětovné fosforylaci PAG a návratu lymfocytů k normálnímu fenotypu (8).
LAT (“Linker for activation of T cells”) je důležitý zejména pro vývoj T lymfocytů (9). Tato molekula je nezbytná k přenosu signálu od TCR do nitra buňky. LAT –/ - myším chybí zralé periferní T lymfocyty neboť T prekurzory (thymocyty) se nevyvinou přes stadium “double-negative” (DN) (9). LAT je také exprimován v pre-B lymfocytech, kde je zapojen v signalizaci přes pre-B receptor a vývoji pre-B buněk směrem k nezralým B lymfocytům. B lymfocyty v LAT -/ - myších jsou částečně zablokované v tomto stadiu a v hematopoetické tkáni je zvýšené množství pre-B buněk (10). LAT tak může v B řadě fungovat jako tumor supresor indukující fyziologickou diferenciaci B lymfocytů (11).
NTAL (“Linker for activation of T-cells 2”), také nazývaný LAT2, LAB nebo WBSCR5, byl původně považován za potenciální homolog LAT genu v B lymfocytech (12). NTAL je fyziologicky přítomen v B, NK a myeloidních buňkách. Po cross-link BCR je NTAL rychle fosforylován Syk kinázou a asociuje s Grb2, Sos1, Gap1 a c-Cbl. NTAL nemá vazebné místo pro PLCgamma (12) – takže nejspíše není zapojen do signalizační odpovědi časného zvýšení intracelulárního Ca2+. Na NTAL deficientní myši prokázal Wang lepší Ca2+ influx a lepší proliferaci B buněk po antigenní stimulaci (13). Protože je tedy zapojen spíše do prolongovaného než časného zvýšení koncentrace intracelulárního Ca2+ (14), není NTAL ekvivalentem LAT v B lymfocytech. Podle některých autorů kompetuje v aktivovaných T lymfocytech NTAL s LAT o palmitoylaci a lokalizaci v lipidovém raftu a tím inhibuje TCR signalizaci (15). NTAL tedy nejspíše funguje jako negativní regulátor lymfocytární signalizace.
Dynamika exprese PAG, LAT a NTAL v průběhu diferenciace lymfocytů dosud nebyla detailně popsána. Současné studie navrhují, že TRAPs mohou být užitečné imunofenotypické markery relevantní pro diagnózu a stanovení prognosy lymfomů (7, 16). Cílem této studie bylo charakterizovat expresi PAG, LAT a NTAL na úrovni m-RNA (pomocí kvantitativní reverzně-transkriptázové polymerázové řetězové reakce, qRT-PCR) a na úrovni proteinu (použitím průtokové cytometrie) u normálních B a T lymfocytárních prekurzorů a současně popsat jejich roli v dětských leukemiích.
Materiál a metodika
Normální hematopoetická tkáň, leukemické vzorky a buněčné linie
Celkem 9 vzorků periferní krve zdravých dárců bylo použito k analýze zralých lymfocytů. Pro analýzu vývoje B lymfocytů jsme použili kostní dřeň dětí bez známek maligního onemocnění (pacienti více než 1 rok po ukončení léčby ALL a pacienti, kteří byli vyšetřováni k vyloučení hematologické malignity) (16 vzorků).
Odebrané části tkáně thymu 13 dětí podstupujících operaci srdce byly použity jako zdroj T lymfocytárních prekurzorů.
Pro analýzu maligních lymfocytárních blastů jsme použili diagnostické vzorky kostní dřeně od 75 dětí s ALL. Z této skupiny mělo 36 pacientů B-prekurzorovou leukémii (BCP) (15 TEL/AML1 pozitivní, 5 MLL/AF4 pozitivní, 8 hyperdiploidní, 8 BCP-ALL bez hyperdiploidie, TEL/AML1 a MLL/AF4) a 39 pacientů T-ALL (7 preT-ALL, 13 intermediální T-ALL,19 zralou T-ALL).
K in vitro experimentům jsme použili buněčnou linii Jurkat (linie pocházející od 14letého pacienta s T-ALL, která přirozeně neexprimuje NTAL) a Jurkat buňky transfekované expresním vektorem pEFIRES-N produkujícím NTAL (12). Exprese NTAL byla v derivované buněčné linii ověřena jak na úrovni mRNA (RT-PCR), tak na úrovni proteinu (Western Blot). V buněčné kultuře se nativní i derivované Jurkat buňky chovaly obdobně.
Všechny experimenty byly prováděny v souladu s Helsinskou deklarací. Projekt byl schválen etickou komisí a všichni zákonní zástupci dětských pacientů i dobrovolní dárci podepsali informovaný souhlas.
Třídění buněk do jednotlivých subpopulací (sorting)
Za pomoci průtokové cytometrie (FACS Aria, BD San Jose) jsme provedli rozdělení nemaligních lymfocytů do frakcí odpovídajících jednotlivým vývojovým stadiím podle imunofenotypu.
Exprese proteinů PAG, LAT a NTAL v průběhu vývoje B lymfocytů byla analyzována v následujících vývojových stadiích: (1) CD34+CD19 - lymfocyty, které představují „non-committed“ prekurzory lymfoidních i myeloidních buněk (n = 8), (2) CD19+CD10+CD34+ (n = 8), (3) CD19+CD10+CD34 - (n = 8) a (4) CD19+CD20+CD10 - (nejzralejší B lymfocyty přítomné v kostní dřeni). Metodou qRT-PCR byly analyzovány pouze subpopulace CD10+CD20+/ - a CD10-CD20+, odpovídající stadiím (2)+(3) respektive (4). B lymfocyty z periferní krve byly oběma metodami analyzovány jako stadium (5).
Pro analýzu vývoje T lymfocytů jsme použili klasifikaci ALL publikovanou skupinou EGIL (17), „intermediate“ T-lymfocytární populace byla rozdělena na CD3 - „early-intermediate“ T-buňky a CD3+ „late-intermediate“ T-buňky. TCR alfa/beta a TCR gama/delta byly sloučeny do skupiny zralých T-lymfocytů. Stadia (1)-(4) byly FACS sortovány z thymů: (1) „pro/pre“ T-buňky CD7+CD3-CD1a-CD8-; (2) „early-intermediate“ T-buňky CD7+CD3-CD1a+CD8+/-; (3) „late-intermediate“ T-buňky CD7+CD3 +CD1a+; (4) zralé T-buňky CD7+CD3+CD1a-. Jako stadium (5) byly FACS sortovány CD3+ T-lymfocyty z periferní krve. Čistota všech sortů byla 87–97,9 %.
Vývojová stadia thymocytů použitá ke qRT-PCR byla stejná jako pro průtokovou cytometrii, pouze byla podpořena pozitivitou CD34 ve stadiu (1) a (2) a stadium (4) bylo rozděleno na „double-positive“ (CD4+CD8+) a „single-positive“ (CD4+CD8 - nebo CD4-CD8+) buňky.
Příprava RNA a qRT-PCR
RNA ze zkoumaných buněk byla extrahována modifikovanou metodou podle Chomczynského a Sacchi (18). RNA ze sortovaných buněk byla izolována za použití RNeasy Micro Kit a RNeasy Mini Kit (Qiagen GmbH, Hilden, Německo) v závislosti na velikosti sortované populace. RNA byla přepsána do cDNA MoMLV reverzní transkriptázou (Gibco BRL, Carlsbad, TX, USA) podle protokolu výrobce.
Všechny qRT-PCR byly provedeny na přístrojích iCycler iQ system (Bio-Rad, Hercules, CA, USA) nebo ABI 7700 (Applied Biosystems, Foster City, CA, USA). Jako kontrola kvantity a kvality cDNA byl použit housekeeping gen ABL (19). Standardní křivky pro amplifikaci genů ABL, LAT a PAG byly připraveny logaritmickým seriovým ředěním cDNA od zdravých dobrovolníků do vody, pro NTAL jsme použili cDNA z buněčné linie REH. Výsledná normalizovaná exprese jednotlivých genů (PAG, LAT, NTAL) ve vzorku byla definována jako poměr mezi expresí příslušného genu (PAG, LAT, NTAL) a expresí ABL.
Průtoková cytometrie
Vzorky kostní dřeně, periferní krve nebo kryoprezervované thymocytární tkáně byly značeny následujícími monoklonálními protilátkami (mAbs): anti-CD1a PE (phycoerythrin) nebo anti-CD1a PC5™, anti-CD3 FITC (fluorescein isothiocyanate), anti-CD4 ECD™, anti-CD7 FITC, anti-CD7 PE, anti-CD5 PC7™, anti-CD10 ECD™, anti-CD19 PC7™, anti-CD34 FITC, anti-CD34 PC7™ (Immunotech, Marseille, Francie), anti-CD8 Pacific Blue (Dako, Glostrup, Denmark), anti-CD20 Alexa Fluor 405™ (Serotec, Kidlington, Oxford, UK) nebo anti-CD20 Pacific Blue™ (eBioscience, San Diego, CA, USA), anti-CD3 Alexa Fluor 700™, anti-CD7 Pacific Blue™, anti-Cbp/PAG Dyomics647™, anti-LAT Dyomics647™, anti-NTAL PE, anti-IgG2a Dyomics647™, anti-IgG1 Dyomics647™ (Exbio Praha, Česká republika). Značení povrchových molekul bylo provedeno podle dříve popsaných postupů (20). Ke značení intracelulárních adaptorových proteinů byl použit FIX&PERM buněčný permeabilizační kit (An der Grub, Kaumbach, Rakousko) podle protokolu výrobce. Vzorky byly analyzovány na přístroji FACS Aria (BD, San Jose, CA), CyAn ADP (Dako) nebo BD LSRII (BD). Analýza byla provedena pomocí softwaru FlowJo 8.1.1. (Treestar, Ashland, OR, USA). Ve vzorcích byly vyšetřeny následující antigeny: BCP-ALL: CD3, CD10, CD19, CD20 a Cbp/PAG nebo LAT. T-ALL: CD3, CD7, CD5, CD20 a Cbp/PAG nebo LAT. Nemaligní buňky kostní dřeně: CD34, CD10, CD19, CD20 a Cbp/PAG nebo LAT. Thymocyty: CD8, CD7, CD1a, CD4, CD34, CD3 a Cbp/PAG nebo LAT. Pro analýzu NTAL v thymocytech jsme vyšetřili CD7, CD8, NTAL, CD4, CD1a, CD34 a CD3.
Exprese LAT, PAG a NTAL v gatovaných populacích je ukázána jako poměr jejich střední intenzity fluorescence (MFI) k MFI izotypové kontroly v odpovídajícím gatu. Zvolený postup umožňuje srovnání hodnot získaných na třech různých průtokových cytometrech. Pro měření apoptózy byl použit Annexin V (Exbio Praha, Česká republika) a DAPI (Invitrogen, Carlsbad, USA).
In vitro experimenty
Netransfekované, nativní linie Jurkat a Jurkat/NTAL transfektanty byly pěstovány za standardních podmínek v Roswell Park Memorial Institute (RPMI) 1640 médiu se 2 mmol/L L-glutaminu, 10% fetálním bovinním sérem a antibiotiky o koncentraci 10 ml/l (penicilinu: 100 jednotek/ml, streptomycinu: 100 μg/ml), při 37 °C a v atmosféře s 5% CO2. Transfektanty a nativní Jurkat linie byly inkubovány s dexamethasonem (Sigma-Aldrich, St. Louis, USA) o koncentraci 25 μM, Methylprednisolonem (Solu-medrol, Pharmacia Upjohn, Puurs, Belgie) o koncentraci 0,5 μM a aqua pro injectionem jako negativní kontrolou. Po 48 a 72 hodinách jsme po značení Annexinem V a DAPI měřili za použití průtokové cytometrie procento přežívajících buněk definovaných jako Annexin V i DAPI negativní.
Statistická analýza
Ke statické analýze byl použit test Mann-Whitney (Stat-View software, SAS Institute, Cary, NC, USA).
Výsledky
Normální a leukemické B buňky
Exprese PAG
Obrázek 1 ukazuje expresi PAG v B lymfocytární linii.
Image 1. Hladina exprese mRNA (A) a proteinu (B) genu PAG v průběhu fyziologického vývoje B lymfocytu a u dětských BCP-ALL. BCP-ALL, B-prekurzorová leukemie; MLL/AF4 (mRNA n = 5); HD, hyperdiploidní (mRNA n = 8, protein n = 4); TEL/AML1 (mRNA n = 15, protein n = 6); ostatní, ne-hyperdiploidní, fúzní geny negativní B-prekurzorová leukemie (mRNA n = 8, protein n = 16); fyziologická BCP 0, CD34+CD19- buňky (protein n = 8); fyziologická BCP 1, CD19+CD10+CD34+ (protein n = 8); fyziologická BCP 2, CD10+CD20+/- v analýze mRNA (n=2) a CD19+CD10+CD34- v proteinové analýze (n = 8); fyziologická BCP3, CD20+CD10- v analýze mRNA (n = 2) a CD19+CD20+CD10- v proteinové analýze (n = 8); PB, fyziologické periferní B lymfocyty, CD19+ (mRNA n = 4, protein n = 4). 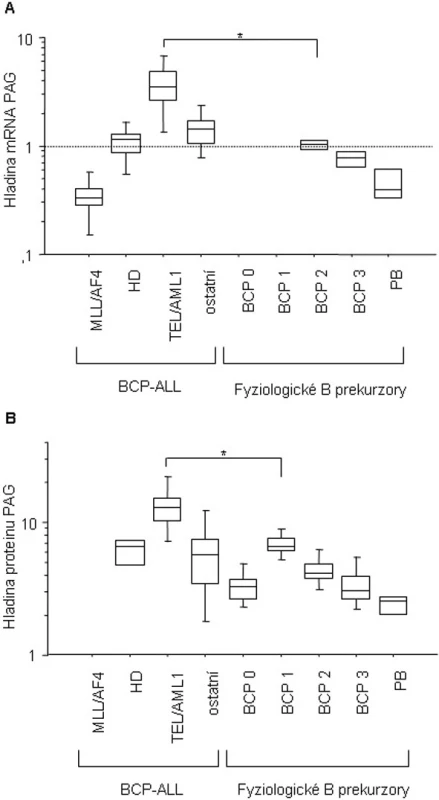
V nemaligní tkáni, nejvíce nezralé “non-committed“ CD19-CD34+ buňky mají velmi nízkou expresi PAG proteinu. Se získáním CD19 pozitivity, exprese PAG rychle stoupá a při dalším vývoji do zralého B lymfocytu následně hladina PAG mRNA i proteinu postupně klesá.
V BCP-ALL byla exprese PAG měřena v následujících podtypech: TEL/AML1 pozitivní, MLL/ALF pozitivní (kojenci), hyperdiploidní a „ostatní“ (ne-hyperdiploidní, TEL/AML1 negativní, MLL/AF4 negativní). Hladina m-RNA a proteinu PAG koreluje velice dobře. Hladina PAG ve skupině hyperdiploidních a „ostatních“ leukemií je obdobná jako exprese ve zdravých lymfocytech odpovídajícího stadia maturace, nízká exprese PAG v kojenecké MLL/AF4 pozitivní leukemii odpovídá vzniku těchto leukemií z velmi časných CD10-negativních progenitorů a CD34+CD19 - buňky jsou fenotypicky nejbližší nemaligní populací. TEL/AML1 pozitivní leukemické buňky exprimují významně vyšší hladiny PAG v porovnání s ostatními CD10+ ALL podtypy (hyperdiploidní a „ostatní“ ALL, p = 0,0035 pro protein; p < 0,0001 pro mRNA) i s odpovídajícími nemaligními protějšky (CD19+CD10+CD34+, p = 0,0045 pro protein; CD20+/-CD10+, p = 0,0526 pro mRNA).
Exprese LAT
Absolutní množství LAT mRNA v B lymfocytárních prekurzorech je velmi nízké, o řád nižší ve srovnání s T-ALL, přibližně na úrovni nemaligních thymocytů. Hladina LAT má tendenci stoupat s vyzráváním B linie, ale rozdílná exprese není mezi jednotlivými stadii signifikantní.
Exprese LAT v analyzovaných podtypech dětské BCP-ALL odpovídá nemaligním prekurzorům s výjimkou skupiny “ostatních” BCP-ALL, kde jsou hladiny LAT nižší. Rozdíl mezi touto skupinou a nemaligními prekurzory dosahuje statistické signifikace (p = 0,0247).
Hladiny proteinu LAT v nemaligních B prekurzorech i v BCP-ALL jsou tak nízké, že jsme je nebyli schopni metodami průtokové cytometrie detekovat.
Exprese NTAL
Množství mRNA genu NTAL je téměř stejné v CD10+CD20+/ - a CD10-CD20+ B lymfocytárních prekurzorech a nesignifikantně vyšší v periferních B buňkách. Při proteinové analýze dosahujeme podobných výsledků, navíc u nejméně zralých B-lymfocytárních prekurzorů (analyzovaných pouze průtokovou cytometrií), detekujeme nejvyšší hladiny proteinu NTAL.
Všechny vyšetřované podtypy BCP-ALL s výjimkou TEL/AML1 pozitivních leukemií mají vyšší expresi NTAL než jejich nemaligní protějšky. Zajímavé je že exprese NTAL v TEL/AML1 pozitivních blastech je téměř 10krát nižší než u ostatních BCP-ALL podtypů a je obdobná jako hladina NTAL v nemaligních prekurzorech. Rozdíl mezi hladinou NTAL mRNA u TEL/AML pozitivních ALL a fenotypicky obdobného podtypu hyperdiploidních ALL je statisticky vysoce signifikantní (p = 0,004).
Normální a leukemické T buňky
Exprese PAG
V maligních i nemaligních T lymfocytech jsme nalezli pouze slabou expresi PAG, přibližně o 1 řád nižší než v B lymfocytech.
V normálních thymocytech je hladina PAG mRNA konstantní s výjimkou „early intermediate“ stadia (CD7+CD3-CD1a+CD8+/-), ve kterém je exprese PAG nižší (p = 0,0495). Zralé periferní T lymfocyty mají významně vyšší hladinu mRNA genu PAG v porovnání s thymocyty (p = 0,0339).
Ve vzorcích T-ALL je tendence ke snižování exprese PAG se zralejším genotypem maligních blastů (pre T-ALL versus zralá T-ALL, p = 0,0367). Nicméně mezi maligními blasty a thymocyty není statisticky významný rozdíl.
Na úrovni proteinu je hladina PAG konstantně nízká, mezi jednotlivými stadii vývoje T lymfocytu není v expresi žádný rozdíl (včetně periferních T lymfocytů). Stejně tak se hladina PAG proteinu v T maligních blastech neliší od normálních T buněk.
Exprese LAT
Hladina LAT se v průběhu vývoje normálního T lymfocytu zvyšuje, jak je ukázáno na obrázku 2. Zatímco na úrovni mRNA se exprese signifikantně zvyšuje pouze mezi thymocyty a periferními T lymfocyty (p = 0,0036), rozdíly na proteinové úrovni jsou detekovatelné v celém průběhu vývoje T lymfocytu (CD7+CD3-CD1a+CD8+/ - „early intermediate“ versus CD7+CD3+CD1a+ „late intermediate“, p = 0,0163; zralé „double-positive“ versus zralé „single-positive, p = 0,0373; thymocyty versus CD3+ periferní T lymfocyty, p = 0,0143).
Image 2. Hladina exprese mRNA (A) a proteinu (B) genu LAT v průběhu fyziologického vývoje T lymfocytu a u dětských T-ALL. „Pre“ T-ALL (mRNA n = 4, protein n = 1); IM, “intermediate” T-ALL (m-RNA n = 6, protein n = 1); „mature“ T-ALL (mRNA n = 8, protein n = 6); TCP 1, CD7+CD3-CD1a-CD8- v analýze mRNA (n = 3) a CD34+CD7+CD3-CD1a-CD8- v proteinové analýze (n = 5); TCP 2, CD7+CD3-CD1a+CD8+/- v analýze mRNA (n = 3) a CD34+CD7+CD3-CD1a+CD8+/- v proteinové analýze (n = 5); TCP 3, CD7+CD3+CD1a+ (mRNA n = 3, protein n = 5); TCP 4, CD7+CD3+CD1a- (n = 3); TCP 4a, CD7+CD3+CD1a-CD4+CD8+ (n = 5); TCP 4b, CD7+CD3+CD1a-CD4+CD8- nebo CD7+CD3+CD1a- CD8+CD4- (n = 5); PB, fyziologické periferní T-lymfocyty, CD3+ (mRNA n = 4, protein n = 4). 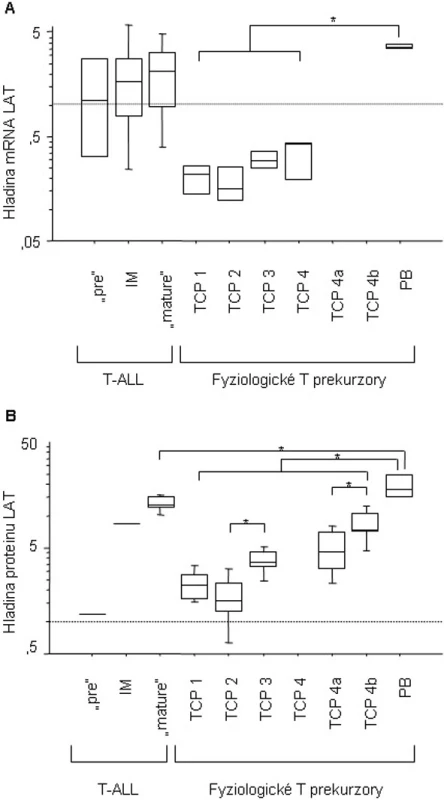
Hladina LAT má také tendenci vzrůstat se zralejším fenotypem maligních blastů, ale z důvodu nízkého počtu vzorků v jednotlivých podtypech T-ALL (pre T – intermediate T – zralá T) nedosahují rozdíly statistické významnosti. Pre T a intermediate T-ALL mají vyšší expresi LAT než fyziologické pre T a intermediate T buňky. Zralé T-ALL mají vyšší hladinu LAT v porovnání se zralými T thymocyty, i když statistické významnosti dosahují tyto změny pouze na úrovni proteinu (p = 0,0079 pro „single-positive“ thymocyty a p = 0,0062 pro „double-positive“ thymocyty). Hladina LAT ve zralých T-ALL však nedosahuje úrovně nalezené v normálních periferních T lymfocytech (p = 0,0887 pro mRNA, p = 0,0428 pro protein).
Exprese NTAL
Detekovatelnou hladinu NTAL mRNA jsme překvapivě nalezli ve všech thymocytárních populacích s výjimkou CD4 „single-positive“ lymfocytů. Hladina NTAL mRNA v průběhu vývoje T lymfocytu klesá a stejný trend je vidět i na úrovni proteinu, kdy pro/pre-T buňky mají nejvyšší hladiny NTAL.
Exprese NTAL rozděluje T-ALL do 2 skupin – s nízkou a s vysokou hladinou NTAL mRNA. Práh mezi „nízkou“ a „vysokou“ expresí byl stanoven jako dvojnásobek exprese NTAL v buněčné linii REH (ta byla pro qRT-PCR analýzu exprese NTAL mRNA použita jako standard). Rozdělení do NTAL „vysoké“ a „nízké“ skupiny nekoreluje s imunofenotypem, věkem pacientů při diagnose, ani s počáteční hladinou leukemických blastů v periferní krvi. Nicméně tyto 2 skupiny se významně liší v odpovědi na iniciální léčku ALL. Zatímco více než polovina pacientů (6/11) s nízkou expresí NTAL odpoví špatně na počáteční léčbu prednizonem (= prednison “poor responders”), velká většina (20/24) pacientů v vysokým NTAL mají dobrou odpověď na prednizon (= prednison “good responders”) (p = 0,04). Rozdíl hladin NTAL mezi „good“ a „poor responders“ je statisticky významný (p = 0,0285) (obr. 3).
Image 3. Hladina NTAL m-RNA u pacientů s T-ALL s různou odpovědí na iniciální prednizonovou léčbu. PGR, prednison “good responders”; PPR, prednison “poor responders” 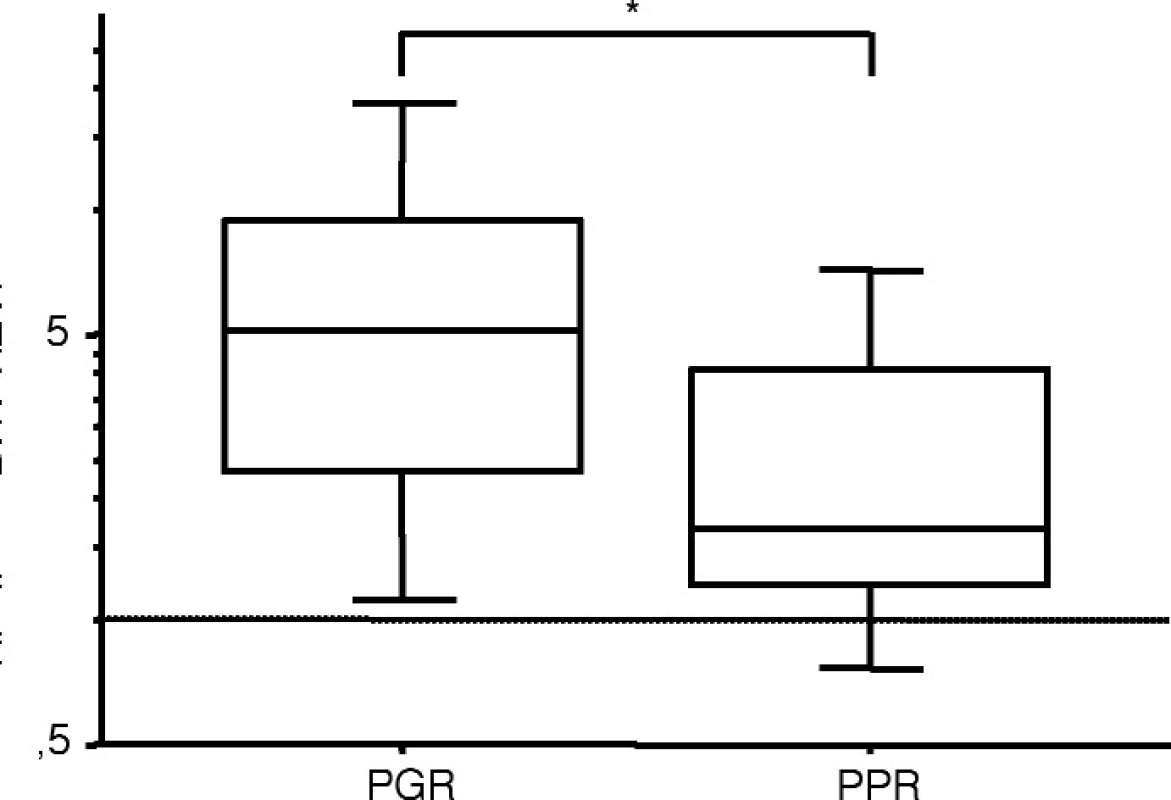
In vitro odpověď na terapii kortikoidy
Nativní a NTAL-transfekovaná linie Jurkat byly inkubovány s dexamethasonem, methylprednisolonem a samotným rozpouštědlem (H2O) jako negativní kontrolou. V každém časovém bodě byl počet živých buněk ve vzorku negativní kontroly stanoven jako 100%. Po 48 hodinách inkubace s dexamethasonem se počet přežívajících buněk lišil, v nativní linii přežívalo o 12% více leukemických buněk než v linii exprimující NTAL. Po 72 hodinách inkubace byl rozdíl dokonce 46 %. Obdobný efekt methylprednisolonu byl méně výrazný (nesignifikantní rozdíl po 48 hodinách, 5% rozdíl po 72 hodinách).
Diskuse
Pomocí metod qRT-PCR a průtokové cytometrie jsme analyzovali expresi 3 adaptorových molekul na proteinové a mRNA úrovni. Obecně, hladina i dynamika mRNA i proteinu korespondují velmi dobře. Definovali jsme změny v expresi adaptorových molekul v průběhu normálního lymfocytárního vývoje u lidí a porovnali jsme výsledky fyziologické exprese s hladinami v hlavních podtypech dětské ALL. Nalezli jsme statisticky významné změny v expresi adaptorových molekul u leukemií s rozdílným genetickým podkladem a ukázali jsme jejich prognostický význam. Naše primární data mohou být použita pro následnou funkční analýzu těchto molekul, která je pro plné porozumění jejich role ve vývoji B a T lymfocytů a u leukemií nezbytná.
Analýza na úrovni proteinu a mRNA ukázala, že zatímco některé adaptorové molekuly jsou při vývoji B a T lymfocytu přítomny v relativně konstantních hladinách, jiné ukazují statisticky významnou dynamiku (snižování exprese NTAL, zvyšování exprese LAT v průběhu vývoje T buněk, snižování hladiny PAG při vývoji B řady). Tato pozorování ukazují, že v průběhu fyziologického lymfocytárního vyzrávání jsou zapojeny rozdílné adaptorové proteiny a aktivovány rozdílné signalizační dráhy.
Pro pochopení funkce a patologie těchto molekul je velmi užitečné studium maligních protějšků normálních lymfocytů. My jsme analyzovali leukemické buňky nejčastějších podtypů dětských ALL, porovnávali expresi adaptorových molekul v leukemických buňkách a v odpovídajících fyziologických prekurzorech a následně jsme se zaměřili na prognostický vliv rozdílných hladin některých adaptorů.
TEL/AML1 a hyperdiploidní leukemie tvoří dohromady přibližně polovinu dětských ALL. Tyto dvě velmi dobře definované podskupiny mají velmi podobnou charakteristiku – každá tvoří 20–25 % případů ALL u dětí, typicky jsou obě diagnostikovány v předškolním věku (1–5 let), mají podobný imunofenotyp (CD34+19+10+), odpověď na léčbu i celkovou prognózu přežití (velmi dobrou). Přesto, překvapivě, se právě u těchto 2 podtypů leukemií významně liší exprese adaptorových molekul (TEL/AML1 mají vyšší expresi PAG a nižší hladinu NTAL, p = 0,001, p = 0,004). Rovněž se u těchto podtypů liší exprese adaptorů i při porovnání s odpovídajícími nemaligními B prekurzory. Toto pozorování nejspíše reflektuje odlišné biologické pozadí těchto leukemií a ukazuje, že adaptorové molekuly by přímo nebo nepřímo mohly hrát roli při etiopatogenezi TEL/AML1 nebo hyperdiploidní ALL.
U leukemií z B prekurzorů je nejvýraznější odchylkou vysoká exprese PAG v TEL/AML1 pozitivních maligních blastech. Vysoká hladina PAG může ukazovat na vznik těchto leukemií z časného B progenitoru. To koresponduje s našimi předchozími pozorováními založenými na detailní imunofenotypické analýze této skupiny (21). Vyšší hladina exprese PAG v TEL/AML1 pozitivních leukemických buňkách by také mohla vysvětlovat známý fenomén vysoké VDJ rekombinantní aktivity, která vede k vysokému počtu přestaveb genů pro immunoglobuliny a T buněčné receptory v TEL/AML1 pozitivních buňkách v porovnání s TEL/AML1 negativními leukemiemi (22). Jak bylo zmíněno dříve, vyšší aktivita PAG v B prekurzorech vede k vyšší aktivitě Csk a tím k potlačení Src kinázové aktivity. Tím se sníží fosforylace inhibičních ITIM motivů což umožní vyšší propagaci aktivačního signálu včetně VDJ rekombinantní aktivity. Dále PAG statisticky významně koreluje s expresí CD27 antigenu. Tato molekula je exprimována na buňkách s vysokou aktivitou VDJ rekombinantní aktivity –časné B progenitory přestavující geny pro těžké imunoglobulinové řetězce, B-buňky v germinálních centrech a také ALL s TEL/AML1 fúzním genem (7, 16, 21, 23). Vysoká exprese proteinu PAG byla nedávno popsána ve vzorcích folikulárního lymfomu (7).
Hladina LAT se signifikantně zvyšuje se zráním maligních i nemaligních T buněk. U T-ALL z nejméně zralých progenitorů exprese LAT překročí hladinu nalezenou ve zralých thymocytech, ale nedosáhne hladiny, která se vyskytuje v periferních T lymfocytech. Protože LAT je nezbytný pro aktivaci T buněk (24), vysoká hladina LAT v periferních T lymfocytech pravděpodobně reflektuje antigenní zkušenost těchto buněk. Nižší hladina LAT v leukemických buňkách tak může demonstrovat fakt, že ačkoliv jsou leukemické a neleukemické buňky fenotypicky ve stejném maturačním stadiu, maligní T buňky nejsou schopny adekvátně odpovědět na antigenní stimulaci.
Naše výsledky ukazují, že rozdílná exprese NTAL u T-ALL ovlivňuje časnou odpověď na léčbu a tím i prognózu onemocnění (nízká hladina NTAL signifikantně koreluje se špatnou odpovědi na iniciální týdenní terapii prednisonem, p = 0,028). Tato data získaná analýzou pacientských vzorků se nám následně podařilo potvrdit i v in vitro experimentu. Po dvou až třídenní kultivaci buněčné linie dětské T-ALL jsme detekovali významný rozdíl mezi buňkami lišícími se pouze expresí adaptorové molekuly NTAL. Stejně jako u pacientských vzorků jsme pozorovali významnější “léčebný” efekt (tedy menší procento přežívajících leukemických buněk) u linie s expresí NTAL. NTAL může fungovat jako předpokládaný tumor supresorový gen, působící pravděpodobně přes kompetitivní inhibici LAT (jehož aktivita je nezbytná k propagaci signálu do buněčného jádra), a snižovat tak úroveň fosforylace Src kináz. NTAL a LAT mohou soupeřit o pozici v určitém lipidovém raftu či o účinnou palmitoylaci (připojení zbytku kyseliny palmitové na –SH skupinu cysteinu) nutnou ke správné funkci obou proteinů. U jiných typů leukemie (konkrétně u TEL/AML1 pozitivních ALL) má vysoká exprese NTAL spíše nepříznivý prognostický vliv – pacienti, kteří následně prodělají relaps onemocnění, mají tendenci k vyšším hladinám exprese NTAL. Přestože tato změna nedosahuje hranice statistické významnosti (p = 0,071), tento fenomén ukazuje na možnou rozdílnou roli molekuly NTAL v maligních B a T prekurzorech.
Naše data ukazují, že rozdílná exprese transmembránových adaptorových molekul je u určitých podtypů ALL specifická – zvláště u TEL/AML1 pozitivní ALL. Dále jsme prokázali, že rozdílná exprese některých adaptorů může hrát důležitou roli v časné odpovědi na léčbu dětské ALL.
Práce byla podpořena grantem IGA NR9108-3.
MUDr. Karel Švojgr
Klinika dětské hematologie a onkologie
UK v Praze 2. LF a FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: karel.svojgr@lfmotol.cuni.cz
Doručeno redakci: 4. 2. 2009
Přijato: 27. 3. 2009
Sources
1. Horejsi V, Zhang W, Schraven B. Transmembrane adaptor proteins: organizers of immunoreceptor signalling. Nat Rev Immunol 2004; 4 : 603–616.
2. Hancock JF. Lipid rafts: contentious only from simplistic standpoints. Nat Rev Mol Cell Biol 2006; 7 : 456–462.
3. Brdicka T, Pavlistova D, Leo A, et al. Phosphoprotein associated with glycosphingolipid-enriched microdomains (PAG), a novel ubiquitously expressed transmembrane adaptor protein, binds the protein tyrosine kinase csk and is involved in regulation of T cell activation. J Exp Med 2000; 191 : 1591–1604.
4. Horejsi V. Transmembrane adaptor proteins in membrane microdomains: important regulators of immunoreceptor signaling. Immunol Lett 2004; 92 : 43–49.
5. Posevitz-Fejfar A, Smida M, Kliche S, Hartig R, Schraven B, Lindquist JA. A displaced PAG enhances proximal signaling and SDF-1-induced T cell migration. Eur J Immunol 2008; 38 : 250–259.
6. Smida M, Posevitz-Fejfar A, Horejsi V, Schraven B, Lindquist JA. A novel negative regulatory function of the phosphoprotein associated with glycosphingolipid-enriched microdomains: blocking Ras activation. Blood 2007; 110 : 596–615.
7. Svec A, Velenska Z, Horejsi V. Expression pattern of adaptor protein PAG: correlation between secondary lymphatic follicle and histogenetically related malignant lymphomas. Immunol Lett 2005; 100 : 94–97.
8. Baumgartner M, Angelisova P, Setterblad N, et al. Constitutive exclusion of Csk from Hck-positive membrane microdomains permits Src kinase-dependent proliferation of Theileria-transformed B lymphocytes. Blood 2003; 101 : 1874–1881.
9. Zhang W, Sommers CL, Burshtyn DN, et al. Essential role of LAT in T cell development. Immunity 1999; 10 : 323–332.
10. Su YW, Jumaa H. LAT links the pre-BCR to calcium signaling. Immunity 2003; 19 : 295–305.
11. Su YW, Herzog S, Lotz M, Feldhahn N, Muschen M, Jumaa H. The molecular requirements for LAT-mediated differentiation and the role of LAT in limiting pre-B cell expansion. Eur J Immunol 2004; 34 : 3614–3622.
12. Brdicka T, Imrich M, Angelisova P, et al. Non-T cell activation linker (NTAL): a transmembrane adaptor protein involved in immunoreceptor signaling. J Exp Med 2002; 196 : 1617–1626.
13. Wang Y, Horvath O, Hamm-Baarke A, et al. Single and combined deletions of the NTAL/LAB and LAT adaptors minimally affect B-cell development and function. Mol Cell Biol 2005; 25 : 4455–4465.
14. Stork B, Engelke M, Frey J, et al. Grb2 and the non-T cell activation linker NTAL constitute a Ca(2+)-regulating signal circuit in B lymphocytes. Immunity 2004; 21 : 681–691.
15. Zhu M, Koonpaew S, Liu Y, et al. Negative regulation of T cell activation and autoimmunity by the transmembrane adaptor protein LAB. Immunity 2006; 25 : 757–768.
16. Tedoldi S, Paterson JC, Hansmann ML, et al. Transmembrane adaptor molecules: a new category of lymphoid-cell markers. Blood 2006; 107 : 213–221.
17. Bene MC, Castoldi G, Knapp W, et al. Proposals for the immunological classification of acute leukemias. European Group for the Immunological Characterization of Leukemias (EGIL). Leukemia 1995; 9 : 1783–1786.
18. Chomczynski P, Sacchi N. Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Anal Biochem 1987; 162 : 156–159.
19. Boublikova L, Kalinova M, Ryan J, et al. Wilms’ tumor gene 1 (WT1) expression in childhood acute lymphoblastic leukemia: a wide range of WT1 expression levels, its impact on prognosis and minimal residual disease monitoring. Leukemia 2006; 20 : 254–263.
20. Kalina T, Vaskova M, Mejstrikova E, et al. Myeloid antigens in childhood lymphoblastic leukemia: clinical data point to regulation of CD66c distinct from other myeloid antigens. BMC Cancer 2005; 5 : 38.
21. Vaskova M, Fronkova E, Starkova J, Kalina T, Mejstrikova E, Hrusak O. CD44 and CD27 delineate B-precursor stages with different recombination status and with an uneven distribution in nonmalignant and malignant hematopoiesis. Tissue Antigens 2008; 71 : 57–66.
22. Zuna J, Krejci O, Madzo J, et al. TEL/AML1 and immunoreceptor gene rearrangements-which comes first? Leuk Res 2005; 29 : 633–639.
23. Klein U, Tu Y, Stolovitzky GA, et al. Gene expression dynamics during germinal center transit in B cells. Ann N Y Acad Sci 2003; 987 : 166–172.
24. Finco TS, Kadlecek T, Zhang W, Samelson LE, Weiss A. LAT is required for TCR-mediated activation of PLCgamma1 and the Ras pathway. Immunity 1998; 9 : 617–626.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2009 Issue 2-
All articles in this issue
- Adaptorové molekuly PAG, NTAL a LAT ve fyziologických lymfocytárních prekurzorech a u dětských leukemií
- Novinky v terapii nízce rizikových nemocných s myelodysplastickým syndromem
- Interfant 99 – léčebná studie zohledňující odlišnou biologii akutní lymfoblastické leukemie kojenců a její výsledky v České republice
- Rizikové faktory u chronické lymfocytární leukemie, validace flow-cytometrické detekce ZAP-70 pomocí RT-PCR a imunohistochemie
- Mikrochimérismus – na hraně počínajícího relapsu AML?
- Klonální evoluce u chronické lymfocytární leukemie
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Mikrochimérismus – na hraně počínajícího relapsu AML?
- Klonální evoluce u chronické lymfocytární leukemie
- Interfant 99 – léčebná studie zohledňující odlišnou biologii akutní lymfoblastické leukemie kojenců a její výsledky v České republice
- Novinky v terapii nízce rizikových nemocných s myelodysplastickým syndromem
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

