-
Medical journals
- Career
Stanovení chimérismu pomocí polymerázové řetězové reakce v reálném čase. Přehled a první vlastní zkušenosti
Authors: O. Horký; J. Mayer; D. Dvořáková
Authors‘ workplace: Centrum molekulární biologie a genové terapie, Interní hematoonkologická klinika, Fakultní nemocnice Brno
Published in: Transfuze Hematol. dnes,13, 2007, No. 2, p. 73-78.
Category: Comprehensive Reports, Original Papers, Case Reports
Overview
Metoda polymerázové řetězové reakce v reálném čase (RQ-PCR) představuje v současnosti jednu z nejcitlivějších kvantitativních metod stanovení chimérismu po alogenní transplantaci krvetvorných buněk. Tato metoda je minimálně desetkrát citlivější než běžně používaná metoda fragmentační analýzy (FA) s fluorescenční detekcí. Aplikace metody umožňující stanovení mikrochimérismu, tj. smíšeného chimérismu (SC) na hladině menší než 1 %, dovoluje zachycení relapsu onemocnění signifikantně dříve a ve větším počtu případů, než je tomu u méně senzitivních metod. U pacientů s náhlým znovuobjevením autologní krvetvorby, odhalilo použití RQ-PCR SC také u předchozích odběrů, pomocí FAjiž klasifikovaných jako chimérismus kompletní (KC). Rovněž retrospektivní RQ-PCR analýza vzorků s pozitivní minimální zbytkovou chorobou, dle FA klasifikovaných jako KC, opakovaně potvrdila přítomnost autologní krvetvorby na hladině menší než 1 %. Použití metody stanovení chimérismu s lepší mezí detekce tedy umožňuje dřívější klinickou intervenci, avšak absolutní význam chimérismu i mikrochimérismu musí být dále hodnocen.
Klíčová slova:
chimérismus, mikrochimérismus, PCR v reálném čase, fragmentační analýzaÚvod
Alogenní transplantace kostní dřeně, a později i periferních kmenových buněk krvetvorby, se stala léčebným zákrokem u řady maligních i nemaligních hematologických onemocnění (1). Následné stanovení chimérismu, tedy určení podílu vlastní a dárcovské krvetvorby, je velmi důležitou součástí posttransplantačního sledování pacientů (2).
Smyslem analýzy chimérismu a jeho dynamiky v čase je, vedle počáteční informace o úspěšnosti nahrazení krvetvorby, nenahraditelná pomoc při hledání optimálního léčebného přístupu, jako je především úprava imunosuprese nebo podání infuze dárcovských lymfocytů (DLI) (3, 4).
Během éry transplantací se k analýze chimérismu používala řada metod (pro souhrn viz např. naše předcházející review (5). V posledním desetiletí byla za zlatý standard považována metoda fragmentační analýzy (FA) s fluorescenční detekcí polymorfních úseků genomové DNA (6). Konkrétně se jedná o oblasti obsahující repetitivní sekvence (VNTR – variable number of tandem repeat, STR – short tandem repeat), jejichž variabilní počet určuje délku dané oblasti (2). Jejich amplifikace pak umožňuje porovnání a odlišení jednotlivých jedinců, v případě chimérismu odlišení dárce a příjemce, a sledovat tak podíl krvetvorby po transplantaci. Mez stanovitelnosti se u FA pohybuje v rozmezí 1–5 % (6), ovšem ani hranice 1 % se nejeví jako dostatečná (2). Naopak se ukazuje, že použití metody s možností detekce mikrochimérismu, tzn. autologní krvetvorby na úrovni menší než 1 %, umožňuje dřívější odhalení relapsu onemocnění (7–14). Takovou metodou je polymerázová řetězová reakce v reálném čase (RQ-PCR).
V předkládaném článku uvádíme přehled dosud publikovaných prací využívajících RQ-PCR pro monitorování chimérismu po alogenní transplantaci krvetvorných buněk, diskutujeme aspekty spojené s jejím používáním, a to zvláště v konfrontaci s metodou FA, včetně vlastních zkušeností a prvních výsledků.
Přehled použití RQ-PCR
První práce zabývající se možností aplikace RQ-PCR pro účely monitorování chimérismu po transplantaci hematopoetických buněk byla publikována v roce 2000 (15). Úspěšně byl tehdy testován komerčně dostupný kit pro detekci jediného polymorfismu jednoho nukleotidu (SNP, single nucleotide polymorphism).
Polymorfismy jednoho nukleotidu se v genomu vyskytují zhruba každých 1,9 kb (16). Zpravidla jsou bialelické, vyskytují se v kódujících i nekódujících oblastech DNA, a představují hlavní část genomické diversity (16).
Pro kvantifikaci chimérismu pomocí RQ-PCR byla dále využita detekce sekvencí lidského chromozomu Y (14). Tohoto přístupu bylo, u dvojic dárce-žena příjemce - muž, využito také v řadě jiných publikovaných prací; pro ostatní dvojice pak bylo použito buďto SNP, nebo polymorfismu typu (krátké) inserce/delece, existence tzv. nulových alel, případně HLA (viz tab. 1) (7–15, 18–31).
Využití skupiny 19 polymorfismů, náležejících 12 bialelickým lokusům na 9 chromozomech, publikovali pro stanovení chimérismu v roce 2002 Alizadeh a kol. (7). Vybírali přitom sekvence lišící se alespoň dvěma za sebou jdoucími nukleotidy (krátké inserce/delece) s vysokým stupněm informativity. Z této publikace o tři roky později přímo vychází Masmas a kol. (26). Kromě úpravy podmínek amplifikace byly navrženy nové primery a sonda pro detekci pohlavně specifického polymorfismu.
Obě tyto práce využívají metodu dvojitě značených TaqMan® sond. Tato technologie je založená na měření fluorescenčního signálu sondy, která specificky hybridizuje do oblasti kvantifikovaného úseku DNA. Mezi první cyklem, kdy množství uvolněné próby excituje detekovatelný fluorescenční signál, a logaritmem počátečního množství DNA existuje lineární závislost. Tento cyklus je označován jako Ct („cycle treshold“). Dosazením Ct do vzorce
QU=QCx(1+E)-(ΔCtU - ΔCtC), kde
QU... (normalizované) množství DNA v neznámém vzorku
QC......(normalizované) množství DNA kalibrátoru (vzorek DNA příjemce před transplantací)
ΔCtU.....rozdíl hodnot Ct u neznámého vzorku
ΔCt = Ct cílové sekvence – Ct referenční sek.) Δ CtC...... rozdíl hodnot Ct kalibrátoru
E..... efektivita reakce (je-li efektivita reakce 100 %, pak E = 1),
nebo použitím kalibrační křivky standardů o známé koncentraci, může být také určeno množství sledované DNA v neznámém vzorku (7, 26). Principiálně velmi podobné TaqMan® sondám je použití dvojic jednoduše značených sond pro LighCycler® (Roche) (12).
Odlišný princip kvantitativní RQ-PCR je naproti tomu založen na detekci fluorescenční látky nazývané SYBR Green. Tato látka emituje fluorescenční záření až po interkalaci do dvouvláknové DNA. Při PCR tak lze kontinuálně měřit množství vznikajícího produktu. Nevýhodou této metody je, že se SYBR Green váže i na primerové dimery a jiné nespecifity, jež se mohou během reakce tvořit, což může zkreslit kvantifikaci vlastní amplifikované DNA. Naopak výhodou jsou nízké náklady a univerzální použití – odpadají vysoké náklady na syntetizování značených specifických sond (18, 30–31).
RQ-PCR versus FA
Hlavním přínosem metody RQ-PCR je lepší mez stanovitelnosti i detekce. Zatímco u FA s fluorescenční detekcí je nejmenší udávané detekovatelné množství minoritní populace s určením exaktní hodnoty 1–5 % (6), je tato hranice u RQ-PCR posunuta minimálně desetkrát (4).
V závislosti na typu používaného polymorfismu a postavení informativní alely, je možné mikrochimérismus detekovat i pomocí FA (6). Úrovně detekčního limitu srovnatelné s RQ-PCR lze dosáhnout analýzou chimérismu v jednotlivých buněčných liniích krve (4, 6).
Další výhodou RQ-PCR je rychlejší provedení kvantitativní analýzy – pouze příprava a provedení PCR plus výpočet – tedy bez dalšího zpracovávání (odpadá příprava PCR produktů na FAa především její déletrvající provedení). Rovněž univerzální podmínky amplifikace šetří čas tím, že se dají analyzovat všechny polymorfismy najednou.
Je ovšem třeba mít na paměti limitaci v kvantitativní přesnosti metody RQ-PCR: rozdíl jediného cyklu tvoří ve výsledku dvojnásobný kvantitativní rozdíl. To ovšem znamená koeficient variace až 56 % (26). Reprodukovatelnost FA se naproti tomu pohybuje v rozmezí 4–8 % (3). Z toho plyne, že použití RQ-PCR je přesné pouze pro vzorky s podílem vlastních buněk do 5 % (3, 4) a nemůže tedy zcela nahradit FA. Zatímco u FA lze najít informativní STR či VNTR polymorfismus hypoteticky u všech dvojic příjemce-dárce, u RQ-PCR existuje tato možnost asi jen u 90 % dvojic (4).
Nevýhodou RQ-PCR zůstává také vyšší cena výsledku jednoho stanovení – kromě skutečnosti, že se vyšetření provádí vždy ve dvou paralelách, je rovněž třeba připočíst náklady na amplifikaci referenčního „house-keeping“ genu (včetně negativní a pozitivní kontroly).
RQ-PCR – naše zkušenosti
Na našem pracovišti jsme pro detekci chimérismu pomocí RQ-PCR převzali 11 polymorfismů krátkých insercí a delecí z publikace Alizadeh a kol. (7) a marker vázaný na chromozom Y (26). Podmínky reakce jsme modifikovali použitím jiného reakčního objemu a délkou denaturace a změnili jsme rovněž množství templátu, typ značení sond a použité reagencie, což znamenalo především příznivější finanční dopad. 100 ng DNA bylo smícháno s 12,5 μl univerzálního mixu (2x ABsolute QPCR ROX Mix, ABgene), 600 nM primery a 200 nM sondou (BHQ1-FAM, Generi Biotech), v reakčním objemu 25 μl. Na přístroji RG-3000 (Corbett Research) byla reakce iniciována inkubací 15 minut při 95 ºC, po které následovalo 50 amplifikačních cyklů (95 °C/20 s a 60 °C/60 s). Jako referenční gen sloužil albumin (32). Treshold analýzy reakce byl standardně nastaven na 0,005 a výpočet podílu minoritní DNA byl proveden podle výše uvedeného vzorce.
Do září 2005 výhradně používaná metoda FA byla postupně nahrazována nejprve u pacientů, kde podíl vlastní krvetvorby vycházel menší než jedno procento. Dále u těch, kteří měli pozitivitu na minimální zbytkovou nemoc (MRD), ale vykazovali přitom kompletní chimérismus (KC). Retrospektivní analýza těchto vzorků metodou RQ-PCR opakovaně potvrdila mikrochimérismus (obr. 1).
Image 1. Pacient s chronickou myeloidní leukemií (CML): KC dle FA, zároveň zbytková nemoc (MRD) pomocí detekce fúzního genu bcr/abl pozitivní. Ve všech takových odběrech byl pomocí RQ-PCR retrospektivně potvrzen mikrochimérismus. Obdobný fenomén byl pozorován u dalších 9 CML pacientů. Legenda: G = Glivec, DLI = infuze dárcovských lymfocytů 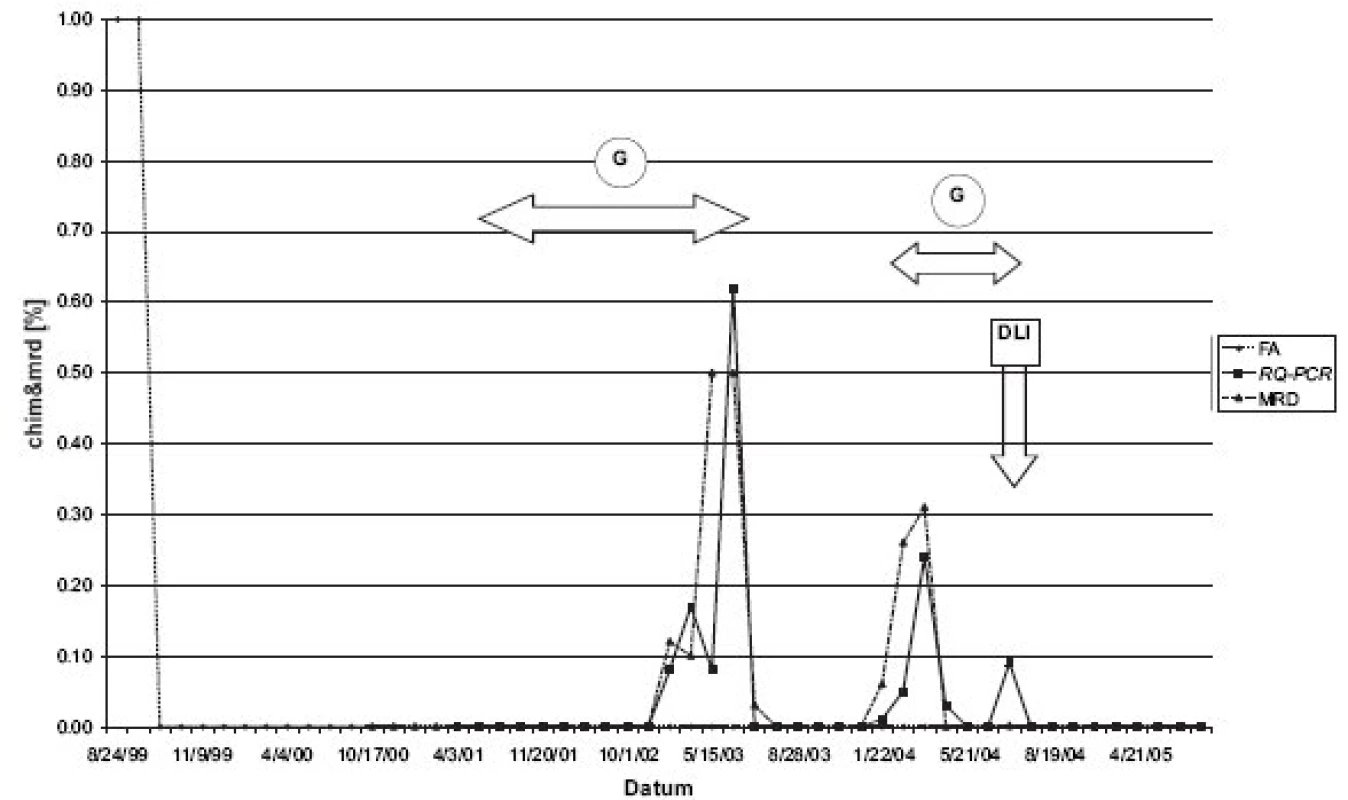
Rovněž retrospektivní RQ-PCR analýza vzorků pacientů s akutní myeloidní leukemií (AML), předcházejích náhlému znovuobjevení se autologní krvetvorby, odhalila smíšený chimérismus (SC) i u těch odběrů, pomocí FA již klasifikovaných jako KC (obr. 2).
Image 2. Pacient s akutní myeloidní leukemií, vykazujícím dlouhodobě KC dle FA, den +693 náhle SC 1–2 %. Retrospektivní analýza předchozích odběrů pomocí citlivější metody RQ-PCR odhalilo signifikantní přítomnost autologní krvetvorby již v den +583 (SC 0,1 %) a v den +632 – nárůst na SC 0,3 %. Relaps onemocnění byl tedy metodou RQ-PCR zachycen o 110 dní dříve. 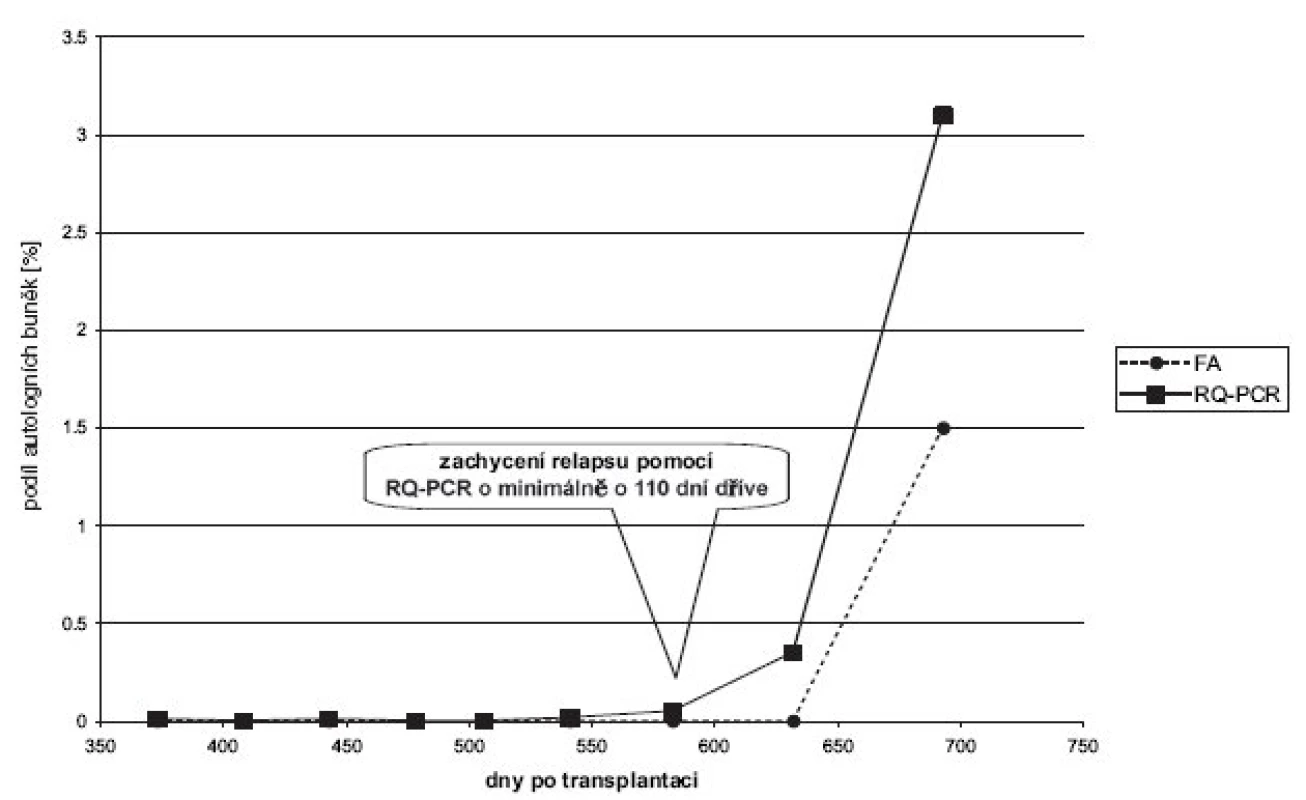
Přechod na RQ-PCR se dosud uskutečnil u 82 našich pacientů, z toho 24 tvoří skupina, u které detekujeme pohlavně specifický marker. Informativní polymorfismus nebyl nalezen u čtyř z 62 genotypizovaných pacientů (6,5 %).
Jak již bylo řečeno, metoda RQ-PCR nemůže zcela nahradit metodu FA. U nově transplantovaných pacientů začínáme s analýzou chimérismu pomocí FA, a teprve když u nich podíl autologní krvetvorby klesne pod jedno procento, přecházíme na RQ-PCR. Pokud přetrvává SC na vyšší úrovni, je u daného pacienta používána metoda FA s fluorescenční detekcí i dále.
Vzhledem k výše zmíněné variabilitě mezi jednotlivými PCR reakcemi se nám, u vzorků se SC, osvědčilo provádět současně s novým odběrem analýzu chimérismu i u odběru předcházejícího. Pokud se pak takovýto kontrolní výsledek liší od výsledku vydaného, je tento „rozpor“ zohledněn či komentován při klasifikaci chimérismu nového odběru. V tomto ohledu se jeví výhodnější vydávat výsledek SC v určitém intervalu, získaného výpočtem více rovnic (nejlépe z různých polymorfismů) u FA, respektive amplifikací vzorků ve dvou paralelách u RQ-PCR.
Výsledky pod mezí stanovitelnosti, ale v rámci meze detekce (bez udání exaktní hodnoty), jsou pak vydávány intervalem SC < 1 % respektive SC < 1 % u FA resp. SC < 0,1 % respektive SC < 0,1 % u RQ-PCR. U výsledku KC je vhodné vždy použitou metodu uvést. Diskuse Znovuobjevení se autologní krvetvorby či nárůst smíšeného chimérismu zpravidla souvisí s vyšším výskytem relapsu onemocnění, jež patří mezi časté příčiny selhání transplantace krvetvorných buněk a to především u akutních leukemií (pro přehled viz např. 4, v rámci naší republiky práce 33–35). Prediktivní význam samotného SC zůstává nicméně nadále nejednoznačný (36–37). Jinými slovy, není možné stanovit obecně platnou hladinu SC, jejíž dosažení by pro všechny pacienty znamenalo vyšší riziko relapsu (12). Pokud navíc uvažujeme o významu mikrochimérismu, stane se situace jenom komplikovanější. Řada prací však už nyní jasně ukazuje, že aplikace citlivější metody, kterou RQ-PCR představuje, umožňuje zachycení signifikantně většího množství relapsů, než pomocí FA, případně jiných, běžně používaných metod. Jiménéz-Velasco a kol. pomocí RQ-PCR, ve srovnání s FA VNTR oblastí, zachytili signifikantně větší množství relapsů (88,2 vs. 44,4 %), s mediánem předpovědi 58 dní (21). Obdobné výsledky byly publikovány i při srovnání RQ-PCR a STR či FISH (8–11, 13–14) – viz tabulka 1. Naše první výsledky ukazují totéž – analýza vzorků pomocí metody RQ-PCR odhalila SC dříve, než bylo znovuobjevení autologní krvetvorby před relapsem zaznamenáno metodou FA s fluorescenční detekcí (viz také obr. 2).
Table 1. Přehled všech publikovaných prací (citace tučně) a některých abstraktů z konferencí European Group for Blood and Marrow Transplantation (EBMT) a American Hematology Association (ASH) od r. 2003 (kurzivou), zabývajících se bezprostředně metodikou a využitím RQ-PCR pro stanovení chimérismu. Z uvedených polymorfismů vychází nejlépe použití detekce markeru vázaných na chromozom Y, a to pro jeho mez detekce. Pro větší specifičnost reakce a tedy menší riziko falešně pozitivních výsledků se jeví výhodnější aplikace polymorfismů typu inserce/delece před použitím SNP. Výhody a nevýhody rozdílného principu PCR je uveden v textu. 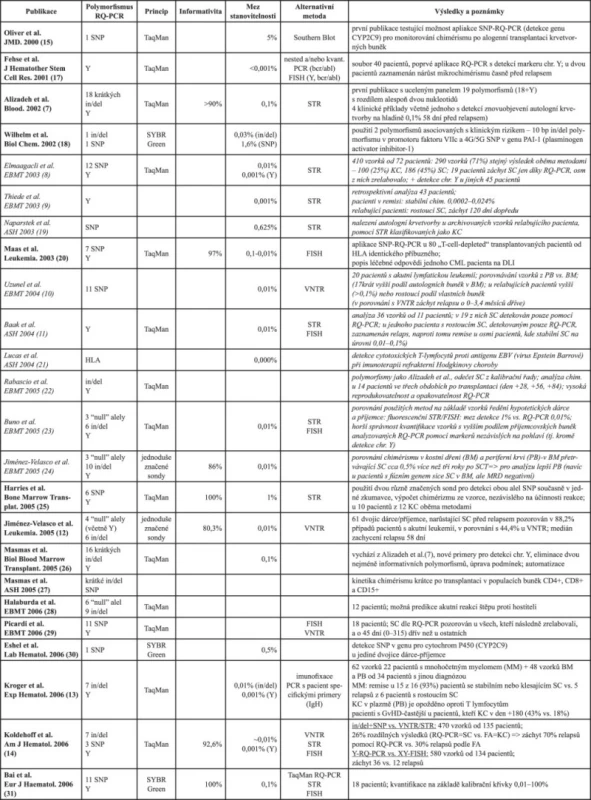
Použití RQ-PCR dále umožnilo objasnění situace u MRD pozitivních pacientů s KC. Ve všech těchto případech bylo potvrzeno, že tato diskrepance je zapříčiněna pouze horší mezí detekce původně použité metody. Naproti tomu v případech, kdy vychází SC, avšak pacient je MRD negativní, pochází autologní populace z nemaligního klonu, u myeloidních leukemií tedy z lymfocytární řady (38–40). Zdá se tedy, že stanovení chimérismu pomocí RQ-PCR, zvláště v kombinaci s analýzou v jednotlivých buněčných liniích krve, může být použita k monitorování MRD u těch pacientů, kde jiný molekulární marker (např. fúzní gen) není k dispozici (41).
Závěr
Mezí detekce metoda RQ-PCR velmi přispívá k časnému odhalení relapsu u pacientů transplantovaných pro malignity krevních buněk, a umožňuje tak včasnou klinickou intervenci. Klinický význam absolutních hodnot chimérismu, a zvláště pak mikrochimérismu, však musí být dále hodnocen.
Mgr. Ondřej Horký
Centrum molekulární biologie a genové terapie, IHOK,
FN Brno
Černopolní 9
25 00 Brno
Došlo do redakce: 23. 11. 2006
Přijato: 12. 3. 2007
Sources
1. Thomas ED. Bone marrow transplantation: a review. Semin Hematol 1999; 36 : 95–103.
2. Antin JH, Childs R, Filipovich AH, et al. Establishment of complete and mixed donor chimerism after allogeneic lymphohematopoietic transplantation: recommendations from a workshop at the 2001 Tandem Meetings of the International Bone Marrow Transplant Registry and the American Society of Blood and Marrow Transplantation. Biol Blood Marrow Transplant 2001; 7 : 473–485.
3. Thiede C, Bornhäuser M, Ehninger G. Strategies and clinical implications of chimerism diagnostics after allogeneic hematopoietic stem cell transplantation. Acta Haematol 2004; 112 : 16–23.
4. Bader P, Niethammer D, Willasch A, Kreyenberg H, Klingebiel T. How and when should we monitor chimerism after allogeneic stem cell transplantation? Bone Marrow Transplant 2005; 35 : 107–119.
5. Horký O, Dvořáková D, Mayer J. Kvantitativní analýza chimerismu po alogenní transplantaci hematopoetických buněk. Trans Hemat dnes 2004; 10 : 70–75.
6. Lion T. Summary: Reports on quantitative analysis of chimerism after allogeneic stem cell transplantation by PCR amplification of microsatellite markers and capillary electrophoresis with fluorescence detection. Leukemia 2003; 17 : 252–254.
7. Alizadeh M, Bernard M, Danic B, et al. Quantitative assessment of hematopoietic chimerism after bone marrow transplantation by real-time quantitative polymerase chain reaction. Blood 2002; 99 : 4618–4625.
8. Elmaagacli AH, Hlinka M, Steckel NC, Beelen DW.Anew sensitive quantitative real-time PCR method for chimerism analyses can help to identify patients at high risk for leukemic relapse after allogeneic stem cell transplant earlier than STR-PCR chimerism analyses. Bone Marrow Transplant 2003; S123
9. Thiede C, Kellermann T, Schwerdtfeger R, et al. Real-time PCR for the SRY-gene allows sensitive and quantitative chimerism analysis after allogeneic blood stem cell transplantation: clinical results in 43 patients. Bone Marrow Transplant 2003; 31: S31.
10. Uzunel M, Sundin U, Mattsson J, Schaffer M, Hauzenberger D, Ringden O. Sensitive and quantitative chimerism analysis in ALL patients with real-time PCR. Bone Marrow Transplant 2004; 33: S101.
11. Baak U, Marinets O, Rieger O, et al. Real-time quantitative Y chromosome specific PCR vs. XY-FISH vs. fluorescent STRPCR for chimerism analysis after allogeneic sex-mismatched PBSCT. ASH Annnual Meeting Abstracts 2004; 104 : 5047
12. Jiménez-Velasco A, Barrios M, Román-Gómez J, et al. Reliable quantification of hematopoietic chimerism after allogeneic transplantation for acute leukemia using amplification by realtime PCR of null aleles and insertion/deletion polymorphisms. Leukemia 2005; 19 : 336–343.
13. Kroger N, Zagrivnaja M, Schwartz S, et al. Kinetics of plasmacell chimerism after allogeneic stem cell transplantation by highly sensitive real-time PCR based on sequence polymorphism and its value to quantify minimal residual disease in patients with multiple myeloma. Exp Hematol 2006; 34 : 688–694.
14. Koldehoff M, Steckel NK, Hlinka M, Beelen DW, Elmaagacli AH. Quantitative analysis of chimerism after allogeneic stem cell transplantation by real time polymerase chain reaction with single nucleotide polymorphism, standard tandem repeats, and Y chromosome-specific sequences. Am J Hematol 2006; 81 : 735–746.
15. Oliver DH, Thompson RE, Griffin CA, Eshleman JR. Use of single nucleotide polymorphisms (SNP) and real-time polymerase chain reaction for bone marrow engraftment analysis. J Mol Diagn 2000; 2 : 202–208.
16. Sachidanandam R, Weissman D, Schmidt SC, et al. A map of human genome sequence variation containing 1.42 million single nucleotide polymorphisms. Nature 2001; 409 : 928–933.
17. Fehse B, Chukhlovin A, Kuhlcke K, et al. Real-time quantitative Y chromosome-specific PCR (QYCS-PCR) for monitoring hematopoietic chimerism after sex-mismatched allogeneic stem cell transplantation. J Hematother Stem Cell Res 2001; 10 : 419–425.
18. Wilhelm J, Reuter H, Tews B, Pingoud A, Hahn M. Detection and quantification of insertion/deletion variations by allele-specific real-time PCR: application for genotyping and chimerism analysis. Biol Chem 2002; 383 : 1423–1433.
19. Naparstek E, Vainas O, Eshel R. Real-time PCR SNP assay for monitoring chimerism after allogeneic stem cell transplantation. Blood 2003; 102: Abstract 5460.
20. Maas F, Schaap N, Kolen S, et al. Quantification of donor and recipient hemopoietic cells by real-time PCR of single nucleotide polymorphisms. Leukemia 2003; 17 : 621–629.
21. Lucas KG, Sun Q, Chorney K, Erickson T, Nelson JL. Microchimerism detection by HLA-specific real-time polymerase chain reaction analysis in recipients of allogeneic Epstein Barr virus specific cytotoxic T lymphocytes. ASH Annual Meeting Abstracts 2004; 104 : 2648.
22. Rabascio C, Raia V, Muratori E, et al. Quantitative PCR for chimerism kinetics in non-myeloablative allo-transplants. Bone Marrow Transplant 2005; R1181.
23. Buno I, Barrios M, Navarro G, et al. A methodological algorithm for chimerism quantification after stem cell transplantation. Bone Marrow Transplant 2005; P598.
24. Jiménez-Velasco A, Barrios M, Roman-Gomez J, et al. Differential prognostic significance of bone marrow and peripheral blood mixed chimerism determined by real-time quantitative PCR after SCT in patients with acute leukemia. Bone Marrow Transplant 2005; P599.
25. Harries LW, Wickham CL, Evans JC, Rule SA, Joyner MV, Ellard S. Analysis of haematopoietic chimerism by quantitative real-time polymerase chain reaction. Bone Marrow Transplant 2005; 35 : 283–290.
26. Masmas TN, Madsen HO, Petersen SL, et al. Evaluation and automation of hematopoietic chimerism analysis based on realtime quantitative polymerase chain reaction. Biol Blood Marrow Transplant 2005; 11 : 558–566.
27. Masmas TN, Petersen SL, Madsen HO, et al. Kinetics of early donor chimerism after nonmyeloablative haematopoietic stem cell transplantation monitored with high-resolution real time quantitative PCR. ASH Annual Meeting Abstracts 2005; 106 : 3669.
28. Halaburda K, Guz K, Orzinska A, et al. Real-time PCR for early chimerism evaluation in peripheral blood mononuclear cells of allogeneic stem cell recipients: potential value for prediction of acute graft-versus-host disease. Bone Marrow Transplant 2006; 37: S95.
29. Picardi A, Spagnoli A, Cordone I, et al. Reliable quantification of haematopoietic chimerism after allogeneic stem cell transplantation by real-time quantitative PCR analysis. Bone Marrow Transplant 2006; 37: S322.
30. Eshel R, Vainas O, Shpringer M, Naparstek E. Highly sensitive patient-specific real-time PCR SNP assay for chimerism monitoring after allogeneic stem cell transplantation. Lab Hematol 2006; 12 : 39–46.
31. Bai L, Deng YM, Dodds AJ, Milliken S, Moore J, Ma DD. A SYBR green-based real-time PCR method for detection of haemopoietic chimerism in allogeneic haemopoietic stem cell transplant recipients. Eur J Haematol 2006; 77 : 425–431.
32. Chiu RW, Murphy MF, Fidler C, Zee BC, Wainscoat JS, Lo YM. Determination of RhD zygosity: comparison of a double amplification refractory mutation system approach and a multiplex real-time quantitative PCR approach. Clin Chem 2001; 47 : 667–672.
33. Formánková R, Sedláček P, Kršková L, Říhová H, Šrámková L, Starý J. Chimerism-directed adoptive immunotherapy in prevention and treatment of post-transplant relapse of leukemia in childhood. Haematologica 2003; 88 : 117–118.
34. Formánková R, Honzátková L, Sieglová Z, Starý J, Sedláček P, Brdička R. Detailed monitoring of hematopoietic chimerism in a child treated by adoptive immunotherapy for high risk of relapse after BMT for acute myeloid leukemia. Bone Marrow Transplant 2000; 25 : 453–456.
35. Formánková R, Honzátková L, Moravcová J, Sieglová Z, Dvořáková R, Nádvorníková S., Vítek A, Lukášová M, Starý J, Brdička R. Prediction and reversion of post-transplant relapse in patients with chronic myeloid leukemia using mixed chimerism and residual disease detection and adoptive immunotherapy. Leuk Res 2000; 24 : 339–347.
36. Baron F, Sandmaier BM. Chimerism and outcomes after allogeneic hematopoietic cell transplantation following nonmyeloablative conditioning. Leukemia 2006; 20 : 1690–1700.
37. Khan F, Agarwal A, Agarwal S. Significance of chimerism in hematopoietic stem cell transplantation: new variations on an old theme. Bone Marrow Transplant 2004; 34 : 1–12.
38. Serrano J, Roman J, Sanchez J, et al. Molecular analysis of lineage-specific chimerism and minimal residual disease by RTPCR of p210(BCR-ABL) and p190(BCR-ABL) after allogeneic bone marrow transplantation for chronic myeloid leukemia: increasing mixed myeloid chimerism and p190(BCR-ABL) detection precede cytogenetic relapse. Blood 2000; 95 : 2659–2665.
39. Roman J, Alvarez MA, Torres A. Molecular basis for therapeutic decisions in chronic myeloid leukemia patients after allogeneic bone marrow transplantation. Haematologica 2000; 85 : 1072–1082.
40. Horký O, Mayer J, Borský M, Pospíšilová J, Krejčí M, Dvořáková D. Dynamics of lineage-specific chimerism in patients after non-myeloablative hematopoietic stem cell transplantation. Haematologica 2006; 91(S1): 304.
41. Elmaagacli AH. Real-time PCR for monitoring minimal residual disease and chimerism in patients after allogeneic transplantation. Int J Hematol 2002; Suppl. 2 : 204–205.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2007 Issue 2-
All articles in this issue
- Alogenní transplantace krvetvorných buněk po přípravném režimu redukované intenzity v léčbě lymfoproliferací (výsledky ÚHKT 1999–2005)
- Stanovení chimérismu pomocí polymerázové řetězové reakce v reálném čase. Přehled a první vlastní zkušenosti
- Stanovení t(14;18) z punkční biopsie uzliny u folikulárního lymfomu a význam tzv. molekulární uzlinové remise
- První nález fenotypu Gy(a-) v České republice od jeho objevu v r. 1967. Možné příbuzenství s původními nositeli tohoto fenotypu v USA v letech 1967–1968
- Chronická B-lymfocytární leukemie Část IV: Možnosti léčby s použitím monoklonálních protilátek alemtuzumabu a rituximabu
- Autologní transplantace u 495 pacientů s mnohočetným myelomem – analýza dat z Národního registru transplantací krvetvorných buněk České republiky
- Léčba recidivující multifokální histiocytózy z Langerhansových buněk 2-chlordeoxyadenosinem u osob dospělého věku. Zkušenosti jednoho pracoviště
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Stanovení chimérismu pomocí polymerázové řetězové reakce v reálném čase. Přehled a první vlastní zkušenosti
- Autologní transplantace u 495 pacientů s mnohočetným myelomem – analýza dat z Národního registru transplantací krvetvorných buněk České republiky
- Stanovení t(14;18) z punkční biopsie uzliny u folikulárního lymfomu a význam tzv. molekulární uzlinové remise
- Léčba recidivující multifokální histiocytózy z Langerhansových buněk 2-chlordeoxyadenosinem u osob dospělého věku. Zkušenosti jednoho pracoviště
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

