-
Medical journals
- Career
Autologní transplantace u 495 pacientů s mnohočetným myelomem – analýza dat z Národního registru transplantací krvetvorných buněk České republiky
Authors: M. Krejčí 1; B. Vacková 2; H. Krejčová 2; V. Maisnar 3; P. Žák 3; E. Faber 4; J. Vondráková 4; T. Kozák 5; E. Gregora 5; A. Vítek 6; M. Trněný 7; M. Trnková 7; A. Svobodník 8; V. Ščudla 9; J. Bačovský 9; I. Špička 2; J. Straub 2; L. Jebavý 3; Z. Adam 1; L. Pour 1; R. Hájek 1
Authors‘ workplace: Interní hematoonkologická klinika, FN Brno, 2I. interní klinika, VFN Praha, 3II. interní klinika – Oddělení klinické hematologie LF a FN Hradec Králové, 4Hematoonkologická klinika, FN Olomouc, 5Oddělení klinické hematologie, FN KV Praha, 6Ústav hematologi 1
Published in: Transfuze Hematol. dnes,13, 2007, No. 2, p. 56-62.
Category: Comprehensive Reports, Original Papers, Case Reports
Overview
Autologní transplantace krvetvorných buněk (ASCT) hraje důležitou roli v terapii symptomatických pacientů s mnohočetným myelomem (MM). Cílem práce bylo retrospektivně analyzovat výsledky transplantační léčby u 495 pacientů s MM z 6 transplantačních center na základě dat z Národního registru transplantací krvetvorných buněk České republiky se zaměřením na identifikaci parametrů významných pro dobu do progrese (PFS) a celkové přežití (OS) pacientů po transplantaci. Pacienti byli transplantováni v období 1994–2005, medián věku byl 56 let, zastoupení klinických stadií dle Durie-Salmona bylo následující: I – 8 %, II – 29 %, III – 63 %. Celkem 411 pacientů (83 %) mělo ASCT do 1 roku od stanovení diagnózy. Medián doby sledování po transplantaci byl 33,3 měsíce. Peritransplační mortalita do dne +100 byla 1 %, medián přihojení štěpu byl 12 dní. Léčebné odpovědi po transplantaci dle kritérií EBMT byly uvedeny u 149 pacientů (30 %), z toho bylo u 94 pacientů dosaženo kompletní remise. Medián PFS od transplantace byl 27,5 měsíce a medián OS 62,3 měsíce. Faktory asociované s významně kratší dobou do progrese a kratším celkovým přežitím v analyzovaném souboru 495 pacientů byly následující: přítomnost paraproteinu IgA, vstupní přítomnost renální insuficience, klinické stadium III dle Durie-Salmona, nedosažení kompletní remise po transplantaci. Věk a léčebné odpovědi před transplantací neovlivnily významně dobu do progrese a celkové přežití. Autologní transplantace u mnohočetného myelomu je bezpečná a efektivní léčebná metoda s nízkou toxicitou. Nejvýznamnější prognostické faktory pro delší přežití nemocných po transplantaci jsou nepřítomnost renální insuficience a dosažení kompletní remise po transplantaci (p < 0,001).
Klíčová slova:
mnohočetný myelom, autologní transplantace krvetvorných buněk, kompletní remise, prognostické
faktoryÚvod
Mnohočetný myelom (MM) je klonální B-lymfoproliferativní onemocnění, charakteristické v typických případech infiltrací kostní dřeně nádorovými plazmocyty, přítomností monoklonálního imunoglobulinu (MIG) v séru a/nebo v moči a osteolytickými ložisky skeletu. Mnohočetný myelom přestavuje asi 10 % všech hematologických malignit (1, 2).
V terapii MM hraje autologní transplantace krvetvorných buněk (ASCT) již řadu let důležitou úlohu. Autologní transplantace je nadále považována za zlatý standard pro všechny vhodné nemocné zpravidla do 65 let věku (bez přítomnosti jiného závažnějšího onemocnění kromě MM) a je většinou používána v léčbě první linie (3). Při srovnání se standardní chemoterapií vede podání vysokodávkované chemoterapie s následnou ASCT k signifikantně vyššímu počtu kompletních remisí (CR), k významně delší době do progrese (PFS) i k prodloužení celkového přežití (OS) (4–7).
U mnohočetného myelomu existuje celá řada prognostických faktorů, které ovlivňují průběh nemoci (8). Patří mezi ně například vstupní kombinace hodnot beta2-mikroglobulinu a albuminu (tvoří základ nového klasifikačního systému dle Greippa) (9), dále stav renálních funkcí, dosažení dobré léčebné odpovědi, některé cytogenetické změny a řada dalších (3).
Aby bylo možno vyhodnotit výsledky transplantační léčby, vznikla centrální počítačová databáze Evropské skupiny pro transplantace krvetvorných buněk a kostní dřeně (EBMT), do níž jsou zasílána anonymně data od transplantovaných pacientů z celé Evropy. Česká republika (ČR) je jednou ze zemí, které aktivně participují na zasílání dat do tohoto evropského transplantačního registru. Kromě toho byl v roce 2003 vytvořen v rámci ČR Národní registr transplantací krvetvorných buněk ČR, v němž jsou shromažďována a vyhodnocována data od transplantovaných pacientů v rámci ČR. Mnohočetný myelom tvoří jednu z nejčastějších indikací pro autologní transplantace u hematologických malignit. Cílem této práce byla retrospektivní analýza dosavadních výsledků autologních transplantací u 495 pacientů s MM z 6 transplantačních center ČR na základě dat z Národního registru transplantací krvetvorných buněk ČR se zaměřením na identifikaci prognostických faktorů důležitých pro PFS a OS.
Soubor pacientů a metodika
Metodika sběru dat, charakteristika souboru pacientů
U všech pacientů po jejich předchozím písemném souhlasu s anonymním zpracováním jejich dat byly 100 dní po provedení autologní transplantace vyplněny formuláře obsahující údaje týkající se typu základního onemocnění před transplantací s uvedením klinického stadia dle Durie-Salmona (10), dále léčebné odpovědi před a po transplantaci, věku, přihojení štěpu a některých dalších základních parametrů. Pacienti byli následně pravidelně sledováni v ročních intervalech od provedení transplantace, byl hodnocen jejich klinický stav a stav základního onemocnění. Formuláře s daty byly zasílány současně do evropského transplantačního registru i do databáze Národního registru transplantací krvetvorných buněk ČR.
Byla analyzována data od 495 pacientů s MM z 6 transplantačních center ČR, tito pacienti byli transplantováni v období 1994–2005. Na dodání podkladů pro analýzu se podílela následující centra: Interní hematoonkologická klinika FN Brno (119 pacientů), I. interní klinika VFN Praha (116 pacientů), II. interní klinika – Oddělení klinické hematologie LF a FN Hradec Králové (95 pacientů), Hematoonkologická klinika a III. interní klinika FN Olomouc (82 pacientů), Oddělení klinické hematologie FN Královské Vinohrady Praha (79 pacientů) a Ústav hematologie a krevní transfúze Praha (14 pacientů).
Základní charakteristiky souboru pacientů jsou uvedeny v tabulce 1. Jednalo se o 269 mužů (54 %) a 226 žen (46 %). Medián věku v době transplantace byl 56 let (rozpětí 31–69 let). Klinická stadia dle Durie-Salmona byla uvedena u 408 pacientů (82 %). Jejich zastoupení v souboru bylo následující: stadium I – 8 %, stadium II – 29 %, stadium III – 63 %. Typ MIG, neboli paraproteinu byl uveden u 485 nemocných (98 %), u 315 pacientů se jednalo o typ IgG (66 %), u 99 pacientů o typ IgA (20 %), u 7 pacientů typ IgD (1 %), u 52 pacientů o lehké řetězce (11 %) a nesekreční varianta byla přítomna u 12 nemocných (2 %).
Table 1. Charakteristika souboru pacientů. 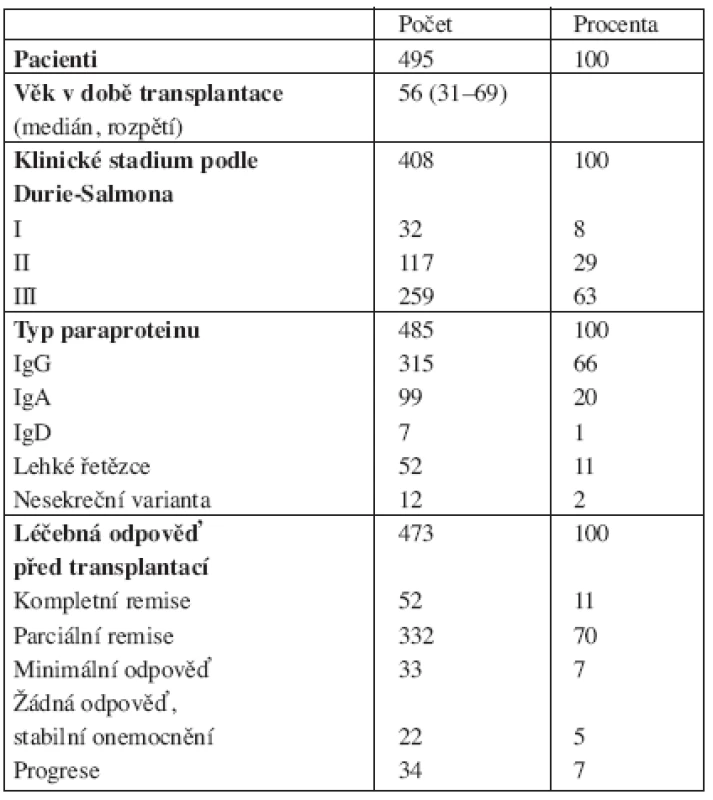
Vyhodnocení klinických stadií A a B (nepřítomnost či přítomnost renální insuficience) bylo uvedeno u 407 pacientů, z toho u 336 pacientů (82 %) bylo klinické stadium A (nepřítomnost renální insuficience, kreatinin < 177 μmol/l), u 71 pacientů bylo klinické stadium B (kreatinin > 177 μmol/l).
Jako přípravný předtransplantační režim byl použit vysokodávkovaný melfalan 200 mg/m2, u všech pacientů byly podány autologní periferní krvetvorné buňky. U pacientů s renální insuficiencí přetrvávající i v době transplantace byla dávka melfalanu redukována na 140 mg/m2.
Většina pacientů (411 nemocných, 83 %) byla transplantována do 1 roku od stanovení diagnózy MM.
U 275 (56 %) nemocných byla provedena jedna autologní transplantace, u 220 (44 %) pacientů dvě autologní transplantace. U pacientů, kteří absolovali 2 transplantace, část (101 nemocných) tvořili tzv. tandemové transplantace (2 transplantace provedené krátce za sebou, v odstupu maximálně 6 měsíců), část pacientů (119 nemocných) měla druhou transplantaci provedenou v rámci terapie prvního relapsu onemocnění.
Potransplantační udržovací léčba, podpůrná léčba a terapie relapsů či progrese onemocnění se řídila dle zvyklostí jednotlivých center a nebyla předmětem analýzy.
Hodnocení léčebných odpovědí
Pro hodnocení léčebných odpovědí byla použita standardní kritéria Evropské společnosti pro transplantace kostní dřeně (EBMT) (11). Kompletní remise (CR) byla definována jako absence MIG v séru nebo v moči metodou imunofixace, současně počet plazmatických buněk v kostní dřeni < 5 %. Parciální remise (PR) byla definována jako alespoň 50 % snížení iniciální hodnoty MIG anebo snížení iniciální hodnoty lehkých řetězců o více než 90 % a současně jejich absolutní hodnota musí být nižší než 0,2 g/24 hodin. Jako minimální léčebná odpověď (MR) je klasifikován stav, kdy vstupní hodnota MIG v séru poklesne o 25–49 % nebo dojde ke snížení hodnoty lehkých řetězců v moči o 50–89 %, jejich absolutní hodnota přesahuje 0,2 g/24 h. Jako žádná léčebná odpověď, nebo stabilní onemocnění (SD) je označován stav, kdy dochází ke kolísání hodnoty MIG v rozmezí do 25 % kolem vstupní hodnoty před léčbou; nejsou naplněna kritéria ani pro MR, ani pro progresi nemoci. Progrese nemoci (PG) je definována jako nárůst MIG v séru nebo v moči o více než 25 %, nárůst infiltrace kostní dřeně o více než 25 % v případě nesekreční varianty myelomu, případně rozvoj hyperkalcemie nad 2,8 mmol/l.
Statistická analýza
Výpočty statistické analýzy byly provedeny za použití počítačových programů STATISTICA (verze 6.1) a SAS verze 7. Kaplan - Meierova metoda byla použita ke stanovení výpočtů pravděpodobností PFS a OS, rozdíly byly srovnávány log-rank testem. Všechny statistické analýzy byly prováděny na hladině statistické významnosti 5 %. Doba do progrese byla hodnocena od doby transplantace do progrese, úmrtí či posledního známého kontaktu s pacientem. Celkové přežití bylo hodnoceno od provedení transplantace do úmrtí nebo do posledního známého kontaktu s pacientem.
Výsledky
Léčebné odpovědi před transplantací
Hodnocení léčebných odpovědí před provedením transplantace bylo uvedeno u 473 (96 %) pacientů: u 52 nemocných (11 %) byla CR, u 332 pacientů (70 %) byla PR, dále u 33 nemocných (7 %) MR, u 22 pacientů (5 %) SD a progrese nemoci u 34 pacientů (7 %).
Přihojení štěpu a potransplantační mortalita
Jako přihojení štěpu byl definován den po transplantaci, kdy došlo k vzestupu počtu neutrofilů nad 0,5x109/l v souladu s kritérii EBMT. Medián doby přihojení štěpu byl 12 dní (rozpětí 6–33 dní). Peritransplantační mortalita do dne +100 byla 1 % (5 pacientů z 495), konkrétní příčiny úmrtí nebyly blíže specifikovány.
Léčebné odpovědi po transplantaci, doba do progrese a celkové přežití
Léčebné odpovědi byly hodnoceny 100 dní po provedení transplantace, léčebné odpovědi dle kritérií EBMT byly uvedeny u 149 pacientů (30 %), z toho bylo u 94 pacientů dosaženo kompletní remise, u 23 pacientů parciální remise, u 1 pacienta bylo stabilní onemocnění a u 31 pacientů byla progrese nemoci. U dalších 246 pacientů (50 %) bylo uvedeno, že nebylo dosaženo kompletní remise, léčebné odpovědi nebyly u těchto nemocných dále specifikovány.
Z celkově 395 hodnocených nemocných bylo dosaženo u 94 pacientů CR, což je 24 %.
Medián doby sledování pacientů od transplantace byl 33,3 měsíce (rozpětí 0,3–117,1 měsíce). Medián doby do progrese nemoci od transplantace byl 27,5 měsíce, medián celkového přežití od provedení transplantace byl 62,3 měsíce (graf 1).
Graph 1. Doba do progrese (PFS) a celkové přežití (OS) u 495 pacientů s mnohočetným myelomem po autologní transplantaci. 
Vliv některých faktorů na dobu do progrese a celkové přežití po transplantaci
Faktory asociované s významně delší dobou do progrese a delším celkovým přežitím v analyzovaném souboru 495 pacientů byly následující: přítomnost jiného typu paraproteinu než IgA, nepřítomnost renální insuficience, vstupní klinické stadium I nebo II dle Durie-Salmona, dosažení kompletní remise po transplantaci. Výsledky univariační analýzy jsou shrnuty v tabulce 2.
Table 2. Univariační analýza faktorů majících vztah k době do progrese a celkovému přežití. 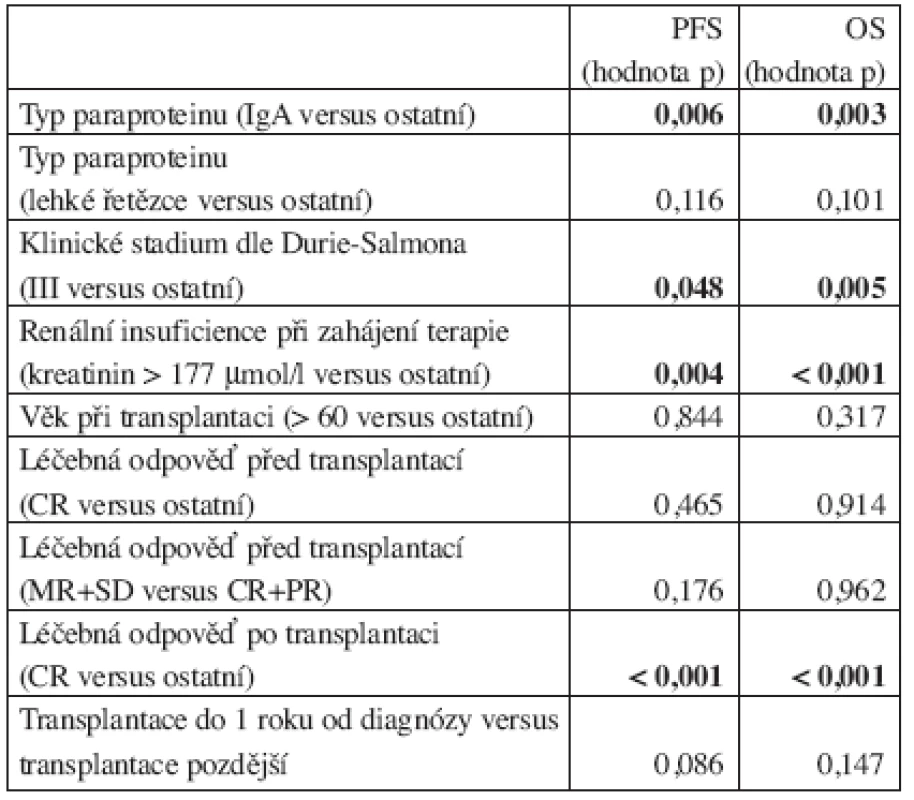
1) Klinická stadia dle Durie-Salmona
Pacienti s klinickým stadiem III dle Durie-Salmona ve srovnání s nemocnými s klinickými stadii I a II měli statisticky významně kratší dobu do progrese po transplantaci (medián PFS 23,9 měsíce versus 29,1 měsíce; p = 0,048), rovněž bylo u těchto pacientů významně kratší celkové přežití po transplantaci ve srovnání s pacienty s klinickými stadii I a II (medián OS 52,8 měsíce versus 72,9 měsíce; p = 0,003) (graf 2).
Graph 2. Vliv klinických stadií dle Durie-Salmona na PFS a OS po transplantaci. 
2) Věk
Byla srovnána skupina nemocných starších 60 let (354 pacientů) s pacienty do 60 let věku v době transplantace (141 pacientů). Mezi těmito 2 skupinami nebyly zjištěny statisticky významné rozdíly, pokud jde o dobu do progrese (medián PFS 27,7 měsíce versus 25,3 měsíce; p = 0,844) i pokud jde o celkové přežití (medián OS 62,6 měsíce versus 55,8 měsíce; p = 0,317) (graf 3).
Graph 3. Vliv věku na PFS a OS po transplantaci. 
3) Léčebné odpovědi před transplantací
Pacienti, kteří dosáhli před transplantací kompletní remise, neměli ve srovnání s ostatními významně odlišnou dobu do progrese (medián PFS 30,2 měsíce versus 27,1 měsíce; p = 0,465) ani celkové přežití (medián OS 58,7 měsíce versus 62,7 měsíce; p = 0,914) (graf 4). Skupina nemocných, která dosáhla před transplantací kompletní a parciální remise, neměla ve srovnání s pacienty s kategoriemi předtransplantačních léčebných odpovědí MR a SD významně rozdílnou dobu do progrese po transplantaci (medián PFS 30,1 měsíce versus 20,5 měsíce; p = 0,176) ani celkové přežití po transplantaci (medián OS 62,6 měsíce versus 71,2 měsíce; p = 0,962). Byla rovněž hodnocena skupina nemocných s progresí MM před transplantací (34 pacientů), ve srovnání s ostatními pacienty byl pozorován trend ke kratší době do progrese (medián PFS 12,1 měsíce versus 29,2 měsíce; p = 0,227) a rovněž trend ke kratšímu celkovému přežití (medián OS 48,3 měsíce versus 63,6 měsíce; p = 0,162), rozdíly však nebyly statisticky signifikantní.
Graph 4. Vliv dosažení CR před transplantací na PFS a OS. 
4) Léčebné odpovědi po transplantaci
Nemocní, kteří dosáhli po transplantaci kompletní remise, měli signifikantně delší dobu do progrese (mediánu PFS u pacientů s CR nebylo dosaženo, medián PFS u ostatních 24,6 měsíce; p < 0,001) i signifikantně delší celkové přežití (mediánu OS u pacientů s CR nebylo dosaženo, medián OS u ostatních 61,2 měsíce; p < 0,001) (graf 5).
Graph 5. Vliv dosažení CR po transplantaci na PFS a OS. 
5) Typ paraproteinu
Byla hodnocena možná korelace mezi typem MIG, PFS a OS. U pacientů s typem paraproteinu IgA byla pozorována signifikantně kratší doba do progrese po transplantaci (medián PFS 19,9 měsíce versus 30,4 měsíce; p = 0,006) i významně kratší celkové přežití (medián OS 45,2 měsíce versus 66,5 měsíce; p = 0,003) (graf 6).
Graph 6. Vliv typu paraproteinu IgA na PFS a OS po transplantaci 
6) Renální insuficience
Pacienti se vstupní přítomností renální insuficience měli významně kratší dobu do progrese po transplantaci (medián PFS 17,4 měsíce versus 30,4 měsíce; p = 0,004) i významně kratší celkové přežití (medián OS 38,0 měsíce versus 66,6 měsíce; p < 0,001) (graf 7).
Graph 7. Vliv vstupní renální insuficience na PFS a OS po transplantaci. 
Diskuse
Autologní transplantace u MM sice nevede k vyléčení nemocných, ale signifikantně prodlužuje dobu do progrese i celkové přežití nemocných ve srovnání se standardní chemoterapií, což bylo prokázáno randomizovanými studiemi (4, 5). Tato léčebná možnost nabízí části nemocných i dlouhodobé přežití, kolem 15–20 % po 10 letech (3). Některé randomizované klinické studie se zabývaly srovnáním provedení jedné nebo dvou ASCT u nemocných s MM, zdá se, že provedení druhé transplantace může být přínosné především u těch nemocných, kteří nedosáhnou velmi dobré léčebné odpovědi po provedení první ASCT s poklesem paraproteinu nižším než 90 % vstupní hodnoty (12). Někteří autoři doporučují provedení druhé ASCT jako efektivní součást terapie prvního relapsu onemocnění (13). Bohužel ani provedení dvou AT nevede k vyléčení nemocných s MM a dříve nebo později dochází opět k relapsu onemocnění, v jeho terapii jsou potom většinou využívány některé nové léky (thalidomid nebo bortezomib), obvykle v kombinaci s kortikoidy a cytostatiky (nejčastěji je používán dexamethason a cyklofosfamid) (3).
Analýza dat z Národního registru transplantací krvetvorných buněk ČR prokázala efektivitu transplantační léčby s nárůstem počtu kompletních remisí po transplantaci z 11 % na 24 %. Analýza rovněž prokázala bezpečnost této metody, neboť riziko 1 % úmrtnosti při provedení transplantací je na úrovní nejlepších center ve světě. Tento parametr je dokladem dlouhodobé vysoké úrovni péče o nemocné v transplantačních centrech České republiky. Počet kompletních remisí po transplantaci, medián přihojení štěpu, PFS a OS v hodnoceném souboru 495 pacientů byly srovnatelné s výsledky autologních transplantací u MM publikovaných v zahraničí (14, 15).
Analýza byla dále zaměřena na možné prognostické faktory se vztahem k PFS a OS. Výběr těchto proměnných byl zúžený, k analýze byla dodána pouze základní data, nebylo tedy možno zhodnotit například klinická stadia dle nového klasifikačního systému založeného na kombinaci hodnot beta2-mikroglobulinu a albuminu (9), nebo cytogenetické nálezy a jejich korelace s PFS a OS. Jedním z možných prognostických faktorů je věk, dle výsledků některých prací je pokládán vyšší věk v době transplantace za negativní prognostický faktor (16–18), jiní autoři naopak nepovažují vyšší věk za prognosticky negativní proměnnou (14, 19), přesto je obecně doporučována jako věková hranice pro transplantační léčbu u MM 65–70 let (18, 19). V našem souboru nemocných byl medián věku 56 let, nebyl prokázán zásadní vliv věku na PFS či OS po transplantaci.
Bylo rovněž provedeno podrobné hodnocení jednotlivých léčebných odpovědí před transplantací a jejich možný vztah k PFS a OS. V našem souboru pacientů nebyl prokázán jednoznačný vliv předtransplantační léčebné odpovědi na PFS či OS, pouze byl zaznamenán trend ke kratšímu PFS a OS u nemocných s progresí onemocnění. Tato data jsou v souladu s analýzami jiných velkých souborů (12, 14). Léčebná odpověď před transplantací nerozhoduje o dlouhodobém přežití. Klíčové je dosažení nejméně velmi dobré parciální remise po provedení autologní transplantace (12). Je zřejmé, že v případě rezistence na indukční léčbu je přínos transplantace zásadní, neboť intervaly PFS a OS u této skupiny nemocných jsou velmi podobné jako u skupiny nemocných senzitivních na indukční léčbu.
Léčebné odpovědi po transplantaci vyjma pacientů, kteří dosáhli kompletní remise, nebylo možno podrobněji vyhodnotit, byly sice uvedeny u 395 pacientů, nicméně u 236 nemocných bylo pouze zadáno, že nebylo dosaženo kompletní remise bez dalšího upřesnění. Léčebné odpovědi dle kritérií EBMT byly uvedeny pouze u 149 nemocných. Dosažení CR po transplantaci je významný prognostický faktor, který je asociován se signifikantním prodloužením PFS a OS (20–22). Výsledky naší analýzy potvrdily tento předpoklad, pacienti s dosažením CR po transplantaci měli výrazně delší PFS i OS ve srovnání s ostatními nemocnými.
Vysokodávkovaná chemoterapie s autologní transplantací může být dle řady autorů užitečná i u pacientů s renální insuficiencí (23–25). Názory na ovlivnění PFS a OS se různí, některé práce neprokázaly významný vliv renální insuficience na PFS a OS po transplantaci (24), jiné naopak poukazují na signikantně kratší přežití transplantovaných pacientů s renální insuficiencí (25). Většina autorů se shoduje v tom, že transplantovaní nemocní s renální insuficiencí mají vyšší TRM a zvýšenou nehematologickou toxicitu, proto je u těchto pacientů doporučována redukce dávky melfalanu v rámci přípravného předtransplantačního režimu (23–25). V našem souboru pacientů měli nemocní se vstupní renální insuficiencí významně kratší PFS i OS.
Možný vliv typu paraproteinu na PFS či OS po transplantaci není zcela jasný. Dle některých prací byl IgA typ paraproteinu popsán jako negativní prognostický ukazatel se zkrácením PFS i OS (26), jiní autoři neprokázali prognostický vliv IgA typu paraproteinu na PFS či OS (13). V našem souboru nemocných se IgA typ paraproteinu jevil jako významný prognostický faktor, nemocní s tímto typem MIG měli signifikantně kratší dobu do progrese i celkové přežití.
Závěr
Autologní transplantace je bezpečná a efektivní terapie mnohočetného myelomu. Výsledky autologních transplantací u pacientů s MM z Národního registru transplantací krvetvorných buněk ČR jsou plně srovnatelné s výsledky autologních transplantací MM publikovaných v zahraničí, nebyly zjištěny výraznější rozdíly v počtu kompletních remisí, v peritransplantační mortalitě, v době do progrese či v celkovém přežití. V hodnocené skupině 495 pacientů s MM byly jako prognosticky nepříznivé faktory signifikantní pro zkrácení doby do progrese i pro zkrácení celkového přežití definovány následné základní klinické či laboratorní ukazatele: vstupní přítomnost renální insuficience, typ paraproteinu IgA, klinické stadium III dle Durie-Salmona, nedosažení kompletní remise po transplantaci.
Práce byla podpořena grantem IGA MZ CR NR/8223-3.
MUDr. Marta Krejčí, PhD.
Interní hematoonkologická klinika
Fakultní nemocnice Brno
Jihlavská 20
625 00 Brno
e-mail: mkrejci@fnbrno.cz
Sources
1. Bataille R, Harousseau JL. Multiple Myeloma. N Engl J Med 1997; 336 : 1657–1664.
2. Greenlee RT, Murray T, Bolden S, Wingo PA. Cancer statistics. CA Cancer J Clin 2000; 50 : 7–33.
3. Adam Z, Bačovský J, Flochová E, et al. Diagnostika a léčba mnohočetného myelomu – Doporučení vypracované Českou myelomovou skupinou, Myelomovou sekcí České hematologické společnosti a experty Slovenské republiky pro diagnostiku a léčbu mnohočetného myelomu. Transf a Hematol 2005; Suppl. 1, 11 : 3–51.
4. Attal M, Harousseau JL, Stoppa AM, et al. A prospective, randomized trial of autologous bone marrow transplantation and chemotherapy in multiple myeloma. Intergroupe Francais du Myelome. N Engl J Med 1996; 335 : 91–97.
5. Child JA, Morgan GJ, Davies FE, et al. High-dose chemotherapy with hematopoietic stem-cell rescue for multiple myeloma. N Engl J Med 2003; 348 : 1875–1883.
6. Blade J, Sureda A, Ribera JM, et al. High-dose therapy autotransplantation/ intensification versus continued conventional chemotherapy in multiple myeloma patients responding to the intitial chemotherapy. Definitive results of the PETHEMA trial after median follow up of 66 months. Blood 2003; 102: abstr. 43a.
7. Fermand JP, Katsahian S, Divine M, et al. High-dose therapy and autologous blood stem-cell transplantation compared with conventional treatment in myeloma patients aged 55 to 65 years: long-term results of a randomized control trial from the Group Myelome-Autogreffe. J Clin Oncol 2005; 36 : 9227–9233.
8. Ščudla V., Bačovský J. Prognostické faktory. In: Adam Z, Hájek R, Mayer J et al. Mnohočetný myelom a další monoklonální gamapathie. 1. vyd. Brno, Masarykova Univerzita, 1999; 157–173.
9. Greipp PR, San Miguel J, Durie BG, et al. International staging system for multiple myeloma. J Clin Oncol 2005; 23 : 3412–3420. 10. Durie B, Salmon S. A clinical staging system for multiple myeloma. Cancer 1975; 36 : 842–854.
11. Blade J, Samson D, Reece D, et al. Criteria for evaluating disease response and progression in patients with multiple myeloma treated by high-dose therapy and haemopoietic stem cell transplantation. Myeloma Subcommittee of the EBMT. Br J Haematol 1998; 102 : 1115–1123.
12. Attal M, Harousseau JL, Facon T, et al. Single versus double autologous stem-cell transplantation for multiple myeloma. N Engl J Med 2003; 349 : 2495–2502.
13. Krivanova A, Hajek R, Krejci M, et al. Second autologous transplantation for multiple myeloma patients relapsing after the first autograft — a pilot study for the evaluation of experimental maintenance therapies. Report of the prospective non-randomized pilot study of the Czech Myeloma Group. Onkologie 2004; 27 : 275–279.
14. Terpos E, Apperley JF, Samson D, et al. Autologous stem cell transplantation in multiple myeloma: improved survival in nonsecretory multiple myeloma but lack of influence of age, status at transplant, previous treatment and conditioning regimen. A single - centre experience in 127 patients. Bone Marrow Transplant 2003; 31 : 163–170.
15. Alegre A, Diaz-Mediavilla J, San-Miguel J, et al. Autologous peripheral blood stem cell transplantation for multiple myeloma: a report of 259 cases from the Spanish Registry. Spanish Registry for Transplant in MM (Grupo Espanol de Trasplante Hematopoyetico - GETH) and PETHEMA. Bone Marrow Transplant 1998; 21 : 133–140.
16. Majolino I, Vignetti M, Meloni G, et al. Autologous transplantation in multiple myeloma: a GITMO retrospective analysis on 290 patients. Gruppo Italiano Trapianti di Midollo Osseo. Haematologica 1999; 84 : 844–852.
17. Bjorkstrand B. European Group for Blood and Marrow Transplantation Registry studies in multiple myeloma. Semin Hematol 2001; 38 : 219–225.
18. Sirohi B, Powles R, Mehta J, et al. An elective single autograft with high-dose melphalan: single-center study of 451 patients.Bone Marrow Transplant 2005; 36 : 19–24.
19. Siegel DS, Desikan KR, Mehta J, et al. Age is not a prognostic variable with autotransplants for multiple myeloma. Blood 1999; 38 : 219–225.
20. Barlogie B, Tricot G, Rasmussen E, et al. Total therapy 2 without thalidomide: comparison with total therapy 1: role of intensified induction and post-transplant consolidation therapies. Blood 2006; 107 : 2633–2638.
21. O’Shea D, Giles C, Terpos E, et al. Predictive factors for survival in myeloma patients who undergo autologous stem cell transplantation: a single-centre experience in 211 patients. Bone Marrow Transplant 2006; 37 : 731–737.
22. Alexanian R, Weber D, Delasalle K, et al. Clinical outcomes with intensive therapy for patients with primary resistant multiple myeloma. Bone Marrow Transplant 2004; 34 : 229–234.
23. Badros A, Barlogie B, Siegel E, et al. Results of autologous stem cell transplant in multiple myeloma patients with renal failure. Br J Haematol 2001; 114 : 822–829
24. San Miguel JF, Lahuerta JJ, Garcia-Sanz R, et al. Are myeloma patients with renal failure candidates for autologous stem cell transplantation? Hematol J 2000, 1 : 28–36.
25. Knudsen LM, Nielsen B, Gimsing P, Geisler P. Autologous stem cell transplantation in multiple myeloma: outcome in patients with renal failure. Eur J Haematol 2005; 75 : 27–33.
26. Vesole DH, Tricot G, Jaganath S, et al. Autotransplants in multiple myeloma: what have we learned? Blood 1996; 88 : 838–847.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2007 Issue 2-
All articles in this issue
- Alogenní transplantace krvetvorných buněk po přípravném režimu redukované intenzity v léčbě lymfoproliferací (výsledky ÚHKT 1999–2005)
- Stanovení chimérismu pomocí polymerázové řetězové reakce v reálném čase. Přehled a první vlastní zkušenosti
- Stanovení t(14;18) z punkční biopsie uzliny u folikulárního lymfomu a význam tzv. molekulární uzlinové remise
- První nález fenotypu Gy(a-) v České republice od jeho objevu v r. 1967. Možné příbuzenství s původními nositeli tohoto fenotypu v USA v letech 1967–1968
- Chronická B-lymfocytární leukemie Část IV: Možnosti léčby s použitím monoklonálních protilátek alemtuzumabu a rituximabu
- Autologní transplantace u 495 pacientů s mnohočetným myelomem – analýza dat z Národního registru transplantací krvetvorných buněk České republiky
- Léčba recidivující multifokální histiocytózy z Langerhansových buněk 2-chlordeoxyadenosinem u osob dospělého věku. Zkušenosti jednoho pracoviště
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Stanovení chimérismu pomocí polymerázové řetězové reakce v reálném čase. Přehled a první vlastní zkušenosti
- Autologní transplantace u 495 pacientů s mnohočetným myelomem – analýza dat z Národního registru transplantací krvetvorných buněk České republiky
- Stanovení t(14;18) z punkční biopsie uzliny u folikulárního lymfomu a význam tzv. molekulární uzlinové remise
- Léčba recidivující multifokální histiocytózy z Langerhansových buněk 2-chlordeoxyadenosinem u osob dospělého věku. Zkušenosti jednoho pracoviště
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

