-
Medical journals
- Career
Využití přístrojové technologie v rehabilitaci – zkušenosti z praxe
Authors: Ragulová M. 1; Pavlů D. 1; Dvořák T. 2
Authors‘ workplace: Katedra fyzioterapie, Fakulta tělesné výchovy a sportu, Univerzita Karlova, Praha 1; MONADA, spol. s. r. o. – Klinika komplexní rehabilitace 2
Published in: Rehabil. fyz. Lék., 29, 2022, No. 3, pp. 151-157.
doi: https://doi.org/10.48095/ccrhfl2022151Overview
Autoři v příspěvku poukazují na možnosti využití dvou přístrojů 3D scaneru a ultrazvukového vyšetření v praxi fyzioterapeuta. Na příkladu pacientky po distorzi kolenního kloubu, u níž přetrvával i po prodělaných opakovaných artroskopických operacích a absolvované, vč. stále probíhající rehabilitace, omezený rozsah kolenního kloubu, který by v daném časovém horizontu měl být již upraven, demonstrují jednoduchost a přínos těchto nových metod, které se jeví vhodným doplňkem při vyšetřovacích postupech v oblasti rehabilitace.
Klíčová slova:
ultrazvuk – rehabilitace – fyzioterapie – kolenní kloub – 3D scaner – nové metody
Úvod
Vyšetřovací postupy, se kterými pracujeme v rehabilitaci, zahrnují z převážné části metody založené na hodnocení pohledem, pohmatem a poslechem. Všechny tyto postupy jsou zatíženy velkou chybou, která vychází jednak ze strany vyšetřujícího, ale v některých případech leží i na straně vyšetřovaného. K přístrojovým vyšetřovacím metodám, které již nalezly své vlastní místo v rehabilitaci, patří elektromyografie, posturografie či kinematická analýza. Neustálý pokrok ve vývoji nových technologií však přináší v současné době také řadu dalších možností pro oblast rehabilitace. V předloženém příspěvku si dovolujeme poukázat na využití některých nových přístrojů, jež mohou být využitelné či nápomocné právě v oblasti rehabilitace. Možnost využití dvou přístrojů – 3D scaner a ultrasonografické vyšetření – demonstrujeme na kazuistice pacientky, která utrpěla distorzi kolenního kloubu.
Technologie 3D scanování
Pokrok v technologiích 3D scanování za účelem vytvoření takzvaného 3D modelu lidského těla nám dává další možnost analýzy lidského těla v jeho skutečné trojrozměrné podobě. Právě tyto možnosti mohou být s výhodou využitelné i v oblasti rehabilitace. Pozorování všech tří dimenzí (3D) místo dvou (2D) nám umožňuje např. lepší automatická antropometrická měření, detekovat změny na tvaru těla aj. [1].
Ve 3D zobrazování lze využít několik typů zobrazovacích metod. Nejvíce se používají laserové linky a strukturované světlo (SL – structured light), ale ve specifických případech se využívají více pohledové kamerové systémy a milimetrové vlny [2].
Nejen v lékařství, ale např. i v oděvním průmyslu nebo při analýze kinematického pohybu lze používat 3D celotělový scaner [1]. V tomto článku ale nevyužíváme 3D celotělový scaner, nýbrž ruční povrchový scaner Academia50.
Scaner promítá obrazec SL, podobný známému QR kódu, na povrch scanovaného objektu, v našem případě na povrch dané části těla (stehna), a snímá zakřivení tohoto obrazce na povrchu scanovaného objektu (stehna). Poziční body (reflexní značky, targety) se umístí na scanovaný objekt (stehno) nahodilým způsobem. V tomto případě čím větší nahodilost, tím lépe pro scaner. Při této nahodilosti nenastane žádný případ dvou totožných uskupení čtyř bodů na objektu (poziční model tvořený z reflektivních bodů bude v každém místě objektu jednoznačný). Vzájemná pozice jednotlivých pozičních bodů v prostoru slouží pro správné zarovnání všech snímků pořízených scanerem. Scaner provede cca 30 snímků/s, ty následně musí zarovnat vůči sobě správně (za pomocí pozičních bodů), aby byl schopen vytvořit polygonovou síť (3D model).
Výhodou 3D scaneru je zajisté jeho rychlost (snímání končetiny probíhá řádově několik sekund), nepředstavuje žádné ohrožení pro pacienta (ionizující záření) a v neposlední řadě vyšetřující nepotřebuje specifickou odbornost (se scanerem je snadné se po krátkém zacvičení naučit pracovat). Oproti tomu je nevýhodou, že scaner snímá pouze povrchové struktury, a proto „nevidíme dovnitř dané tkáně“ [3].
Muskuloskeletální ultrasonografie
Diagnostická ultrasonografie se začíná v posledních několika letech velmi využívat i v oblasti rehabilitace, a to především v podobě tzv. muskuloskeletální ultrasonografie. Přístroje pro vyšetření nalezly již na řadě klinik, ale i v privátních praxích jak lékařů, tak fyzioterapeutů, své místo a rovněž tak je dostupná řada studií, které se danou tematikou zabývají [4–9]. Nejběžnějším scanovacím formátem v diagnostické muskuloskeletální ultrasonografii je lineární scanování. Pojem lineární naznačuje, že existuje pole vytvořené z obdélníkových prvků uspořádaných do linií. Převodníky lineárního pole poskytují optimální obraz a mají zvukový paprsek kolmý na sledovanou tkáň v celém zobrazovacím poli. Ultrazvuková energie je přenášena vlnami, které mají průměrnou rychlost šíření v měkkých tkáních, kromě kostí, 1,54 mm/s nebo přibližně 3 300 mil/h [10].
Ultrazvukové vyšetření se provádí pomocí ultrazvukového měniče, což je ruční součást, která pracuje na principu piezoelektrického jevu. Ultrazvukové měniče přeměňují elektrickou energii na energii ultrazvukovou a naopak [11].
Pomocí ultrasonografie lze snadno vyšetřovat měkké tkáně (kůži, svaly, šlachy, nervy, chrupavky, vazivové struktury), ale v neposlední řadě i přítomnost tekutin uvnitř kloubu. Tato metoda je navíc levnější než v současné době již dostupnější magnetická rezonance. Kromě toho sonolog může pozorovat tkáně i během aktivního či pasivního pohybu v kloubu [12].
Kazuistika
Na příkladu kazuistiky pacientky, která prodělala v červenci 2020 distorzi levého kolenního kloubu, demonstrujeme jednoduché použití dvou pomocných přístrojových vyšetření – ruční povrchový scaner (3D scanování) a diagnostickou ultrasonografii.
Základní informace o pacientce
Pacientka (narozena 1996) prodělala tři operace levého kolenního kloubu. První operací, která proběhla v září 2020, byla artroskopie kolenního kloubu. Během ní byla provedena parciální mediální menisectomie a shaving levého kolenního kloubu. Jelikož pooperační bolesti a špatná hojivost kloubu vedly k rigiditě kolene, pacientka absolvovala na konci roku 2020 druhou operaci kolenního kloubu, během níž byl proveden redres kolene. Po tomto zákroku byla zahájena ihned celková rehabilitace, vč. individuální fyzioterapie, cílená k rozcvičení kolenního kloubu. Aplikovány byly i elektroterapeutické a vodoléčebné procedury. Po 6 týdnech individuální fyzioterapie následoval 3týdenní intenzivní pobyt na rehabilitační klinice. Jelikož bolestivost kolenního kloubu ani po druhé operaci a následné rehabilitaci neodeznívala, byla pacientka odeslána ortopedem na magnetickou rezonanci. Výsledek magnetické rezonance „laesio meniskus medialis, laesio LCA, defectus chondralis patellae gnus sin“ byl indikací k třetí operaci, která proběhla v únoru 2021, tj. za 7 měsíců od distorze. Během artroskopie došlo k uvolnění srůstů měkkých tkání v koleni, k vyrovnání a zpevnění předního zkříženého vazu.
Nyní, rok od poslední třetí operace, se celkový stav kolenního klubu zlepšil. Bolestivost kloubu je pouze občasná, spíše po ránu, kdy je kloub ztuhlý a nerozcvičený. Dochází k občasnému samovolnému tuhnutí kolene, spíše při delších statických pozicích. Rozsah pohybu v kolenním kloubu do extenze je bez omezení, ale přetrvává ještě omezená flexe jak aktivní (90°), tak pasivní (100°). Je znatelná atrofie svalů v oblasti levého stehna a lýtka a na pohled je znatelně „zbytnělý“ levý kolenní kloub oproti druhé straně.
Vzhledem ke změnám stehna, které byly velmi nápadné, jsme se kromě běžných vyšetřovacích postupů pokusili vyhodnotit i svalový objem v dané oblasti a dále provést sonografické vyšetření. Od těchto postupů jsme si slibovali, že nám pomohou lépe objasnit přetrvávající pooperační problémy, a to zejména atrofii levého stehna a omezení rozsahu pohybu v kolenním kloubu do flexe. Pomocí scaneru jsme chtěli detailněji objasnit viditelnou atrofii svalů stehna, a to přesným matematickým výpočtem v programu VX scan (v mm3). Ultrasonografii jsme zvolili proto, abychom „nahlédli“ do vlastního kolenního kloubu. Uvažovali jsme také o možnosti přítomnosti tekutiny v koleni, která by právě mohla být jednou z možných příčin, které limitovaly pacientku během probíhající terapie.
Při hodnocení svalového objemu jsme porovnávali pravou (zdravou) a levou (operovanou) dolní končetinu (DK). Pravá končetina pro nás byla výchozí hodnotou, ke které jsme vztahovali výsledek vyšetření na straně operované, a v neposlední řadě i hodnotou, která pro nás byla cílem v terapii, tj. snažili jsme se dosáhnout shodného objemu na obou DK.
Ke zjištění objemu jsme využívali ruční scaner Academia50, kterým byl proveden 3D snímek stehna. Následně byl vypočítán svalový objem stehna v programu VX model.
Při vlastním scanování se postupuje standardním způsobem, který stručně popisujeme dále. Před samotným měřením je jako první krok nutné provést kalibraci scaneru. Ta se provádí pomocí kalibrační desky, která je součástí výbavy scaneru. Kalibrace je důležitá proto, aby se scaner přizpůsobil podmínkám měření (podstatnou roli zde hraje osvětlení a okolní teplota). Po kalibraci vyšetřovaný zaujme výchozí polohu. V našem případě se pacientka položila na lehátko a proběhlo palpování tří bodů – vnitřní/vnější kondyl femuru a trochanter major, které jsou nezbytné pro následné určení rovin řezu. Mezi tyto body byly náhodně rozmístěny targety, které jsou důležité pro zacílení scanovaného obrazu během scanování (obr. 1).
Image 1. Ukázka rozložení 30 targetů na levém stehně mezi kondyly femuru a trochanterem major femoris. Targety jsou rozmístěny po celém obvodu stehna, tzn. jak na ventrální, tak na dorzální straně stehna.
Fig. 1. Demonstration of the distribution of 30 targets on the left thigh between the condyles of the femur and the greater trochanter of the femur. The targets are distributed around the entire circumference of the thigh, i.e. both on the ventral and dorsal side of the thigh.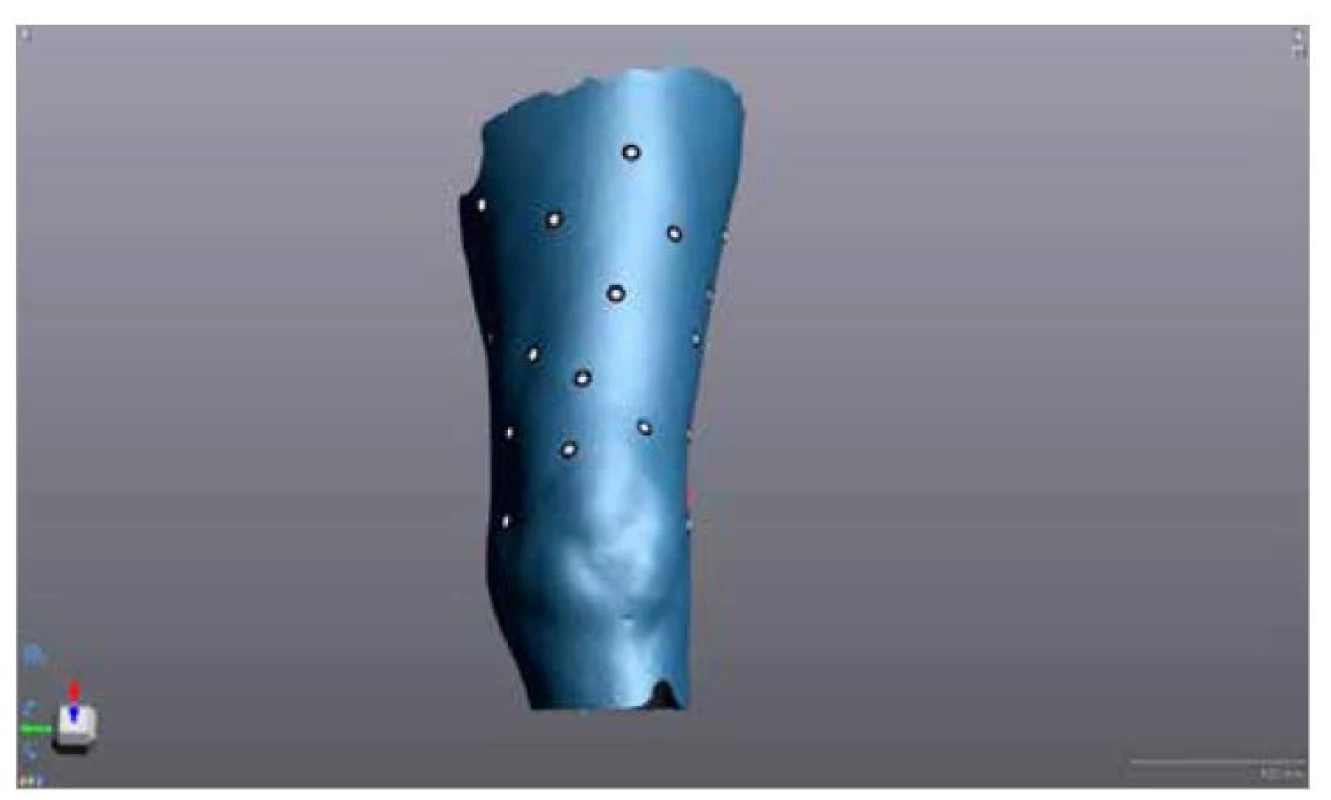
Dalším velmi důležitým krokem bylo zajištění vhodné pozice pro pacientku, protože v dané pozici musí vyšetřovaná setrvat po celou dobu scanování bez pohnutí, aby nedošlo k rozostření snímku. Naší výchozí pozicí byla pozice ve stoji, kdy pacientka byla opřená hýžděmi o okraj stolu. Natažená DK, ta, u které bylo stehno scanováno, byla mírně pokrčená v kolenním kloubu (20°). Druhá DK, prozatím nescanovaná, byla pokrčená (90° v koleni) a opřená o stoličku (obr. 2).
Image 2. Výchozí pozice pacientky během scanování s ručním skenerem Academia50.
Fig. 2. Initial patient positions during scanning with the Academia50 handheld scanner.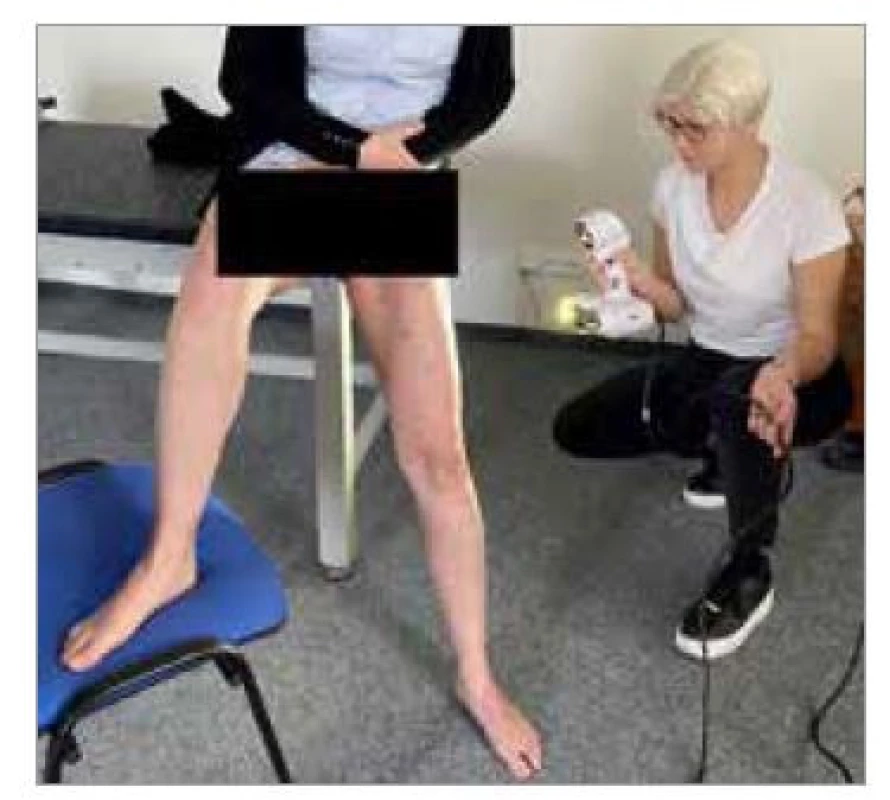
Scanování DK probíhá několik sekund a výsledný obraz je vidět ihned v programu VX elements. Pokud se snímek nepovede, nemusí se ukládat a znovu se obraz nascanuje. Po ukončení scanování se snímek odešle do programu VX model, kde probíhá samotný výpočet svalového objemu stehna. Pomocí bodů, které nám vytvoří roviny řezu, následuje samotný ořez v místě, kde chceme sledovat největší změny svalového objemu (obr. 3). V našem případě se jedná o zacílení do oblasti vastus lateralis et medialis, kde se dá změna objemu předpokládat jako největší. Bohužel scaner neumí rozpoznat jednotlivé svaly, ale pouze stehno jako celek, proto byl řez určen následovně. Spodní řez stehna byl určen vnitřním a vnějším kondylem femuru. Horní řez byl vypočítán, tentokrát v programu VX scan, a to odsazením od trochanteru major. VX scan vypočítá 3D délku mezi trochanterem major a vnějším kondylem femuru. Získanou hodnotu vynásobíme 0,8, neboť jsme si určili, že chceme zjistit svalový objem v 80 % stehna, tj. 80 % z celkového rozměru trochanter – vnější kondyl, protože v horní části stehna (konkrétně v oblasti trochanteru), nelze spolehlivě nasnímat data v celém obvodu stehna (vnitřní část horní poloviny stehna „schovaná“ za druhou nohou, dané také pozicí pacientky (sedí na stole). Určené procento (80 %) nebude mít vliv ve výsledku na svalový deficit/přírůstek hodnocené oblasti.
Image 3. Vytvoření ořezu stehna v oblasti vastii medialis et lateralis pomocí určení horní a dolní roviny řezu (výpočet se provádí v programu VX scan); v takto definovaném prostoru následně vypočítáme objem stehna v programu VX elements.
Fig. 3. Creating a cropped image of the thigh in the area of vastus medialis et lateralis by determining the upper and lower planes of the cut (calculation in VX scan program); in the defined space the volume of the thigh is calculate in the VX elements program.
Výsledné číslo zadáme v programu VX scan do vytvoření horního ořezu – vytvoření ořezu demonstruje obr. 3.
Program VX model umí i provést 2D řezy předem definovanými rovinami, odsazené o stejnou hodnotu, u kterých můžeme vypočítat obvod v daném řezu (obr. 4).
Image 4. Ukázka rozdělení stehna do jednotlivých křivek, v tomto případě bylo stehno rozděleno do 10 křivek.
Fig. 4. Demonstration of dividing the thigh into individual curves, in this case the thigh was divided into 10 curves.
Po provedení ořezu stehna dojde ihned v programu VX model k výpočtu obvodu stehna. V případě naší pacientky nás zajímaly jednotlivé obvody mezi rovinami. Celkem jsme určili 10 křivek v oblasti stehna a porovnali největší a nejmenší objem.
Scanování obou DK ukázalo, že u 3× operovaného kolene na levé DK je celkový objem stehna nižší, a to o 566 100,25 mm3 (tab. 1). Díky určení 10 křivek mezi horním a dolním ořezem stehna můžeme zhodnotit, jak se liší svalový objem mezi jednotlivými křivkami. Největší objem stehna je u křivky, která je nejvzdálenější od kondylů femuru, tudíž se nachází v 80 % 3D délky (nejkratší možná vzdálenost mezi dvěma body v prostoru, v našem případě mezi trochanterem major a vnějším kondylem femuru. Je to rozměr, který není promítnut do žádné roviny souřadného systému a není v žádné ose souřadného systému. Pro náš výpočet to není důležitý parametr, pouze definuje prostor, ve kterém počítáme).
Table 1. Výsledky svalového objemu stehna pravé (tzv. zdravé) a levé (operované) dolní končetiny.
Tab. 1. Results of the muscle volume of the thigh of the right (so-called healthy) and left (operated) lower limb.
Svalový objem je znatelně větší u pravého (zdravého) stehna, a to o 3 746,537 mm3. Naopak nejmenší objem je u nejspodnější křivky, a to v přímce mezi vnitřním a vnějším kondylem femuru. Je větší u pravého stehna, a to o 877,17 mm3. Provedené scanování nám potvrdilo naše hodnocení aspekcí a jednoduchým měřením obvodových rozměrů.
Jelikož u naší pacientky byl stále limitován rozsah pohybu v kolenním kloubu do flexe, uvažovali jsme jako jednu z možných příčin či vlivů přítomnost tekutiny uvnitř kloubu, která by mohla rovněž prohlubovat atrofii stehna, kterou jsme v předchozím vyšetření potvrdili. Proto jsme po scanování zapojili do dalšího hodnocení diagnostickou ultrasonografii.
Vyšetření probíhalo vleže na lehátku, kdy pacientka měla obě DK natažené. Vyšetřovaná DK byla navíc vypodložená pod kolenem (flexe v kolenním kloubu 20°). Aby sonda fungovala, je ještě potřeba gel, který se nanáší na sondu, a obraz se ihned převádí na obraz obrazovky. Prozkoumávali jsme oblast suprapatelární, kde bývá často pooperační tekutina, a poté oblast na vnitřní straně kolenní štěrbiny. Vyšetření opět trvá několik sekund a obraz ihned vidíme na obrazovce.
Na výsledných snímcích ultrazvuku můžeme dokumentovat potvrzení našeho předpokladu – je zde viditelná tekutina jak v oblasti suprapatelárního prostoru, tak v oblasti na vnitřní straně kolenního kloubu (obr. 5). Přítomnost tekutiny uvnitř kloubu by mohla mít vliv na nedostatečné zapojení svalů stehna během pohybu, a tím by mohla přetrvávat jejich viditelná atrofie.
Image 5. A – snímek ze sonografického vyšetření suprapatelárního prostoru; B – snímek ze sonografického vyšetření oblasti vnitřní strany kloubní štěrbiny. Oba snímky byly provedené na levé (operované) dolní končetině; červená kontura ohraničuje tekutinu přítomnou v kolenním kloubu.
Fig. 5. A – Sonographic image of the suprapatellar space; B – sonographic image of the inner side of the joint space. Both images were taken on the left (operated) lower limb; the red contour delineates the fluid present in the knee joint.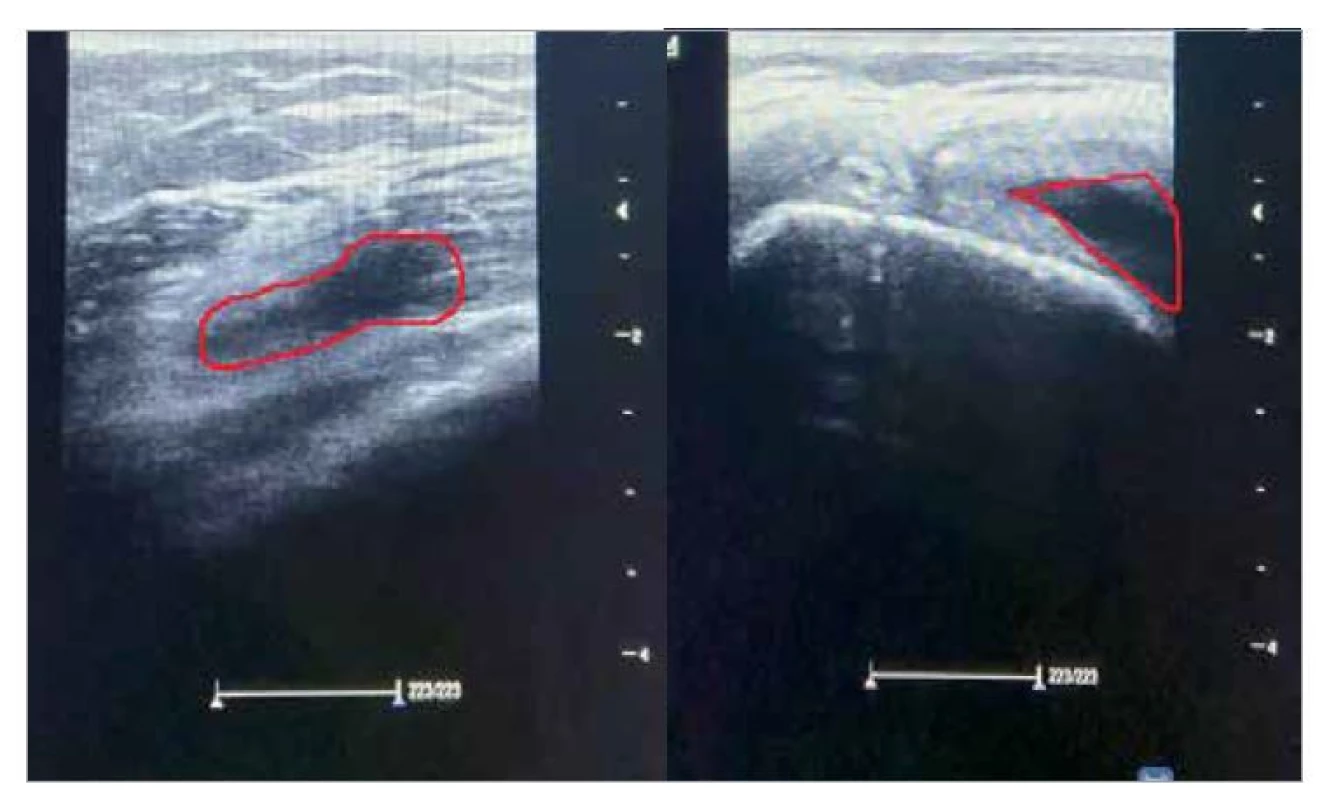
Při našem šetření se ukázalo, že objem stehna u levé DK je značně menší než u pravé DK, a to o 566 100,25 mm3. V oblasti suprapatelární a v oblasti na vnitřní straně kolenního kloubu byla vyhodnocena přítomnost tekutiny. Tyto nálezy dokumentují, že levý kolenní kloub, i přes již mnoho týdnů probíhající terapii, není ještě zcela zdravý, že převažuje atrofie svalů na levém stehně a že pacientka bude muset dále pokračovat v zavedené rehabilitaci. S odstupem času budeme moci za použití daných postupů znovu u pacientky provést shodná vyšetření a porovnat, zda nedošlo ke změně svalového objemu na levé DK a zda se přítomná tekutina nevstřebala.
Diskuze
Cílem naší práce bylo poukázat na možnosti využití 3D scaneru k vyšetření objemu DK a ultrasonografické vyšetření na příkladu pacientky, u které přetrvával i po prodělaných opakovaných artroskopických operacích a absolvované, včetně stále probíhající rehabilitace, omezený rozsah kolenního kloubu, který by v daném časovém horizontu měl být již upraven.
Postupy, se kterými běžně při fyzioterapeutickém vyšetření pracujeme, nám nedovolují „nahlédnout“ do nitra kloubu. Na stav dané oblasti – v případě naší pacientky to byla DK s hlavním zřetelem ke kolennímu kloubu, můžeme usuzovat pouze z hodnocení manuálními postupy a dále jednoduchými postupy spočívajícími v měření obvodových rozměrů. Z obvodových rozměrů DK můžeme usuzovat na změny objemu DK, ale existují postupy, kterými lze získat detailnější informace. V našem případě jsme se rozhodli pracovat s neinvazivní metodou – 3D scaner – která se velmi dobře hodí k vyšetření svalového objemu.
Je to neinvazivní metoda, která není nebezpečná, její měření je velmi rychlé, a proto i dobře využitelné v praxi. I přes jednoduchost postupů měření se však potýkáme s některými problémy při vlastním scanování. Prvním problémem je poloha pacienta. Zde je nutné, aby pacient, resp. daná část těla, která je měřena, byla po celou dobu scanování (několik sekund) bez pohybu. Pokud by se pacient pohnul, získaný obraz zůstane rozostřený. Z uvedeného důvodu zde tedy hraje roli i zkušenost vyšetřujícího, který musí být schopen uvést pacienta do takové pozice, která pro něj bude co nejpříjemnější, a přitom povede k získání kvalitního obrazu z vyšetření. Ze zkušeností vyšetřujícího souvisí i druhý problém, se kterým se můžeme setkat, a tím je vlastní manipulace s přístrojem. Ta sice není složitá, ale je důležité pracovat s přístrojem v optimální vzdálenosti od těla. Vzdálenost přístroje od povrhu scanované oblasti neovlivňuje výsledný měřený objem, ale skutečnost, že v případě nesprávné vzdálenosti přístroje od těla (příliš malá nebo naopak příliš velká) nedojde k přenesení obrazu ze scaneru do počítače. Pokud k přenosu obrazu do počítače nedojde, není možné objem vypočítat a celý postup měření je nutné opakovat.
V lékařství se zatím 3D scaner používá minimálně, jeho využití je však více známé v některých odvětvích průmyslu. Např. v reverzním inženýrství je scanování běžnou součástí. Pomocí technologie 3D scanování lze rychle a snadno naměřit i analyzovat data, která lze ihned s použitím 3D tiskárny vytisknout. Zejména je to vhodné pro produkty vyrobené z křehkých nebo měkkých materiálů, jako jsou pryžové díly nebo tenké skořepiny [13].
Může to být tím, že se o něm obecně nediskutuje a není zatím příliš v podvědomí lékařů a dalšího zdravotnického personálu. Dle nám dostupných informací se v Praze využívá 3D scaner ve FN Motol, na oddělení ortotiky, a to při léčbě kraniosynostóz. Kraniosynostóza je definována jako předčasný uzávěr lebečních švů, což může vést k deformitám hlavičky u novorozence. Pomocí 3D scaneru je možné nascanovat hlavičku novorozence a přímo přes 3D tiskárnu vyrobit na míru helmičku [14–16]. Využitím 3D scanování a následnou výrobou protéz a jiných zdravotnických pomůcek se zabývá také firma Ottobock. Scaner v tomto případě umožňuje co nejvěrněji zachytit tvar scanovaného modelu. 3D scanování si našlo své místo i v ortodoncii, a to jak při diagnostice, tak při výrobě ortodontických aparátů [17,18]. V oblasti ortopedie byl v některých studiích scaner využíván jako rychlejší a dostupnější verze magnetické rezonance při diagnostice kolenního kloubu a jeho patologických stavech [19]. Také oblast ortotiky scanuje DK pro efektivnější výrobu kolenních protéz [20].
Oproti výhodám, které 3D scaner má, musíme upozornit i na jistou nevýhodu, kterou je jeho funkční zařazení např. do pooperační fyzioterapie. Scaner nedokáže „nahlédnout dovnitř sledované tkáně“. Proto se 3D scaner ve fyzioterapii neobjede bez dalších, doplňujících vyšetření.
Druhé vyšetření, které jsme v případě naší pacientky použili, bylo právě ultrasonografické vyšetření tkání. Na rozdíl od scaneru nám pomohlo nahlédnout „dovnitř tkání“. Ultrasonografií se zobrazí měkké tkáně, kůže, svaly, nervy, chrupavky, vazivové a kostěné struktury [21–23] a lze mimo jiné také odhalit přítomnost tekutin uvnitř kloubu [24–28]. Uvedené vyšetření je schopné v kolenním kloubu zobrazit kloubní výpotek již od 5 ml. Můžeme tedy říci, že je mnohem citlivější než klinické vyšetření a díky jeho rychlosti a nenáročnosti během vyšetření nám dává lepší možnost terapeutické volby k ovlivnění výpotku v kloubu [29].
Právě tato skutečnost – odhalení přítomnosti tekutiny v kloubu – nám napomohla k odhalení jedné pravděpodobné příčiny stálé limitace rozsahu pohybu v kolenním kloubu, jakož i masivní atrofie stehna u naší pacientky. Hypotrofie svalstva m. quadriceps femoris je po poranění kolenních kloubů běžná. K největší atrofii z jeho čtyř hlav dochází u vnitřní hlavy. Spolu s objemem dochází i k úbytku svalové síly a k tomu může přispět výpotek a bolest kolenního kloubu [30]. Palmieri-Smith et al. [31] ve své studii prokázali, že až 60 ml fyziologického roztoku je schopno vyvolat snížení svalové síly o 13 %.
Ultrasonografické vyšetření je však také provázeno limitacemi, a to v případě, pokud zkoumaná oblast leží v akustickém stínu kostních struktur.
Na druhou stranu je sonografické vyšetření rychlé a nepotřebuje žádnou indikaci od lékaře, jako je tomu např. u magnetické rezonance. Nejen z tohoto důvodu začíná být velmi populární také u fyzioterapeutů a postupně se stává stále běžnější součástí vstupních i výstupních fyzioterapeutických vyšetření.
Závěr
Práce poukazuje na možnosti zařazení nových vyšetřovacích metod, 3D scaneru a diagnostické ultrasonografie do praxe. Na prezentované kazuistice pacientky po distorzi levého kolenního kloubu se ukázalo, že zařazení těchto metod může být přínosem a především vhodným doplňkem při vyšetřovacích postupech v oblasti rehabilitace. V případě prezentované kazuistiky pacientky po třech artroskopických operacích kolene bylo možné pomocí těchto jednoduchých postupů porovnat svalový objem u pravého a levého stehna a také vyhodnotit, že je v kloubu přítomná tekutina, která by mohla limitovat rozcvičení kolenního kloubu na fyziologické hodnoty.
Doručeno/Submitted: 20. 3. 2022
Přijato/Accepted: 14. 6. 2022
Korespondenční autor:
Mgr. Michaela Ragulová
Katedra fyzioterapie FTVS UK
José Martího 31
162 52 Praha 6
e-mail: michaela.ragulova@gmail.com
Sources
1. Đonlić M, Petković T, Peharec S et al. On the segmentation of scanned 3D human body models. 8th Intern Sci Conf Kinesiol 2017, Opatija, Croatia. [online]. Available from: file:///C:/Users/Uzivatel/Downloads/875035.On_the_Segmentation_of_Scanned_3D_Human_Body_Models.pdf.
2. Daanen H, Har F. 3D whole body scanners revisited. Displays 2013; 34(4): 270–275. doi: 10.1016/j.displa.2013.08.011.
3. Skenování ve 3D. Využití 3D skenování v lékařství. [online]. Dostupné z: https://www.skenovanive3d.cz/skenovani/kde-skener-vyuzit/lekarstvi/.
4. Gelb HJ, Glasgow SG, Sapega AA et al. Magnetic resonance imaging of knee disorders: clinical value and cost-effectiveness in a sports medicine practice. Am J Sports Med 1996; 24(1): 99–103. doi: 10.1177/036354659602400118.
5. Kälebo P, Swärd L., Karlsson J et al. Ultrasonography in the detection of partial patellar ligament ruptures (jumper’s knee). Skeletal Radiol 1991; 20(4): 285–289. doi: 10.1007/BF02341668.
6. Kelsch G, Ulrich C, Bickelhaupt A. Ultrasound imaging of the anterior cruciate ligament. Possibilities and limits. Unfallchirurg 1996; 99(2): 119–123.
7. Kremkau FW. Diagnostic Ultrasound. Principles and Instruments. Philadelphia: WB Saunders 1998.
8. Laine HR, Harjula A, Peltokallio P. Ultrasound in the evaluation of the knee and patellar regions. J Ultrasound Med 1987; 6(1): 33–36 doi: 10.7863/jum.1987.6.1.33.
9. Mezian K, Steyerová P, Vacek J et al. Úvod do neuromuskulární ultrasonografie. Česk Slov Neurol N 2016; 79/112(6): 656–661. doi: 10.14735/amcsnn2016656.
10. Roberts CS, Beck DJ Jr, Heinsen J et al. Review article: diagnostic ultrasonography: applications in orthopaedic surgery. Clin Orthop Relat Res 2002; 401 : 248–264. doi: 10.1097/00003086-200208000-00028.
11.Van Holsbeec MT et al. Physical principles of ultrasound imaging. In: Bralow L (ed). Musculoskeletal Ultrasound 2001; 2 : 1–7.
12. Paczesny Ł, Kruczyński J. Ultrasound of the knee. Semin Ultrasound CT MR 2011; 32(2): 114–124. doi: 10.1053/j.sult.2010.11.002.
13. Yao AWL. Applications of 3D scanning and reverse engineering techniques for quality control of quick response products. Int J Adv Manuf Technol 2005; 26(11): 1284–1288. doi: 10.1007/s00170-004-2116-5.
14. Ortotika. Kraniosynostóza. [online]. Dostupné z: https://www.ortotika.cz/kranialni-ortezy.
15. Chahaki E, Javanshir M, Saeeidi H et al. Investigating the prevalence of positional plagiocephaly with 3D scan in children under one year of age in Mofid hospital. Func Disabil J 2021; 4(1): 33–33.
16. Geoffroy M, Gardar J, Goodnough J et al. Cranial remodeling orthosis for infantile plagiocephaly created through a 3D scan, topological optimization, and 3D printing process. J Prosthet Orthot 2018; 30(4): 247–258. doi: 10.1097/JPO.0000000000000190.
17. Kim T, Cho Y, Chang M et al. Tooth segmentation of 3D scan data using generative adversarial networks. Applied Sciences 2020; 10(2): 490. doi: 10.3390/app10020490.
18. Barreto MS, Faber J, Vogel CJ et al. Reliability of digital orthodontic setups. Angle Orthod 2016; 86(2): 255–259. doi: 10.2319/120914-890.1.
19. Telfer S, Yi JS, Kweon CY et al. Monitoring changes in knee surface morphology after anterior cruciate ligament reconstruction surgery using 3D surface scanning. Knee 2020; 27(1): 207–213. doi: 10.1016/j.knee.2019.10.004.
20. Dessery Y, Pallari J. Correction: Measurements agreement between low-cost and high-level handheld 3D scanners to scan the knee for designing a 3D printed knee brace. PLoS One 2018; 13(4): e0196183. doi: 10.1371/journal.pone.0196183.
21. Richter J, Dàvid A, Pape HG et al. Diagnosis of acute rupture of the anterior cruciate ligament. Value of ultrasonic in addition to clinical examination. Unfallchirurg 1996; 99(2): 124–129.
22. Zeng H, Kang B, Liu G et al. Ultrasonographic diagnosis of bone tumor of the knee and its clinical implication. J Tongji Med Univ 2001; 21(3): 236–237, 245. doi: 10.1007/BF02886440.
23. Wada A, Fujii T, Takamura K et al. Congenital dislocation of the patella. J Child Orthop 2008; 2(2): 119–123. doi: 10.1007%2Fs11832-008-0090-4.
24. Guiral J, Rodrigo A, Tello E. Subcutaneous echinococcosis of the knee. Lancet 2004; 363(9402): 38. doi: 10.1016/S0140-6736(03)15168-9.
25. Eşen S, Akarırmak U, Aydın FY et al. Clinical evaluation during the acute exacerbation of knee osteoarthritis: the impact of diagnostic ultrasonography. Rheumatol Int 2013; 33(3): 711–717. doi: 10.1007/s00296-012-2441-1.
26. Terslev L, Qvistgaard E, Torp-Pedersen S et al. Ultrasound and Power Doppler findings in jumpers knee – preliminary observations. Eur J Ultrasound 2001; 13(3): 183–189. doi: 10.1016/S0929-8266(01)00130-6.
27. Mandl P, Brossard M, Aegerter P et al. Ultrasound evaluation of fluid in knee recesses at varying degrees of flexion. Arthritis Care Res 2012; 64(5): 773–779. doi: 10.1002/acr.21598.
28. Basha MAA, Eldib DB, Aly SA et al. Diagnostic accuracy of ultrasonography in the assessment of anterior knee pain. Insights Imaging 2020; 11(1): 107. doi: 10.1186/s13244-020-00914-2.
29. Hrazdira L (ed). Praktická muskuloskeletální ultrasonografie pro lékaře a fyzioterapeuty. Paido 2020. ISBN 978-80-7315-270-3.
30. Thomas AC, Wojtys EM, Brandon C et al. Muscle atrophy contributes to quadriceps weakness after anterior cruciate ligament reconstruction. J Sci Med Sport 2016; 19(1): 7–11. doi: 10.1016/j.jsams.2014.12.009.
31. Palmieri-Smith RM, Kreinbrink J, Ashton-Miller JA et al. Quadriceps inhibition induced by an experimental knee joint effusion affects knee joint mechanics during a single-legged drop landing. Am J Sports Med; 35(8): 1269–1275. doi: 10.1177/0363546506296417.
Labels
Physiotherapist, university degree Rehabilitation Sports medicine
Article was published inRehabilitation & Physical Medicine

2022 Issue 3-
All articles in this issue
- Vliv zvýšeného napětí závěsného aparátu žaludku na funkční zřetězení poruch v pohybovém aparátu
- Vliv biofeedbacku na aktivaci svalů pánevního dna
- Představa pohybu – neurální podstata a možnosti jejího využití ve fyzioterapii
- Biomechanický pohled na riziko pádu seniorů
- Joga – vhodná doplnková metóda onkologickej liečby?
- Využití přístrojové technologie v rehabilitaci – zkušenosti z praxe
- Rehabilitation & Physical Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Představa pohybu – neurální podstata a možnosti jejího využití ve fyzioterapii
- Vliv biofeedbacku na aktivaci svalů pánevního dna
- Vliv zvýšeného napětí závěsného aparátu žaludku na funkční zřetězení poruch v pohybovém aparátu
- Využití přístrojové technologie v rehabilitaci – zkušenosti z praxe
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

