-
Medical journals
- Career
Vyšetření spermií metodou fluorescenční in situ hybridizace
Authors: M. Vozdová; J. Rubeš
Authors‘ workplace: Výzkumný ústav veterinárního lékařství, v. v. i., Brno
Published in: Prakt Gyn 2011; 15(3-4): 162-166
Category: Review Article
Overview
Metoda fluorescenční in situ hybridizace (FISH) umožňuje stanovit frekvenci chromozomálně abnormálních spermií v ejakulátu. V minulosti byly publikovány základní hladiny disomií pro jednotlivé chromozomy (0,03–0,47 %) zjištěné metodou FISH ve spermiích normálních zdravých dárců. Celkově je u zdravých mužů asi 7 % spermií chromozomálně abnormálních, nejčastější jsou aneuploidie chromozomů 21, X a Y. Byla však zaznamenána významná individuální variabilita. Vyšší frekvence numerických aberací se často nacházejí v ejakulátu mužů s abnormálním spermiogramem, u nositelů vrozených chromozomálních abnormalit (numerické aberace pohlavních chromozomů, marker chromozomy, balancované translokace a inverze) a ve spermiích získaných TESE. Největší přínos má vyšetření spermií metodou FISH pro nositele vrozených reciprokých a Robertsonových translokací, příp. pericentrických inverzí. Publikované frekvence chromozomálně nebalancovaných spermií se pohybují v rozmezí 0–37 % u nositelů pericentrických inverzí, 3–40 % u nositelů Robertsonových translokací a až 23–81 % u nositelů reciprokých translokací. Stanovení frekvence chromozomálně abnormálních spermií umožňuje individualizaci rizika u jednotlivých pacientů, informované rozhodování páru při plánování rodičovství a predikci úspěšnosti IVF cyklu.
Klíčová slova:
spermie – FISH – chromozomové aberace – balancované translokace – inverzeÚvod
V poslední době se stále více dostávají do popředí zájmu veřejnosti témata z oblasti reprodukční medicíny a asistované reprodukce. Počet infertilních párů v celosvětovém měřítku stoupl na 15 %, přičemž minimálně v polovině případů se uplatňuje dříve často podceňovaný mužský faktor. Nezanedbatelnou část těchto pacientů pak tvoří muži s geneticky podmíněnou infertilitou. Pokud je příčinou omezení reprodukčních schopností fakt, že daný muž produkuje zvýšené množství chromozomálně abnormálních spermií, je možno jeho riziko personalizovat pomocí metody fluorescenční in situ hybridizace (FISH).
V minulých letech byly publikovány práce zaměřené na stanovení frekvence aneuploidií jednotlivých chromozomů ve spermiích. Bylo zjištěno, že až na výjimky jsou nulisomie ve spermiích častější než disomie, což by mohlo být vysvětleno možným selháním FISH. Nulisomie však byly častější i při využití starší metody in vitro penetrace křeččích oocytů lidskými spermiemi. Ve většině světových laboratoří bylo pro oblast FISH ve spermiích obecně přijato pravidlo stanovující frekvenci aneuploidií jako dvojnásobek počtu disomií. Dnes jsou známy základní hladiny disomií pro jednotlivé chromozomy, které se při striktních kritériích hodnocení pohybují v rozmezí 0,03–0,47 % [1]. Celkově je zřejmě asi 7 % spermií chromozomálně abnormálních, přičemž nejčastější jsou aneuploidie chromozomů 21, X a Y. Existuje však řada příčin, v jejichž důsledku mohou být frekvenceabnormálních spermií u některých mužů několikanásobně vyšší. Ty nejznámější budou dále podrobněji popsány. V posledních letech se vyšetření spermií metodou FISH uplatňuje především u nositelů vrozených chromozomových aberací pro stanovení frekvence parciálně a úplně disomických, nulisomických a diploidních spermií.
Metodika
Při FISH na spermiích je vždy základním předpokladem přesné stanovení karyotypu pacienta za využití všech dostupných metod (pruhování, FISH). To následně umožňuje výběr vhodné kombinace DNA sond a správnou interpretaci dat.
Pokud jde o vlastní vyšetření spermií, po obdržení vzorku ejakulátu získaného masturbací následujezákladní spermatologické vyšetření, tj. především stanovení koncentrace, motility a procenta morfologicky normálních spermií dle manuálu WHO [2]. Vzorky pro vyšetření FISH pak mohou být bez kryokonzervace zamraženy a uchovány v kapalném dusíku nebo při -80 °C. Před vlastní FISH je nutno vzorky rozmrazit, připravit a fixovat nátěry o optimální koncentraci spermií a dekondenzovat jaderný chromatin pomocí dithiothreitolu nebo NaOH. Dekondenzace je nezbytná pro zpřístupnění DNA spermií pro sondy uvolněním disulfidických můstků v protaminech, což jsou bazické jaderné proteiny, které během spermatogeneze postupně nahrazují histony. Fixace a dekondenzace je nutná i při přípravě preparátů obsahujících spermie získané od azoospermických pacientů pomocí testikulární extrakce spermií (TESE). Při FISH se využívá kombinace dvou až pěti různě značených DNA sond. Podle typu se uplatňují sondy centromerické, telomerické, příp. lokus specifické. Hodnocení probíhá podle striktních kritérií [3] ve fluorescenčním mikroskopu vybaveném fázovým kontrastem (obr. 1). Pro zaručení vysoké výpovědní hodnoty je nutné vyšetřit nejméně 1 000 až 10 000 spermií. Pak je možné provést i statistické vyhodnocení srovnáním frekvence chromozomálně abnormálních spermií s výsledky získanými u kontrolních dárců.
Image 1. FISH u pacienta s reciprokou translokací. Spermie normální/balancované (A) a nebalancované (B, C). 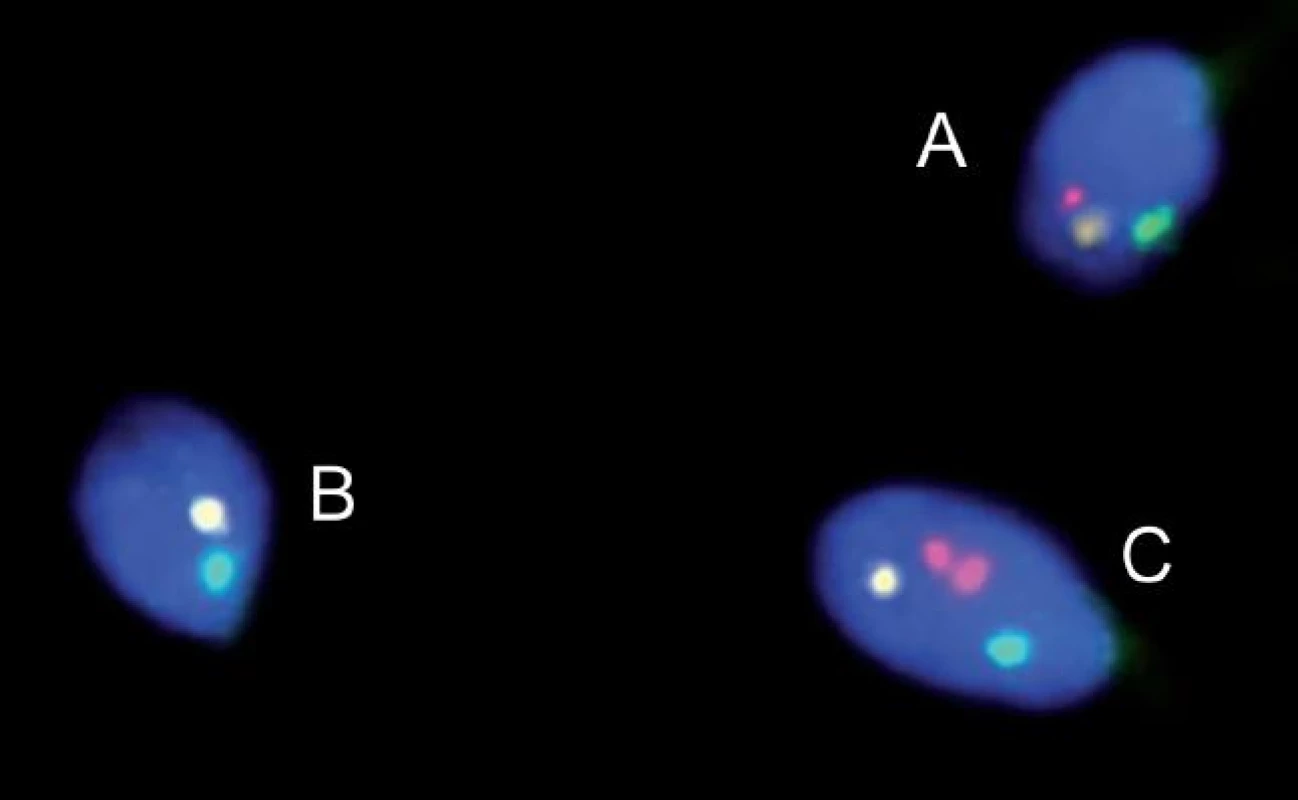
Využití
A. Muži s normálním karyotypem
Již v prvních pracích zabývajících se frekvencí aneuploidií ve spermiích byla pozorována významná inter - a intraindividuální variabilita. Bylo zjištěno, že se frekvence aneuploidií zvyšuje působením vlivů prostředí i s věkem vyšetřovaného, někteří muži navíc vykazují při opakovaných odběrech stabilně zvýšené frekvence některých numerických abnormalit [4,5].
1. Genotoxické vlivy
Práce zaměřené na studium genotoxických vlivů na reprodukční aparát mužů prokázaly zvýšení frekvence aneuploidií při znečištění životního prostředí genotoxickými polutanty [6] a vystavení organizmu genotoxickým látkám na pracovišti (chemické provozy, pesticidy) [7], dále pak u onkologických pacientů [8]. V neposlední řadě je nutné zmínit kouření jako jeden z rizikových faktorů pro narušení meiotických procesů a správné segregace chromozomů během gametogeneze [9].
2. Reprodukční medicína
Vyšší frekvence numerických aberací se často nacházejí u mužů s abnormálním spermiogramem. Zájem o vyšetření gamet u této skupiny pacientů byl odstartován zavedením metody intracytoplazmatické injekce spermií (ICSI), která umožňuje mít biologicky vlastní dítě i mužům se závažnými abnormalitami spermiogramu. Byly publikovány práce vypovídající o možnostech predikce úspěšnosti IVF cyklu u těchto pacientů na základě vyšetření spermií metodou FISH, neboť v cyklech párů s vysokou frekvencí chromozomálně abnormálních spermií byla pozorována snížená četnost implantace, vyšší četnost aneuploidních embryí při PGD a vyšší riziko spontánního abortu [10,11].
Zvláštní skupinou pacientů s poruchou spermatogeneze jsou muži s neobstrukční azoospermií. U nich lze získat spermie vhodné pro oplození přímo z varlete metodou TESE (testicular sperm extraction), avšak o chromozomální konstituci těchto gamet je dosud známo jen minimum informací. Obecně jsou zřejmě ve spermiích získaných TESE chromozomální abnormality častější než ve spermiích ejakulovaných, a to i u fertilních mužů [12,13]. To naznačuje zvýšené riziko vzniku aneuploidních embryí při použití testikulárních spermií pro ICSI.
B. Muži s abnormálním karyotypem
1. Nositelé numerických abnormalit
Přítomnost vrozené numerické chromozomální abnormality v lidském karyotypu je většinou spojena se závažným zdravotním postižením, které je pro daného jedince letální, nebo jej vyřazuje z běžného života (trisomie chromozomů 13, 18, 21). Výjimku tvoří numerické aberace pohlavních chromozomů.
Pokud jde o muže s karyotypem 47,XYY („super-male“), je známo, že v jejich testikulární tkáni jsou obsaženy jak buňky 47,XYY, tak 46,XY, které vstupují do meiózy. Avšak většina aneuploidních spermatocytů a spermatid je před dokončením spermatogeneze eliminována apoptózou [14]. Produkce disomických spermií 24,XY a 24,YY je pak sice oproti mužům s normálním karyotypem zvýšená, ale nižší než 1 % [15].
V případě karyotypu 47,XXY (Klinefelterův syndrom) je naproti tomu pravidlem výrazné narušení spermatogeneze a azoospermie. Spermatogeneze bývá zřejmě dokončena pouze u jedinců s testikulární mozaikou 46,XY/47,XXY [16]. Jak už bylo zmíněno výše, přinesl rozvoj metod asistované reprodukce (využití ICSI po TESE) naději na početí potomka i pro muže s úplnou azoospermií. Obecně platí, že pacientis Klinefelterovým syndromem mají zvýšené riziko vzniku abnormálních gamet a embryí a při asistované reprodukci je u nich na místě provedení preimplantační genetické diagnostiky [17].
2. Nositelé nadpočetných (marker) chromozomů
Přítomnost nadpočetného (marker) chromozomu v karyotypu se většinou nepojí s žádným zdravotním postižením daného jedince, představuje však riziko pro potomstvo. Pro stanovení rizika je vždy nejprve nutné přesně určit, ze kterého chromozomu marker chromozom vznikl (nejlépe FISH s malovací sondou po mikrodisekci a naznačení DNA markeru). Od toho se pak odvíjí volba vhodných sond pro FISH na spermiích. Vzhledem k tomu, že přítomností nadpočetného chromozomu bývá narušeno meiotické párování a segregace obou normálních homologů chromozomového páru, ze kterého marker chromozom pochází, vzniká u těchto pacientů zvýšené množství aneuploidních gamet [18]. Až 50 % marker chromozomů pochází z chromozomu 15, což s sebou přináší v případě vzniku trisomické zygoty i riziko následné paternální uniparentální disomie chromozomu 15 spojené s projevy Angelmanova syndromu.
3. Nositelé vrozených balancovaných přestaveb chromozomů (Robertsonovy a reciproké translokace, inverze)
Stanovení frekvence nebalancovanýchspermií metodou FISH ve spermiích mužů s vrozenými balancovanými přestavbami chromozomů umožňuje stanovit riziko vzniku nebalancovaného karyotypu u plodu, kvalifikovaně rozhodnout o přínosu preimplantační genetické diagnostiky a predikovat úspěšnost IVF cyklu [19].
Balancované translokace
Robertsonovy a reciproké balancované translokace se v novorozenecké populaci vyskytují s frekvencí asi 0,2 %, avšak jejich četnost vzrůstá v případě infertilních párů až na 9,2 % u párů s opakovanými potraty [20]. Jejich přítomnost v karyotypu zůstává většinou skryta, až v reprodukčním období se může objevit snížení fertility různého stupně, od poruch spermatogeneze přes opakované spontánní aborty až po porod postiženého dítěte s nebalancovaným karyotypem. Chromozomové páry zahrnuté v translokaci během prvního meiotického dělení formují trivalent (u Robertsonových translokací) nebo kvadrivalent (u reciprokých translokací). Příčinou poruch reprodukce pak bývá narušení meiózy nebo meiotická segregace chromozomů trivalentu, resp. kvadrivalentu za vzniku gamet nesoucích parciální a úplné disomie a nulisomie chromozomů zúčastněných na translokaci [21] (obr. 2, 3).
Image 2. Robertsonova translokace. Meiotické párování (A) a chromozomy v gametách: normálních (B), balancovaných (C) a nebalancovaných (D). 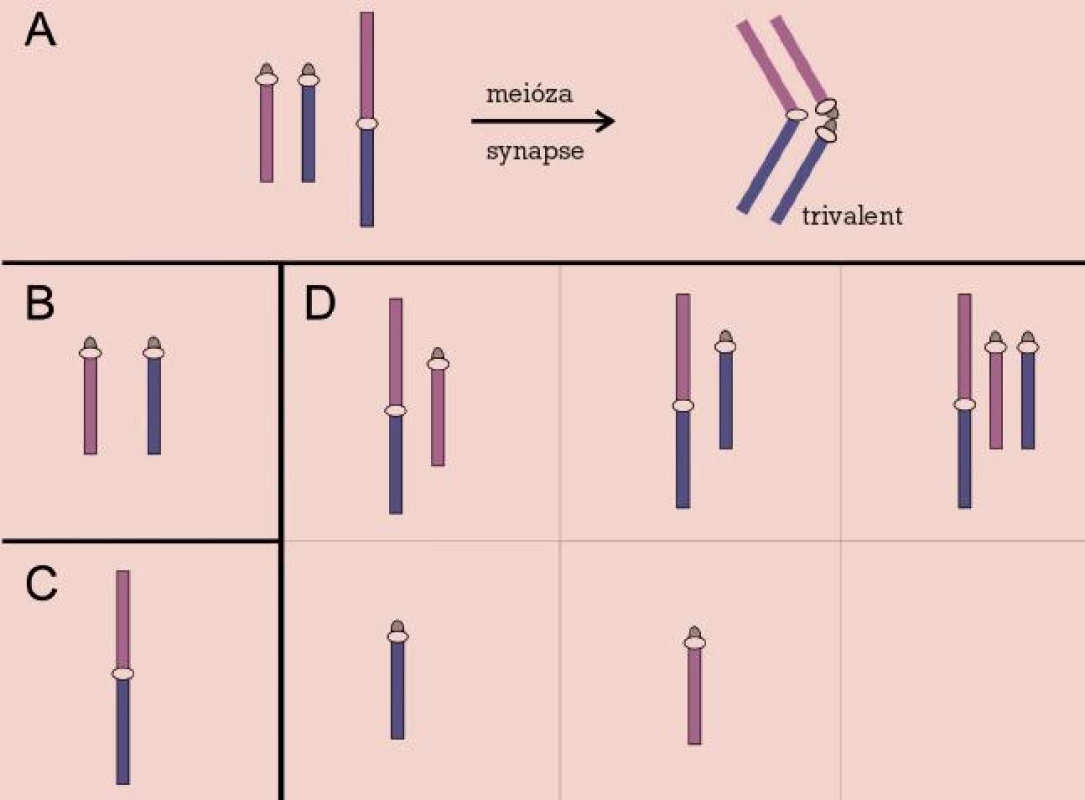
Image 3. Reciproká translokace. Meiotické párování (A) a chromozomy v gametách: normálních (B), balancovaných (C) a nebalancovaných (D). 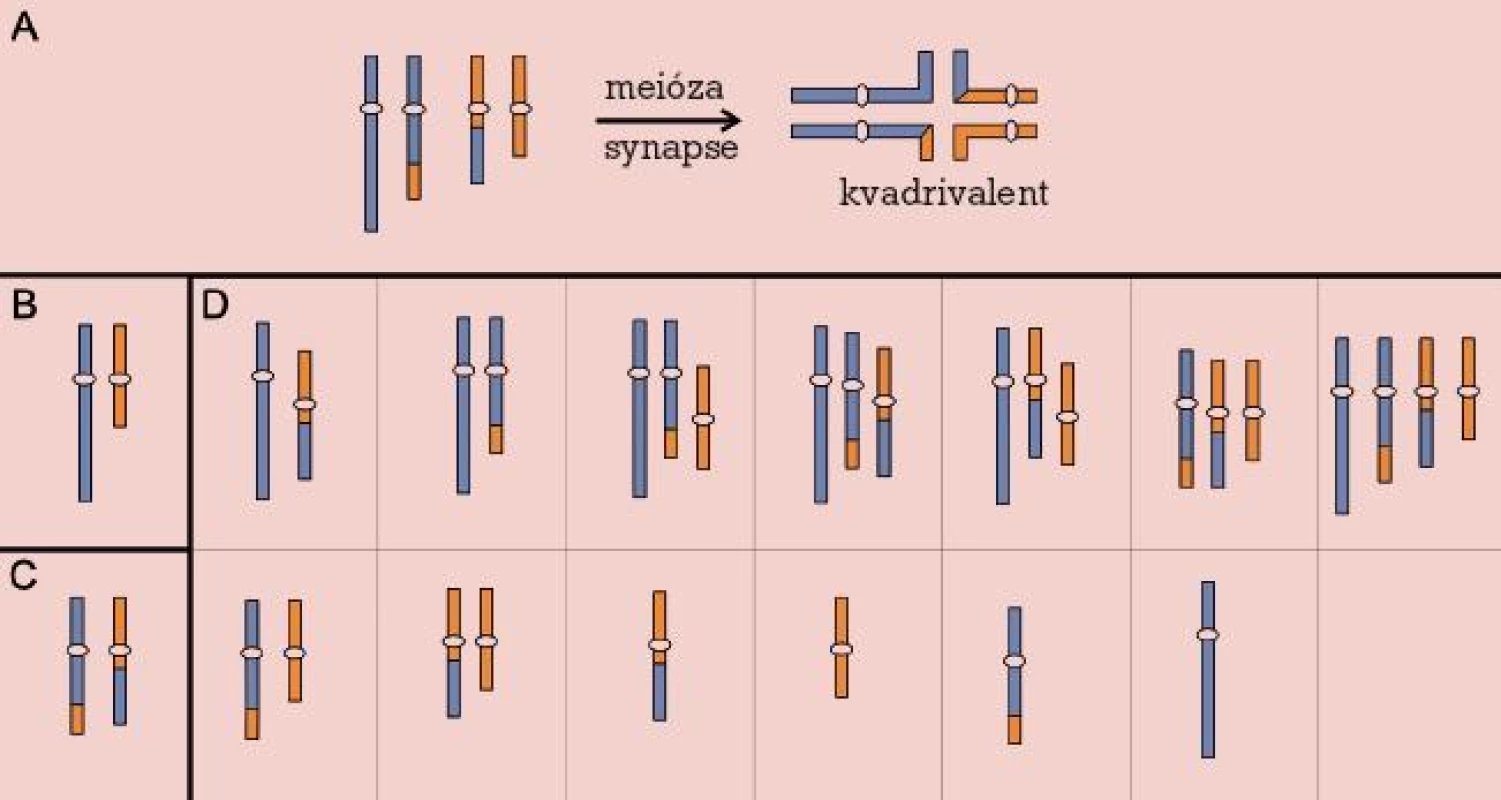
U některých nositelů balancovaných translokací bylo navíc pozorováno zvýšené množství spermií aneuploidních pro jiné chromozomy než ty, které byly zahrnuty v translokaci [22]. Jde o tzv. interchromozomální vliv translokací. Jeho podstatou je narušení meiotického párování a segregace chromozomů v důsledku interakce trivalentů a kvadrivalentů s jinými částečně nespárovanými bivalenty. Pokud nedojde k zastavení meiózy činností kontrolních mechanizmů, je výsledkem nondisjunkce a vznik aneuploidních gamet.
Robertsonovy translokace (centrické fúze akrocentrických chromozomů, nejčastěji 13 a 14) jsou nejčetnější vrozené strukturní abnormality. U většiny jejich nositelů byla pozorována oligospermie jako důsledek vážného narušení spermatogeneze. Publikované frekvence chromozomálně abnormálních spermií leží u těchto pacientů v rozmezí 3–40 % [23]. Tomu odpovídají i data získaná na našem pracovišti, kde bylo při vyšetření 13 infertilních mužů s Robertsonovými translokacemi nalezeno 5,8–23,5 % nebalancovaných spermií.
Z hlediska klinické praxe je na tomto místě nutné zmínit, že nebalancovaný karyotyp u plodu byl prenatální diagnostikou zatím prokázán pouze v rodinách, kde byla nositelkou Robertsonovy translokace matka, a riziko pro otce - nositele je tedy zřejmě nízké [24,25].
Reciproké translokace, tedy vzájemné výměny částí ramen chromozomů, jsou naproti tomu známým rizikovým faktorem pro početí a narození postiženého potomka s nebalancovaným karyotypem. Frekvence nebalancovaných spermií jsou u jejich nositelů udávány v širokém rozmezí 23–81 % a závisí na zúčastněných chromozomech, pozici zlomů, frekvenci meiotické rekombinace a poloze chiazmat [26]. Na našem pracovišti bylo dosud vyšetřeno 35 nositelů reciprokých translokací a zjištěné frekvence nebalancovaných spermií se pohybovaly v rozmezí 40–70 % [27,28]. Pro tyto rodiny je nepochybně velkým přínosem preimplantační genetická diagnostika, která umožňuje vybrat pro embryotransfer pouze embrya s normálním/balancovaným karyotypem.
Inverze
Genetické vyšetření spermií metodou FISH je přínosem i pro nositele pericentrických inverzí zastoupených v populaci s frekvencí 1–2 %. Podobně jako ostatní vrozené balancované aberace nebývají spojeny se zdravotním postižením daného jedince, mohou však představovat riziko při jeho reprodukci. Důvodem je fakt, že po meiotické rekombinaci mezi normálním a invertovaným homologem vznikají gamety s parciální duplikací a delecí koncových částí tohoto chromozomu (obr. 4). Množství nebalancovanýchgamet přímo závisí na velikosti invertovaného úseku. Literatura udává při minimální délce inverze 30–50 % délky chromozomu frekvenci spermií s parciální duplikací a delecí až 37,4 % [29]. Riziko u menších inverzí je zanedbatelné.
Image 4. Inverze. Chromozom normální (A), invertovaný (B) a rekombinovaný (C, D). 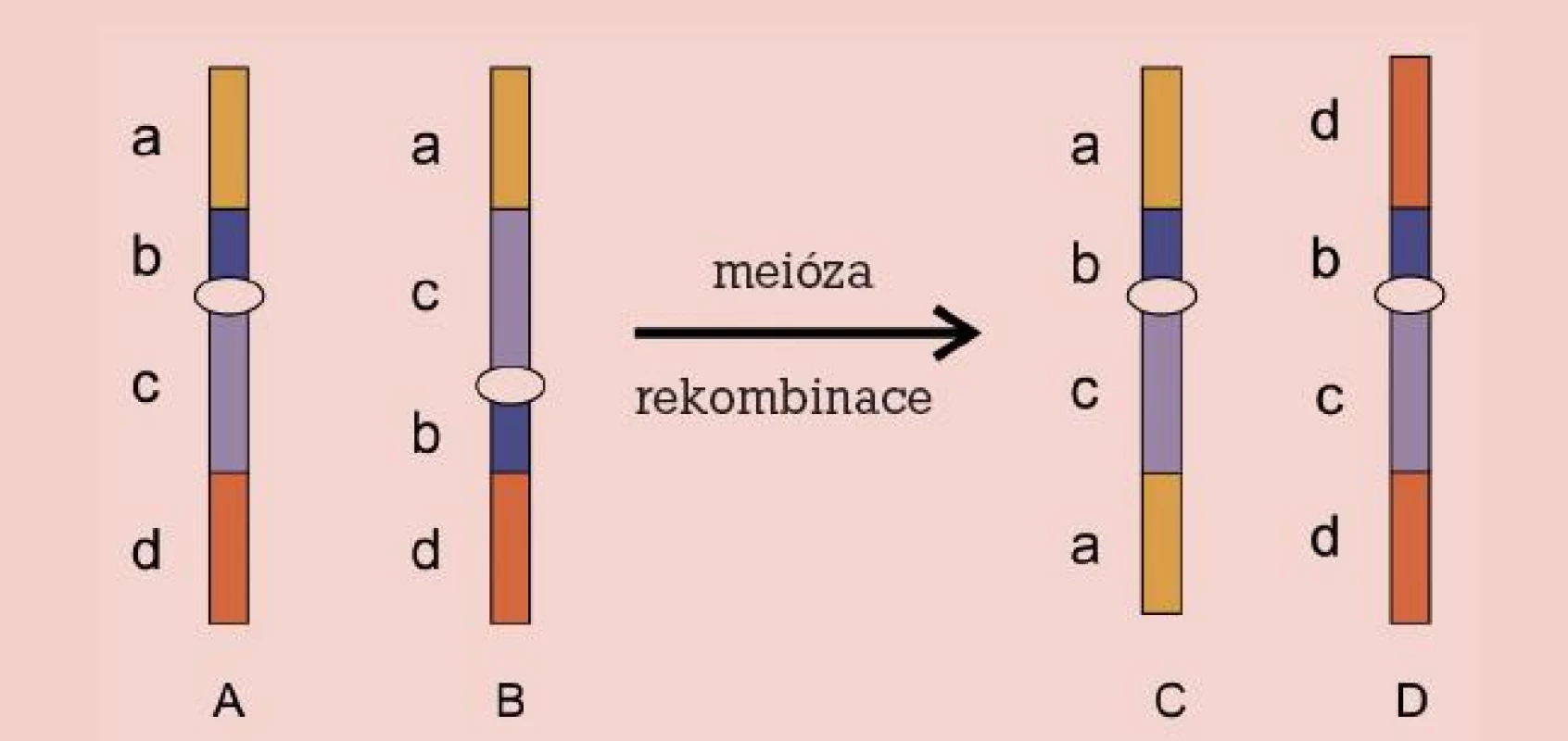
Pokud jde o příbuzné paracentrické inverze (invertovaný úsek neobsahuje centromeru), u nich po meiotické rekombinaci vznikají acentrické a dicentrické chromozomy, jejichž přítomnost vede k zastavení meiotického dělení. Jsou produkovány pouze gamety s normální sestavou chromozomů a riziko pro potomstvo není zvýšené.
Závěr
Vyšetření spermií metodou FISH obecně poskytuje cenné informace při léčbě mužské infertility a v případě nositelů vrozených chromozomových aberací představuje významné rozšíření možností genetického poradenství. Tímto vyšetřením je možné individualizovat riziko početí potomka s abnormálním karyotypem, a proto nalézá uplatnění při plánování rodičovství v těchto rodinách. Stanovení frekvence geneticky abnormálních spermií umožňuje informované rozhodování páru o volbě optimální metodiky asistované reprodukce (preimplantační genetická diagnostika, semeno dárce) a predikci úspěšnosti IVF cyklu.
Práce byla podpořena grantem IGA MZ ČR č. NS9842-4/2008.
Doručeno do redakce: 5. 5. 2011
Přijato po recenzi: 18. 7. 2011
Mgr. Miluše Vozdová, Ph.D.
Výzkumný ústav veterinárního lékařství, v.v.i., Brno
vozdova@vri.cz
Sources
1. Templado C, Bosch M, Benet J. Frequency and distribution of chromosome abnormalities in human spermatozoa. Cytogenet Genome Res 2005; 111(3–4): 199–205.
2. WHO laboratory manual for the examination and processing of human semen. 5th ed. Geneva: WHO 2010.
3. Rubes J, Vozdova M, Robbins WA et al. Stable variants of sperm aneuploidy among healthy men show associations between germinal and somatic aneuploidy. Am J Hum Genet 2002; 70(6): 1507–1519.
4. Rubes J, Vozdova M, Oracova E et al. Individual variation in the frequency of sperm aneuploidy in humans. Cytogenet Genome Res 2005; 111(3–4): 229–236.
5. Tempest HG, Ko E, Rademaker A et al. Intra-individual and inter-individual variations in sperm aneuploidy frequencies in normal men. Fertil Steril 2009; 91(1): 185–192.
6. Perreault SD, Rubes J, Robbins WA et al. Evaluation of aneuploidy and DNA damage in human spermatozoa: applications in field studies. Andrologia 2000; 32(4–5): 247–254.
7. Härkönen K. Pesticides and the induction of aneuploidy in human sperm. Cytogenet Genome Res 2005; 111(3–4): 378–383.
8. Tempest HG, Ko E, Chan P et al. Sperm aneuploidy frequencies analysed before and after chemotherapy in testicular cancer and Hodgkin’s lymphoma patients. Hum Reprod 2008; 23(2): 251–258.
9. Rubes J, Lowe X, Moore D 2nd et al. Smoking cigarettes is associated with increased sperm disomy in teenage men. Fertil Steril 1998; 70(4): 715–723.
10. Sánchez-Castro M, Jiménez-Macedo AR, Sandalinas M et al. Prognostic value of sperm fluorescence in situ hybridization analysis over PGD. Hum Reprod 2009; 24(6): 1516–1521.
11. Rubio C, Gil-Salom M, Simón C et al. Incidence of sperm chromosomal abnormalities in a risk population: relationship with sperm quality and ICSI outcome. Hum Reprod 2001; 16(10): 2084–2092.
12. Rodrigo L, Rubio C, Peinado V et al. Testicular sperm from patients with obstructive and nonobstructive azoospermia: aneuploidy risk and reproductive prognosis using testicular sperm from fertile donors as control samples. Fertil Steril 2011; 95(3): 1005–1012.
13. Gianaroli L, Magli MC, Cavallini G et al. Frequency of aneuploidy in sperm from patients with extremely severe male factor infertility. Hum Reprod 2005; 20(8): 2140–2152.
14. Milazzo JP, Rives N, Mousset-Siméon N et al. Chromosome constitution and apoptosis of immature germ cells present in sperm of two 47,XYY infertile males. Hum Reprod 2006; 21(7): 1749–1758.
15. Shi Q, Martin RH. Multicolor fluorescence in situ hybridization analysis of meiotic chromosome segregation in a 47,XYY male and a review of the literature. Am J Med Genet 2000; 93(1): 40–46.
16. Yamamoto Y, Sofikitis N, Mio Y et al. Morphometric and cytogenetic characteristics of testicular germ cells and Sertoli cell secretory function in men with non-mosaic Klinefelter’s syndrome. Hum Reprod 2002; 17(4): 886–896.
17. Staessen C, Tournaye H, Van Assche E et al. PGD in 47,XXY Klinefelter’s syndrome patients. Hum Reprod Update 2003; 9(4): 319–330.
18. Oracova E, Musilova P, Kopecna O et al. Sperm and embryo analysis in a carrier of supernumerary inv dup(15) marker chromosome. J Androl 2009; 30(3): 233–239.
19. Escudero T, Abdelhadi I, Sandalinas M et al. Predictive value of sperm fluorescence in situ hybridization analysis on the outcome of preimplantation genetic diagnosis for translocations. Fertil Steril 2003; 79 (Suppl 3): 1528–1534.
20. Stern C, Pertile M, Norris H et al. Chromosome translocations in couples with in-vitro fertilization implantation failure. Hum Reprod 1999; 14(8): 2097–2101.
21. Morel F, Douet-Guilbert N, Le Bris MJ et al. Meiotic segregation of translocations during male gametogenesis. Int J Androl 2004; 27(4): 200–212.
22. Douet-Guilbert N, Bris MJ, Amice V et al. Interchromosomal effect in sperm of males with translocations: report of 6 cases and review of the literature. Int J Androl 2005; 28(6): 372–379.
23. Roux C, Tripogney C, Morel F et al. Segregation of chromosomes in sperm of Robertsonian translocation carriers. Cytogenet Genome Res 2005; 111(3–4): 291–296.
24. Boué A, Gallano P. A collaborative study of the segregation of inherited chromosome structural rearrangements in 1356 prenatal diagnoses. Prenat Diagn 1984; 4 : 45–67.
25. Engels H, Eggermann T, Caliebe A et al. Genetic counseling in Robertsonian translocations der(13;14): frequencies of reproductive outcomes and infertility in 101 pedigrees. Am J Med Genet A 2008; 146A(20): 2611–2616.
26. Benet J, Oliver-Bonet M, Cifuentes P et al. Segregation of chromosomes in sperm of reciprocal translocation carriers: a review. Cytogenet Genome Res 2005; 111(3–4): 281–290.
27. Vozdova M, Oracova E, Horinova V et al. Sperm fluorescence in situ hybridization study of meiotic segregation and an interchromosomal effect in carriers of t(11;18). Hum Reprod 2008; 23(3): 581–588.
28. Vozdova M, Oracova E, Gaillyova R et al. Sperm meiotic segregation and aneuploidy in a 46,X,inv(Y), t(10;15) carrier: case report. Fertil Steril 2009; 92(5): 1748.e9–1748.e13.
29. Anton E, Blanco J, Egozcue J et al. Sperm studies in heterozygote inversion carriers: a review. Cytogenet Genome Res 2005; 111(3–4): 297–304.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inPractical Gynecology

2011 Issue 3-4-
All articles in this issue
- Genetická predikce osteoporózy v klinické praxi
- Prevence postpartální hemoragie u císařského řezu carbetocinem
- Analoga gonadoliberinu v léčbě infertility
- Cílená – biologická léčba karcinomu ovaria
- Vyšetření spermií metodou fluorescenční in situ hybridizace
- Prevence dědičného rizika nádorů prsu a ovaria
- Sayana – nová tvář klasického depotního medroxyprogesteron acetátu
- Císařský řez, ale jaká anestezie?
- Liečba rekurentného karcinómu ovária
- Vývoj spontánnych potratov na Slovensku v rokoch 1997–2009
- Príčiny závažných foriem ovariálneho hyperstimulačného syndrómu u hospitalizovaných pacientok
- Operační techniky a legislativní podmínky sterilizace žen v České republice
- Donošená vysoká kornuální gravidita
- Prolaps dělohy a pochvy přes Mayerův podpůrný pesar
- 13th World Congress on Menopause
- Inhibítory aromatázy v liečbe karcinómu prsníka: prehľad a možné prínosy u žien pred menopauzou
- Practical Gynecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Prolaps dělohy a pochvy přes Mayerův podpůrný pesar
- Analoga gonadoliberinu v léčbě infertility
- Donošená vysoká kornuální gravidita
- Príčiny závažných foriem ovariálneho hyperstimulačného syndrómu u hospitalizovaných pacientok
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

