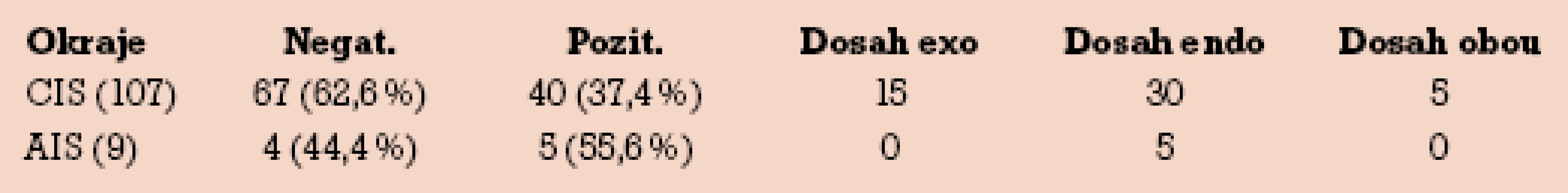-
Medical journals
- Career
Stav okrajů konizací s histologickým nálezem carcinoma in situ
: P. Freitag
: Gynekologicko‑porodnická klinika 1. LF UK a VFN v Praze
: Prakt Gyn 2010; 14(1): 10-13
: Original Article
Retrospektivně analyzován soubor 116 konizací s histologickým nálezem carcinoma in situ. Pozitivní okraje byly zjištěny v 37,4 % dlaždicových a 55,6 % žlázových carcinoma in situ. Dvakrát častěji se vyskytl dosah endocervikálního oproti exocervikálnímu okraji. Kyretáž proximálního kanálu děložního hrdla poskytla v části případů nediagnostický materiál. Závažnější je endocervikální pozitivní okraj a jeho management musí být aktivnější. Přibližně v polovině případů reoperací pro pozitivní okraje byl histologický nález reoperace negativní. Diskutovány požadavky na adekvátní provedení konizace, možnosti minimalizace výskytu pozitivních okrajů a jejich management.
Klíčová slova:
konizace – carcinoma in situ – stav okrajůÚvod
Carcinoma in situ je nejzávažnější formou preinvazivních lézí děložního hrdla. V Richartově klasifikaci je zahrnut do kategorie cervikální intraepiteliální neoplazie 3. stupně – CIN 3. Spolu s CIN 2 nálezy patří do skupiny high‑grade lézí. Podle posledních údajů Národního onkologického registru (2005) byla jeho incidence v České republice 33,08/100 000 žen za rok, což představovalo 1 736 hlášených případů s diagnózou D06.9. Tento údaj je třeba chápat pouze jako orientační, protože je ovlivněn přístupem histopatologických laboratoří – některé striktně reflektují Richartovu klasifikaci, jiné v rámci CIN 3 nálezu verbálně a kódově specifikují nejzávažnější CIN 3 léze jako carcinoma in situ.
Carcinoma in situ (CIS) se vyskytuje ve dvou základních histologických variantách – dlaždicové (spinocelulární, skvamózní) a žlázové (adenocarcinoma in situ). Podezření na přítomnost těchto nejzávažnějších forem cervikální intraepiteliální neoplazie je obvykle vysloveno na základě prebioptických nálezů – onkologické cytologie a kolposkopie. Cytologický nález HSIL (high‑grade skvamózní intraepiteliální léze) spolu s kolposkopickými znaky high‑grade léze indikují jako adekvátní a relevantní přístup provedení konizace, která posléze může potvrdit jako histologický podklad léze dlaždicový carcinoma in situ. Obtížnější je diagnostika žlázových lézí – adenokarcinomu in situ (AIS). Cytologický nález atypických žlázových buněk AGC‑AIS (někdy AGC‑NEO či opakovaně AGC‑NOS) je zjištěn jen v části případů, mnohdy k diagnóze vede jen častý současný výskyt dlaždicové high‑grade léze (mixed prekancerózy). Kolposkopické znaky charakteristické pro žlázové léze byly opakovaně popsány, v praxi však jsou jen zřídka zjištěny a jejich senzitivita a specifita pro diagnózu AIS je nízká [1].
Pro další management zjištěných nálezů CIS je důležitý věk nemocných a jejich případný zájem na zachování reprodukčních funkcí. Kromě těchto faktorů je však stejně důležité adekvátní provedení konizace „in sano“ a podrobné histologické zpracování konu. Stav okrajů je nejvýznamnějším podkladem pro rozhodování o dalším postupu. Histologický nález musí obsahovat jak popis exocervikálního okraje (na bázi konu), tak endocervikálního (apikálního) okraje. Jen volné okraje (free margins) jsou výrazem adekvátního rozsahu provedené operace a předpokladem následného konzervativního přístupu. Významné je rovněž zhodnocení stavu sliznice proximálního kanálu hrdla nad apexem konu, ať už je užita kyretáž hrdla, punch biopsie či minikonus nad vrcholem konického defektu děložního hrdla. Předmětem práce je především analýza stavu okrajů provedených konizací pro diagnózu CIS.
Materiál a metodika
V letech 2007–2008 bylo na Gynekologicko‑porodnické klinice 1. LF UK a Všeobecné fakultní nemocnice v Praze provedeno celkem 842 konizací. Histologický nález CIN 3/CIS byl zjištěn u 448 nemocných, tj. v 53,2%. K retrospektivní analýze bylo vybráno všech 116 případů hodnocených jako carcinoma in situ: 107 případů dlaždicového CIS (92,2% všech CIS) a 9 případů žlázového – adenocarcinoma in situ (AIS) (7,8%). Výkony byly prováděny několika operatéry onkogynekologického centra kliniky, radiofrekvenčními kličkami nebo jehlou (cylindrické disekce), elektrochirurgickou jednotkou Alsatom‑MB1/A‑MC.
Podle histologického popisu jsme sledovali okraje konizátu (nebo cylindrické disekce) – jako pozitivní jsme zařadili všechny případy uvedeného dosahu do okraje či popisu dosahu „téměř do okraje“ konu. Rozlišili jsme dosah do exocervikálního, endocervikálního či obou okrajů. Dále jsme sledovali histologické nálezy z provedené kyretáže proximálního kanálu děložního hrdla. U všech případů následných reoperací jsme hodnotili histologické nálezy těchto výkonů. Všechny sledované parametry byly sledovány zvlášť pro dlaždicový a žlázový carcinoma in situ. V diskuzi hodnotíme možnosti minimalizace rizika výskytu pozitivních okrajů a následný management v případě jejich výskytu.
Výsledky
Výskyt pozitivních okrajů pro dlaždicový a žlázový CIS a rozlišení exocervikálního a endocervikálního dosahu (či dosahu obou okrajů) uvádí tab. 1.
Ne vždy dosahuje do okraje léze právě carcinoma in situ. V případě exocervikálního dosahu to byl z 15 případů 1× CIN 2 a 14× CIN 3/CIS nález. V případě endocervikálního dosahu to byl z 30 případů dlaždicového CIS v okraji 2× CIN 2 a 28× CIN 3/CIS, v 5 případech AIS to byl vždy též nález AIS.
Histologické nálezy kyretáže proximálního kanálu děložního hrdla uvádí tab. 2.
2. Histologické nálezy kyretáže proximálního kanálu děložního hrdla. 
V některých případech byl získaný materiál nediagnostický (bez přítomnosti hodnotitelného cylindrického epitelu endocervixu). Pozitivní nálezy odhalují přesah léze výše do endocervikálního kanálu.
Tab. 3 uvádí přehled histologických nálezů z reoperací (rekonizací či cylindrických disekcí nebo hysterektomií) při nálezu pozitivních okrajů konizátu. Častý výskyt již zcela negativního nálezu (nepřítomnosti CIN) v reoperaci znamená, že popsaný dosah nebyl současně přesahem.
3. Histologické nálezy reoperací pro pozitivní okraj konizace (reoperováno 26 ze 40 dlaždicových CIS – 65 % a 5 z 5 AIS – 100 %). 
Pokud byla reoperace provedena pro pozitivitu exocervikálního okraje (provedeno v sedmi případech), byl histologický nález 5× již zcela negativní, 1× šlo o CIN 2 a 1× CIN 3 nález. V 18 případech (ze 30) byla provedena reoperace pro pozitivitu endocervikálního okraje a nález zde byl 8× zcela negativní, 2× šlo o CIN 1, 1× CIN 2 a 7× CIN 3/CIS. Pokud byla reoperace provedena pro nález CIN 3/CIS v kyretáži proximálního kanálu hrdla (8×), byl v šesti případech tento nález potvrzen i v nálezu z reoperace, 1× byl nález negativní a 1× šlo o CIN 1.
Diskuze
Výskyt pozitivních okrajů či naopak zastoupení volných okrajů (free margins) provedených konizací sledovali četní autoři. Většinu hodnocených souborů tvořily konizace provedené pro high‑grade léze, někteří autoři hodnotili zvlášť nálezy u diagnózy AIS [2–17]. Přehled uvádí tab. 4.
4. Literární přehled – pozitivní okraje konizací. 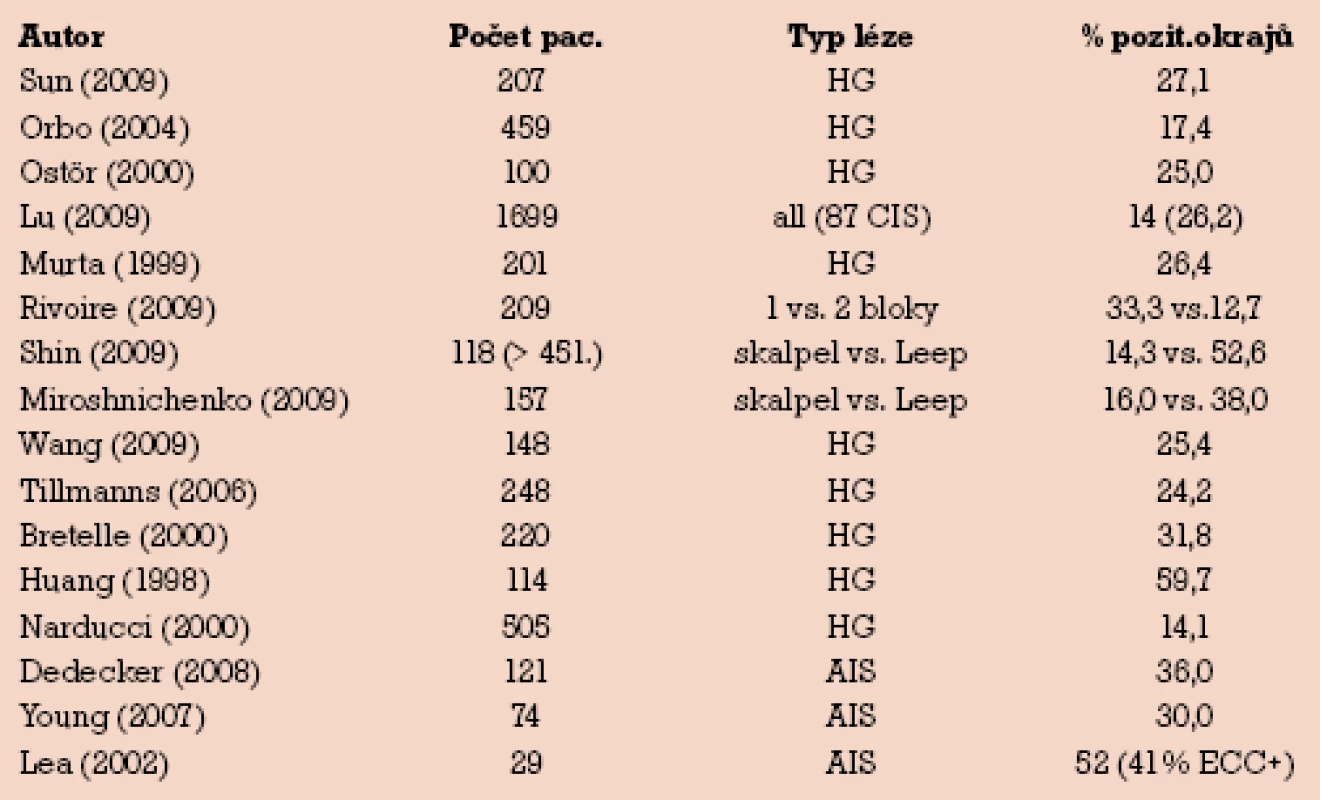
Panuje shoda, že výskyt pozitivních okrajů stoupá se závažností (stupněm) léze, nejvyšší je popisován v případech zastižené mikroinvaze. V tomto ohledu naše poměrně vysoké zastoupení pozitivních okrajů (37,4% u dlaždicových CIS a 55,6% u AIS) reflektuje zaměření naší studie právě na nejtěžší nálezy high‑grade lézí, tj. na případy carcinoma in situ.
Je nepochybné, že riziko rekurencí nálezů se zásadně liší v případech negativních či pozitivních okrajů. Počet rekurencí při negativních okrajích se pohybuje mezi 2–14%, při pozitivních okrajích mezi 19–53%. V souhlase s autory jsme zjistili (i když při malém počtu případů AIS) vyšší výskyt pozitivních okrajů u žlázových karcinomů in situ. To souvisí mimo jiné s častou multifokalitou žlázových lézí. Dosah endocervikálního okraje byl v našem souboru 2× častější než dosah okraje exocervikálního. Ne vždy do okraje zasahuje nejtěžší stupeň léze – někdy je v okraji preparátu přítomen nižší stupeň CIN.
K minimalizaci výskytu pozitivních okrajů konizací musí směřovat řada opatření. Každá léze indikovaná ke konizaci by měla být vyšetřena expertní kolposkopií, v našich podmínkách tedy nositelem funkční licence F17 (kolposkopická expertíza). Jen tak lze zajistit adekvátní popis a hodnocení léze a vhodný typ výkonu. Úměrně velikosti a topografii léze, typu atypické transformační zóny (ATZ 1-3), tj. dosahu změn do endocervixu a viditelnosti či zanoření skvamokolumnární junkce, je pak doporučen rozsah výkonu, tj. velikost a především výška vyťatého konu či válce (v případě cylindrické disekce). Je třeba zvážit individuální anatomické poměry – velikost a tvar čípku a paritu, resp. přání na zachování fertility ženy. Při výkonu v graviditě (v druhém trimestru) je na místě provedení ultrazvukové cervikometrie před výkonem. Výška konu při ATZ 3 či u žlázových lézí by měla být minimálně 25mm (2/3 délky cervikálního kanálu). Těsně před výkonem je třeba provést Schillerovu zkoušku k ozřejmené velikosti a tvaru léze na bázi budoucího konu.
Důležitá je vlastní technika provedení výkonu. Vedle dnes nejčastěji užívané techniky využívající radiofrekvenčních kliček (loop, LEEP – loop electrosurgical excisional procedure) je možné provést konizaci i klasicky skalpelem (cold knife), CO2 laserem, jehlou (NETZ – needle excision of transformation zone, SWETZ – straight wire excision of transformation zone) či kombinovanými technikami. Volba nízkého výkonu (40–70 W) zajišťuje minimální termické poškození okrajů konu, a tím adekvátní hodnotitelnost vzorku histopatologem. Někteří autoři preferují v případech očekávaných žlázových lézí použítí klasického skalpelu a dokládají nižší výskyt pozitivních okrajů ve srovnání s LEEP technikou (viz tab. 4). Jiní preferují provedení výkonu jehlou s dostřižením apexu nůžkami. Různým způsobem je také verifikován nález v proximálním endocervixu, nad apexem konu – kyretáží, punch biopsií nebo druhým minikonem (technikou cowboy hat). Při kyretáži zbytku hrdla je nutno počítat s určitým procentem nediagnostických materiálů – v našem případě v 13,1% u dlaždicových CIS a ve 22,2% AIS. Jiní autoři dokládají lepší výsledky technikou dvou vyťatých bloků místo jednoho (viz tab. 4). Výjimečné jsou práce doporučující při konizaci využít frozen section techniky [18].
Konzervativní management pozitivních okrajů (kolposkopická a cytologická kontrola za tři měsíce) lze akceptovat především v případech dosahu exocervikálních okrajů. Endocervikální dosah většinou vyžaduje reoperaci, v individuálních případech (krátké hrdlo, další reprodukční plány) lze volit kontrolní cytologické vyšetření a endocervikální kyretáž (ECC) za 2–3 měsíce. Pozitivní nález high‑grade léze v kyretáži proximálního kanálu děložního hrdla vyžaduje reoperaci prakticky ve všech případech.
Reoperace pro pozitivní okraje (rekonizace či cylindrické disekce nebo hysterektomie – nejčastěji jako LAVH) ukazují, že v mnoha případech je histologický nález již zcela negativní – dosah okrajů tedy nebyl současně přesahem. Tak tomu bylo zhruba v polovině případů námi provedených reoperací. V ostatních případech byla reoperace zpravidla již dostatečným výkonem pro diagnózu CIS.
Závěr
Riziko výskytu pozitivních okrajů po konizaci nebo cylindrické disekci je vyšší u žlázového oproti dlaždicovému carcinoma in situ. Výskyt pozitivních okrajů stoupá se závažností léze. Pozitivita excocervikálního okraje je méně častá, její následný management je snazší a může být konzervativní. Pozitivita endocervikálního okraje je častější a závažnější, její managment musí být aktivnější a přísnější. Pozitivita kyretáže proximálního kanálu děložního hrdla vyžaduje téměř vždy reoperaci.
Výskyt pozitivních okrajů lze minimalizovat respektováním důležitých zásad. Patří k nim především vyšetření expertní kolposkopií před výkonem s návrhem adekvátního typu a rozsahu výkonu podle velikosti a topografie léze, typu atypické transformační zóny, s přihlédnutím k individuálnímu anatomickému nálezu na děložním hrdle a k event. přání na zachování fertility. Optimální je provedení výkonu operatérem erudovaným v problematice cervikální patologie a kolposkopie (v našich podmínkách nejlépe nositelem funkční licence F17).
doc. MUDr. Pavel Freitag, CSc.
Gynekologicko‑porodnická klinika
1. LF UK a VFN v Praze
pfreitag@vfn.cz
Sources
1. Sláma J, Freitag P, Cibula D et al. Adenoprekancerózy děložního hrdla. Čes Gynek 2006; 17(6): 446 – 450.
2. Sun XG, Ma SQ, Zhang JX et al. Predictors and clinical significance of the positive cone margin in cervical intraepithelial neoplasia III patients. Chin Med J (Engl) 2009; 122(4): 367 – 372.
3. Ørbo A, Arnesen T, Arnes M et al. Resection margins in conization as prognostic marker for relapse in high‑grade dysplasia of the uterine cervix in northern Norway: a retrospective long‑term follow‑up material.Gynecol Oncol 2004; 93(2): 479 – 483.
4. Ostör AG, Duncan A, Quinn M et al. Adenocarcinoma in situ of the uterine cervix: an experience with 100 cases. Gynecol Oncol 2000; 79(2): 207 – 210.
5. Lu HX, Chen YX, Ni J et al. Study on high risk factors associated with positive margin of cervix conization in patient with cervical intraepithelial neoplasia. Zhonghua Fu Chan Ke Za Zhi 2009; 44(3): 200 – 203.
6. Murta EF, Resende AV, Souza MA et al. Importance of surgical margins in conization for cervical intraepithelial neoplasia grade III. Arch Gynecol Obstet 1999; 263(1 – 2): 42 – 44.
7. Rivoire WA, Monego HI, Dos Reis R et al. Comparison of loop electrosurgical conization with one or two passes in high‑grade cervical intraepithelial neoplasias. Gynecol Obstet Invest 2009; 67(4): 228 – 235.
8. Shin JW, Rho HS, Park CY. Factors influencing the choice between cold knife conization and loop electrosurgical excisional procedure for the treatment of cervical intraepithelial neoplasia. J Obstet Gynaecol Res 2009; 35(1): 126 – 130.
9. Miroshnichenko GG, Parva M, Holtz DO et al. Interpretability of excisional biopsies of the cervix: cone biopsy and loop excision. J Low Genit Tract Dis 2009; 13(1): 10 – 12.
10. Wang T, Kong WM, Li BZ et al. Clinical management of patients with positive excision margin after cervical conization: analysis of 148 cases. Zhonghua Yi Xue Za Zhi 2008; 88(19): 1331 – 1334.
11. Tillmanns TD, Falkner CA, Engle DB et al. Preoperative predictors of positive margins after loop electrosurgical excisional procedure‑Cone. Gynecol Oncol 2006; 100(2): 379 – 384.
12. Bretelle F, Cravello L, Yang L et al. Conization with positive margins: what strategy should be adopted? Ann Chir 2000; 125(5): 444 – 449.
13. Huang M, Anderson P. Positive margins after cervical conization as an indicator of residual dysplasia. Prim Care Update Ob Gyns 1998; 5(4): 160 – 161.
14. Narducci F, Occelli B, Boman F et al. Positive margins after conization and risk of persistent lesion. Gynecol Oncol 2000; 76(3): 311 – 314.
15. Dedecker F, Graesslin O, Bonneau S et al. Persistence and recurrence of in situ cervical adenocarcinoma after primary treatment. About 121 cases. Gynecol Obstet Fertil 2008; 36(6): 616 – 622.
16. Young JL, Jazaeri AA, Lachance JA et al. Cervical adenocarcinoma in situ: the predictive value of conization margin status. Am J Obstet Gynecol 2007; 197(2): 195.
17. Lea JS, Shin CH, Sheets EE et al. Endocervical curettage at conization to predict residual cervical adenocarcinoma in situ. Gynecol Oncol 2002; 87(1): 129 – 132.
18. Bretelle F, Agostini A, Rojat ‑ Habib MC et al. The role of frozen section examination of conisations in the management of women with cervical intraepithelial neoplasia. BJOG 2003; 110(4): 364 – 370.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inPractical Gynecology

2010 Issue 1-
All articles in this issue
- Margin status of conizations with histological finding carcinoma in situ
- Selected immunohistochemical prognostic factors of endometrial cancer
- ICTP marker and breast cancer with bone metastases – our experience
- Therapeutic options for assisted reproduction in patients with impaired ovarian reserve
- Intrahepatic cholestasis of pregnancy – selected perinatal outcomes.
- Perimenopausal obesity and how to approach it
- The effect of docosahexaenoic acid on antenatal foetal development and postnatal child development
- Practical Gynecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Margin status of conizations with histological finding carcinoma in situ
- ICTP marker and breast cancer with bone metastases – our experience
- Intrahepatic cholestasis of pregnancy – selected perinatal outcomes.
- Therapeutic options for assisted reproduction in patients with impaired ovarian reserve
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career