-
Medical journals
- Career
Diferenciální diagnostika a terapie opakovaných těhotenských ztrát – 2. část
: R. Krajčovičová; R. Hudeček; J. Kalvodová
: Gynekologicko-porodnická klinika LF MU a FN Brno
: Prakt Gyn 2007; 11(5): 201-204
*1. část tohoto příspěvku byla uveřejněna v Prakt Gyn 2007; 11(4): 164–169.
Autoři práce podávají ucelený přehled etiologie, diferenciální diagnostiky a terapie habituálního potrácení. Práce obsahuje komplexní souhrn etiologických faktorů infertility se zaměřením na faktory, jejichž epidemiologický význam v současnosti narůstá. Jedná se především o imunologické a genetické příčiny habituálního potrácení. Dále je diskutována dysfertilita podmíněná hematologickými poruchami a infekčními stavy. Práce shrnuje přehled možností terapeutického ovlivnění habituálního potrácení od konzervativních postupů, přes techniky asistované reprodukce a preimplantační genetické diagnostiky, po operační intervenci. Podrobněji jsou rozebrány nové léčebné trendy na bázi embryoprotektivní imunomodulace.
Klíčová slova:
habituální potrácení – asistovaná reprodukce – endokrinologie reprodukce - genetika dysfertility – vrozené trombofilní stavy – antropozoonózy – embryoprotektivní imunomodulaceImunologické příčiny infertility
Fyziologický průběh těhotenství zajišťuje velice rozsáhlý soubor imunitních mechanizmů. Intenzivní studium těchto mechanizmů vede v současnosti k zjištění, že významný podíl na případech opakovaného potrácení mají právě imunologické příčiny. Po možné účasti imunopatologických mechanizmů je třeba pátrat ve všech případech primárně či sekundárně potrácejících žen, u nichž byly vyloučeny genetické, anatomické, hormonální a infekční příčiny. Takových případů je podle různých autorů 40 % až 60 % [33].
Z imunologického hlediska představuje těhotenství nejčastější výjimku transplantačních zákonů. Oplozené vejce, trofoblast a plod vykazují totiž pro matku cizí antigenní znaky otcovského původu. Matčin imunitní systém přítomnost „cizího“ registruje. Místo očekávané odmítavé reakce však dochází k specifické imunosupresi v děložní sliznici. Mechanizmů imunosuprese je vícero. Po implantaci blastocyty dochází v přilehlé oblasti deciduy ke zmnožení leukocytů, především monocytů a makrofágů (mechanizmy buněčné imunity). Jejích fagocytární aktivita je však snížena a stávají se naopak producenty imunosupresivních faktorů. Mezi T-lymfocyty dominují tlumivé buňky s gama/delta receptory, T-lymfocyty navíc neodpovídají na aktivační signály a i tvorba IL-2 je výrazně snížena. Naproti tomu je vystupňována produkce cytokinů s protrofoblastovou aktivitou. V průběhu celého těhotenství klesají v krvi trvale počty cytotoxických T-lymfocytů (CTL) a natural killer (NK) buněk [33].
Imunosupresi v děložní sliznici v oblasti implantace blastocysty zajišťují také četné humorální mechanizmy. Převláda tvorba transformujících růstových faktorů a dalších imunosupresivních a embryotropních cytokinů. Významné imunoregulační úlohy jsou připisovány i progesteronu a estrogenům, které se v hraniční oblasti mezi matkou a plodem hromadí a dosahují vysokých koncentrací [33]. Poslední výzkumy uvádějí, že nedostatečná aktivace progesteronových receptorů na fetomaternálním rozhraní vyvolá alogenní imunitní reakci, a tím odmítnutí embrya [35]. Progesteron stejně jako dydrogesteron aktivuje produkci PIBF (Progesteron Induced Blocking Faktor), což vede k nízké aktivitě NK-buněk a fyziologickému průběhu gravidity [35].
V mechanizmech imunosuprese sehrává klíčovou úlohu trofoblast. Dlouho se věřilo v existenci povrchové izolační blanky sialomucinové povahy, zabraňující výměně makromolekul mezi matkou a plodem. Významnější je nízce imunogenní povrchová výbava trofoblastových buněk a jejich vysoká odolnost na matčinu imunitní reakci. Na syncytiotrofoblastu nejsou exprimovány „klasické“ HLA znaky I. a II. třídy (aktivátory vypuzovací imunitní reakce a terče imunitních nástrojů), místo nich jsou vyjádřeny nepolymorfní HLA znaky G, E a F, které nevyvolávají imunitní reakci matky a nejsou citlivé na útok jejich lymfocytů, makrofágů a protilátek [33].
Zárodek je pro úspěšný vývoj vybaven řadou ochranných a podpůrných mechanizmů. Významný je např. EPF – faktor časného těhotenství, alfa-fetoprotein, HCG. Všechny tyto (a další) působky omezují množení a aktivaci matčiných imunitních buněk a faktorů a stupňují odolnost buněk plodu vůči imunitním mechanizmům [33].
Existence tak rozsáhlého souboru mechanizmů zajišťujících fyziologický průběh těhotenství nemůže být a není bez chyb. Porušení prakticky kteréhokoliv z uvedených mechanizmů může vést k opakovanému potrácení
Imunologicky podmíněné potraty můžeme z hlediska cílového antigenu rozdělit na:
- autoimunitní – cílový antigen = komponenty plodového lůžka – cévní endotel a těhotenská decidua
- aloimunitní – cílový antigen = tkáně embryonálního původu
Autoimunitně podmíněné habituální potrácení - z imunologických příčin opakovaného potrácení je nejlépe poznán autoimunitní antifosfolipidový syndrom – AFS (prvotní a druhotný, provázející SLE a další imunopatologické procesy) [34]. Frekvence jeho výskytu v rámci „imunopatologické skupiny“ se odhaduje na 15-25 % [33]. Potrácení je zde podmíněno koagulopatií v cévách placenty i deciduy. Dlouho se předpokládalo, že přítomné antifosfolipidové, antikoagulační, antinukleární a další protilátky poškozují přímo trofoblast nebo vytvářejí s jeho antigeny toxické imunitní komplexy. Nověji převládá názor, že poškozovány jsou primárně cévy deciduy a/nebo placenty, kde jsou nacházeny trombózy a rozsáhlé infarkty. Klíčovým patogenetickým mechanizmem je při tom snížení poměru mezi vasodilatačním prostacyklinem a vasokonstrikčním tromboaglutinačním tromboxanem. Tyto změny se mohou podílet také na vzniku preeklampsie či hypotrofie plodu [34]. Podobný mechanizmus se uplatňuje i u dalších imunopatologických chorob. Vedle SLE lze uvést dermatomyozitidu, Sjögrenův syndrom, vaskulitidy, chronickou aktivní hepatitidu, mnohotnou sklerózu, idiopatickou trombocytopenickou purpuru [33].
Aloimunitně podmíněné habituální potrácení - častější je aloimunitní potrácení, u něhož se předpokládá porucha blokády potenciální imunitní reakce matky proti „otcovským“ znakům plodu.
Porušená blokáda imunitní reakce matky může být způsobena:
- a) chyběním blokujících faktorů (protilátek), zvláště časté v případech značné shody matky a otce ve znacích HLA systému
- b) mechanizmy nekontrolované protitrofoblastové a protiplodové buněčné imunity
- c) nekontrolovanou produkcí trofoblastotoxických a embryotoxických cytokinů, které mají velmi nežádoucí účinky na blastocystu, trofoblast a plod. Tyto faktory mohou vznikat, jak ukázaly experimentální studie a potvrdily klinické analýzy, v procesu reakce matčiných leukocytů se spermiemi, trofoblastem i plodovými složkami [33].
Diagnostika
Při autoimunitním potrácení je důležitá detekce přítomnosti autoprotilátek a cirkulujících imunokomplexů.
Při aloimunitním potrácení je nevyhnutelná HLA typizace partnerů, detekce embryotoxických a trofoblastotoxických faktorů a v neposlední řadě imunohistochemické vyšetření deciduy, které může odhalit chybění imunosuprese v deciduální tkáni [33].
Terapie
Při autoimunitním opakovaném potrácení je metodou léčebné volby podávání nízkých dávek kyseliny acetylsalicylové v kombinaci s heparinem, případně se středně vysokými dávkami glukokortikoidů. Patologické protilátky lze také dočasně odstranit opakovanou plazmaferézou. Příznivou odezvu může vyvolat i imunomodulačně působící (ale velice drahá) opakovaná i.v. aplikace vysokých dávek imunoglobulinů specificky působících na cirkulující imunokomplexy nebo autoprotilátky. Léčbu je třeba zahájit do 2 dnů po ovulaci: zahájení až při průkazu otěhotnění je méně účinné [33].
Při aloimunitním opakovaném potrácení v případech, kde byl u partnerů prokázán vysoký stupeň shody ve znacích HLA-systému a/nebo nedostatek blokujících faktorů, se doporučuje imunizovat ženu partnerovými leukocyty (či mononukleáry) nebo jeho kožními štěpy. Příznivé zkušenosti byly získány i po imunizaci materiálem od cizích (third party) mužů, trofoblastovými membránami, seminální plazmou i spermiemi a dokonce i po převodech plné krve [33].
Po průkazu patogenetické účasti buněčné imunity a jejích faktorů se nabízí léčba monoklonálními protilátkami proti T-lymfocytům, cyklosporinem A či pentoxifylinem. Uvažuje se i o blokádě embryotoxických cytokinů a prostaglandinů monoklonálními protilátkami a selektivními inhibitory a o aplikaci embryo podporujících cytokinů, prostaglandinů a dalších působků.
Velká pozornost se v současnosti zaměřuje na embryoprotektivní imunomodulaci a antiabortivní účinek progesteronu na deciduální úrovni [35]. V léčbě je využívaný dydrogesteron (Duphaston©), což je synteticky připravený, perorálně účinný progestogen, podobný strukturou i farmakologickým účinkem endogennímu progesteronu. Rozbor více studií léčby hrozícího nebo habituálního potratu dydrogesteronem prokázal pozitivní výsledek u 81 % žen a selhání léčby u 19 % z celkového počtu 339 žen [35]. Studie prokázali, že aplikace dydrogesteronu zvyšuje tvorbu PIBF a embryoprotektivní imunomodulací signifikantně snižuje četnost potratů [35]. Perorální aplikace je účinná, dobře tolerovaná a bezpečná [36].
Recentní zprávy svědčí pro výraznou léčebnou aktivitu perorálně podávaných kombinací proteolytických enzymů – systémová enzymoterapie [37,38]. Systémová enzymoterapie se ukazuje být dobře snášenou alternativou, účinnou u všech forem imunitně podmíněného opakovaného potrácení. Intenzivnímu zkoumání systémové enzymoterapie se věnovala studie Akademické fakultní nemocnice univerzity Ludwiga-Maximiliana v Mnichově v letech 1994-1999 [37]. 144 žen s anamnézou habituálního potrácení bylo v rámci této studie léčeno v průběhu dalšího těhotenství kombinovanými enzymovými preparáty a pacientky byly sledovány až do porodu. Kromě podávání gestagenů dostávaly pacientky zpočátku pouze Wobenzym N (71 pacientek) a posléze také Phlogenzym (73 pacientek). Podávání bylo zahájeno před početím nebo po něm a ukončeno nejdříve 15. týden těhotenství, většina žen však pokračovala v užívání až do porodu. Z celkového počtu 144 žen 114 absolvovalo fyziologické těhotenství a porodilo 114 zdravých dětí (úspěšnost 79 %) [37]. K porodům docházelo ve 34. až 40. týdnu těhotenství a u žádného dítěte nebyly zjištěny známky teratogenního poškození. Preparáty byly snášeny bez problémů, nedošlo k žádným nežádoucím účinkům [38]. Příznivé výsledky studie lze objasnit pomocí proteolytického působení enzymů na prozánětlivé a embryotoxické cytokiny. Při podávání systémové enzymoterapie dochází rovněž k snížení exprese adhezivních molekul, které mají klíčovou roli v patologické imunitní reakci matky vůči embryu. Kromě ovlivnění cytokinů a adhezních molekul systémová enzymoterapie omezuje vznik a škodlivé působení autoprotilátek a imunokomplexů. Úspěšnost 79 % dosažená v této studii výrazně převýšila úspěšnost všech dosavadních forem chemické, biologické i psychoterapeutické léčby [37].
1. Odběr buněk při preimplantačním genetickém vyšetření embryí. 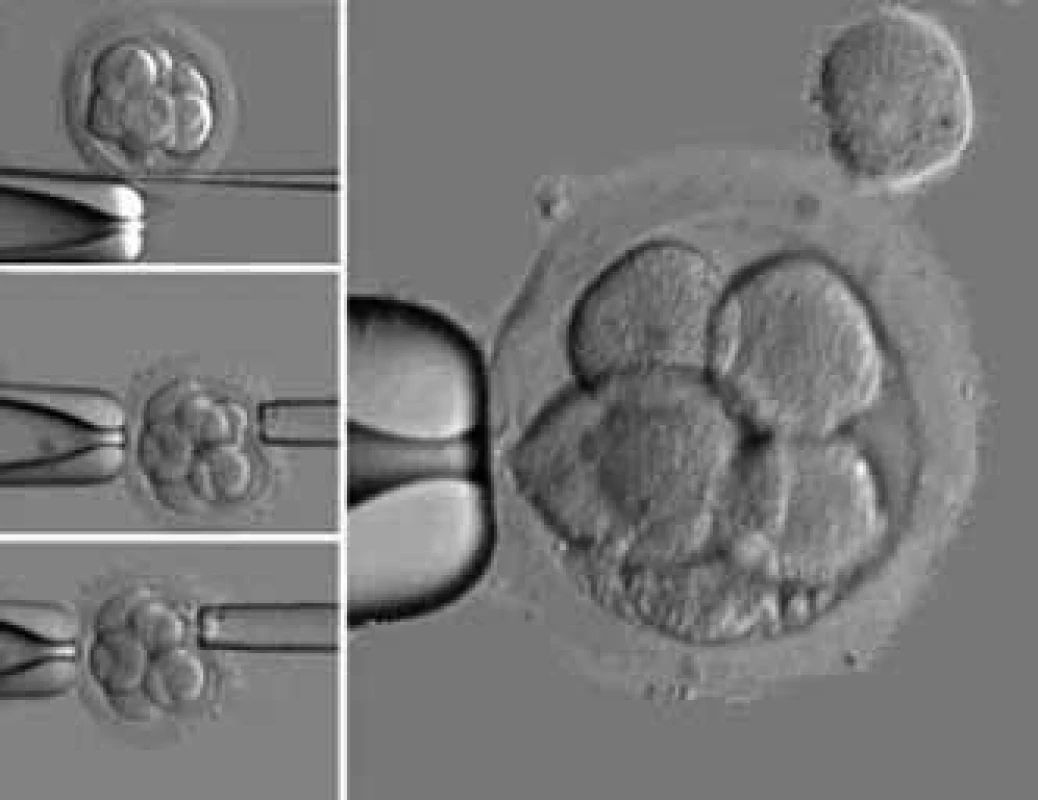
Environmentální příčiny opakovaných fetálních ztrát
V současnosti je věnována velká pozornost vlivu faktorů zevního prostředí na infertilitu. Některé faktory zevního prostředí mají potvrzený vliv na habituální potrácení [39], některé lze označit za suspektní, jiné pochybné a o mnohých dodnes nemáme jednoznačné informace (tab. 1).
1. Environmentální činitele a jejich vztah ke spont. potratům [41]. ![Environmentální činitele a jejich vztah ke spont. potratům [41].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/c0742bf951467b7b5d1b6add060405e3.png)
V diagnostice je nutné pečlivé odebrání anamnézy pacienta. Zaměřujeme se na osobní, farmakologickou, pracovní, sociální, cestovatelskou anamnézu a na abusus pacienta. Cílem je odhalit působení zevního faktoru, který mohl vést k reprodukční ztrátě a jeho následné odstranění. Více než terapie je v této oblasti důležitá prevence.
Psychologické příčiny infertility
Pouze 5 % případů infertilních párů může být označeno jako emocionálně determinovaná infertilita [3]. Tato diagnóza může být stanovena až po vyloučení všech somatických příčin. Emocionální příčina je tedy primární ve velmi malém procentu, jako sekundární ji ale můžeme pozorovat u vysokého procenta párů. Somatická a emocionální infertilita často existují společně. Jsou popisovány spontánní potraty po negativním zážitku nebo po stresové situaci. Předpokládá se však spíše negativní vliv kontinuálního chronického emočního problému a psychického traumatu než vliv jednorázového zážitku [40].
Diagnostika a terapie primárních a především sekundárních psychologických příčin je v rukou psychologů a psychoterapeutů.
Závěr
V souladu s nárůstem našich poznatků o mechanizmech podmiňujících fyziologický průběh gravidity dochází k přehodnocování jednotlivých etiologických faktorů ve vztahu k habituálnímu potrácení. Dominantní role anatomických a infekčních příčin ustupuje narůstající incidenci imunologicky, geneticky a hematologicky podmíněných habituálních potratů.
Diagnostika příčin habituálního potrácení vyžaduje komplexní diagnostický algoritmus a interdisciplinární terapeutický přístup. V první vlně je vhodná preference základních, jednoduchých a plošně dostupných vyšetřovacích metod. Pokud tyto nepřinesou jednoznačné řešení diferenciálně diagnostického problému, přistupujeme k metodám specifických a technicky náročnějším.
Mezi obligatorní vyšetření páru s anamnézou habituálního potrácení patří:
- bimanuální gynekologické vyšetření a aspekce v zrcadlech
- ultrazvukové vyšetření malé pánve
- hysterosalpingografie
- komplexní diagnostická laparoskopie a hysteroskopie
- biopsie endometria
Fakultativní vyšetření páru s anamnézou habituálního potrácení zahrnuje:
- karyotypizace partnerů, genetická konzultace
- hematologické vyšetření
- endokrinologické vyšetření
- vyšetření antropozoonóz
- komplexní imunologické vyšetření
- genetické a patologické vyšetření potraceného plodu
- preimplentační genetická diagnostika embrya
Adekvátní diferenciální diagnostika a terapie habituálního potrácení je podmíněná komplexním interdisciplinárním přístupem a využitím širokého spektra diagnostických metod. Z klinického pohledu je vhodné zohlednit cost-benefitu jednotlivých diagnostických kroků a postupovat od metod jednoduchých, minimálně invazivních k metodám náročnějším a více invazivním. Finální úspěch léčby je podmíněn důslednou mezioborovou spoluprácí gynekologa, hematologa, imunologa, endokrinologa, psychologa a dalších specialistů. Dominantní role ve vedení procesu diagnostiky a terapie habituálního potrácení by však měla zůstat v rukou erudovaného reprodukčního gynekologa.
MUDr. Renáta Krajčovičová
as. MUDr. Robert Hudeček, Ph.D.
MUDr. Jana Kalvodová
Gynekologicko-porodnická klinika LF MU a FN Brno
Sources
1. Madar J, Nouza D, Nováková D. Imunologické aspekty habituálního potrácení. Moderní gynekologie a porodnictví. Sterilita a opakované potrácení. Mod Gynek Porod 2002; 11(4): 621-627.
2. Zwinger A. Opakované potrárcení in Zwinger A et al. Porodnictví. Praha: Galén 2004 : 173-183.
3. Gaillyová R. Genetické příčiny poruch reprodukce. Brno 2006.
4. Kupferminc MJ, Roqué H, Binder T. Je nosičství trombofilie příčinou časných spontánních potratů v prvním trimestru? Gynek po Prom 2004; 4(3): 55-59.
5. Roztočil A. Poruchy délky trvání těhotenství. In: Roztočil A et al. Porodnictví. Brno: IDVPZ 2001 : 157.
6. Vojtaššák J. Charakteristika reprodukčních strát v korelácii s vekom ženy. Asistovaná reprodukce 12 2002; 1 : 9.
7. Monteagudo A, Tsybal T. Sonografické známky anomálií Műllerových vývodů. Gynek po Prom 2005; 5(3): 36.
8. Bick RL, Madden J, Heller KB et al. Medscape Womens Health 1998; 3(3): 2.
9. Berghella V, Baxter J, Pereira L. Měli bychom cerclage provádět? Gynek po Prom 2006; 6(2): 24-33.
10. Čech E, Hájek Z, Maršál K et al. Porodnictví. Praha: Grada Publishing 2004 : 148-154.
11. Macků F et al. Kompendium gynekologických operací. Praha: Grada 1995 : 220-226, 305-314.
12. Arici A, Kelly S M, Tulandi T. Kontroverze: Měla by být u neplodných žen s itramurálními myomy prováděná myomectomie. Gynek po Prom 2005; 5(5): 56.
13. Lockwood CHJ. Inherited Thrombophilias in Pregnant Patiens: Detection and Treatment Paradigma. Obstet Gynekol 2002; 9 : 333-341.
14. Guttenbach M, Engel W, Schmidt M. Analysis of structural and numerical chromosome abnormalities in sperm of normal men and carriers of constitutional chromosome aberrations. A review. Hum Genet 1997; 100 : 1-21.
15. Alves C, Sousa M, Silva J, Barros A. Preimplanntation genetic diagnosis FISH for carriers of Robertsonial translocations: the Portuguese experience. Prenat Diagn 2002; 22 : 1153-1162.
16. Žáková J, Ventruba P, Vojtíšková M. Aktuální otázky vztahující se k preimplantační diagnostice. Asist Reprod 2000; 10(1): 18.
17. Martius G, Breckwoldt M, Pfleiderer A et al. Gynekologie a porodnictví. Martin: Osveta 1997.
18. Binder T. Možnosti terapie opakovaného potrácení. Mod Gynek Porod 2002; 11(4): 628-634.
19. Veselá K, Tauwinklová G, Trávník P et al. Preimplantační genetická diagnostika (PGD) numerických a strukturálních abnormit třídenních embryí v programu in vitro fertilizace u párů s opakovanými těhotenskými ztrátami či neúspěchy v předchozích IVF cyklech. Asist Reprod 2001; 11(1): 10.
20. Brachtlovová T, Hlinka D, Mardešić T. Preimplantační genetické vyšetření embryí – nový pohled na lidská embrya a léčbu neplodnosti. Sanquis 2005; 39 : 30.
21. Hashimoto K, Shizusawa Y, Shimoya K et al. The factor V Leden mutation in Japanese couples with recurrent spontaneous abortion, Hum Reprod 1999; 14(7): 1872-1874.
22. James AH, Brancazio LR. Prenatal Screening for Trombophilia: The Background and the Approach. Gynecol Obstet Invest 2005; 60 : 47-57.
23. Kupferminc MJ, Roqué H, Binder T. Je nosičství trombofilie příčinou časných spontánních potratů v prvním trimestru? Gynek po Prom 2004; 4(3): 55-59.
24. Pisák M. Fosfolipidový syndrome a reprodukčné straty. Slov Gynek Porod 2004; 11(4): 64-68.
25. Murphy RP, Donoghue C, Nallen RJ et al. Prospective Evaluation of the Risk Conferred by Factor V Leiden and Thermolabile Methylenetetrahydrofolate Reductase Polymorphisms in Pregnancy. American Heart Association 2000; 20(1): 266.
26. Dulíček P, Penka M, Binder T et al. Návrh antitrombotické profylaxe a péče o trombofilní stavy v gynekologii a porodnictví (Doporučení Sekce pro trombózu a hemostázu ČHS ČLS JEP).
27. Kauffman RP, Castracane D, Kosasa T. Syndrom polycystických ovarií. Gynek po Prom 2003; 3(6): 39-47.
28. Carrington B, Sacks G, Regan L et al. Recurrent miscarriage: pathophysiology and outcome. Curr Opin Obstet Gynecol 2005; 17(6): 591-597.
29. Erlebacher A, Zhang D, Parlow AF et al. Ovarian insuficiency and early pregnancy loss. J Clin Invest 2004; 114(1): 39-48.
30. Hájek Z. Rizikové a patologické těhotenství. Praha: Grada 2004.
31. Višňová H, Ventruba P, Crha I. Metformin v léčbě sterility u žen s PCOS. Asist Reprod 2003; 13(1): 12.
32. Armstrong J, Nageotte M. Může progesteron zabránit předčasnému porodu? Gynek po Prom 2006; 6(1): 18-24.
33. Nouza K, Nouza M, Madar J. Prevence a léčba imunologicky podmíněného opakovaného potrácení. Medicína 2000; 6(7): 21.
34. Bulíková A, Crha I. Antifofolipidové protilátky a antifosfolipidový syndrom v porodnictví. Prakt Gyn 2004; 8(1): 6-9.
35. Ventruba P, Višňová H, Crha I. Embryoprotektivní imunomodulace. Asist Reprod 2002; 12(1): 8.
36. Višňová H, Ventruba P, Hruban L. Využití dydrogesteronu v reprodukční gynekologii. Asist Reprod 2002; 12(1): 11.
37. Dittmar F. Systémová enzymoterapie – úspěšná imunoterapie imunologicky podmíněných habituálních potratů. Medicína 2001; 7(8): 15.
38. Uhrová E, Brandejská M, Nováková D. Enzymoterapie a infertilita. Asist Reprod 2002; 12(1): 20.
39. Hrubá D. Kouření je největší preventabilní riziko poruch reprodukce. Prakt Gyn 2001; 2 : 35-41.
40. Korytová D. Psychosomatika sterility. Sterilita a opakované potrácení. Mod Gynek Porod 2002; 11(4): 635-636.
41. Gardella JR, Hill JR. Environmental toxins associated with recurrent pregnancy loss. Semin Reprod Med. 2000; 18(4): 407–424.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inPractical Gynecology

2007 Issue 5-
All articles in this issue
- Differential diagnosis and therapy of recurrent pregnancy loss – part 2
- Analysis of Perinatology Results in Olomouc Region in Recent Ten Years (1997-2006)
- The significance of ultrasound 3D examination in diagnosing foetal birth defects
- Microwawe radiometry and the breast disease - introducing the new diagnostic method into practice?
- Detection of Chlamydia trachomatis antigens by the Clearview Chlamydia test
- Current view of the effect of hormone replacement therapy on cardiovascular risks – 2007 update
- Practical Gynecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- The significance of ultrasound 3D examination in diagnosing foetal birth defects
- Differential diagnosis and therapy of recurrent pregnancy loss – part 2
- Detection of Chlamydia trachomatis antigens by the Clearview Chlamydia test
- Microwawe radiometry and the breast disease - introducing the new diagnostic method into practice?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

