-
Medical journals
- Career
Úspěšná léčba gastrolienální píštěle po sleeve gastrektomii
Authors: D. Toman 1,2; A. Foltýs 1,2; P. Ostruszka 1,2; L. Tulinský 1,2; L. Martínek 1,2
Authors‘ workplace: Chirurgická klinika, Fakultní nemocnice Ostrava, Česká republika 1; Lékařská fakulta, Ostravská univerzita, Ostrava, Česká republika 2
Published in: Rozhl. Chir., 2024, roč. 103, č. 1, s. 26-30.
doi: https://doi.org/10.33699/PIS.2024.103.1.26–30Overview
Úvod: Laparoskopická sleeve gastrektomie (LSG) patří mezi nejčastěji prováděné bariatrické výkony. Rovněž je ale spojena se závažnými a potenciálně život ohrožujícími komplikacemi souvisejícími se staplerovou linii, jako je „leak“ ze žaludku a krvácení.
Kazuistika: Popisujeme případ operačního řešení časné píštěle mezi žaludkem a slezinou 3 týdny po LSG. Svou pozornost jsme zaměřili na diagnostiku a možnosti léčby této závažné komplikace.
Závěr: Snaha o snížení četnosti výskytu leaku po LSG zahrnuje celou řadu nejrůznějších opatření. Je vhodné mít odborné znalosti nejen v primární bariatrické operativě, ale také v řešení problémů a reoperací v gastrointestinální chirurgii. Základním předpokladem úspěšné terapie je individualizace přístupu a multidisciplinární týmová spolupráce.
Klíčová slova:
bariatrická chirurgie – píštěl žaludku – revizní operace
ÚVOD
Laparoskopická sleeve gastrektomie (LSG) patří mezi nejčastěji prováděné bariatrické výkony [1]. Přestože je operační technika považována za bezpečnou a standardizovanou, je LSG spojena s možností výskytu závažných a potenciálně život ohrožujících komplikací, které souvisejí se staplerovou linii, jako je „leak“ (dále jen leak) ze žaludku a krvácení. Podle různých zdrojů se leak ze staplerové linie pohybuje od 0 do 7 % a může se objevit kdykoli v pooperačním období [2]. Ve vztahu k době vzniku této komplikace po primárním výkonu jsou staplerové leaky klasifikovány jako akutní (<1 týden), časné (1–6 týdnů), pozdní (>6 týdnů) a chronické (>12 týdnů) [3]. Jejich vývoj může být navíc nepředvídatelný a může vést ke vzniku píštělí jak se sousedními intraabdominálními, tak i vzdálenými orgány, jako jsou plíce a dýchací cesty [4]. Léčba leaku ze žaludku vyžaduje komplexní diagnostiku a rovněž multidisciplinární tým složený z chirurgů, radiologů, endoskopistů a intenzivistů. Komplexní píštěle mohou vyžadovat několik chirurgických a endoskopických výkonů [4]. Krvácení po LSG se obvykle objevuje brzy po operaci a ve většině případů souvisí s krvácením ze staplerové linie nebo z velkého omenta. Výskyt pooperačního krvácení je uváděn u cca 4,9 % pacientů [5]. V této kazuistice popisujeme případ časné píštěle mezi žaludkem a slezinou po LSG. Svou pozornost jsme zaměřili na diagnostiku a možné varianty léčby této potenciálně život ohrožující komplikace.
KAZUISTIKA
51letá pacientka byla znovu přijata 22. den po LSG pro zvýšenou teplotu a bolesti na levé straně hrudníku. V době provedení LSG měla body mass index (BMI) 40,65 g/m2. Léčila se s hypertenzí a dyslipidemií. Primární operační výkon LSG proběhl bez komplikací, bez zjevného krvácení ze staplerové linie, která nebyla přešívána, podél resekční linie byl standardně uložen silikonový drén. Časný pooperační průběh byl bez komplikací, bez poklesu v krevním obraze, břišní drén byl odstraněn 2. pooperační den. Pacientka po edukaci propuštěna 4. pooperační den. Dle sdělení pacientky přibližně 18. pooperační den měla tlaky v horní části břicha a hrudníku vlevo, dvakrát v daný den zvracela, údajně po dietní chybě, následně se jí ulevilo, stolice byla normální, bez průjmů či melény, potíže s polykáním neměla. Na kontrole u obvodního lékaře zjištěna elevace CRP na 180 mg/l, proto odeslána na naše pracoviště. V laboratorních odběrech potvrzena elevace CRP 224 mg/l, leukocyty byly v normě 7,70 ×109/l, hemoglobin v normě 131 g/l. Provedena diagnostika za pomoci výpočetní tomografie s nitrožilně a per os podanou kontrastní látkou (Obr. 1). Zjištěn leak z oblasti fundu žaludku z resekční linie směrem do kraniálního pólu sleziny, kde se zobrazilo depo kontrastní látky velikosti 40×18×26 mm s bublinou vzduchu, bez zjevného krvácení. Přijata na chirurgickou jednotku intenzivní péče k předoperační přípravě, následně indikována k laparoskopické revizi břišní dutiny.
Peroperačně byla nalezena píštěl v horní části resekční linie velikosti přibližně 1×1 cm, která naléhala na horní pól sleziny, kde byla i nekrotická tkáň a dutina abscesu velikosti cca 3×3 cm. Píštěl byla v dostatečné vzdálenosti od Hisova úhlu. Nekrotické hmoty byly odstraněny a odeslány na bakteriologické vyšetření. Do žaludku byla zavedena kalibrační sonda 36 F. Přes píštěl založen vicrylový steh pro trakci, následně provedena resekce píštěle na kalibrační sondě pomocí stapleru Echelon s použitím dvou 60mm černých nábojů, konec resekční linie byl označen klipem. Byl proveden výplach operačního pole a podél žaludku zaveden kapilární drén zleva. Po dilataci rány v levém podžebří na 20 mm byla odstraněna resekovaná část žaludku s píštělí z dutiny břišní. Po výkonu byla pacientka na jednotce intenzivní péče, 1. pooperační den byla odstraněna nazogastrická sonda. Následně byly pacientce podávány tekutiny a tekutá strava, které tolerovala, s obnovením střevní pasáže byla propuštěna 6. pooperační den domů. Tři týdny od operace na ambulantní klinické kontrole byla bez potíží.
Image 1. CT s per os kontrastní látkou zobrazující gastrolienální píštěl Fig. 1: CT with oral contrast showing a gastrosplenic fistula 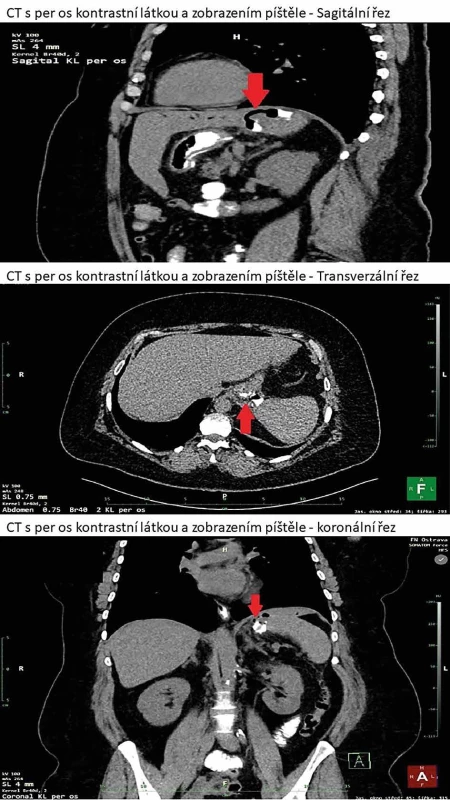
DISKUZE
Laparoskopická sleeve gastrektomie je oblíbená díky velmi dobrým výsledkům v oblasti hubnutí a účinné kontroly hypertenze, hyperlipidemie či diabetu mellitu. Leak je důsledkem narušení svorkové linie v pooperačním období. Vyskytuje se až u 5,1 % primárních bariatrických operací a u 20 % revizních operací [6]. Většina úniků po LSG se vyskytuje v proximální třetině žaludku nebo pod Hisovým úhlem (85,7 %), na rozdíl od oblasti distální třetiny žaludku (14,3 %). Přetrvávající leaky se mohou stát chronickými, což následně vede k tvorbě abscesů. Absces pak může tvořit píštěl se sousedními epiteliálně vystlanými strukturami nebo tvořit sinusy se strukturami nevystlanými epitelem. Disrupce staplerové linie po LSG je obvykle spojena se zvýšeným intraluminálním tlakem. Tato situace je způsobena sníženou distenzí rukávu žaludku, rovněž s možnou změnou ve vyprazdňování žaludku po LSG [7]. Také se zdá, že přispívajícím faktorem může být narušené cévní zásobení v oblasti kardie žaludku. Leak způsobený ischemií se obvykle objeví do jednoho týdne od operace, zatímco mechanická dehiscence svorkové linie se projeví i dříve. Dalšími rizikovými faktory leaku jsou diabetes mellitus, infekce, věk nad 55 let, hypertenze a předchozí operace [8].
Tachykardie je nejčastějším klinickým příznakem leaku a vyskytuje se u 72 až 92 % pacientů. Stejně jako u pacientů s jinou než gastrolienální píštěli, jako je například gastrokolická nebo gastropleurální píštěl, je pacient často bez horečky a bez bolesti. Subjektivně pacient může popisovat nespecifický tlak v horní části břicha či na hrudi více vlevo. Rovněž se někdy udává, že pacient„stůně jinak než obvykle“. Vysoké klinické podezření je tedy zásadní, protože včasné rozpoznání umožňuje optimální léčbu. V rámci diagnostiky má kontrastní vyšetření výpočetní tomografií (CT) až 92 % senzitivitu. Senzitivita CT skenu vychází z toho, že kromě identifikace skutečného prosakování může prokázat nepřímé známky zánětu či pleurální výpotek [9].
Léčba leaku z resekční linie může být konzervativní a operační. Neoperační řešení pozůstává z drenáže abscesu, nitrožilně podávaných antibiotik, omezení per os příjmu, totální parenterální nutrice a monitorování jak lokálních, tak systémových komplikací, jako jsou sepse, hluboká žilní trombóza či nedostatečná výživa. Při takto zavedené léčbě může dojít ke spontánnímu uzavření úniku do 4−6 týdnů [10]. Možnosti neoperační léčby dále rozšiřují endoskopické postupy a intervence. Jejich výhodou je menší invazivita, s minimální lokální zánětlivou reakcí ovlivňující hojení bez limitací hodnotou BMI. Endoskopické postupy zahrnují celou řadu intervencí, spočívajících ve vnitřní drenáži abscesů, použití podtlakové terapie, aplikaci materiálů uzavírajících trakt píštěle a zavedení speciálních stentů překrývajících místo úniku [10]. Jednotlivé endoskopické techniky jsou často používány kombinovaně podle průběhu hojení v rámci komplexu ostatních konzervativních opatření. Konvenční chirurgická léčba píštělí obecně zahrnuje drenáž a chirurgické uzavření píštěle. Dle literatury je morbidita a mortalita chirurgického řešení nebo reoperace pro leaky do 50 %, respektive 2 až 10 %, s 48 % konverzí na otevřenou operaci [11]. V důsledku toho bývá počáteční léčba často neoperační kombinující konzervativní opatření a endoskopický přístup. Správné načasování chirurgické léčby může být obtížné. Závisí zejména na stavu pacienta a době mezi primární operací a objevením se leaku.
Symptomatický leak s horečkou, tachykardií, bolestmi zad nebo ramene, pleurálními výpotky či atelektázou levého dolního plicního laloku a známkami hemodynamické nestability nebo difuzní peritonitidy však obvykle vyžaduje brzké operační řešení [3].
Leaky mají tendenci při neoperační léčbě přetrvávat a progredovat do chronických píštělí a kolekcí. Dochází k tomu, zejména pokud existuje funkční (pylorus) nebo mechanická (angulace nebo zkroucení incisury) pseudoobstrukce, jako v případě LSG.
Časné leaky lze chirurgicky řešit drenáží kolekce a kontrolou píštěle. U pozdních leaků je chirurgická léčba metodou volby. Podle údajů z literatury je nepravděpodobné, že by se chronický leak (>12 týdnů od primárního výkonu) uzavřel bez chirurgického zákroku. Podle Rosenthala a kol. je optimální interval 12 týdnů neoperační léčby, aby se zabránilo tuhým adhezím a optimalizoval se nutriční stav [3]. Ošetření prostou suturou je většinou neúčinné kvůli lokálnímu zánětu. Studie van de Vrandeho a kol. udává, že radikální intervence, jako je konverze LSG na Roux-en-Y gastrický bypass, má až 66% úspěšnost [12]. Tento přístup zahrnuje korekci leaku pomocí Rouxovy kličky a vytvoření fistulojejunoanastomózy (Obr. 2). Hlavní výhodou této techniky je, že se vyhne totální nebo proximální gastrektomii. Po vytvoření anastomózy mezi ústím píštěle a jejunem, ve kterém byl vytvořen malý otvor, může Rouxova klička sloužit jako kanál pro výstup slin a potravy. Zavedení nazogastrické sondy do Rouxovy kličky může pomoci udržet anastomózu otevřenou a zároveň umožní enterální výživu.
Další chirurgickou modalitou popsanou v literatuře je en-block resekce píštěle s proximální gastrektomií a Roux-en-Y ezofagojejunoanastomózou. Podle Thompsona a kol. byla úspěšnost tohoto postupu v souboru 15 pacientů s leakem po LSG až 93,4 % [13].
Komplikovanější variantou je provedení proximální gastrektomie s rekonstrukcí v podobě „dvojitého traktu“. Termín„dvojitý trakt“ označuje obousměrný tok potravy zbytkem žaludku a jejuna po rekonstrukci, která zahrnuje tři anastomózy: ezofagojejunoanastomózu, gastrojejunoanastomózu a jejunojejunoanastomózu (Obr. 3). Při tomto postupu je zachována distální část žaludku, což může pomoci snížit výskyt perniciózní anémie a umožnit standardní endoskopický přístup do žlučových cest po operaci. Rizikem je další anastomóza navíc ve srovnání s totální gastrektomií. Omezený průchod potravy do distálního žaludku může přesto vést k nedostatečné sekreci intirinsic faktoru. Je důležitá také kontrola hladin železa a vitaminu B12 [14].
Pokud nelze identifikovat místo úniku nebo pokud je okolní tkáň příliš křehká pro anastomózu, může být nutné provést totální gastrektomii s následnou ezofagojejunoanastomózou. Předpokládá se, že rekonstrukce Roux-en-Y po totální gastrektomii představuje nižší riziko leaku v důsledku vytvoření anastomózy mezi částmi zdravého trávicího traktu. Mezi nevýhody však patří pooperační anémie a obtížný přístup do žlučových cest standardní endoskopií.
Předoperační strategie by měla sestávat z pečlivého poučení pacienta o plánované operaci (včetně rizik a dlouhodobých důsledků), předoperačních zobrazovacích vyšetření, optimalizace nutričního stavu a v ideálním případě i plné kontroly lokální sepse. Chirurg by měl pacientovi vysvětlit možnosti včetně konstrukce Roux-en-Y anastomózy, či případně i radikálnější výkon, jako je resekce komplexu píštěle s ezofagojejunální rekonstrukcí. Optimalizace nutričního stavu by mělo být dosaženo enterální výživou, pokud je dostupný enterální přístup, nebo alternativně totální parenterální výživou. Optimální délka nutričního období závisí na obvyklých výživových parametrech.
Přímá komunikace mezi žaludkem a horním pólem sleziny může taky způsobit masivní intragastrické krvácení. V námi prezentovaném případě se nejednalo o krvácivou komplikaci, která by vyžadovala urgentní řešení. V literatuře je ale popsáno několik případů, kde se gastrolienální píštěl projevila masivním krvácením, které si vyžádalo neodkladnou operační revizi [15].
U hemodynamicky stabilního pacienta je možné pacienta časně došetřit, a to provedením výpočetní tomografie (CT) s nitrožilně a per os podanou kontrastní látkou jak k verifikaci píštěle, tak i případného aktivního krvácení. Otázkou je provedení ezofagogastroduodenoskopického vyšetření, které by mohlo ozřejmit případnou ulceraci nebo defekt v horní části svorkové linie jako zdroj tvořící se píštěle. Po LSG je žaludeční stěna a slezina vzdálenější než v neporušeném anatomickém stavu a teoreticky by se penetrující vřed měl otevírat spíše do dutiny břišní, než aby dosahoval do sleziny, což potvrdil i náš případ.
V případě prokázaného krvácení při CT vyšetření je angiografie s embolizací stále častěji navrhována jako alternativa ke zvládnutí masivního gastrointestinálního krvácení, a to i u nestabilních pacientů s výsledky přežití někdy lepšími než u chirurgického zákroku [16]. Různé klinické stavy provázející gastrolienální píštěle komplikují snahu definovat jasný léčebný algoritmus. Zdá se, že pokud není hemodynamický stav pacienta ohrožen, měl by být pacient primárně odeslán na angiografii k arteriální embolizaci. U pacientů, u kterých selhala oběhová resuscitace, zůstává hlavní terapeutickou možností urgentní operace.
Snaha o snížení četnosti výskytu leaku po LSG zahrnuje celou řadu nejrůznějších opatření. Patří mezi ně zejména snaha o přiměřený rozsah disekce, minimalizace rizika ischemie, limitovaná preparace v oblasti gastroezofageální junkce, vhodný typ a správná manipulace se staplerem a prevence zúžení manžety zejména v místě incisura angularis, aby se zabránilo částečné obstrukci žaludečního tubulu. Při revizní chirurgii je chirurgické riziko vždy vyšší než při počáteční operaci v důsledku tuhnutí tkáně, edému, adheze a zvýšené náchylnosti ke krvácení. Je tedy žádoucí mít odborné znalosti nejen v primární bariatricko-metabolické operativě, ale také v řešení problémů a reoperací v gastrointestinální chirurgii.
Image 2. Korekce leaku pomocí Rouxovy kličky a vytvoření fistulojejunoanastomózy Fig. 2: Correction of the leak using a Roux loop and fistulojejunostomy 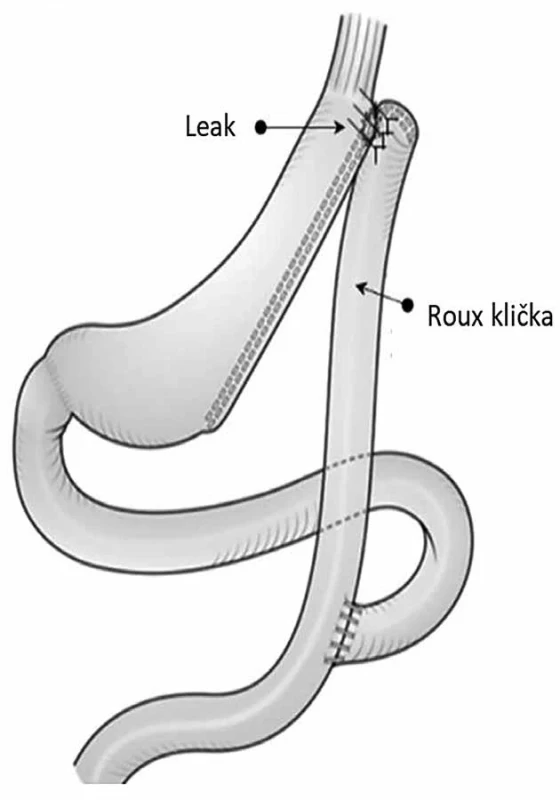
Image 3. Proximální gastrektomie s rekonstrukcí dvojitého traktu Fig. 3: Proximal gastrectomy with double tract reconstruction 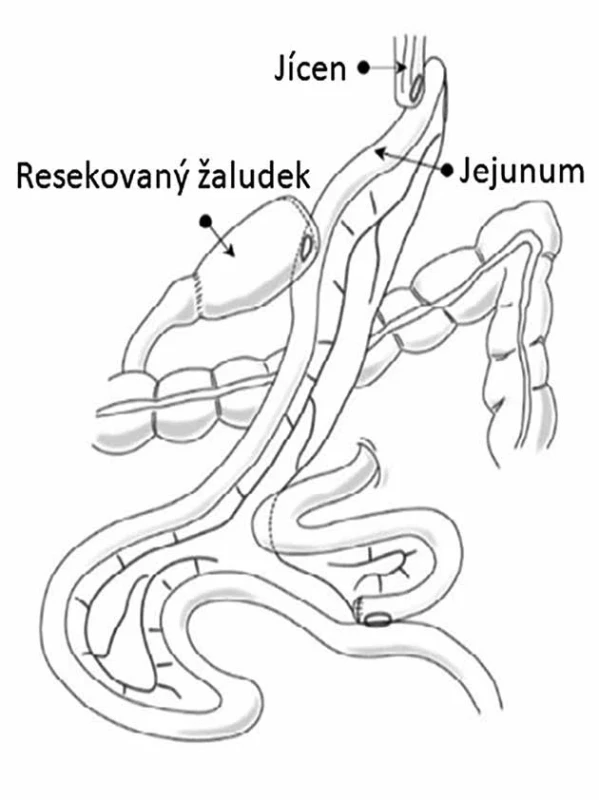
ZÁVĚR
Leak představuje závažnou komplikací LSG s heterogenním klinickým obrazem. Předpokladem úspěšné léčby je personalizovaný přístup zohledňující celou řadu faktorů včetně charakteristik samotného leaku a správného načasování terapie. Zvládání těchto komplikací vyžaduje dobrou týmovou spolupráci mezi chirurgy, radiology, gastroenterology, endoskopisty, specialisty intenzivní péče a intervenčními radiology.
Seznam zkratek:
BMI – body mass indexCT – výpočetní tomografieLSG – laparoskopická sleeve gastrektomieKonflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
Sources
- Angrisani L, Santonicola A, Iovino P, et al. Bariatric surgery survey 2018: Similarities and disparities among the 5 IFSO chapters. Obes Surg. 2021 May;31(5):1937 – 1948. doi:10.1007/s11695-020-05207-7.
- Aurora AR, Khaitan L, Saber AA. Sleeve gastrectomy and the risk of leak: a systematic analysis of 4,888 patients. Surg Endosc. 2012 Jun;26(6):1509–15. doi:10.1007/s00464-011-2085-3.
- Rosenthal RJ, Diaz AA, Arvidsson D, et al. International sleeve gastrectomy expert panel consensus statement: best practice guidelines based on experience of >12,000 cases. Surg Obes Relat Dis. 2012 Jan–Feb;8(1):8−19. doi:10.1016/j. soard.2011.10.019.
- Nguyen D, Dip F, Hendricks L, et al. The surgical management of complex fistulas after sleeve gastrectomy. Obes Surg. 2016;26 : 245–250. doi:10.1007/s11695-015-1788-2.
- Shikora SA, Mahoney CB. Clinical benefit of gastric staple line reinforcement (SLR) in gastrointestinal surgery: a meta-analysis. Obes Surg. 2015;25(7):1133–1141. doi:10.1007/s11695-015-1703-x.
- Morales MP, Miedema BW, Scott JS, et al. Management of postsurgical leaks in the bariatric patient. Gastrointest Endosc Clin N Am. 2011;21(2):295–304. doi:10.1016/j. giec.2011.02.008.
- Ostruszka P, Vávra P, Tulinský L, et al. Changes in bowel habits after laparoscopic sleeve gastrectomy. Wideochir Inne Tech Maloinwazyjne 2020 Sep;15(3):469−477. doi:10.5114/wiitm. 2019.89830.
- Perez M, Brunaud L, Kedaifa S, et al. Does anatomy explain the origin of a leak after sleeve gastrectomy? Obes Surg. 2014; 24(10):1717–1723. doi:10.1007/s11695-014-1256-4.
- Gonzalez R, Sarr MG, Smith CD, et al. Diagnosis and contemporary management of anastomotic leaks after gastric bypass for obesity. J Am Coll Surg. 2007;204(1):47–55. doi:10.1016/j.jamcollsurg.2006.09.023.
- Bege T, Emungania O, Vitton V, et al. An endoscopic strategy for management of anastomotic complicationsfrom bariatric surgery: a prospective study. Gastrointestinal Endoscopy 2011;73(2):238−244. doi:10.1016/j.gie.2010.10.010.
- Dapri G, Cadière GB, Himpens J. Laparoscopic conversion of adjustable gastric banding and vertical banded gastroplasty to duodenal switch. Surg Obes Relat Dis. 2009;5(6):678–683. doi:10.1016/j. soard.2009.07.001.
- van de Vrande S, Himpens J, El Mourad H, et al. Management of chronic proximal fistulas after sleeve gastrectomy by laparoscopic Roux-limb placement. Surgery for Obesity and Relateddiseases 2013;9(6):856−861. doi:10.1016/j. soard.2013.01.003.
- Thompson CE 3rd, Ahmad H, Lo Menzo E, et al. Outcomes of laparoscopic proximal gastrectomy with esophagojejunal reconstruction for chronic staple line disruption after laparoscopic sleeve gastrectomy. Surg Obes Relat Dis. 2014 May−Jun;10(3):455−459. doi:10.1016/j.soard. 2013.10.008.
- Oshiro T, Sato Y, Nabekura T, et al. Proximal gastrectomy with double tract reconstruction is an alternative revision surgery for intractable complications after sleeve gastrectomy. Obes Surg. 2017 Dec; 27(12):3333−3336. doi:10.1007/s11695-017-2935-8.
- Montana L, Genser L, Cortes A, et al. Gastrosplenic fistula with gastrointestinal bleeding: A rare and potentially fatal complication after sleeve gastrectomy. Obes Surg. 2018 Jul;28(7):2135−2139. doi:10.1007/s11695-018-3284-y.
- Tarasconi A, Baiocchi GL, Pattonieri V, et al. Transcatheter arterial embolization versus surgery for refractory non-variceal upper gastrointestinal bleeding: a meta-analysis. World J Emerg Surg. 2019 Feb 1;14 : 3. doi:10.1186/s13017-019-0223-8.
MUDr. Daniel Toman, Ph.D.
Chirurgická klinika, FN Ostrava
Ostrava-Poruba
e-mail: daniel.toman@fno.cz
ORCID: 0000-0002-6627-3162Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2024 Issue 1-
All articles in this issue
- Bariatrie
- Sleeve gastrectomy – stále populární bariatrická metoda
- Single anastomosis sleeve ileal bypass a single anastomosis sleeve jejunal bypass v chirurgické léčbě těžké obezity
- Gastrický bypass − výsledky po 10 letech
- Úspěšná léčba gastrolienální píštěle po sleeve gastrektomii
- Od adjustabilní gastrické bandáže k Roux-Y gastrickému bypassu – kazuistika
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Gastrický bypass − výsledky po 10 letech
- Single anastomosis sleeve ileal bypass a single anastomosis sleeve jejunal bypass v chirurgické léčbě těžké obezity
- Sleeve gastrectomy – stále populární bariatrická metoda
- Bariatrie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

