-
Medical journals
- Career
Současná diagnostika a léčba chirurgických infekcí kůže a měkkých tkání
Authors: J. Ulrych 1; V. Adámková 2; R. Gürlich 3; M. Kolář 4; H. Lahoda-Brodská 5; V. Třeška 6; L. Veverková 7
Authors‘ workplace: I. chirurgická klinika – hrudní, břišní a úrazové chirurgie, Všeobecná fakultní nemocnice a 1. lékařská fakulta, Univerzity Karlovy v Praze 1; Klinická mikrobiologie a ATB centrum, Ústav lékařské biochemie a laboratorní diagnostiky VFN, Praha 2; Chirurgická klinika Fakultní nemocnice Královské Vinohrady a 3. lékařské fakulty Univerzity Karlovy v Praze 3; Ústav lékařské mikrobiologie Lékařské fakulty Univerzity Palackého Olomouc 4; Ústav lékařské biochemie a laboratorní diagnostiky Všeobecné fakultní nemocnice, Praha 5; Chirurgická klinika Fakultní nemocnice Plzeň a Lékařská fakulta Univerzity Karlovy, Plzeň 6; I. chirurgická klinika Fakultní nemocnice u sv. Anny a Lékařská fakulta Masarykovy univerzity Brno 7
Published in: Rozhl. Chir., 2022, roč. 101, č. 7, s. 300-311.
Category: Review
doi: https://doi.org/10.33699/PIS.2022.101.7.300–311Overview
Chirurgické infekce kůže a měkkých tkání jsou bakteriální infekce postihující primárně kůži a měkké tkáně, u kterých je velmi často nutná chirurgická léčba. Tyto infekce zahrnují celou řadu patologických stavů, od jednoduchých povrchových infekcí, které jsou velmi časté a mají příznivou prognózu, až po hluboké a velmi závažné nekrotizující infekce, které jsou sice vzácnější, zato však způsobují trvalé funkční postižení a jsou potenciálně život ohrožujícím stavem. Dokument shrnuje současné poznatky ohledně diagnostiky a léčby těchto onemocnění a prezentuje tak klinikovi aktuální standardy péče o tyto pacienty v souladu s mezinárodními doporučeními. Zároveň jsou však zohledněna i regionální specifika, takže předkládaný diagnosticko-terapeutický management pro jednotlivé klinické formy těchto infekcí vždy respektuje i reálnou klinickou praxi v ČR. Dokument je zpracován na základě konsenzu oslovených odborníků z univerzitních pracovišť napříč celou ČR.
Klíčová slova:
diagnostika – léčba – infekce kůže a měkkých tkání – IKMT
ÚVOD
Chirurgické infekce kůže a měkkých tkání (IKMT) stojí tak trochu v pozadí zájmu chirurgů při srovnání s nitrobřišními infekcemi. Přesto se jedná o problematiku velmi častou. Dle dat z UZIS bylo v roce 2019 v ČR hospitalizováno 11 666 pacientů s diagnózou L00-L08 (infekce kůže a podkožního vaziva) [1]. Přitom počty ambulantně ošetřených pacientů s touto diagnózou dokonce mnohonásobně převyšují počty pacientů hospitalizovaných. Předkládaný text, který shrnuje současné poznatky ohledně diagnostiky a léčby chirurgických infekcí kůže a měkkých tkání, byl zpracován a je předkládán na základě konsenzu oslovených odborníků z univerzitních pracovišť napříč celou ČR.
OBECNÁ ČÁST
Definice
IKMT můžeme definovat jako bakteriální infekce postihující primárně kůži a měkké tkáně, u kterých je velmi často nutná chirurgická léčba. Jedná se o širší škálu klinicky odlišných onemocnění, která se manifestují zánětlivým procesem v některé z anatomických struktur – kůže, podkoží, fascie, svaly. Nejčastěji jsou postiženy horní a dolní končetiny, perineum a břišní stěna.
Klasifikace
Snaha o přesnou klasifikaci a roztřídění všech forem IKMT vedla k tomu, že do současnosti bylo publikováno několik klasifikačních schémat vytvořených na základě různých kritérií, jako jsou anatomická lokalizace, kauzální mikrobiální patogen, rychlost progrese, hloubka infekce nebo závažnost klinických projevů. Nejčastěji klasifikujeme IKMT podle postižených anatomických vrstev. Povrchové infekce se nacházejí v epidermální a dermální vrstvě (erysipel, impetigo, folikulitida, furunkly a karbunkly). Hluboké infekce se vyskytují v podkožní tkáni a mohou postihovat také fascie nebo svalové kompartmenty (abscesy, fasciitida nebo myonekróza). V roce 2014 byla pod záštitou WSES (World Society of Emergency Surgery) zveřejněna nová klasifikace IKMT (Tab. 1) [2]. Tato klasifikace vyčleňuje samostatně 3 skupiny infekcí s rozdílnou klinickou charakteristikou: infekce v místě chirurgického výkonu, IKMT bez nekróz a nekrotizující IKMT. Infekce v místě chirurgického výkonu představují samostatné téma mezi infekcemi měkkých tkání. Jedná se o pooperační infekce, které jsou vzhledem ke svým mnohostranným aspektům zarámovány do samostatné skupiny. IKMT bez nekróz mají příznivou prognózu a mohou být léčeny pouze antibiotiky nebo chirurgickou drenáží. Nekrotizující IKMT mají vážnou prognózu a jejich léčba vyžaduje multioborovou úzkou spolupráci mezi specialisty, chirurgy, mikrobiology, intenzivisty atd.
Table 1. WSES klasifikace chirurgických infekcí kůže a měkkých tkání
Tab. 1: WSES classification of surgical skin and soft tissue infections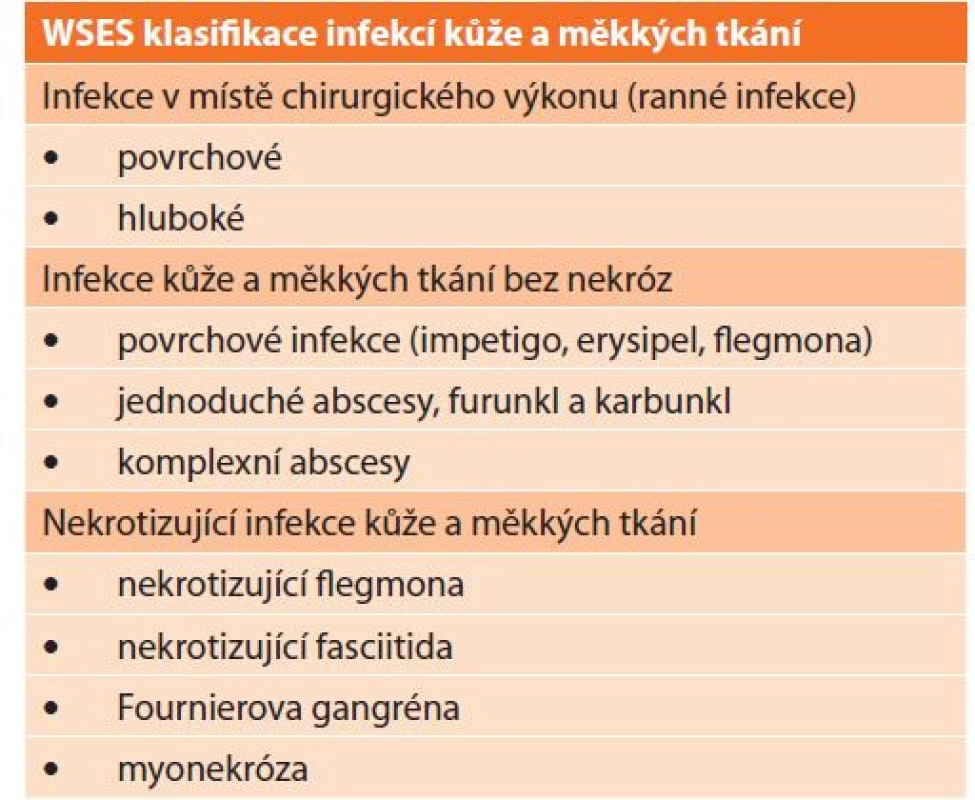
Převzato a upraveno ze Sartelli M et al. World Society of Emergency Surgery (WSES) guidelines for management of skin and soft tissue infections. World J Emerg Surg. 2014;9(1):57. Mikrobiální etiologie
IKMT postihující zdravou kůži jsou převážně monomikrobiální, způsobené aerobními grampozitivními koky, nejčastěji kmeny Staphylococcus aureus a β-hemolytickými streptokoky, především Streptococcus pyogenes. Tyto kmeny stafylokoků a streptokoků produkují řadu enzymů a toxinů, které umožňují invazi do dermis a potencují virulenci těchto bakterií. Současně je však třeba zdůraznit, že přibližně 17–30 % IKMT má polymikrobiální etiologii, zahrnující jak aerobní grampozitivní bakterie, tak i aerobní gramnegativní bakterie a anaerobní bakterie [3]. Se smíšenou mikrobiální etiologií se setkáváme zejména u infekcí v určitých anatomických lokalitách (axily, perineální oblast, genitofemorální oblast atd.).
Z klinického pohledu má pak velký význam výskyt multirezistentních bakterií. V kontextu IKMT je etiologicky nejvýznamnějším multirezistentním patogenem methicilin rezistentní Staphylococcus aureus (MRSA) [4]. Přitom MRSA asociované IKMT nejsou uniformní problematikou a je potřeba zohlednit, zda se jedná o komunitní MRSA (rezistence především na oxacilin/methicilin) nebo o nozokomiální MRSA (kromě rezistence na všechna β-laktamová antibiotika je často přítomna i rezistence na antibiotika z dalších nepříbuzných skupin). V současné době se dokonce zaměřuje pozornost i na animální oblast (hospodářská a domácí zvířata) jakožto epidemiologicky významný rezervoár MRSA v komunitě a zvažuje se rozšíření klasifikace o třetí skupinu – tzv. infekce LA-MRSA (livestock associated – infekce asociované s hospodářskými zvířaty). Komunitní MRSA je vysoce virulentní variantou (s častou produkcí Pantonova - Valentinova leukocidinu), která je epidemiologicky závažným problémem zejména v USA [4]. V Evropě je dominantním patogenem spíše méně virulentní nozokomiální MRSA, přičemž existují velké regionální rozdíly v prevalenci (Švédsko – 0,8 %, Řecko – 44 %) [5]. V ČR se sleduje výskyt invazivních MRSA izolátů z hemokultury a recentně se prevalence pohybuje okolo 12–13 % [6]. Kmeny MRSA v ČR mají většinou sdruženou rezistenci k makrolidům, linkosamidům, aminoglykosidům a fluorochinolonům, což je příčinou terapeutických obtíží. Virulentnější komunitní MRSA je aktuálně v ČR izolován jen sporadicky.
Vzhledem k tomu, že po mnoho let byly glykopeptidy antibiotikem volby u komplikovaných infekcí s grampozitivní etiologií, došlo k významnému nárůstu rezistence na vankomycin u enterokoků. Rezistence stafylokoků vůči glykopeptidům, jako např. u vankomycin intermediárního S. aureus (VISA) a vankomycin rezistentního S. aureus (VRSA), je však v ČR naštěstí stále vzácná.
Diagnostika
Základem diagnostiky je klinické vyšetření. Zejména při povrchových IKMT již samotné klinické vyšetření vede ke stanovení správné diagnózy a určení konkrétní formy IKMT, a to i bez dalších pomocných vyšetření. V případě nekrotizující fasciitidy nebo infekcí uložených hlouběji ve svalech může být zpočátku lokální symptomatologie chudá a diagnostika obtížnější. Pro klinicky nejednoznačné případy byl tedy navržen diagnosticko-terapeutický algoritmus zahrnující vybrané laboratorní markery a zobrazovací metody (Schema 1). Laboratorní vyšetření slouží především k diagnostice a monitoraci zánětu (leukocytóza, CRP, prokalcitonin, presepsin). Mezi další laboratorní biomarkery vhodné k diagnostice nekrotizujících IKMT patří laktát a myoglobin. Laktát je biomarker, který nás informuje o tkáňové ischemii, potažmo přítomnosti tkáňové nekrózy. Hladina myoglobinu se zvyšuje v důsledku rabdomyolýzy při nekróze svalů. Zobrazovací vyšetření by mělo poskytnout spíše informace o přesné lokalizaci, rozsahu a hranicích hlouběji uloženého zánětlivého procesu. CT nebo USG vyšetření tedy může být přínosné zejména při diagnostice subfasciálně lokalizovaných nekrotizujících infekcí. Také MRI přináší přesný obraz o závažnosti a rozsahu zánětlivého postižení měkkých tkání, avšak v průběhu pohotovostní služby není toto vyšetření vždy a všude dostupné. Velmi důležitou součástí diagnostického procesu je mikrobiologické vyšetření zahrnující izolaci a identifikaci mikrobiálního patogenu a stanovení citlivosti bakterie na antibiotika. Přitom velmi důležitou roli hrají správný odběr a transport biologického materiálu.
Schema 1: Doporučený algoritmus laboratorní diagnostiky infekce kůže a měkkých tkání
Scheme 1: Recommended algorithm for laboratory diagnosis of skin and soft tissue infections
Vysvětlivky: CRP – C reaktivní protein; IKMT – infekce kůže a měkkých tkání; KO+dif – krevní obraz a diferenciální rozpočet; PCT – prokalcitonin. Převzato z J. Ulrych Jan et al. Chirurgické infekce kůže a měkkých tkání. Praha, Galén 2020. Principy léčby
Základními modalitami léčby IKMT jsou antibiotická terapie a chirurgická léčba. V následujícím textu jsou uvedeny pouze principy léčby, konkrétní způsob léčby jednotlivých forem IKMT je uveden ve speciální části tohoto článku.
Obecné principy antibiotické léčby
Antibiotická terapie má v současné době nezastupitelnou úlohu v terapii IKMT a spolu s chirurgickým ošetřením je zlatým standardem v léčbě. Nevhodná či pozdě zahájená antibiotická léčba má nepříznivý dopad nejen na výsledek léčby pacienta (zvyšuje morbiditu i letalitu), ale i na náklady na léčbu pacienta (prodlužuje pobyt v nemocnici atd.). Přitom mezi nejčastější příčiny selhání antibiotické léčby patří právě neznalost etiologického mikrobiálního původce a narůstající rezistence bakterií k antibiotikům. Navíc kromě klinické účinnosti antibiotika je potřeba, aby si lékař byl vědom požadavku na klinickou bezpečnost (riziko komplikací, např. infekce vyvolaná Clostridioides difficile) a epidemiologickou bezpečnost (riziko selekce multirezistentních bakterií) antibiotické léčby. Proto volba správného antibiotika se dnes stává výzvou i pro odbornou veřejnost. Přitom IKMT často vyžadují bezodkladné zahájení antibiotické léčby, která má v současnosti svoje zásady a principy. Iniciální ATB léčba vychází ze znalosti předpokládaných mikrobiálních původců konkrétních klinických forem IKMT, přičemž před podáním antibiotik by měl být proveden odběr klinicky relevantního vzorku biologického materiálu na mikrobiologické vyšetření. Na základě zjištěných výsledků je pak antibiotická léčba upravena na tzv. cílenou antibiotickou terapii, která je již selektivně zaměřena na prokázaného původce infekce. U závažných forem IKMT jsou často iniciálně indikována širokospektrá antibiotika, která jsou dle výsledků vyšetření mikrobiální citlivosti a rezistence následně cíleně nahrazena antibiotikem s užším spektrem, které má přirozeně nižší selekční tlak – tzv. deeskalační princip. Návrh iniciální antibiotické léčby (perorálních antibiotik pro ambulantní léčbu a intravenózních antibiotik pro léčbu za hospitalizace) pro jednotlivé formy IKMT na základě předpokládaného mikrobiálního původce a doporučené dávkování antibiotik jsou uvedeny v tabulkách (Tab. 2, 3). Pro optimální antibiotickou léčbu IKMT je však vždy nejlepší aktivní spolupráce chirurga a klinického mikrobiologa.
Table 2. Doporučení ATB terapie u jednotlivých forem IKMT
Tab. 2: Recommendations for antimicrobial therapy of individual SSTI forms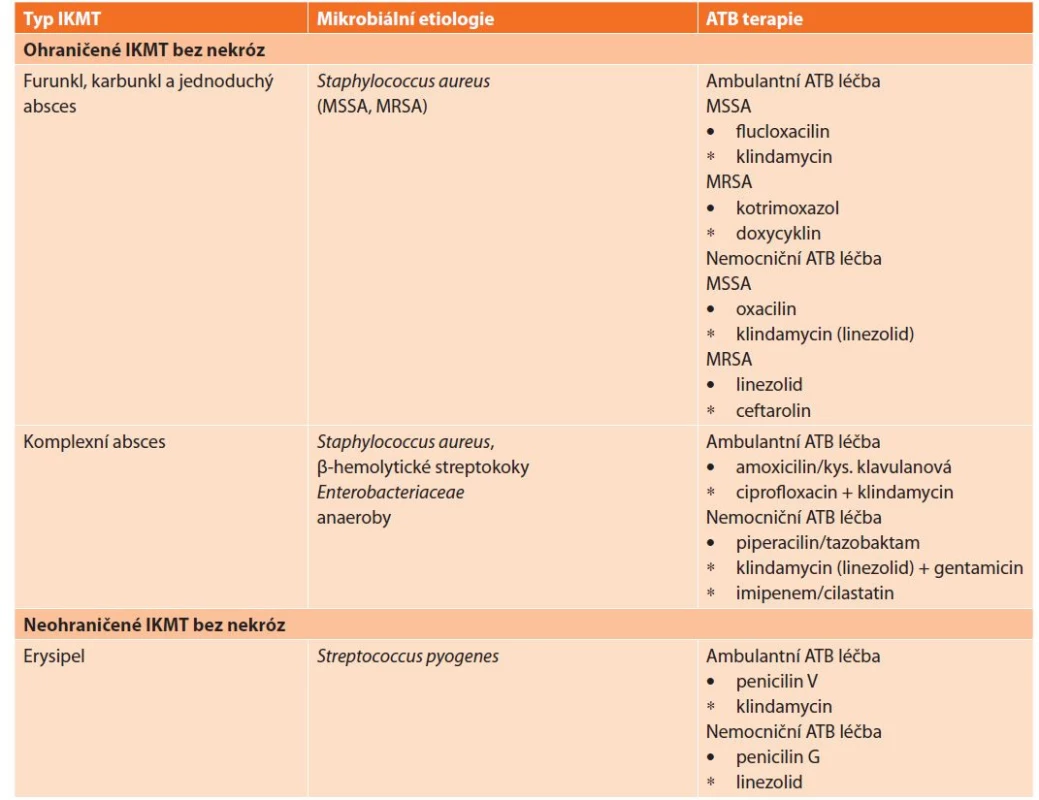

Vysvětlivky: MRSA = Staphylococcus aureus rezistentní k methicilinu, MSSA = Staphylococcus aureus citlivý k methicilinu
• antibiotika první volby
∗ alternativní antibiotikaTable 3. Dávkování doporučených antibiotik
Tab. 3: Dosage of recommended antibiotics

Vysvětlivka: ID – iniciální dávka Obecné principy chirurgické léčby
Chirurgická léčba má zcela zásadní postavení v terapii IKMT. V léčbě některých forem IKMT je samostatná chirurgická léčba dokonce plně dostačující (jednoduché kožní abscesy), v jiných případech je nezbytnou a klíčovou léčbou v rámci multioborové péče (nekrotizující IKMT). Principem chirurgické léčby v akutní fázi IKMT je sanace infekčního fokusu a zánětem poškozených tkání. Chirurgická léčba tak zahrnuje odstranění hnisavé kolekce chirurgickou incizí, evakuací hnisu a drenáží nebo odstranění infikované a nekrotické tkáně chirurgickým debridementem (v krajním případě i amputací). Správné a rychlé chirurgické ošetření má přitom zcela zásadní význam v léčbě IKMT a v případě nekrotizujících IKMT je tím nejdůležitějším faktorem určujícím úspěšnost celé léčby. Chirurgická léčba má své pevné postavení i v postakutním období u pacientů s nekrotizující IKMT s extenzivnější ztrátou kůže a měkkých tkání, kdy pokračuje hojení per secundam intentionem a chirurgická léčba může nabídnout definitivní reparaci anatomického poškození a obnovu fyziologických funkcí. To je doménou rekonstrukční a plastické chirurgie.
SPECIÁLNÍ ČÁST
Ohraničené IKMT bez nekróz
Impetigo a folikulitida jsou purulentní kožní infekce, které jsou léčeny primárně praktickými lékaři nebo dermatology a chirurgická léčba není u těchto pacientů indikována.
Jednoduchý absces, furunkl a karbunkl
Jednoduchý kožní absces je definován jako ohraničené kolikvované ložisko s fluktuací a se zarudnutím omezeným pouze na oblast abscesu, tedy bez přítomnosti flegmony v okolí. Tyto jednoduché abscesy jsou unilokulární a nešíří se hlouběji než do podkoží. Furunkl je povrchový hnisavý zánět, který se po destrukci vlasového folikulu šíří do dermis a podkožní tkáně, kde vytváří malou ohraničenou kolekci hnisu. Vyskytuje se na ochlupené části těla. Karbunkl vzniká splynutím několika furunklů. Diagnóza těchto forem kožních infekcí je stanovena na podkladě typického fyzikálního nálezu. Léčba jednoduchého abscesu a furunklu je primárně chirurgická a zahrnuje provedení incize, evakuace hnisu a drenáže. Lineární incize by měla mít dostatečnou délku, pokud možno paralelně s průběhem kožní štěpitelnosti. Následnou evakuaci reziduálního obsahu abscesové dutiny zajišťujeme vložením drénu. Pouze punkci abscesu jehlou nelze považovat za adekvátní terapii. U komplexnějších karbunklů je vhodné provést radikálnější excizi celé postižené oblasti. Antibiotická léčba není u malých abscesů standardně doporučována, a proto i rutinní odběr hnisu na mikrobiologické vyšetření (kultivace a citlivost) není vždy nezbytný [7,8]. Systémová antibiotická léčba je indikována pouze v určitých případech – velký absces (>4 cm), mnohočetné abscesy, obtížně nebo nedostatečně drénované abscesy, okolní flegmona, známky systémové toxicity, imunosuprese a závažné komorbidity včetně rizika infekční endokarditidy. Obvykle je v těchto případech dostačující krátkodobé podání antibiotik přibližně po dobu 5 dnů [9]. Pokud totiž po této době nedochází k regresi zánětu, je nutné pátrat po příčině selhání léčby a konzultovat další antibiotickou léčbu na základě výsledků mikrobiologického vyšetření.
Komplexní absces
Komplexní abscesy kůže a podkoží jsou většinou dobře ohraničené a jedná se o zánětlivé procesy v lokalitách, jako je perineum, perianální či periproktální oblast, a abscesy v místech vpichu po aplikaci drogy. Tyto abscesy mohou být multilokulární a septované. Diagnózu lze většinou určit na základě klinických projevů. Zobrazovací vyšetření může být užitečné, pokud pátráme po přítomnosti cizího tělesa, chceme posoudit vztah k důležitým strukturám (cévy) nebo chceme vyloučit alternativní diagnózu (pseudoaneurysma v třísle u intravenózního narkomana). Komplexní abscesy mají být vždy léčeny kombinací chirurgické incize a drenáže se systémovou antimikrobiální léčbou [7]. Základním cílem chirurgické léčby je odstranit kolekci hnisu. Pokud by to však vyžadovalo provedení neúměrně velké incize, lze zvážit provedení kontraincizí a zavedení drénů ke snadnému odvádění reziduálního obsahu abscesové dutiny i v pooperačním období. Součástí standardního chirurgického ošetření je i revize abscesové dutiny a přerušení sept u multilokulárního abscesu. Manuální revize abscesové dutiny bychom se měli vyvarovat v případě abscesů u intravenózních narkomanů s ohledem na riziko poranění o cizí těleso (zalomená jehla). Obecně jsou u komplexních abscesů doporučována širokospektrá antibiotika účinná na grampozitivní i gramnegativní bakterie včetně anaerobních [7]. Mikrobiální etiologie těchto abscesů je velmi široká a zahrnuje nejen endogenní bakterie přirozeně kolonizující kůži a slizniční povrchy, ale také exogenní bakterie z okolního prostředí. U intravenózních narkomanů může dojít ke kontaminaci z prostředí při přípravě nebo aplikaci drogy či užitím sdílené stříkačky a jehly. Systémová antibiotická léčba trvá obvykle 5–7 dní, nezřídka však bývá doba podání antibiotik prodloužena. Délka podání antibiotik u konkrétního pacienta je vždy určována hlavně rozsahem lokálního postižení a klinickou odezvou na ATB léčbu.
Neohraničené IKMT bez nekróz
Neohraničené IKMT jsou obecně charakterizovány difuzním purulentním zánětem, kdy nedochází k ohraničení zánětu a kolikvaci ani primárně nevzniká nekróza. Proto jsou tyto infekce indikovány iniciálně k systémové antibiotické léčbě. Chirurgická léčba má své opodstatnění v případě komplikací, konkrétně při sekundárním rozvoji abscesu v terénu erysipelu nebo flegmony. Také u specifických flegmón v terénu preexistujících kožních lézí je samostatná systémová antibiotická léčba nedostatečná bez adekvátní chirurgické sanace postižené kůže.
Erysipel
Erysipel je akutní infekční zánět kůže postihující dermis. Erysipel je způsoben nejčastěji β-hemolytickým streptokokem skupiny A (Streptococcus pyogenes), streptokoky skupiny C a G se uplatňují méně často. Charakteristické pro erysipel je zarudnutí kůže, které bývá lehce vyvýšené a ostře ohraničené, do okolí se šíří tzv. jazykovými výběžky („plameny ohně na horní hranici zarudnutí“). Ve spádové oblasti může být hmatná bolestivá lymfadenopatie. Typické jsou i systémové projevy, jako jsou horečka s třesavkou, malátnost, někdy i nauzea a zvracení. Terapie erysipelu spočívá primárně v systémové léčbě antibiotiky (10–14 dní), potřeba je však i symptomatická léčba (klidový režim, elevace končetiny atd.) [8,9]. I přes úspěšnou konzervativní léčbu dochází často k recidivám.
Flegmona
Flegmona je definována jako akutní bakteriální infekce kůže a podkožních tkání (CAVE – v anglicky psané literatuře se používá termín „cellulitis“). Rozlišujeme dvě základní formy flegmony – prostou flegmonu a specifické flegmony. Prosté flegmony vznikají v terénu zdravé kůže průnikem bakterií v místě drobných kožních lézí (ragády, trhliny, mykotické onemocnění). Specifické flegmony jsou heterogenní skupinou IKMT, které vznikají v terénu již primárně závažně poškozené kůže nebo v důsledku typického inzultu (pokousání, intravenózní aplikace drogy).
Prosté flegmony
Nejčastějším etiologickým agens jsou streptokoky (zejména Streptococcus pyogenes) a stafylokoky (konkrétně Staphylococcus aureus). Streptokoky vytvářejí difuznější a rychleji se šířící formu flegmony, zatímco stafylokokové flegmony jsou více ohraničené. V diagnostice je zásadní pečlivé klinické vyšetření, které odhalí kromě lokálních známek zánětu (lokální zvýšení teploty, zarudnutí, otok, bolestivost a lymfangoitida) i systémové projevy (horečka, leukocytóza). V rámci diagnostiky je nezbytné vyloučit komplikace vyžadující chirurgickou intervenci – vytvoření abscesu a rozvoj nekrózy. Pro tyto účely je někdy vhodné provést zobrazovací vyšetření (USG nebo CT), které nejenže komplikace odhalí, ale lze je využít i k navigované intervenci (cílená incize a drenáž). Principem léčby prosté flegmony je systémová antibiotická terapie (5–10 dní) zaměřená na výše uvedená bakteriální species [8,9]. V indikovaných případech je potřeba nasadit antibiotika s účinností na MRSA (např. při potvrzeném záchytu MRSA v předcházejících mikrobiologických vyšetřeních) [9]. Nedílnou součástí léčby je i symptomatická terapie a profylaxe žilního tromboembolismu. V případě rozvoje abscedující flegmony se provádějí incize a drenáž, při sekundárním rozvoji nekrózy je nezbytná chirurgická nekrektomie a debridement.
Specifické flegmony
Pro specifickou flegmonu je charakteristická přítomnost preexistující kožní léze nebo vznik v důsledku typického inzultu. Patří sem flegmony v terénu trofických defektů kůže, popálenin a dekubitů nebo flegmony u intravenózních narkomanů či po kousnutí zvířetem. Společným rysem těchto infekcí je, že pokud nejsou adekvátně léčeny, mohou progredovat v závažnější formy IKMT.
Flegmony v terénu dekubitů, popálenin a trofických defektů kůže jsou typicky polymikrobiální infekce, na nichž se často podílejí jak aerobní či fakultativně anaerobní bakterie (Staphylococcus aureus, Enterococcus sp., Proteus mirabilis, Escherichia coli, Pseudomonas sp.), tak i anaerobní bakterie (Peptococcus sp., Bacteroides fragilis, Clostridium perfringens). Stěry odběrovou štětkou z povrchu kůže či defektu přitom většinou informují pouze o kolonizujících bakteriích a skutečnou bakteriální etiologii infekce odhalí až vzorky biologického materiálu odebraného z hlubokých tkání po provedeném chirurgickém debridementu. Klinická diagnostika flegmony není obtížná, daleko náročnější je však stanovení rozsahu a hloubky infekce. V případě flegmony v terénu trofických defektů, jako jsou ischemické a diabetické periferní gangrény, je nezbytné provedení RTG vyšetření k vyloučení osteomyelitidy. Diagnostika infekce ulcerace při syndromu diabetické nohy je založená na precizním klinickém vyšetření na třech úrovních – celkové vyšetření pacienta (systémové klinické projevy, laboratorní vyšetření), vyšetření postižené končetiny (kromě klinického vyšetření je klíčové posouzení cévního zásobení) a vyšetření vlastní ulcerace (vypracována jsou různá klasifikační schémata, např. IWGDF-IDSA) [10]. Také v případě dekubitů je naprosto kruciální rozlišit neinfikované dekubity a dekubity s rozvojem flegmony a s infekcí hlubokých tkání. Nesprávné stanovení rozsahu infekce může vést k tzv. „undertreatment“ nebo „overtreatment“, v obou případech se pak jedná o poškození pacienta. Principem léčby u těchto specifických flegmon je vždy kombinace chirurgické intervence a systémové antibiotické léčby. Podmínkou k podání antibiotik jsou systémové projevy infekce, lokální progrese zánětu nebo ostomyelitida, v žádném případě není indikací k zahájení ATB léčby pouze pozitivní výsledek mikrobiologického vyšetření z povrchu defektu [9]. Cílem chirurgické léčby je sanace infekčního fokusu odstraněním nekrotických tkání a provedením chirurgického debridementu do zdravé tkáně [7]. U periferních gangrén je často nutné předřadit před plánovaný cévně-rekonstrukční výkon chirurgickou sanaci periferního infekčního fokusu. Někdy je však amputace jedinou možností, jak ukončit torpidní lokální infekci způsobující chronickou sepsi.
Častý výskyt IKMT u intravenózních narkomanů souvisí s parenterální aplikací drog, respektive s nesterilním způsobem jejich aplikace (vzájemné půjčování jehel, sdílení pomůcek k přípravě drogy, nesterilní podmínky při přípravě drogy atd.). Důvodem k častým IKMT je právě i způsob aplikace, konkrétně pak opakovaná podkožní nebo nitrosvalová aplikace drogy při absenci periferního žilního vstupu u letitých narkomanů. Pokročilejší zánět a závažnější průběh IKMT je u těchto pacientů určován jak systémovými faktory (imunodeficience, chronické infekce – HIV, HBV, HCV), tak i lokálními faktory (flebotrombóza, lokální cévní spasmy po aplikaci drogy). Charakteristické jsou i život ohrožující septické komplikace, jako je infekční endokarditida. Původcem bývají obvykle stafylokoky (zejména Staphylococcus aureus), streptokoky, gramnegativní bakterie včetně Pseudomonas aeruginosa, anaeroby, ale i Candida sp. Terapie IKMT u intravenózních narkomanů se v principech neliší od léčby IKMT v běžné populaci. Nepříznivý průběh a horší výsledky léčby jsou často způsobeny také nedodržováním léčebného režimu, odmítáním dlouhodobé léčby, špatnou hygienou a malnutricí.
Infekce je nejčastější komplikací po kousnutí zvířetem nebo člověkem. Přitom riziko rozvoje flegmony je determinováno mnoha faktory, avšak tím nejpodstatnějším je právě bakteriální flora v dutině ústní zvířete či člověka. Riziko infekce se liší v závislosti na typu kousnutí a je například vyšší po kousnutí kočkou (30–50 %) než po kousnutí psem (5–25 %) [9]. Převážně se tedy jedná o patogeny pocházející z dutiny ústní zraňujícího zvířete nebo z povrchu kůže zraněného jedince. Spolu se stafylokoky (včetně MRSA) a streptokoky (včetně Streptococcus pyogenes) jsou běžně zachycenými patogeny Pasteurella sp. (Pasteurella multocida, Pasteurella canis, Pasteurella dagmatis), Capnocytophaga canimorsus nebo anaerobní bakterie (Fusobacterium sp., Prevotella sp., Bacteroides sp., Porphyromonas sp.). Mikrobiální spektrum nejčastějších patogenů se však významně liší v závislosti na konkrétním druhu zvířete [11]. Při kousnutí mohou být přeneseny také virové infekce. Při pokousání člověkem je potřeba zvážit riziko HIV či virové hepatitidy B a C, při pokousání zvířetem musíme myslet na riziko vztekliny. Nejefektivnější je infekci v ráně předcházet. Chirurgické ošetření rány zahrnuje revizi rány s odstraněním cizích předmětů a devitalizované tkáně. Redukci bakteriální kontaminace dosáhneme mechanicky důkladnou laváží rány. Primární uzávěr rány není doporučován, avšak ve vybraných případech lze připustit adaptační suturu okrajů. Výjimku tvoří pouze rány v obličeji, které z kosmetických důvodů ošetřujeme primární suturou po předchozí důkladné revizi, laváži a debridementu rány [8]. Rutinní podávání antibiotické profylaxe u ran způsobených kousnutím není ve standardech obecně doporučováno [9]. Jedná se však o rány s vysokým rizikem rozvoje infekce a v klinické praxi se antibiotika často podávají, konkrétně jsou pak indikována u imunosuprimovaných pacientů, u středně až velmi závažných ran (zejména na rukou, obličeji, genitálu), u poranění zasahující k fascii, svalu, periostu a do kloubního pouzdra nebo u pacientů s implantovaným cizorodým materiálem (srdeční chlopně), a to v délce 3–5 dní [9]. Antibiotika by neměla být profylakticky podávána u ran starších 24 hodin, pokud nejsou přítomny známky infekce.
Nekrotizující IKMT
Nekrotizující IKMT jsou poměrně vzácné infekce, velkou pozornost a odlišení od ostatních forem IKMT si však zaslouží pro jejich závažný průběh a velmi nepříznivou prognózu. Navíc nekrotizující IKMT postihují jak staré a polymorbidní pacienty, kteří jsou obecně velmi náchylní k infekcím, tak i mladé a zdravé lidi bez jakýchkoliv predisponujících faktorů. Tyto infekce jsou nejčastěji klasifikovány podle lokalizace a primárně postižené anatomické vrstvy – nekrotizující fasciitida, nekrotizující myositida, plynatá sněť (gangraena emphysematosa), Fournierova gangréna, nekrotizující mastitida atd. Ačkoliv bylo popsáno mnoho specifických variant nekrotizujících IKMT, počáteční přístup k diagnostice, chirurgické intervenci a antibiotické léčbě je u všech forem podobný. Rychlá identifikace nekrotizujících infekcí, které obecně vyžadují okamžitou agresivní léčbu, je důležitější než určení konkrétní varianty. Z mikrobiologického pohledu se jedná o onemocnění monomikrobiální (typ II), vyvolané nejčastěji kmeny Streptococcus pyogenes nebo Staphylococcus aureus (včetně MRSA) nebo o onemocnění polymikrobiální (typ I) s významným podílem anaerobních bakterií (zejména Clostridium sp.), ale i dalších enterobakterií (např. Escherichia coli, Proteus sp.) [12,13]. Charakteristickou vlastností těchto bakterií je schopnost produkovat specifické toxiny a enzymy, které jsou důležitými faktory virulence zodpovědné za lokální i systémové projevy nekrotizujících IKMT (Pantonův - Valentinův leukocidin atd.) [12]. Z patofyziologického pohledu je pro nekrotizující IKMT typický nekrotický zánětlivý proces s fulminantním průběhem a časnými projevy systémové toxicity v podobě septického šoku. Klinická symptomatologie nekrotizující IKMT je zpočátku nespecifická s velice chudým lokálním nálezem. Iniciálně je často jediným alarmujícím příznakem intenzivní, až nesnesitelná bolest, která se šíří daleko za hranice kožního zarudnutí. Lokálně je patrná spíše indurace, zarudnutí je většinou diskrétní. Stanovení správné diagnózy v časném období je velice obtížné, až v podstatě nemožné, pokud sám vyšetřující lékař aktivně nepomýšlí na nekrotizující infekci. V pozdní fázi, která ovšem nastupuje již za 12–24 hodin, se už objevují příznaky specifické pro nekrotizující IKMT – ekchymózy, buly, nekrózy, krepitace, emfyzém, hypestezie. Klinický obraz se může zhoršovat velmi rychle, někdy se již během několika hodin přidružují příznaky systémové toxicity, jako jsou horečky, malátnost, únava, tachykardie, hypotenze a porucha vědomí. Při diagnostice nekrotizující IKMT lze využít laboratorních biomarkerů a zobrazovacích vyšetření (viz Obr. 1). Přestože laboratorní testy nejsou zpočátku pro nekrotizující IKMT příliš specifické, právě zdánlivá neshoda mezi relativně chudým lokálním klinickým nálezem a vysokými hodnotami biomarkerů zánětu či tkáňového poškození bývá charakteristická a může napomoci k odhalení nekrotizující infekce již v časné fázi. Léčba pacientů s nekrotizující IKMT je typickým příkladem komplexní terapie vyžadující multioborovou spolupráci, naprosto kruciální je však léčba chirurgická [7,14]. Chirurgická léčba má svoje pevné postavení nejen v rámci urgentní léčby při sanaci infekčního fokusu, ale zásadním způsobem se uplatňuje i plastická chirurgie při rekonstrukčních výkonech v postakutní fázi onemocnění. Současná doporučení zdůrazňují zejména rychlost chirurgického debridementu (<6 hodin od přijetí) [9], protože každé oddálení chirurgické léčby je spojeno se zhoršující se prognózou a vyšší letalitou. Strategie urgentního chirurgického výkonu se posunula od původně čistě život zachraňujících operací (amputační výkony) ve prospěch chirurgických výkonů, které kromě záchrany života kladou stále větší důraz také na kvalitu života. Základním předpokladem úspěšné léčby je však vždy chirurgický debridement – odstranění všech avitálních infikovaných a nekrotických tkání, ať už je postižena kůže, fascie nebo sval. Chirurgický debridement by měl být vždy proveden na operačním sále, kde lze nejlépe provést dostatečné obnažení a bezbolestné vyšetření rány. Typickým nálezem u progredující nekrotizující IKMT je koagulační nekróza tkání a přítomnost kalné tekutiny připomínající „vodu na nádobí“. Zásadní význam má i odběr biologického vzorku tkáně k mikrobiologickému vyšetření, a to nejlépe z hloubky na rozhraní mezi zdravými a nekrotizovanými tkáněmi. V současné době se můžeme setkat se dvěma odlišnými chirurgickými přístupy – tradiční radikální chirurgický debridement a kůži šetřící chirurgický debridement. Podstatou tradičního konceptu radikálního chirurgického debridementu je provedení širokých excizí postižených měkkých tkání současně i s odstraněním přilehlé kůže. Extenzivní odstranění kožního krytu však vede ke vzniku rozsáhlých komplexních ranných ploch, které jsou příčinou následné dlouhodobé morbidity. Principem kůži šetřícího chirurgického debridementu je odstranění pouze jasně nekrotické fascie či avitální tkáně z podkoží a zároveň zachování maxima vitální kůže pro pozdější snazší hojení ranných ploch a lepší možnosti rekonstrukce. Obavy z kůže ponechané nad tkáněmi postiženými fulminantním zánětem jsou zcela neopodstatněné za předpokladu provedení dostatečně velkých incizí a kontraincizí, které umožňují kompletní exploraci a dostatečný radikální chirurgický debridement. Vzhledem k rychle progredujícímu charakteru nekrotizující infekce je nezbytnou součástí chirurgické strategie provedení časné operační revize (second-look za 12–24 hodin) k posouzení lokálního vývoje nekrotizujícího zánětu [7]. Opakované operační revize s chirurgickým debridementem jsou téměř standardem a měly by být prováděny, dokud nejsou odstraněny všechny avitální tkáně [9]. Případná perzistující či progredující sepse totiž bývá způsobena právě podceněním nutnosti opakované explorace, oddalováním chirurgických revizí a nedostatečnou chirurgickou sanací postižených měkkých tkání. Definitivní rekonstrukce kožního krytu velkých ranných ploch, které vznikly v důsledku urgentního chirurgického debridementu, je většinou obtížná a složitá. Univerzální rekonstrukční možností je krytí kožními autotransplantáty – dermoepidermálními štěpy. Tento způsob rekonstrukce je však spojen s nepříznivým kosmetickým efektem, sníženou elasticitou kožního krytu a častou tvorbou kontraktur a erozí. Zachování dostatečného množství dobře vaskularizované okolní kůže umožňuje zvažovat v rámci definitivního krytí ranné plochy i další metody rekonstrukční chirurgie, jako jsou místní a vzdálené laloky. Rekonstrukčnímu chirurgickému výkonu však předchází často zdlouhavá a náročná péče o ránu, jejímž cílem je po ukončení chirurgického debridementu ránu zklidnit a připravit vhodné lokální podmínky. S výhodou lze k lokální léčbě využít podtlakovou terapii, která obecně urychluje hojení ran tím, že aktivně odstraňuje z rány bakterie a tkáňovou drť, zvyšuje kapilární cirkulaci a podporuje endoteliální i epiteliální migraci. Nepostradatelnou součástí komplexní terapie nekrotizujících IKMT je aplikace antibiotik. Iniciálně se doporučují antibiotika se širokým spektrem (pokrytí grampozitivních i gramnegativních bakterií včetně anaerobních), které musí zahrnovat také antibiotika inhibující proteosyntézu, resp. produkci bakteriálních toxinů (linezolid, klindamycin) [7,8,9]. Iniciální antibiotickou terapii je vhodné v následujícím období upravit na základě výsledků mikrobiologického vyšetření na léčbu cílenou. Mezi metody nově diskutované v souvislosti s léčbou nekrotizující IKMT patří hyperbarická oxygenoterapie, intravenózní podání imunoglobulinu nebo modulace zánětlivé reakce organismu preparátem reltecimod (syntetický antagonista zabraňující vazbě superantigenu na receptor CD28 na povrchu Th - 1-lymfocytů). Pro žádnou z těchto modalit však doposud neexistují dostatečné podklady na úrovni Evidence - -based medicine pro jejich zařazení do standardního algoritmu léčby nekrotizujících IKMT [15,16]. Také intenzivní péče a podpůrná léčba jsou důležitou součástí komplexní multioborové terapie [14]. Přesto jsou nekrotizující IKMT provázeny vysokou hospitalizační letalitou (20–30 %) a pacienti mají dlouhodobě signifikantně zhoršenou kvalitu života po fyzické, emoční i sociální stránce [17].
ZÁVĚR
Principy správné klinické praxe jsou předpokladem k úspěšné léčbě a většinou vycházejí z obecných doporučení (standardů), která by měla být vždy aktualizována na základě nových poznatků. Výše uvedený text byl zpracován v souladu s recentně publikovanými mezinárodními doporučeními léčby IKMT (WSES/GAIS/ WSIS/SIS-E/AAST) a přináší aktuální chirurgický pohled na problematiku těchto významných infekcí. Zároveň však respektuje regionální specifika a možnosti běžné klinické praxe v ČR. Jedním z takových specifik je třeba mikrobiální epidemiologická situace v ČR, což je naprosto podstatné pro volbu optimální antibiotické léčby. Chirurgovi, který nemá aktuálně možnost konzultovat podání antibiotik na spádovém ATB centru, tak můžeme nabídnout alespoň rámcový návod pro volbu nejvhodnějšího antibiotika a částečně tak eliminovat riziko selhání ATB léčby.
Seznam zkratek:
ATB – antibiotika
CRP – C-reaktivní protein
HBV – virus hepatitidy typu B
HCV – virus hepatitidy typu C
HIV – virus lidské imunodeficience
IKMT – infekce kůže a měkkých tkání
IWGDF-IDSA – International Working Group on the Diabetic Foot – Infectious Diseases Society of America
MRSA – methicilin rezistentní Staphylococcus aureus
LA-MRSA – livestock associated – methicilin rezistentní Staphylococcus aureus
SSTI – skin and soft tissue infection
VISA – vankomycin intermediárně citlivý Staphylococcus aureus
VRSA – vankomycin rezistentní Staphylococcus aureus
WSES – World Society of Emergency Surgery
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
doc. MUDr. Jan Ulrych, Ph.D.
I. chirurgická klinika – hrudní, břišní a úrazové chirurgie
VFN a 1. LF UK v Praze
e-mail: Jan.Ulrych@vfn.cz
orcid: 0000-0002-5225-9562
Sources
1. https://www.uzis.cz/res/f/008357/hospit2019. pdf/str.45
2. Sartelli M, Malangoni MA, May AK, et al. World Society of Emergency Surgery (WSES) guidelines for management of skin and soft tissue infections. World J Emerg Surg. 2014;9(1):57. doi:10.1186/1749-7922-9-57.
3. Jenkins TC, Knepper BC, Jason Moore S, et al. Microbiology and initial antibiotic therapy for injection drug users and non-injection drug users with cutaneous abscesses in the era of community - associated methicillin-resistant Staphylococcus aureus. Acad Emerg Med. 2015;22(8):993–997. doi:10.1111/ acem.12727.
4. Moet GJ, Jones RN, Biedenbach DJ, et al. Contemporary causes of skin and soft tissue infections in North America, Latin America, and Europe: report from the SENTRY Antimicrobial Surveillance Program (1998–2004). Diagn Microbiol Infect Dis. 2007;57(1):7–13. doi:10.1016/j. diagmicrobio.2006.05.009.
5. Tiemersma EW, Bronzwaer SL, Lyytikäinen O, et al. European Antimicrobial Resistance Surveillance Systém Participants. Methicillin-resistant Staphylococcus aureus in Europe, 1999–2002. Emerg Infect Dis. 2004;10(9):1627–34. doi:10.3201/ eid1009.040069.
6. https://www.ecdc.europa.eu/sites/default/ files/documents/Country%20summaries - AER-EARS-Net%20202019.pdf
7. Sartelli M, Guirao X, Hardcastle TC, et al. 2018 WSES/SIS-E konsensus conference: recommendations for the management of skin and soft-tissue infections. World J Emerg Surg. 2018;13 : 58. doi:10.1186/ s13017-018-0219-9.
8. Stevens DL, Bisno AL, Chambers HF, et al. Practice guidelines for the diagnosis and management of skin and soft tissue infections: 2014 update by the Infectious Diseases Society of America. Clin Infect Dis. 2014;59(2):e10–52. doi:10.1093/cid/ ciu444.
9. Sartelli M, Coccolini F, Kluger Y, et al. WSES/ GAIS/WSIS/SIS-E/AAST global clinical pathways for patiens with skin and soft tissue infections. World J Emerg Surg. 2022;17(1):3. doi:10.1186/s13017-022-00406-2.
10. Lipsky BA, Aragón-Sánchez J, Diggle M, et al. IWGDF guidance on the diagnosis and management of foot infections in persons with diabetes. Diabetes Metab Res Rev. 2016;32 Suppl 1 : 45–74. doi:10.1002/ dmrr.2699.
11. Abrahamian FM, Goldstein EJ. Microbiology of animal bite wound infections. Clin Microbiol Rev. 2011;24(2):231–246. doi:10.1128/CMR.00041-10.
12. Tessier JM, Sanders J, Sartelli M, et al. Necrotizing soft tissue infections: A focused review of pathophysiology, diagnosis, optative management, antimicrobial therapy, and pediatrics. Surg Infect (Larchmt). 2020;21(2):81–93. doi:10.1089/sur.2019.219.
13. van Stigt SF, de Vries J, Bijker JB, et al. Review of 58 patients with necrotizing fasciitis in the Netherlands. World J Emerg Surg. 2016;11 : 21. doi:10.1186/s13017 - 016-0080-7.
14. Gatti M, Gasparini LE, Laratta M, et al. Intensive multidisciplinary management in critical care patiens affected by severe necrotizing soft tissue infections: a cooperative method to improve the efficacy of treatment. Eur J Clin Microbiol Infect Dis. 2019;38(6):1153–1162. doi:10.1007/ s10096-019-03521-2.
15. Levett D, Bennett MH, Millar I. Adjunctive hyperbaric oxygen for necrotizing fasciitis. Cochrane Database Syst Rev. 2015;1(1):CD007937. doi:10.1002/14651858.CD007937.pub2.
16. Hua C, Bosc R, Sbidian E, et al. Interventions for necrotizing soft tissue infections in adults. Cochrane Database Syst Rev. 2018;5(5):CD011680. doi:10.1002/14651858.CD011680.pub2.
17. Hakkarainen TW, Kopari NM, Pham TN, et al. Necrotizing soft tissue infections: review and current concepts in treatment, systems of care, and outcomes. Curr Probl Surg. 2014;51(8):344–362. doi:10.1067/j. cpsurg.2014.06.001.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2022 Issue 7-
All articles in this issue
- Mikrobiologie v chirurgii
- Současná diagnostika a léčba chirurgických infekcí kůže a měkkých tkání
- Analýza mikrobiálních nálezů z peritoneální tekutiny pacientů s perforovaným peptickým vředem – retrospektivní observační studie
- Ohlédnutí za infekcemi cévních rekonstrukcí na chirurgické klinice v Plzni
- Laparoskopická sutura perforovaného peptického vředu – rutina, nebo cílený výběr pacientů?
- Benigní stenóza společného žlučovodu po Roux-Y gastrektomii
- Obří agresivní intraabdominální fibromatóza desmoidního typu kazuistika
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Současná diagnostika a léčba chirurgických infekcí kůže a měkkých tkání
- Obří agresivní intraabdominální fibromatóza desmoidního typu kazuistika
- Laparoskopická sutura perforovaného peptického vředu – rutina, nebo cílený výběr pacientů?
- Benigní stenóza společného žlučovodu po Roux-Y gastrektomii
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career



