-
Medical journals
- Career
Kvalita života pacientů po transanální totální mezorektální excizi – naše zkušenosti
Authors: M. Svoboda; V. Procházka; T. Grolich; Z. Kala
Authors‘ workplace: Chirurgická klinika Fakultní nemocnice Brno a Lékařské fakulty Masarykovy univerzity v Brně
Published in: Rozhl. Chir., 2021, roč. 100, č. 11, s. 534-542.
Category: Original articles
doi: https://doi.org/10.33699/PIS.2021.100.11.534–542Overview
Úvod: Funkční výsledky a kvalita života (QoL) pacientů po transanální totální mezorektální excizi (TaTME) jsou důležitou součástí hodnocení této metody ve srovnání s ostatními přístupy k TME. Po resekci rekta se setkáváme nejčastěji se střevními, urologickými a sexuálními dysfunkcemi. V této studii přinášíme přehled výsledků hodnocení kvality života u pacientů z našeho pracoviště po TaTME a výsledky v diskuzi srovnáváme s literaturou ve světě.
Metody: Kvalita života byla zjišťována dotazníkovým šetřením. Celkem bylo hodnoceno 54 pacientů. Byl použit obecný dotazník pro nádorová onemocnění od European Organisation for Research and Treatment of Cancer (EORTC) QLQ-C30 a specifický dotazník pro kolorektální problematiku EORTC-QLQ-CR29. U všech pacientů byl rovněž zaznamenán low anterior resection syndrome (LARS). Follow-up byl průměrně 42,65 měsíce v rozmezí 9–91.
Výsledky: Průměrná hodnota LARS skóre u pacientů po TaTME byla v naší studii 30,7 s častějším zastoupením major LARS v 64,2 %. Ze všech symptomů v EORTC-QLQ-C30 dotazníku u pacientů po TaTME jsou nejzávažnější průjem (30,25), únava (23,87) a insomnie (20,37). V QLQ-CR29 dotazníku to jsou flatulence (50,94), fekální inkontinence (45,06) a frekvence stolice (35,19). Výsledky EORTC dotazníků QoL po TaTME jsou značně heterogenní.
Závěr: Kvalita života v našem souboru pacientů s pokročilými nádory rekta a 81,5% zastoupením neoadjuvantní terapie po TaTME je srovnatelná s výsledky v současné literatuře. Nejzávažnější anorektální symptomy ovlivňující QoL po TaTME jsou flatulence, fekální inkontinence a frekvence stolice. Mezi další závažné symptomy po TaTME patří únava a insomnie. LARS po TaTME jsme zaznamenali u 73,6 % pacientů s větším podílem major LARS.
Klíčová slova:
transanální totální mezorektální excize − kvalita života − funkční výsledky − syndrom nízké přední resekce − EORTC
ÚVOD
Jedním z aktuálních témat v minimálně invazivní chirurgii rekta je sledování funkčních výsledků a kvality života (QoL). V posledním desetiletí jsme mohli pozorovat postupnou implementaci metody TaTME do praxe, která byla provázena především hodnocením onkologických výsledků ve srovnání s ostatními metodami, zejména s laparoskopickou totální mezorektální excizí (lapTME). Metoda TaTME si získala své místo především u nízko uložených tumorů středního a distálního rekta, obézních pacientů a u pacientů s úzkou pánví, kdy je transabdominální preparace velmi náročná [1]. Právě onkologické výsledky jsou již od počátku zavedení TaTME do praxe příčinou obav a potenciální kritiky. Z krátkodobých výsledků je zřejmé, že z hlediska četnosti pozitivity cirkumferenční resekční linie (CRM) a kvality TME, tedy prognostických ukazatelů rizika lokální recidivy (LR), je metoda TaTME srovnatelná s laparoskopickou i otevřenou TME [2]. Konkrétní operační metodu k provedení TME je však třeba hodnotit nejen podle onkologických výsledků, ale také podle výsledků funkčních, které mají významný dopad na QoL. U pacientů po resekci rekta se setkáváme především s potížemi při vyprazdňování, souhrnně nazývanými jako syndrom nízké přední resekce (low anterior resection syndrome – LARS). Mezi mechanismy vedoucí k funkčním poruchám patří redukce objemu neorekta, poškození vegetativních nervů (jak při radioterapii, tak při operačním výkonu), ztráta rekto-análního inhibičního reflexu a poškození svěračů. Po operaci pacienti nejčastěji trpí průjmy, inkontinencí stolice a únavou. Nezanedbatelné jsou také urologické a sexuální dysfunkce. Všechny tyto potíže mají vliv na výslednou QoL pacienta, a tudíž jsou i u metody TaTME nezbytnou součástí jejího hodnocení. V naší studii přinášíme přehled výsledků hodnocení kvality života u pacientů z našeho pracoviště po TaTME a výsledky v diskuzi srovnáváme s literaturou ve světě.
METODY
Na Chirurgické klinice Fakultní nemocnice v Brně jsme od začátku roku 2014 do konce roku 2020 provedli celkem 106 operací pro adenokarcinom konečníku metodou TaTME. Kvalitu života jsme zjišťovali dotazníkovým šetřením, a to telefonicky, nebo přímo v ambulanci. Všichni pacienti byli o povaze studie informováni a udělili souhlas se zařazením do ní. Z celkového počtu 106 pacientů bylo dotazníkem osloveno 79 pacientů, 27 pacientů v době analýzy již zemřelo. Příčinou úmrtí pacientů, kteří v době analýzy již zemřeli, byla progrese onkologického onemocnění (17 pacientů mělo synchronní metastatické postižení) a v jednom případě suicidium. Žádný z pacientů nezemřel v důsledku operace či chirurgických komplikací. Délka života do úmrtí po operaci byla průměrně 30,5 měsíce (medián 31,6 měsíce). Ze 79 pacientů dotazník nevyplnilo nebo se nepodařilo kontaktovat 15 pacientů, kteří logicky nebyli zahrnuti do hodnocení. Dalších 10 pacientů, kteří sice dotazník vyplnili, ale do studie zahrnuti nebyli, protože v době analýzy mají stomii, bylo vyřazeno. Celkem bylo k hodnocení výsledků zahrnuto 54 pacientů. Kolostomie byla provedena u tří pacientů po dokončení abdominoperinální resekce (APR) pro ischemii střeva. U jednoho pacienta byla provedena APR z důvodu LR. Dva pacienti preferovali ponechání ileostomie z obav inkontinence. Další dva pacienti měli ponechanou ileostomii z důvodu pokračující chemoterapie pro satelitní ložiska v játrech. Jeden pacient měl znovu vyvedenou ileostomii pro pokročilost onemocnění a poslední pacient má ileostomii z důvodu komplikovaného průběhu po pokusu o zrušení protektivní ileostomie. Kvalita života byla zjišťována pomocí široce využívaných dotazníků EORTC-QLQ-C30 a EORTC-QLQ-CR29 vytvořených Evropskou organizací pro výzkum a léčbu rakoviny (European Organisation for Research and Treatment of Cancer – EORTC). U pacientů bylo současně sledováno LARS skóre. Follow-up pacientů byl průměrně 42,65 měsíce v rozmezí 9–91 měsíců (Tab. 1).
Table 1. Charakteristika našeho souboru pacientů po TaTME k analýze (v závorce jsou uvedena procenta nebo medián; ISREC skóre – International Study Group of Rectal Cancer: skóre klinické závažnosti dehiscence)
Tab. 1: Baseline characteristics of patients undergoing TaTME (percentages or medians are given in parentheses; ISREC score – International Study Group of Rectal Cancer: severity of anastomotic dehiscence)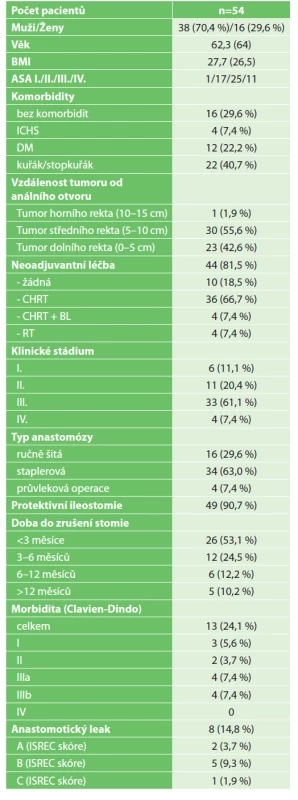
Detaily předoperační přípravy a chirurgické techniky na našem pracovišti jsme již publikovali v Rozhledech v chirurgii v březnu v roku 2020 [3]. Provedení TaTME bylo indikováno individuálně dle charakteristik pacienta a lokalizace tumoru, dle rozhodnutí chirurga. Před operací byla vždy provedena anorektální manometrie a posouzena inkontinence stolice jako kontraindikace sfinkter šetřícího výkonu. Všichni pacienti byli poučeni o riziku vzniku LARS a o možnosti vyvedení permanentní kolostomie. Operaci prováděl vždy stejný operační tým. Protektivní ileostomie byla vyvedena u 49 (90,7 %) pacientů z 54 hodnocených. Zrušení stomie bylo provedeno u všech analyzovaných pacientů. Časový odstup zrušení stomie od primární operace je uveden v Tab. 1. Přestože 81,5 % pacientů absolvovalo neoadjuvantní léčbu, adjuvantní terapie byla indikována dle rozhodnutí onkologa na základě kvality resekátu, stupně regrese tumoru, patologické TNM klasifikace a celkového stavu pacienta. Z toho vyplývá možnost obnovení kontinuity GIT u 53,1 % pacientů do 3 měsíců od operace, u kterých adjuvantní terapie nebyla indikována. Dalším faktorem k časné obnově kontinuity GIT byla metabolická intolerance stomie.
QoL byla hodnocena pomocí dvou dotazníků, a to EORTC-QLQ-C30 (verze 3.0) a EORTC-QLQ-CR29 [4]. Dotazníky jsou k dispozici v oficiálním českém překladu. Oba dotazníky obsahují otázky, na které pacient většinou odpovídá na stupnici od 1 (žádné potíže) do 4 (závažné potíže). K vyhodnocení výsledků bylo postupováno dle oficiálního manuálu EORTC [5]. Podle něj se vypočítá výsledné skóre, které je v rozmezí 0–100. V případě hodnocení symptomů platí, že čím vyšší skóre, tím větší závažnost symptomu. V případě hodnocení funkčních výsledků naopak platí, že čím vyšší skóre, tím lepší funkce.
EORTC-QLQ-C30 sleduje QoL obecně u pacientů s nádorovým onemocněním a obsahuje celkem 30 otázek. Skládá se ze tří hlavních oddílů, tj. z celkového zdravotního stavu/QoL (global health status/QoL), funkčních (functional scales) a symptomových (symptom scales) škál. Funkčních stupnic je celkem pět a sledují fyzické, osobní, emoční, kognitivní a sociální fungování v životě (physical, role, emotional, cognitive, social functioning). Mezi symptomy jsou zařazeny únava, nauzea a zvracení, bolest, dušnost, insomnie, ztráta chuti, obstipace, průjem a finanční potíže (fatigue, nausea and vomiting, pain, dyspnea, insomnia, appetite loss, constipation, diarrhoea, financial difficulties). V tabulkách uvádíme názvy v angličtině pro lepší přehlednost.
EORTC-QLQ-CR29 je doplňkový dotazník navazující na EORTC-QLQ-C30, který se používá u pacientů s kolorektální problematikou a sleduje specifické potíže po operacích tlustého střeva a konečníku. Podobně jako předchozí dotazník zahrnuje celou řadu hodnocených symptomů a funkčních poruch (Tab. 3).
LARS skóre je jednoduchým nástrojem ke zhodnocení anorektální funkce. Hodnotí inkontinenci stolice a plynů, frekvenci stolic, fragmentaci stolice a urgenci. Po vypočítání bylo LARS skóre následně zařazeno do jedné ze tří možných skupin dle závažnosti, tj. žádný LARS (0–20), minor LARS (21–29) a major LARS (30 – 42). LARS skóre bylo získáno kromě jednoho pacienta u všech, tj. u 53 pacientů. Závažnost anastomotického leaku (AL) byla posuzována dle klasifikace International Study Group of Rectal Cancer (ISREC) [6]. Stupeň A vyjadřuje, že nalezený AL nevyžaduje změnu léčebného postupu, stupeň B vyžaduje změnu léčebného postupu bez provedení laparotomie a stupeň C taktéž vyžaduje změnu léčebného postupu včetně provedení laparotomie nebo laparoskopie.
Mezi limity studie patří absence kontrolní skupiny, nekompletní návratnost dotazníků, která byla ze 79 oslovených pacientů 64 získaných (81,0 %) v době provedení dotazníkového šetření, a z toho plynoucí velikost souboru. Cílem studie je předložit naše zkušenosti s funkčními výsledky a kvalitou života u pacientů po TaTME a diskutovat je v kontextu aktuální literatury. Studie byla před zahájením schválena etickou komisí podle Helsinské deklarace z roku 1975.
VÝSLEDKY
Neoadjuvantní léčbu podstoupilo 44 (81,5 %) pacientů (Tab. 1). Průměrná hodnota LARS skóre u pacientů po TaTME byla v naší studii 30,7 s častějším zastoupením major LARS v 64,2 % (Tab. 4). Ze všech symptomů v EORTC-QLQ-C30 dotazníku u pacientů po TaTME patří mezi nejzávažnější průjem (30,25), únava (23,87) a insomnie (20,37) (Tab. 2). V QLQ-CR29 dotazníku to jsou flatulence (50,94), fekální inkontinence (45,06) a frekvence stolice (35,19) (Tab. 3). Výsledky EORTC dotazníků kvality života po TaTME jsou napříč studiemi značně heterogenní, což činí interpretaci obtížnou. V případě sexuálních dysfunkcí mohou být výsledky zkresleny malým počtem odpovídajících pacientů.
Table 2. Výsledky dotazníku EORTC QLQ-C30 u TaTME ve FN Brno a na zahraničních pracovištích
Tab. 2: Results of EORTC QLQ-C30 in TaTME at the University Hospital Brno in comparison with other studies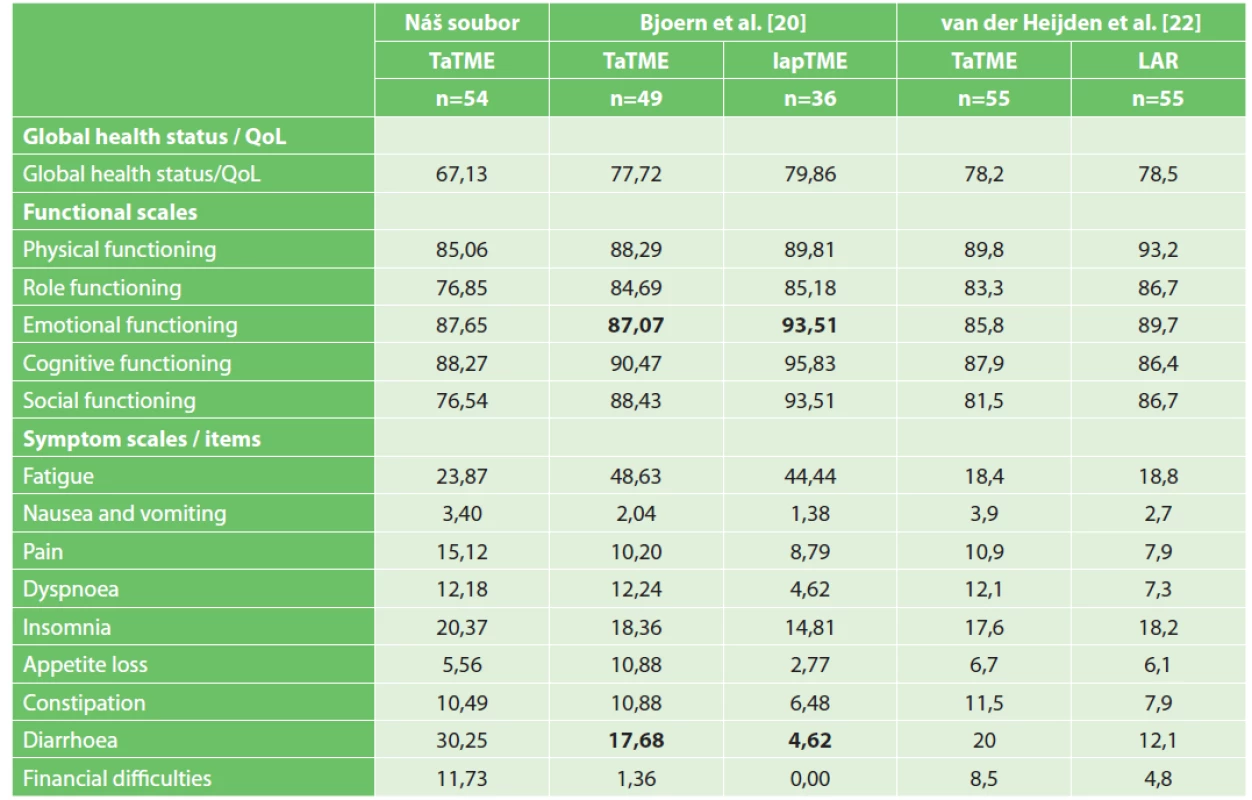
Poznámka: Tučně jsou vyznačeny signifikantní rozdíly; v tabulce van der Heijdena a kol. jsou uvedeny hodnoty po propensity score matching (PSM); vzhledem k tomu, že manuál k hodnocení je dostupný pouze v anglickém jazyce, uvádíme názvy v tabulce v originálním znění.
Notes: Significant differences are indicated in bold; the table of van der Heijden et al. gives values after propensity score matching (PSM).Table 3. Výsledky dotazníku EORTC QLQ-CR29 u TaTME ve FN Brno a na zahraničních pracovištích
Tab. 3: Results of EORTC QLQ-CR29 in TaTME at the University Hospital Brno in comparison with other studies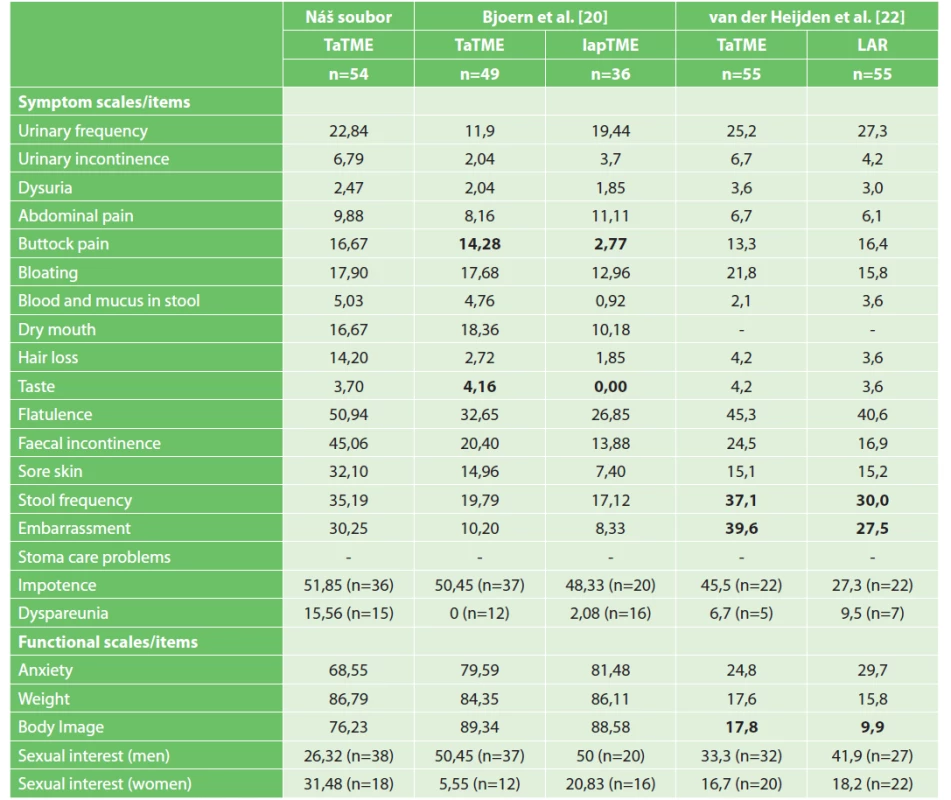
Poznámka: Tučně jsou vyznačeny signifikantní rozdíly; v tabulce van der Heijdena a kol. jsou uvedeny hodnoty po propensity score matching (PSM); vzhledem k tomu, že manuál k hodnocení je dostupný pouze v anglickém jazyce, uvádíme názvy v tabulce v originálním znění.
Notes: Significant differences are indicated in bold; the table of van der Heijden et al. gives values after propensity score matching (PSM); a dash means that data is not availableTable 4. Výsledky LARS u TaTME ve FN Brno a na zahraničních pracovištích
Tab. 4: The LARS results for TaTME at the University Hospital Brno in comparison with other studies
DISKUZE
Hodnocení funkčních výsledků a QoL po TaTME se v posledních letech stává stále diskutovanějším tématem. Jedná se o velmi důležitý aspekt vnímaný pacienty po operaci, který významně ovlivňuje jejich další život, a proto je třeba ho zohlednit při implementaci TaTME do praxe. V současnosti nejsou známy dlouhodobé funkční výsledky, které byly zpočátku sledovány v porovnání s onkologickými méně. Navíc řada studií uvádí rozdílné výsledky, ať se jedná o srovnávání s laparoskopickou nebo klasickou TME. Obavy z horších funkčních výsledků u TaTME plynou převážně z nízko uložené anastomózy, častěji prováděné intersfinkterické resekce (ISR) a prolongované dilatace análního kanálu transanální platformou. Metoda TaTME umožňuje resekce i nepříznivých tumorů (velikostí i polohou), a je tak alternativou APR s trvalou stomií. Přestože se prokázalo, že QoL po APR je srovnatelná se sfinkter šetřícími resekcemi, je nutné mít přehled o funkčních výsledcích a QoL po TaTME a následně vtáhnout pacienta do problematiky a rozhodování o způsobu léčby [7]. Metodika hodnocení QoL je obtížná a značně individuální. Existují celosvětově uznávané nástroje k hodnocení funkčních výsledků a kvality života, které se stále vyvíjejí. Po resekci rekta tak vznikají nejčastěji střevní, urologické a sexuální dysfunkce, které společně s dalšími faktory mají zásadní vliv na výslednou QoL. Pro chirurga je tak důležitá znalost především anatomických poměrů malé pánve, která je zásadní v detekci důležitých nervových, ale i svalových a orgánových struktur. Mezi hlavní faktory, které mají vliv na výslednou QoL, patří samotný chirurgický výkon a provedení předoperační radioterapie.
Kromě dotazníků, které byly použity v této práci a jsou uvedeny v metodice, je třeba zmínit i další nástroje k hodnocení funkčních poruch a QoL. V případě fekální inkontinence je pro jednoduchost často využíváno Jorge-Wexnerovo skóre, které je dáno frekvencí různých symptomů anální inkontinence (formovaná či tekutá stolice, flatulence, nošení vložky/pleny, změny životního stylu). Výsledné skóre tak může nabývat hodnot 0−20, kdy 0 je plná kontinence a 20 plná inkontinence [8]. Po TME však vznikají i další potíže, a to urgence, fragmentace a frekvence stolice. Z toho důvodu se nejčastěji využívá LARS skóre zahrnující všechny tyto poruchy. Sexuální dysfunkce u mužů se projevuje poruchami erekce a ejakulace a z toho vyplývajícím neuspokojivým sexuálním aktem. U žen dochází k poruše lubrikace zevních pohlavních orgánů, dyspareunii a neschopnosti dosažení orgasmu [9]. Urologické dysfunkce se nejčastěji projevují poruchou kontinence moči, močovou retencí nebo dysurickými problémy. Dotazníky se liší pro muže a ženy. Mezi mezinárodní dotazníky patří female sexual function index (FSFI), international index of erectile function (IIEF-5), international prostate symptom score for men (IPSS), the 8-item overactive bladder questionnaire for women (OAB V8) [10]. Tyto další dotazníky v metodice detailně neuvádíme, protože se věnujeme spíše hodnocení celkové kvality života. Nicméně tyto symptomy jsou rovněž součástí EORTC dotazníků, a je tak možné je částečně hodnotit.
Vliv neoadjuvantní chemoterapie na QoL
Neoadjuvantní chemoradioterapie (CHRT) má negativní vliv jak na anorektální funkce, tak na funkce sexuální a urologické. Příčinou je zřejmě radioterapií (RT) indukovaná fibróza okolních tkání [11]. V literatuře se uvádí více než dvojnásobný výskyt potíží s fekální kontinencí u pacientů po TME, kteří absolvovali RT (57 % vs. 26 %). Zjištěn byl také vyšší výskyt močové inkontinence ve srovnání s pacienty s resekcí rekta bez RT (45 % vs. 27 %) [12]. Randomizovaná studie od Pietrzaka a kol., která byla zaměřena na zjištění rozdílu funkčních komplikací mezi krátkodobou 5×5 Gray (Gy) RT a pětitýdenní CHRT, nepotvrdila signifikantní rozdíl ve výskytu inkontinence ani sexuálních dysfunkcí. Anorektální dysfunkce byly přítomny přibližně u dvou třetin pacientů obou skupin [13]. V našem souboru podstoupilo neoadjuvantní léčbu 81,5 % pacientů, což jistě ovlivnilo funkční výsledky. Za zmínku stojí i funkční výsledky u pacientů s klinickou kompletní odpovědí na léčbu (cCR), u kterých je zvolena watch and wait (W&W) strategie ve srovnání s pacienty s CHRT a následnou TME. Inkontinence stolice při strategii W&W byla zjištěna u více než 30 % pacientů [14]. Sexuální a urologické dysfunkce jsou mírnější při W&W strategii ve srovnání s TME. Hupkens a kol. popsali lepší QoL u pacientů s W&W postupem ve srovnání s CHRT a klasickou TME po 2 letech sledování. Dle kolorektálního modulu EORTC-QLQ-CR29 dotazníku byly zjištěny lepší sexuální funkce (W&W 44,0 vs. TME 33,9; p=0,04) a lepší urologické výsledky dle IPSS dotazníku (W&W 22,7 vs. TME 34,8; p=0,002) u pacientů s W&W strategií [15]. Při W&W strategii je tedy možné očekávat lepší funkční výsledky. Tato skutečnost by mohla být do budoucna jedním z kladných argumentů pro W&W strategii. Je tedy patrné, že chirurgický výkon má na vznik funkčních potíží jednoznačný vliv, ale není jedinou příčinou.
Vliv chirurgického výkonu na QoL
Vliv samotného chirurgického výkonu, tj. TaTME, na funkční výsledky a kvalitu života je porovnáván především s laparoskopickým přístupem, který se stal rutinním v léčbě karcinomu rekta. Právě metoda TaTME byla vyvinuta s nadějí pro lepší funkční výsledky při dokonalé vizualizaci anatomických struktur hluboko v pánvi. Otázkou však zůstává, do jaké míry jsou dosud publikované studie o TaTME srovnatelné s lapTME vzhledem k selekci pacientů, kdy při TaTME jsou operovány převážně tumory distálního rekta [16]. V takových případech tak samotný laparoskopický přístup může být velmi těžko proveditelný, nebo nemožný. To může být jedním z důvodů, proč zatím studie přinášejí rozdílné výsledky. Z toho vyplývá, že design a metodika studií zde hraje důležitou roli. Hlavním faktorem vzniku inkontinence stolice, která je po TaTME uváděna v 10–80 %, je výška anastomózy. Při transanálním přístupu, který umožňuje dosáhnout přehledně a bezpečně adekvátní délky DRM, je nutné, aby DRM nebyla posunována distálněji, než je onkologicky dostačující, protože tak může docházet k horším funkčním výsledkům a závažnějšímu LARS. Existují studie, které uvádějí nižší uložení anastomóz při TaTME ve srovnání s lapTME [17,18]. K tomu je však také potřeba dodat, že výška anastomóz je v souborech měřena heterogenními způsoby, endoskopicky či pomocí magnetické rezonance (MRI). Další zásadou je neprovádět TME tam, kde není indikována. Vždy je nutné posuzovat dle lokalizace nádoru, zdali má být provedena PME (parciální mezorektální excize), nebo TME s významným dopadem na kvalitu života.
Kromě výšky anastomózy se u TaTME zvažuje také vliv prolongovaného zavedení transanální platformy na funkční výsledky. Ačkoliv dle výsledků mezinárodního registru TaTME je rizikem pro komplikace hojení anastomózy, vliv na funkční výsledky není přesvědčivý. Obavy o poškození svěračů kvůli prolongované dilataci svěračů původně pocházejí ze studií o transanální endoskopické mikrochirurgii (TEM), kdy byl zjištěn pokles klidového a volního tonu svěračů, avšak bez vlivu na inkontinenci nebo QoL [19]. Filips a kol. v multivariační analýze uvádějí, že rizikovým faktorem pro vznik LARS je především nízce uložená anastomóza, nikoliv samotný chirurgický přístup TaTME nebo lap TME [20]. Podobné závěry také podporuje studie, kterou publikovali Bjoern a kol., ve které se uvádí, že poškození svěračů zřejmě nesouvisí s transanálním přístupem, vzhledem k tomu, že inkontinence stolice a plynů byla srovnatelná jak po TaTME, tak lapTME (Tab. 3). Ve stejné studii uvádějí horší urgenci a fragmentaci stolice po TaTME. Významným limitem této studie však je rozdílná doba vyplňování dotazníků QoL (22,7 měsíce TaTME a 75,1 měsíce lapTME) [21].
Syndrom nízké přední resekce po TaTME
Dalším předmětem diskuzí je vliv typu operačního výkonu na častý problém, a to na LARS. Recentní metaanalýza z Austrálie publikovaná v roce 2021, která porovnává funkční výsledky TaTME s lapTME (242 a 233 pacientů) mezi lety 2000–2020, uvádí průměrnou hodnotu LARS skóre 30,6 u TaTME a 28,3 u lapTME bez signifikantního rozdílu (p=0,115). Rovněž uvádí, že ačkoliv byl major LARS častější ve skupině TaTME (53,3 %), tak bez statistické významnosti (p=0,235) [22]. V našem souboru jsme zaznamenali podobnou průměrnou hodnotu LARS skóre, a to 30,7, a častější zastoupení major LARS v 64,2 % (Tab. 4). Naproti tomu kupříkladu van der Heijden a kol. publikovali v prospektivní studii (včetně propensity score matching – PSM) z roku 2021 (55 pacientů po TaTME a 55 pacientů po tradiční TME) vyšší LARS skóre (30,6 vs. 25,4; p=0,010) a častější zastoupení major LARS (65 vs. 42 %, p=0,013) ve skupině po TaTME. Doba sledování byla 12 měsíců a jednalo se o srovnání s otevřenou TME [23]. V prospektivní studii ze Švýcarska z roku 2021 bylo navíc zjištěno, že LARS skóre je po TaTME signifikantně vyšší 3 měsíce po operaci, než po lap TME (p=0,032), ale po 12 měsících již bez významného rozdílu (p=0,671). Ačkoliv byla ve stejné studii také zjištěna signifikantně nižší kvalita života v QLQ-CR29 dotazníku po TaTME (fekální inkontinence, frekvence stolice, flatulence, nadýmání a bolesti hýždí), opět byly všechny tyto symptomy po 12 měsících bez signifikantního rozdílu. To by naznačovalo, že TaTME může mít krátce po resekci horší funkční výsledky. Nicméně LARS je po 12 měsících od operace mezi oběma přístupy srovnatelný.
Během rekonstrukční fáze operace při obnově kontinuity GIT se uvádějí lepší krátkodobé výsledky J-pouche ve srovnání s anastomózou koncem ke konci. Po dvou letech sledování jsou však výsledky všech způsobů rekonstrukce obdobné [24]. V budoucnu se očekává multicentrická randomizovaná studie COLOR III, která by měla přinést jasné důkazy o onkologických a funkčních výsledcích.
Urogenitální dysfunkce po TaTME
Urogenitální dysfunkce v souvislosti s operací rekta pro karcinom jsou časté a často podceňované. V randomizované studii COLOR II bylo zjištěno, že téměř 65 % pacientů má již před operací rekta pro karcinom určitý stupeň erektilní dysfunkce a po operaci dochází k jejímu zhoršení. Sexuální potíže byly v této studii častější než urologické. Urologické dysfunkce se obvykle navrátily do normy za 6 měsíců od operace [25]. Při srovnání TaTME s lapTME nebyly zjištěny signifikantní rozdíly v IPPS skóre [26]. Autoři přehledové práce z roku 2017 zaměřené na sexuální dysfunkce u karcinomu rekta konstatují, že neexistují data, která by jasně favorizovala jeden operační přístup nad druhým (roboticky vs. laparoskopicky vs. otevřeně). Problémem je také nedostatečná informovanost pacienta před operací a ke specialistovi je odesláno jen 10 % pacientů se sexuální dysfunkcí [27]. Z prospektivní studie Li a kol. navíc plyne, že po TaTME se zdá být lepší erektilní funkce po jednom roce od operace ve srovnání s lapTME (IIEF-5 skóre 23 TaTME vs. 20 lapTME; p=0,038). Navíc uvádí, že podle FSFI dotazníku pro zjištění sexuálních dysfunkcí u žen nebyly zjištěny rozdíly mezi operačními přístupy [28]. Vysvětlením může být prostornější pánev u žen s lepší vizualizací nervových struktur. Situaci komplikuje také fakt, že o vyplnění sexuálních dotazníků po operaci je malý zájem, a to zvláště u žen, kdy dotazník stran dyspareunie vyplnilo jen 15 žen, a v případě zájmu o sex pouze 18 žen. Naše data ukazují, že zájem o sex je mírně nižší u žen a impotence u mužů je přítomna u více než 50 %. Urologické dysfunkce po TaTME se nezdají být horší než při laparoskopickém přístupu, což potvrzují i dotazníky kvality života. Sexuální dysfunkce jsou celkově obtížně hodnotitelné pro nízký počet respondentů a heterogenitu souborů. Prevalence sexuálních dysfunkcí se udává 5–90 % [27].
Kvalita života po TaTME
World Health Organisation (WHO) definuje QoL tak, jak jedinec vnímá své postavení v životě v kontextu kultury a hodnotových systémů, ve kterých žije, a ve vztahu k jeho osobním cílům, očekáváním, zájmům a životnímu stylu [29]. Proto je také stále kladena otázka, jak správně QoL měřit, a důkazem je celá řada metodik [30]. Asi nejznámější dotazníky vytvořené k měření QoL onkologických pacientů byly vytvořeny pracovní skupinou European Organisation for Research and Treatment of Cancer (EORTC) [4]. V literatuře se diskutuje především vztah jednotlivých funkčních poruch na výslednou QoL, která je tak hlavním ukazatelem úspěšnosti léčby kolorektálního karcinomu. Emmertsen a kol. publikovali v roce 2013 studii, ve které analyzovali LARS, a QoL formou dotazníků EORTC-QLQ-C30 předoperačně, 3 měsíce a 12 měsíců po operaci. Zjistili, že střevní dysfunkce po sfinkter šetřících resekcích mají zásadní vliv na QoL po TME a také, že značná část položek dotazníku QLQ-C30 koreluje s LARS [31]. V recentním systematickém přehledu a metaanalýze z roku 2021, která zkoumá funkční výsledky a QoL po TaTME a lapTME (242 a 233 pacientů), bylo zjištěno, že nebyl žádný signifikantní rozdíl na funkčních škálách v QLQ-CR29 dotazníku. Na symptomatické škále stejného dotazníku byly zjištěny signifikantně větší bolesti hýždí, fekální inkontinence, podrážděná kůže v oblasti konečníku a ztráta vlasů u TaTME skupiny. Ve skupině lapTME byly významně vyšší abdominální bolesti a nadýmání. Ačkoliv se jedná o metaanalýzu, tak zahrnuje pouze 7 studií, z nichž pouze 3 uvádějí EORTC dotazníky s poměrně malými vzorky pacientů [21,32,33]. Žádná ze tří studií v rámci metaanalýzy však nepotvrdila zmíněné signifikantně významné výsledky ostatních [22]. V případě QLQ-C30 dotazníku ve stejné metaanalýze byl zjištěn signifikantně horší průjem, únava, finanční problémy a role functioning v TaTME skupině. Opět ani jedna ze zahrnutých studií nepotvrdila výsledky ostatních. Důvodem mohou být malé vzorky pacientů a heterogenita souborů, kdy například metaanalýza nebere v úvahu výšku tumoru. Pro přehled uvádíme v Tab. 2 a 3 naše výsledky QLQ-CR29 a QLQ-C30 dotazníku společně se dvěma zatím největšími soubory pacientů po TaTME, které hodnotí QoL dle EORTC dotazníků [21,23]. Rozdílné výsledky na funkčních škálách publikovaly dvě studie. Bjoern a kol. publikovali horší emocionální funkci u TaTME, naopak Mora a kol. u lapTME [32]. V již zmíněné prospektivní studii s PSM van der Heijden a kol. neuvádějí v QLQ-C30 dotazníku žádnou statisticky významně se lišící položku. V QLQ-CR29 dotazníku jsou signifikantně horší body image, bowel frequency a emabarrassment u TaTME skupiny [23].
Je zřejmé, že mezi studiemi měřícími QoL po TaTME v porovnávání s lapTME jsou velké rozdíly a není lehké zatím vyvodit jednoznačné závěry. Lze konstatovat, že recentní metaanalýzy se shodují na tom, že střevní dysfunkce a LARS jsou mezi TaTME a lapTME srovnatelné. V případě dotazníků QoL se některé výsledky liší, ale položka QoL/Global health status (zde pacient odpovídá na otázky, jak by hodnotil svoje celkové zdraví a kvalitu života) je srovnatelná mezi TaTME a lapTME a v žádné studii se statisticky signifikantně neliší. Studie mají své limity především v heterogenitě, malém počtu pacientů a nedostatečných charakteristikách souborů pacientů. Již zmíněná selekce pacientů indikovaných k TaTME, především pro tumory distálního rekta, je také významným faktorem.
Intraoperační neuromonitoring
Pro úplnost je třeba zmínit také využití intraoperačního neuromonitoringu (IONM). Slouží k verifikaci polohy autonomních nervů během preparace v pánvi a poskytuje operatérovi zpětnou vazbu o stavu poškození nervových struktur. Kauff a kol. v roce 2020 publikovali nižší výskyt inkontinence u TME s využitím IONM než bez něj. Pozitivní efekt IONM na funkční výsledky byl dán lepší identifikací pelvických nervů než při pouhé vizuální kontrole, která byla téměř dvojnásobně vyšší při využití IONM (80 % vs. 45 %). IONM lze provádět jak u čistě laparoskopických výkonů, tak u TaTME [34]. Výhodné je použití v případech obtížné preparace, kdy je vizuální kontrola znesnadněna anatomickými poměry objemného mezorekta a změnami tkání po předchozí RT. Problémem IONM je však obtížná identifikace artefaktů signálu, které mohou vznikat v důsledku elektrokoagulace či dokonce při preparaci nůžkami [35].
ZÁVĚR
Kvalita života v našem souboru pacientů s pokročilými nádory rekta a 81,5% zastoupením neoadjuvantní terapie po TaTME je srovnatelná s výsledky v současné literatuře. Mezi nejzávažnější anorektální symptomy ovlivňující kvalitu života po TaTME patří flatulence, fekální inkontinence a frekvence stolice. Další závažné symptomy vyskytující se po TaTME, které se netýkají anorektálních funkcí, jsou únava a insomnie. Syndrom nízké přední resekce po TaTME jsme zaznamenali u 73,6 % pacientů s větším podílem major LARS (64,2 %).
Seznam zkratek
TaTME – transanální totální mezorektální excize lap
TME – laparoskopická totální mezorektální excize
QoL – quality of life (kvalita života)
CRM – circumferential resection margin (cirkumferenční resekční linie)
LR – lokální recidiva
LARS – low anterior resection syndrome (syndrom nízké přední resekce)
EORTC – European Organisation for Research and Treatment of Cancer (Evropská organizace pro výzkum a léčbu rakoviny)
EORTC-QLQ-C30 – dotazník kvality života u onkologických pacientů
EORTC-QLQ-CR29 – dotazník kvality života u pacientů s kolorektálním karcinomem
APR – abdominoperineální resekce ISR – intersfinkterická resekce
FSFI – female sexual function index
IIEF-5 – international index of erectile function
IPSS – international prostate symptom score for men
OAB V8 – the 8-item overactive bladder questionnaire for women (OAB V8)
CHRT – neoadjuvantní chemoradioterapie
Gy – gray
RT – radioterapie
cCR – klinická kompletní odpověď na léčbu
W&W – watch and wait strategie
TEM – transanální endoskopická mikrochirurgie
PSM – propensity score matching
MRI – magnetická rezonance
IONM – intraoperační neuromonitoring
DRM – distal resection margin (distální resekční okraj)
GIT – gastrointestinální trakt
ISREC – The International Study Group of Rectal Cancer
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
MUDr. Martin Svoboda
Chirurgická klinika,
FN Brno Bohunice
Jihlavská 20
625 00 Brno
e-mail: Svoboda.Martin2@fnbrno.cz
ORCiD: 0000-0001-5607-3450
Sources
1. Adamina M, Buchs NC, Penna M, et al. St. Gallen consensus on safe implementation of transanal total mesorectal excision. Surg Endosc. 2018;32(3):1091−1103. doi:10.1007/s00464-017-5990-2.
2. Perdawood SK, Thinggaard BS, Bjoern MX. Effect of transanal total mesorectal excision for rectal cancer: comparison of short-term outcomes with laparoscopic and open surgeries. Surg Endosc. 2018;32(5):2312−2321. doi:10.1007/ s00464-017-5926-x.
3. Procházka V, Grolich T, Farkašová M, et al. Our experience with transanal total mesorectal excision (TaTME) procedures in middle and distal rectal tumors. Rozhl Chir. 2020;99(3):124−130. doi:10.33699/ PIS.2020.99.3.124-130.
4. Aaronson NK, Ahmedzai S, Bergman B, et al. The European Organization for Research and Treatment of Cancer QLQ-C30: A Quality-of-Life Instrument for Use in International Clinical Trials in Oncology. JNCI J Natl Cancer Inst. 1993;85(5):365−376. doi:10.1093/ jnci/85.5.365.
5. Fayers P, Aaronson NK, Bjordal K, et al. EORTC QLQ-C30 scoring manual. 3rd ed. European Organisation for Research and Treatment of Cancer 2001.
6. Rahbari NN, Waltz J, Hohenberger W, et al. Definition and grading of anastomotic leakage following anterior resection of the rectum: a proposal by the International Study Group of Rectal Cancer. Surgery 2010;147(3):339−351. doi:10.1016/j. surg.2009.10.012.
7. Kang S-B, Cho JR, Jeong S-Y, et al. Quality of life after sphincter preservation surgery or abdominoperineal resection for low rectal cancer (ASPIRE): A longterm prospective, multicentre, cohort study. Lancet Reg Health - West Pac. 2021;6 : 100087. doi:10.1016/j.lanwpc. 2020.100087.
8. Chapman SJ, Bolton WS, Corrigan N, et al. Cross-sectional review of reporting variation in postoperative bowel dysfunction after rectal cancer surgery: Dis Colon Rectum. 2017;60(2):240−247. doi:10.1097/ DCR.0000000000000649.
9. Allahdadi K, Tostes R, Webb R. Female sexual dysfunction: Therapeutic options and experimental challenges. Cardiovasc Hematol Agents Med Chem. 2009;7(4):260−269. doi:10.2174/187152509789541882.
10. Rosen RC, Cappelleri JC, Smith MD, et al. Development and evaluation of an abridged, 5-item version of the International Index of Erectile Function (IIEF-5) as a diagnostic tool for erectile dysfunction. Int J Impot Res. 1999;11(6):319−326. doi:10.1038/sj.ijir.3900472.
11. Bregendahl S, Emmertsen KJ, Lous J, et al. Bowel dysfunction after low anterior resection with and without neoadjuvant therapy for rectal cancer: a population - based cross-sectional study. Colorectal Dis. Published online April 2013:n/a-n/a. doi:10.1111/codi.12244.
12. Pollack J, Holm T, Cedermark B, et al. Late adverse effects of short-course preoperative radiotherapy in rectal cancer. Br J Surg. 2006;93(12):1519−1525. doi:10.1002/bjs.5525.
13. Pietrzak L, Bujko K, Nowacki MP, et al. Quality of life, anorectal and sexual functions after preoperative radiotherapy for rectal cancer: Report of a randomised trial. Radiother Oncol. 2007;84(3):217−225. doi:10.1016/j.radonc. 2007.07.007.
14. Appelt AL, Pløen J, Harling H, et al. Highdose chemoradiotherapy and watchful waiting for distal rectal cancer: a prospective observational study. Lancet Oncol. 2015;16(8):919−927. doi:10.1016/ S1470-2045(15)00120-5.
15. Hupkens BJP, Martens MH, Stoot JH, et al. Quality of life in rectal cancer patients after chemoradiation: Watch-andwait policy versus standard resection – A matched-controlled study. Dis Colon Rectum. 2017;60(10):1032−1040. doi:10.1097/DCR.0000000000000862.
16. Detering R, Roodbeen SX, van Oostendorp SE, et al. Three-year nationwide experience with transanal total mesorectal excision for rectal cancer in the Netherlands: A propensity score-matched comparison with conventional laparoscopic total mesorectal excision. J Am Coll Surg. 2019;228(3):235−244.e1. doi:10.1016/j. jamcollsurg.2018.12.016.
17. Mosquera C, Licardie E, Bravo D, et al. Fecal incontinence after surgical treatment of middle–low rectal cancer. Laparoscopic low anterior resection versus tatme. Surg Endosc. 2019;33(Suppl 1):S281.
18. Veltcamp Helbach M, Koedam TWA, Knol JJ, et al. Residual mesorectum on postoperative magnetic resonance imaging following transanal total mesorectal excision (TaTME) and laparoscopic total mesorectal excision (LapTME) in rectal cancer. Surg Endosc. 2019;33(1):94−102. doi:10.1007/s00464-018-6279-9.
19. D’Ambrosio G, Picchetto A, Campo S, et al. Quality of life in patients with loco-regional rectal cancer after ELRR by TEM versus VLS TME after nChRT: long-term results. Surg Endosc. 2019;33(3):941−948. doi:10.1007/s00464-018-6583-4.
20. Filips A, Haltmeier T, Kohler A, et al. LARS is associated with lower anastomoses, but not with the transanal approach in patients undergoing rectal cancer resection. World J Surg. 2021;45(3):873−879. doi:10.1007/s00268-020-05876-6.
21. Bjoern MX, Nielsen S, Perdawood SK. Quality of life after surgery for rectal cancer: a comparison of functional outcomes after transanal and laparoscopic approaches. J Gastrointest Surg Off J Soc Surg Aliment Tract. 2019;23(8):1623−1630. doi:10.1007/ s11605-018-4057-6.
22. Choy KT, Yang TWW, Prabhakaran S, et al. Comparing functional outcomes between transanal total mesorectal excision (TaTME) and laparoscopic total mesorectal excision (LaTME) for rectal cancer: a systematic review and meta-analysis. Int J Colorectal Dis. 2021;36(6):1163−1174. doi:10.1007/s00384-021-03849-2.
23. van der Heijden JAG, Qaderi SM, Verhoeven R, et al. Transanal total mesorectal excision and low anterior resection syndrome. Br J Surg. Published online April 9, 2021:znab056. doi:10.1093/bjs/znab056.
24. Ziv Y, Zbar A, Bar-Shavit Y, et al. Low anterior resection syndrome (LARS): cause and effect and reconstructive considerations. Tech Coloproctology. 2013;17(2):151−162. doi:10.1007/ s10151-012-0909-3.
25. Andersson J, Abis G, Gellerstedt M, et al. Patient-reported genitourinary dysfunction after laparoscopic and open rectal cancer surgery in a randomized trial (COLOR II). Br J Surg. 2014;101(10):1272−1279. doi:10.1002/bjs.9550.
26. van der Heijden JAG, Koëter T, Smits LJH, et al. Functional complaints and quality of life after transanal total mesorectal excision: a meta‐analysis. Br J Surg. 2020;107(5):489−498. doi:10.1002/ bjs.11566.
27. Celentano V, Cohen R, Warusavitarne J, et al. Sexual dysfunction following rectal cancer surgery. Int J Colorectal Dis. 2017;32(11):1523−1530. doi:10.1007/ s00384-017-2826-4.
28. Li Y, Bai X, Niu B, et al. A prospective study of health related quality of life, bowel and sexual function after TaTME and conventional laparoscopic TME for mid and low rectal cancer. Tech Coloproctology. 2021;25(4):449-459. doi:10.1007/s10151 - 020-02397-1.
29. WHOQOL: Measuring quality of life. World Health Organization (WHO). Accessed June 1, 2021. https://www.who. int/tools/whoqol.
30. Hnilicová H, Bencko V. Kvalita života – vymezení pojmu a jeho význam pro medicínu a zdravotnictví. Prakt Lék. 2005;85(11):656−660.
31. Emmertsen KJ, Laurberg S, Jess P, et al. Impact of bowel dysfunction on quality of life after sphincter-preserving resection for rectal cancer. Br J Surg. 2013;100(10):1377−1387. doi:10.1002/ bjs.9223.
32. Mora L, Zarate A, Serra-Aracil X, et al. Functional impairment and quality of life after rectal cancer surgery. Cir Cir. 2018;86(2):140−147. doi:10.24875/CIRU. M18000022.
33. Veltcamp Helbach M, Koedam TWA, Knol JJ, et al. Quality of life after rectal cancer surgery: differences between laparoscopic and transanal total mesorectal excision. Surg Endosc. 2019;33(1):79−87. doi:10.1007/s00464-018-6276-z.
34. Kauff DW, Roth YDS, Bettzieche RS, et al. Fecal incontinence after total mesorectal excision for rectal cancer—impact of potential risk factors and pelvic intraoperative neuromonitoring. World J Surg Oncol. 2020;18(1):12. doi:10.1186/ s12957-020-1782-6.
35. Kauff D, Koch K, Kempski O, et al. Impact of selective surgical pelvic autonomic nerve damage on the evoked neuromonitoring signal of the internal anal sphincter. Biomed Eng Biomed Tech. 2012;57(SI-1 Track-H). doi:10.1515/bmt-2012-4209.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2021 Issue 11-
All articles in this issue
- Současné trendy v chirurgické léčbě karcinomu rekta
- „Watch and wait“ strategie v léčbě pacientů s karcinomem rekta
- TaTME (transanal total mesorectal excision) – state of the art
- Resekce rekta s totální excizí mezorekta – laparoskopický versus robotický přístup
- K článku Resekce rekta s totální excisí mezorekta – laparoskopický versus robotický přístup autorů Škrovina M se spoluautory.
- Kvalita života pacientů po transanální totální mezorektální excizi – naše zkušenosti
- Fluorescenčná angiografia v kolorektálnej chirurgii, vplyv rozšírenej reality na operačnom sále na anastomotický leak po nízkej resekcii rekta
- Rizikové faktory syndrómu prednej nízkej resekcie po restoratívnej miniinvazívnej resekcii rekta
- Volvulus středního střeva u kongenitální poruchy rotace v dospělém věku – kazuistika
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Resekce rekta s totální excizí mezorekta – laparoskopický versus robotický přístup
- Volvulus středního střeva u kongenitální poruchy rotace v dospělém věku – kazuistika
- TaTME (transanal total mesorectal excision) – state of the art
- Kvalita života pacientů po transanální totální mezorektální excizi – naše zkušenosti
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

