-
Medical journals
- Career
Co má vědět chirurg o genetice karcinomů štítné žlázy
Authors: P. Bavor 1; B. Peková 2; V. Sýkorová 2; B. Bendlová 2; J. Hoch 1
Authors‘ workplace: Chirurgická klinika 2. lékařské fakulty Univerzity Karlovy a Fakultní nemocnice Motol, Praha 1; Oddělení molekulární endokrinologie, Endokrinologický ústav, Praha 2
Published in: Rozhl. Chir., 2020, roč. 99, č. 11, s. 481-486.
Category: Review
Overview
Zhoubné nádory štítné žlázy jsou nejčastějšími endokrinními malignitami, jejich léčba je multidisciplinární a multimodální. Nádory štítné žlázy jsou heterogenní původem vzniku, morfologií, biologickým chováním a možnostmi terapeutického řešení. Zásadní pokrok v diagnostických metodách karcinomu štítné žlázy vede k záchytu časnějších stadií onemocnění s možností cíleného terapeutického ovlivnění a zlepšení prognózy pacienta. Vedle chirurgické léčby, hormonální suprese a léčby radiojódem se v posledních dekádách dostává do popředí zájem o cílenou molekulární léčbu, jejímž předpokladem je genetické vyšetření. Ve sdělení uvádíme přehled dosažených znalostí genetického podkladu jednotlivých typů karcinomů štítné žlázy s možností terapeutického řešení.
Klíčová slova:
nádory štítné žlázy − genetika
ÚVOD
Zhoubné nádory štítné žlázy patří mezi vzácnější malignity, představují 1−2 % všech lidských karcinomů, jsou nejčastějšími endokrinními nádory (90 %). Výskyt uzlů ve štítné žláze je častý, s vyšším věkem narůstá, ale pouze u přibližně 5 % uzlů štítné žlázy se jedná o karcinom, naproti tomu v sekčním materiálu se nachází mikrokarcinom štítné žlázy až v 10 %. Jedná se o 7. nejčastější maligní nádor lidského organismu, u žen zaujímá 5. pozici z hlediska četnosti. Incidence se celosvětově pohybuje mezi 3,6–6,0 případy na 100 000 obyvatel za rok [1]. Karcinomy štítné žlázy tvoří nehomogenní skupinu nádorů, lišících se morfologicky i biologickým chováním. Mezi maligní nádory vznikající z folikulárního epitelu patří dobře diferencované karcinomy – DTC (papilární – PTC a folikulární – FTC), nízce diferencované karcinomy (PDTC) a velmi agresivní nediferencované karcinomy (anaplastické – ATC). Od parafolikulárních buněk (C-buněk) je odvozen medulární karcinom štítné žlázy (MTC).
V posledních letech došlo k vysokému nárůstu nově diagnostikovaných diferencovaných karcinomů štítné žlázy, a to převážně málo pokročilých papilárních karcinomů. Jedná se o maligní nádor s nejvyšším nárůstem incidence vůbec. Diagnostické a léčebné nástroje se v posledních dekádách významně zdokonalily. Možnost senzitivního měření hladin sérových nádorových markerů tyreoglobulinu a kalcitoninu a dostupnost ultrasonografického zobrazení, cytologického a molekulárně genetického vyšetření vzorků štítné žlázy získaných punkcí tenkou jehlou značně usnadnily a urychlily diagnostiku nádorového onemocnění štítné žlázy. Modernizace přístrojového vybavení na pracovištích nukleární medicíny, zejména zavedení hybridních systémů zobrazení SPECT/CT a PET/CT, umožnila lepší a včasnější detekci zhoubných ložisek [2].
U pacientů s indikací k operaci štítné žlázy musí být rozhodnuto, o jaký typ a rozsah výkonu se bude jednat. Toto rozhodnutí je doporučováno endokrinology a vychází z mnoha faktorů, ze stanovené klinické diagnózy, znalosti lokalizace a předpokládané agresivity nádoru a z dalších klinických a amnestických údajů pacienta. Definitivní rozsah výkonu však určuje chirurg, který je za něj, a případné komplikace, zodpovědný. Nejčastěji bývá v rámci elektivní chirurgie rozhodováno mezi hemityroidektomií (HTE) a totální tyroidektomií (TTE), případně je zvážena nutnost provedení blokové disekce lymfatických uzlin [3]. Při tomto rozhodování má v posledních letech čím dál větší váhu výsledek genetického vyšetření, který bývá stále častěji součástí indikace od endokrinologa. Díky znalosti genetické podstaty nádoru lze lépe odhadnout, jaká je jeho agresivita, a tudíž, s jakou radikalitou by se k výkonu mělo přistupovat. Zároveň je posuzována spojitost mutace s nižší účinností léčby radiojódem. Z těchto důvodů vyvstává otázka: Co má chirurg vědět o genetice karcinomů štítné žlázy? Chirurg operující štítnou žlázu by měl znát nejčastější mutace vyskytující se u různých typů karcinomů a s nimi spojená doporučení týkající se rozsahu výkonu. Tato doporučení vytvořila v nedávné době Evropská tyroidální společnost (ETA) [4]. Nutné je však podotknout, že k nádorům štítné žlázy u dětských a dospívajících pacientů by se mělo přistupovat odlišně než k nádorům u dospělých pacientů, a to z důvodu mnoha prokázaných rozdílů, ať už klinických, tak genetických. Karcinomy u dětských a dospívajících pacientů zasahují ve vyšší frekvenci extratyroidálně a mají podstatně častější výskyt metastáz lymfatických uzlin a metastáz vzdálených. Proto je u této skupiny pacientů základním chirurgickým přístupem TTE [5].
Toto pojednání si klade za cíl seznámit čtenáře se základními typy genetických změn a s výskytem konkrétních mutací u karcinomů štítné žlázy. Snažíme se odpovědět na otázku, jaký je v případě předoperačního nálezu dané mutace doporučený rozsah chirurgického výkonu. Závěrem je shrnuta cílená léčba karcinomů pomocí kinázových inhibitorů, kde je pro efektivní léčbu nutná znalost genetické podstaty karcinomů.
Typy genetických změn
Většina karcinomů štítné žlázy vzniká v důsledku genetických změn vytvářejících se v tkáni štítné žlázy, jedná se o tzv. somatické mutace, které se nedědí na potomstvo. Materiálem pro vyšetření somatických mutací je část suspektního uzlu štítné žlázy, získaného aspirační biopsií tenkou jehlou (FNAB) při předoperačním vyšetření pacienta nebo při sekci části uzlu patologem z operačního materiálu. Výjimku tvoří medulární karcinom štítné žlázy, u kterého lze detekovat jak zárodečné mutace v RET protoonkogenu u familiární formy MTC a MEN2 syndromů, tak somatické mutace (v RET protoonkogenu nebo RAS genech) u sporadické formy. Pro vyšetření zárodečných mutací je třeba odebrat periferní krev pacienta.
U nádorů štítné žlázy lze nejčastěji vyšetřované genetické změny obecně rozlišit na bodové mutace a chromozomální přeskupení neboli fúzní geny. Bodovými mutacemi se označují změny jednoho nukleotidu, příkladem je nejčastější bodová mutace u PTC BRAF V600E (Obr. 1). Fúzní geny vznikají chromozomální přestavbou, jejímž výsledkem je spojení dvou různých genů, které jsou za normálních podmínek od sebe vzdáleny, ať už na stejném chromozomu, nebo na jiném. Součástí fúzního genu bývá onkogen, jehož aktivita je chromozomální přestavbou změněna. Příkladem nejčastějšího fúzního genu u PTC je RET/PTC1 (vznikající spojením částí genu CCDC6 a RET) (Obr. 2).
Image 1. Detekce bodové mutace BRAF V600E Na obrázku nahoře detekce pomocí masivně paralelního sekvenování a její vizualizace pomocí programu Integrative Genomic Viewer (záměna nukleotidu A za T způsobující záměnu aminokyseliny valin za glutamát. Na obrázku dole detekce pomocí alelicky specifického Real-Time PCR (červeně pacient s mutací BRAF V600E, zeleně negativní kontrola).
Fig. 1: BRAF V600E point mutation detection In the picture above, detection by massively parallel sequencing and its visualization using the Integrative Genomic Viewer program (replacement of nucleotide A to T causing the amino acid substitution of valine for glutamate. control). In the figure below, detection by allele-specific Real-Time PCR (red patient with BRAF V600E mutation, green negative control).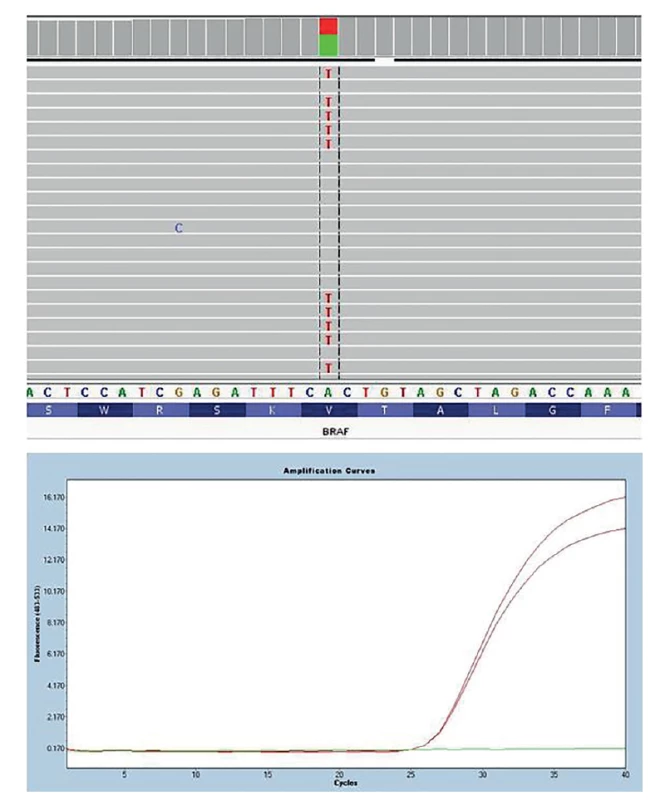
Image 2. Detekce fúzního genu RET/PTC1 (CCDC6/RET) Nahoře na obrázku detekce pomocí masivně paralelního sekvenování (fúze 1. exonu CCDC6 genu s 12. exonem RET genu). Dole na obrázku detekce pomocí analýzy křivky tání metodou Real-Time PCR (fialově pacient s fúzním genem, ostatní pacienti negativní).
Fig. 2: Detection of RET / PTC1 fusion gene (CCDC6/RET) In the figure above, detection by massively parallel sequencing (fusion of the 1st exon of the CCDC6 gene with the 12th exon of the RET gene). In the picture below, detection by melting curve analysis by Real-Time PCR (purple patient with fusion gene, other patients negative).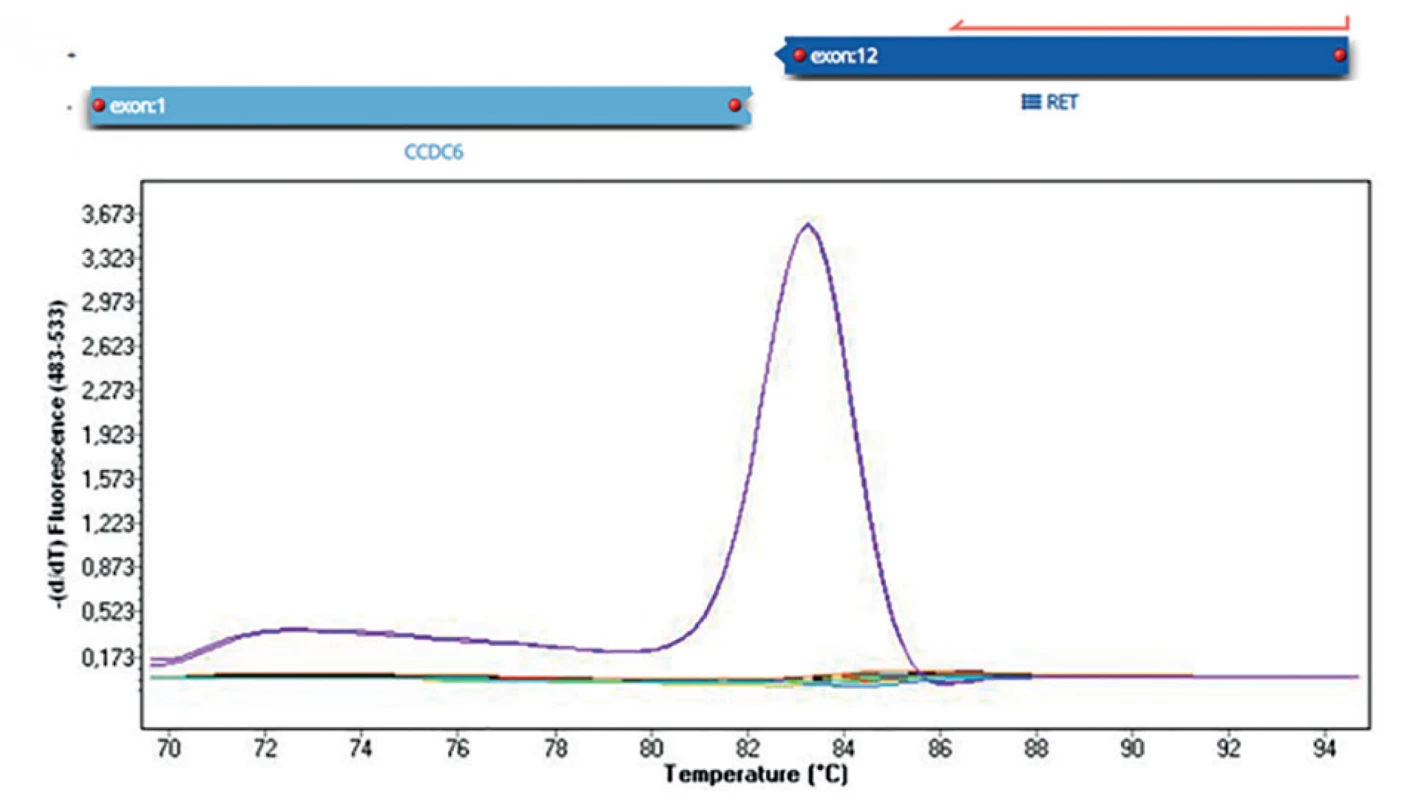
Karcinomy štítné žlázy a jejich nejčastější genetické změny
Papilární karcinom štítné žlázy (PTC)
Papilární karcinom je nejčastějším maligním nádorem štítné žlázy, jehož incidence nejrychleji narůstá a dosahuje v současné době až 90 % zastoupení mezi všemi zhoubnými nádory štítné žlázy. Hlavními genetickými změnami detekovanými u PTC jsou bodové mutace genů BRAF, RAS, TERT a fúzní geny. Mutace v genech BRAF, RAS nebo fúzní geny se obecně společně nevyskytují, ale každá z těchto mutací se může vyskytovat společně s TERT mutací [6].
V 15. exonu BRAF genu se nachází nejčastější mutace papilárního karcinomu BRAF V600E, vyskytující se přibližně u 40 % PTC. V literatuře byla popsána souvislost této mutace s vyšší agresivitou nádoru (především s extratyroidální invazí), metastázami v lymfatických uzlinách, horší prognózou, vyšším TNM stadiem a častějšími recidivami [7]. BRAF V600E bývá detekována ale i u obecně nízkorizikových T1 pacientů. BRAF mutace je navíc spojena s nižší expresí genů pro NIS (natrium-iodide symporter), TPO (thyroid peroxidase) a tyreoglobulin, což při terapii radiojódem způsobuje výrazně zhoršený efekt léčby [8]. Podle doporučení ETA je u uzlů větších než 1 cm s předoperačně detekovanou mutací BRAF V600E doporučena TTE s možnou profylaktickou disekcí centrálních lymfatických uzlin [4].
K bodovým mutacím v RAS genech (H-RAS, K-RAS a N-RAS) dochází ve 12., 13. a 61. kodónu – 2. a 3. exonu genů. U PTC jsou RAS mutace detekovány především u opouzdřených folikulárních variant PTC, tumorů s relativně příznivou prognózou, na druhou stranu v některých studiích byly detekovány RAS mutace bez žádné další mutace u pacientů s PTC a vzdálenými metastázami do plic a kostí [2,9]. Přítomností RAS mutací se folikulární varianta PTC blíží spíše folikulárním karcinomům. Také morfologicky se jim podobá svým typickým folikulárním růstem, ovšem pro své jaderné znaky je zařazována k papilárním karcinomům. Folikulární varianta PTC tak leží na pomezí mezi papilárním a folikulárním karcinomem jak po stránce morfologické, tak genetické [1].
V promotoru genu TERT jsou známy dvě hlavní bodové mutace C228T a C250T, vyskytující se přibližně u 11 % PTC [10]. U TERT pozitivních PTC bývá většinou detekována i mutace BRAF V600E, v menší míře RAS mutace. TERT mutace obecně postihují pacienty starší 40 let a jsou spojeny s větší velikostí a extenzí karcinomu, vyšší frekvencí lokálních a vzdálených metastáz, větší četností recidiv nebo perzistence onemocnění a v neposlední řadě také s vyšší mortalitou [10]. Podle doporučení ETA je u uzlů větších než 1 cm s předoperačně detekovanou mutací v TERT genu doporučena TTE s možnou profylaktickou disekcí centrálních lymfatických uzlin [4].
Fúzní geny se u dospělých pacientů vyskytují přibližně s 15% frekvencí [6], u dětí a mladistvých ale představují nejčastější genetickou změnu (40–70 %) [11]. Zvýšená frekvence je také u pacientů s radiační anamnézou (50–80 %) [12]. Fúzní geny jsou spojeny s vyšší invazivitou nádoru a vyšším rizikem metastáz do lymfatických uzlin [13]. Součástí fúzního genu bývá onkogen, a to nejčastěji RET protoonkogen, fúzní geny, jejichž je součástí, bývají souhrnně nazývány RET/PTC přeskupení. Pokud je předoperačně toto přeskupení detekováno, je doporučena TTE [4]. Některé publikace doporučují zvážit také profylaktickou disekci centrálních lymfatických uzlin [13]. Kromě RET/PTC přeskupení bývají u PTC často detekovány také NTRK, ALK a BRAF fúzní geny [14].
Folikulární karcinom štítné žlázy (FTC)
Nejčastějšími genetickými změnami u folikulárního karcinomu, druhého nejčastějšího maligního nádoru štítné žlázy, jsou mutace RAS genů a PAX8/PPARγ přeskupení. Mutace v genech H-RAS, K-RAS a N-RAS se vyskytují u 20–40 % folikulárních adenomů (FTA) a 45 % folikulárních karcinomů [15]. Přestože jsou mutace v RAS genech přítomné i u FTA nebo hraničních tumorů (např. NIFTP − noninvasive follicular thyroid neoplasm with papillary-like nuclear features), předpokládá se, že RAS pozitivní nádory mohou být prekurzorem vzniku folikulárního karcinomu nebo folikulární varianty PTC a tyto karcinomy mohou dále predisponovat k dediferenciaci a transformaci na anaplastický karcinom (ATC) [16]. Proto preoperační detekce mutací RAS a následné chirurgické odstranění RAS pozitivních adenomů může sloužit jako prevence předpokládané progrese. Podle ETA se doporučuje spíše méně radikální operace, např. HTE [4].
PAX8/PPARγ přeskupení je nejčastěji se vyskytujícím fúzním genem u FTC (25–60 %) a v menší míře také u FTA (2–10 %). Folikulární adenomy pozitivní na tuto mutaci mají obvykle silné pouzdro a vykazují imunohistochemický profil charakteristický pro karcinomy, tudíž by se mohlo jednat o preinvazivní stav FTC nebo tumor, jehož invaze byla při histologickém vyšetření přehlédnuta [17]. U předoperačně detekovaného PAX8/PPARγ přeskupení je doporučena TTE [4].
Nízce diferencovaný (PDTC) a anaplastický karcinom štítné žlázy (ATC)
Často nalézané dobře diferencované buňky v nízce diferencovaných (PDTC) a anaplastických karcinomech štítné žlázy naznačují, že tyto tumory nevznikají pouze de novo, ale mohou vznikat také dediferenciací z diferencovaných karcinomů. Přispívá k tomu i skutečnost, že tyto karcinomy mívají genetické změny typické pro diferencované karcinomy – mutace v genech BRAF a RAS. Vyskytují se ale u nich i další genetické změny, nejčastěji TERT mutace a mutace v genu TP53, které se pravděpodobně podílejí na iniciaci dediferenciace [18,19].
Medulární karcinom štítné žlázy (MTC)
MTC je nádor vycházející z parafolikulárních C-buněk, které pocházejí z neuroektodermu. Zatímco většina pacientů s MTC má sporadickou formu, u 25 % pacientů se vyskytuje forma dědičná, která je klasifikována do tří klinických subtypů – MEN2A a MEN2B (syndrom mnohočetné endokrinní neoplazie typu 2A a 2B) a FMTC (familiární MTC). Genetickou příčinou dědičných forem a přibližně poloviny sporadických MTC jsou mutace v RET protoonkogenu. Nalezení zárodečné mutace v RET genu u pacienta pomůže identifikovat i příbuzné pacienta, kteří mutovanou alelu zdědili a u kterých by se bez včasné profylaktické totální tyroidektomie vyvinul MTC. Na základě popsaných genotypově-fenotypických korelací byly mutace rozděleny dle své agresivity do skupin s doporučením, v jakém věku pacienta by měla být profylaktická operace provedena, aby se zabránilo vzniku onemocnění. Téměř 90 % mutací v rodinách s MEN2A postihuje kodon 634 (11. exon), zatímco u FMTC jsou mutace více rozmístěné v cysteinově bohaté oblasti (10., 11., 13., 14. exon). U MEN2B se většina zárodečných mutací nalézá v kodonu 918 (16. exon), méně pak v 15. exonu v intracelulární tyrozinkinázové doméně RET genu. U sporadických MTC jsou somatické mutace v RET genu nalézány u 50 % pacientů. Většina z nich postihuje kodon 918 (16. exon). Dále jsou u RET-negativních sporadických MTC detekovány mutace v genech HRAS a KRAS [20].
Léčba a molekulárně cílená terapie
Léčba diferencovaných karcinomů štítné žlázy obecně spočívá v chirurgickém řešení a následné léčbě radiojódem, na kterou je ve většině případů příznivá reakce. Menší část DTC je však radiojód refrakterní a stejně jako u PDTC, ATC nebo MTC je nutné přistoupit k radioterapii nebo molekulárně cílené terapii.
Nejslibnějším lékem pro dědičný i sporadický MTC je vandetanib (anilinquinazolin). In vivo studie ukázaly jeho efektivní blokaci fosforylace a signalizace RET proteinu, inhibici nádorového růstu, angiogeneze a zároveň nízkou toxicitu pro okolní tkáně. V klinických studiích došlo u metastatického MTC po podání vandetanibu ke snížení plazmatického kalcitoninu a zastavení růstu primárního nádoru i metastáz [20]. Sorafenib je multikinázový inhibitor s aktivitou proti BRAF, VEGFR-2, VEGFR-3 a PDGFR (platelet-derived growth factor receptor). Efektivně blokuje normální i mutovanou BRAF kinázovou aktivitu, a tím inhibuje MAPK signální dráhu [21]. Vzhledem k tomu, že BRAF mutace je nejčastější genetickou změnou u PTC a je spojena s dediferenciací nádoru a rezistencí na terapii radiojódem, je sorafenib slibným preparátem.
V minulých letech bylo po úspěšných klinických studiích schváleno používání řady dalších kinázových inhibitorů. Jedním z nich je levantinib inhibující kinázy VEGFR1, VEGFR2 a VEGFR3 a je registrován pro léčbu radiojód refrakterních DTC. Dalším velice slibným lékem je larotrectinib, který je specifickým inhibitorem NTRK kináz a může být podáván jen pacientům, u kterých byl genetickým vyšetřením potvrzen NTRK fúzní gen. Dalším lékem je crizotinib, který je hlavně používán u nemalobuněčného karcinomu plic. Jedná se o inhibitor ALK a ROS1 kináz a může být podán pacientům s karcinomem štítné žlázy, u nichž byl detekován ALK fúzní gen [22].
Diskuze
Analýza RET protoonkogenu se v diagnostice familiárního medulárního karcinomu využívá již více než dvě desetiletí a slouží nejen pacientům, ale také k indikaci profylaktické operace u pozitivních příbuzných pacienta. Identifikace jednotlivých genetických změn v RET protoonkogenu může u pacientů pomoci odhadnout prognózu onemocnění, popř. zpřesnit diagnózu, ale hlavně indikuje včasný terapeutický zásah u rizikových osob ještě v presymptomatickém stadiu onemocnění.
Zatímco ještě před několika lety byl genetický výzkum diferencovaných karcinomů štítné žlázy čistě akademický, nyní se získaných poznatků využívá v klinické praxi. Detekce mutací v genech BRAF, RET a RAS, TERT a fúzních genů u nádorů štítné žlázy se nyní rutinně využívá v předoperační molekulární diagnostice z aspiračních biopsií tenkou jehlou i u postoperačních vzorků pro přesnější určení prognózy onemocnění. Nutná je ale především multidisciplinární spolupráce ošetřujícího endokrinologa, molekulárního genetika, chirurga, patologa, lékaře z nukleární medicíny a onkologa. Získání kvalitního materiálu na genetickou analýzu je stěžejním úkolem pro chirurga, který řádně připravený resekát štítné žlázy odešle po domluvě s patologem v nativním stavu a po histologickém vyšetření je část zamraženého nádoru odeslána na molekulárně genetickou analýzu.
Závěr
Díky stále hlubším znalostem o genetice nádorů štítné žlázy je možné detekované mutace korelovat s klinicko-patologickými daty a vyvozovat závěry o agresivitě onemocnění, riziku lokálních a vzdálených metastáz a riziku recidivy onemocnění. Nejvíce prozkoumaná je mutace BRAF, která je 100% specifická pro malignitu, ale jsou zkoumány i další genetické markery. Využití těchto genetických markerů umožní nejenom zpřesnění diagnózy, ale také cílenější chirurgický zákrok a pooperační léčbu pacientů s karcinomy štítné žlázy.
Podpořeno MZ ČR RVO 00023761
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
MUDr. Petr Bavor
Chirurgická klinika 2. LF UK a FN Motol
V Úvalu 84
150 06, Praha 5
e-mail: petr.bavor@fnmotol.cz
Sources
- Kopečková K. Nádory štítné žlázy. Praha, Mladá fronta 2019.
- Pekova B, Dvorakova S, Sykorova V, et al. Somatic genetic alterations in a large cohort of pediatric thyroid nodules. Endocrine connections 2019;8(6):796–805. doi:10.1530/EC-19-0069.
- Astl J. Chirurgická léčba nemocí štítné žlázy. Jesenius Maxdorf 2014.
- Paschke R, Cantara S, Crescenzi A, et al. European Thyroid Association guidelines regarding thyroid nodule molecular fine-needle aspiration cytology diagnostics. European Thyroid Journal 201;6(3):115–129. doi:10.1159/000468519.
- Astl J, Chovanec M, Lukeš P, et al. Thyroid carcinoma surgery in children and adolescents–15 years experience surgery of pediatric thyroid carcinoma. International Journal of Pediatric Otorhinolaryngology 2014;78(7):990–994. doi:10.1016/j.ijporl.2014.03.005.
- Agrawal N, Akbani R, Aksoy BA, et al. Integrated genomic characterization of papillary thyroid carcinoma. Cell 2014;159(3):676–690. doi:10.1016/j.cell.2014.09.050.
- Xing L. Genetic-guided Risk Assessment and Management of Thyroid Cancer. Endocrinology and Metabolism Clinics 2019;48(1):109–124. doi: 10.1016/j.ecl.2018.11.007.
- Xing M, Alzahrani AS, Carson KA, et al. Association between BRAF V600E mutation and recurrence of papillary thyroid cancer. Journal of Clinical Oncology 2015;33(1):42−50. doi:10.1200/JCO.2014.56.8253.
- Mehrzad R, Nishino M, Nucera C, et al. Invasive follicular variant of papillary thyroid cancer harboring the NRAS mutation Q61K and presenting with bone metastasis – A case report. International Journal of Surgery Case Reports 2018;38 : 180−184. doi:10.1016/j.ijscr.2017.06.067.
- Liu X, Qu S, Liu R, et al. TERT promoter mutations and their association with BRAF V600E mutation and aggressive clinicopathological characteristics of thyroid cancer. J Clin Endocrinol Metab. 2014;99(6):E1130−1136. doi:10.1210/jc.2013-4048.
- Paulson V, Rudzinski E, Hawkins D, et al. Thyroid Cancer in the Pediatric Population. Genes 2019;10 : 723. doi:10.3390/genes10090723.
- Su X, Li Z, He C, et al. Radiation exposure, young age, and female gender are associated with high prevalence of RET/PTC1 and RET/PTC3 in papillary thyroid cancer: a meta-analysis. Oncotarget 2016;7 : 16716−16730. doi:10.18632/oncotarget.7574.
- Yip L, Nikiforova MN, Yoo JY, et al. Tumor genotype determines phenotype and disease-related outcomes in thyroid cancer: a study of 1510 patients. Annals of Surgery 2015;262(3):519−525. doi:10.1097/SLA.0000000000001420.
- Yakushina V, Lerner L, Lavrov A. Gene fusions in thyroid cancer. Thyroid 2018;28 : 158−167. doi:10.1089/thy.2017.0318.
- Xing M. Clinical utility of RAS mutations in thyroid cancer: a blurred picture now emerging clearer. BMC Med. 2016;14 : 12. doi:10.1186/s12916-016-0559-9.
- Volante M, Rapa I, Gandhi M, et al. RAS mutations are the predominant molecular alteration in poorly differentiated thyroid carcinomas and bear prognostic impact. J Clin Endocrinol Metab. 2009;94(12):4735−4741. doi:10.1210/jc.2009-1233.
- Nikiforov Y. Molecular diagnostics of thyroid tumors. Arch Pathol Lab Med. 2011;135(5):569−577. doi:10.1043/2010-0664-RAIR.1.
- Sykorova V, Dvorakova S, Vcelak J, et al. Search for new genetic biomarkers in poorly differentiated and anaplastic thyroid carcinomas using next generation sequencing. Anticancer Research 2015;35(4):2029−2036.
- Pozdeyev N, Gay LM, Sokol ES, et al. Genetic analysis of 779 advanced differentiated and anaplastic thyroid cancers. Clinical Cancer Research 2018;24(13). doi:10.1158/1078-0432.CCR-18-0373.
- Roy M, Chen H, Sippel R. Current understanding and management of medullary thyroid cancer. The Oncologist 2016;18(10):1093–1100. doi:10.1634/theoncologist.2013-0053.
- Adnane L, Trail P, Taylor I et al. Sorafenib (BAY 43-9006, Nexavar), a dual-action inhibitor that targets RAF/MEK/ERK pathway in tumor cells and tyrosine kinases VEGFR/PDGFR in tumor vasculature. Methods Enzymol. 2006;407 : 597−612. doi:10.1016/S0076-6879(05)07047-3.
- Tirrò E, Martorana F, Romano C, et al. Molecular alterations in thyroid cancer: from bench to clinical practice. Genes 2019;10(9):709. doi:10.3390/genes10090709.
- Peková B, Sýkorová V, Dvořáková Š et al. RET, NTRK, ALK, BRAF, and MET fusions in a large kohort of pediatric papillary thyroid carcinomas. Thyroid 2020 [On line]. doi:org/10.1089/thy.2019.0802.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2020 Issue 11-
All articles in this issue
- Historie chirurgie štítné žlázy
- Co má vědět chirurg o genetice karcinomů štítné žlázy
- Papilární mikrokarcinom a papilární karcinom štítné žlázy na chirurgii EUC Kliniky Zlín
- Retrosternální struma
- Diferencovaný mikrokarcinom štítné žlázy − aktuální pohled
- Harmonický skalpel versus tradiční ligatury při axilární disekci u pacientek s karcinomem prsu: retrospektivní multivariační analýza
- Endoskopické přístupy v endokrinní chirurgii krku − uvedení TOETVA (Transoral Endoscopic Thyroidectomy by Vestibular Approach) do klinického použití na Chirurgické klinice FN Brno
- Chirurgie štítné žlázy a příštítných tělísek
- Zakladatel německé neurochirurgie a prvního samostatného neurochirurgického časopisu Wilhelm Tönnis (1898–1978) – dílo v kontextu doby
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Retrosternální struma
- Historie chirurgie štítné žlázy
- Papilární mikrokarcinom a papilární karcinom štítné žlázy na chirurgii EUC Kliniky Zlín
- Co má vědět chirurg o genetice karcinomů štítné žlázy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

