-
Medical journals
- Career
Odběr tukové tkáně při dárcovské nefrektomii; chirurgický model pro výzkum aterosklerózy
Authors: F. Thieme 1,2; L. Janoušek 1,2; A. Králová 3; S. Čejková 3; I. Králová Lesná 3; R. Poledne 3; J. Froněk 1,2,4
Authors‘ workplace: Klinika transplantační chirurgie, Institut klinické a experimentální medicíny, Praha 1; 1. lékařská fakulta Univerzity Karlovy, Praha 2; Laboratoř pro výzkum aterosklerózy, Institut klinické a experimentální medicíny, Praha 3; Ústav anatomie, 2. lékařská fakulta Univerzity Karlovy, Praha 4
Published in: Rozhl. Chir., 2019, roč. 98, č. 12, s. 476-480.
Category: Review
doi: https://doi.org/10.33699/PIS.2019.98.12.476–480Overview
Transplantační program v IKEM se zvýšeným počtem příbuzenských transplantací ledvin nabízí možnost získání lidské tukové tkáně pro vědecké účely od pacientů s různým stupněm aterosklerózy. Chirurgie jako obor řeší především komplikace aterosklerózy. Na druhé straně ale může být chirurgický výkon i důvodem akcelerovaného rozvoje aterosklerózy. Takovým příkladem může být žijící dárce ledviny, zejména pak pokud takový dárce na jedné straně splňuje mezinárodně uznaná kritéria dárcovství, na straně druhé trpí metabolickým syndromem. Snaha o zpřesnění některých vyšetření žijících dárců ledvin ve smyslu rizika rozvoje aterosklerózy je dlouhodobý projekt. Cílem je zpřesnění stratifikace rizika žijících dárců ledvin a tím prevence dlouhodobých komplikací po dárcovství. Technika odběru tukové tkáně od žijícího dárce a experimentální model pro výzkum aterosklerózy jsou v práci detailně popsány. Výzkumný projekt má potenciál zvýšit bezpečnost žijícího dárce ledvin a současně může přispět k dalšímu pochopení mechanismů rozvoje aterosklerózy.
Klíčová slova:
ateroskleróza – perivaskulární tuková tkáň – transplantace ledviny od žijícího dárce – metabolický syndrom
Ateroskleróza
Aterosklerózu lze chápat jako degenerativní zánětlivé onemocnění cévní stěny. Je to dlouhotrvající proces, který je ovlivňován genetickým pozadím jedince a vlivy prostředí. Klinicky se manifestuje jako ischemické kardiovaskulární choroby, kterým je pro jejich vysokou prevalenci věnována velká pozornost na poli vědy. Jak přibývají vědecké znalosti, tak se i rozšiřuje seznam činitelů podílejících se na vzniku a progresi aterosklerózy [1]. V současné době je ateroskleróza vnímána jako imunitně zánětlivý proces, který je odpovědí na poškození intimy [2]. Dysfunkční endotel má v časné fázi aterogeneze vyšší propustnost pro aterogenní lipidy a makrofágy. Při zvýšené hladině LDL částic v plazmě se zvyšuje jejich průnik endotelem a jejich vychytávání intimálními makrofágy a buňkami hladkých svalů cévní stěny. Současně se zvyšuje i množství oxidovaných LDL-částic. Po překročení degradační kapacity těchto buněk se v nich lipidy hromadí zejména ve formě esterů cholesterolu a vznikají pěnové buňky. Ty jsou potom základem ateromové léze. Zároveň dochází k vystupňované expresi cytoadhezivních molekul, cytokinů a dalších mediátorů zánětu jak v makrofázích, tak v buňkách cévní stěny [3,4].
Imunologické pozadí vzniku aterosklerózy
Na rozvoji aterosklerotických procesů mají významný podíl imunologické mechanismy. Jako odpověď na hemodynamické poškozování cévní stěny v nejvíce namáhaných místech vzniká chronický zánětlivý proces stěny arterií. Na počátku rozvoje aterosklerózy stojí porušení cévní výstelky vedoucí k dysfunkci cévního endotelu s tvorbou cytokinů, adhezních molekul a růstových faktorů [2]. Dochází k navázání cirkulujících monocytů na endotelové buňky a jejich průniku do subendotelového prostoru [5]. Aktivované endotelové buňky přitahují z krevní cirkulace do místa léze nejen monocyty, ale i T-lymfocyty [6]. Diferencující se monocyty v patogenezi aterosklerózy se uplatňují hlavně akumulací oxidovaných LDL částic a produkcí celé řady cytokinů [7]. V aterosklerotickém plátu se vyskytují makrofágy. Jejich četnost pozitivně koreluje s pokročilostí aterosklerotické léze [8]. Jsou známé dva odlišné fenotypy makrofágů označované jako M1 (prozánětlivé) a M2 (protizánětlivé), které se diferencují na podkladě působení celé řady okolních signálů. Důležitý je jejich vzájemný poměr. Podle některých autorů M1 makrofágy převažují v symptomatických aterosklerotických placích, kdežto M2 makrofágy se vyskytují v placích, které jsou častěji asymptomatické [9]. Imunologické mechanismy vzniku a vývoje aterosklerózy jsou stále předmětem intenzivního výzkumu [10].
Perivaskulární tuková tkáň
Všechny cévy jsou obklopeny tukovou tkání [11]. Tuková tkáň, a to především viscerální tuková tkáň, je v dnešní době vnímána jako významný endokrinní a imunologicky aktivní orgán produkující látky s parakrinním i endokrinním účinkem. Je známo, že se adipokiny z viscerální tukové tkáně uplatňují v patogenezi inzulinové rezistence a metabolického syndromu [12]. Naše recentně publikované výsledky prokázaly přímý vliv produktů uvolněných z viscerální tukové tkáně na aktivaci endotelu a zvýšenou adhezi monocytů k endotelu in vitro [13]. V tomto nově zavedeném in vitro modelu jsme potvrdili, že bioaktivní látky uvolněné z tukové tkáně vedou k významnému zvýšení míry adheze monocytů k endotelu, jakožto iniciálního kroku jejich migrace z krevního oběhu. Dále se podílejí na prozánětlivých změnám v genové expresi endoteliálních buněk. Takto zvýšená adheze monocytů k endotelu a jejich migrace do cévních stěn může přímo přispívat k rozvoji aterosklerózy. Dále přispívá migrace monocytů do tukové tkáně a jejich diferenciace k chronickému zánětu. Právě chronický zánět je zásadní v rozvoji tzv. metabolického syndromu. Metabolický syndrom je těsně spjatý s vývojem kardiovaskulárních onemocnění na podkladě progrese aterosklerózy [14–16]. Perivaskulární tuková tkáň (PVT) byla dlouho považována spíše jen za pasivní strukturální oporu cév. Řada výzkumných prací poukazuje na její významnou vazokrinní úlohu v regulaci průsvitu cév [17,18]. Na základě recentních dat je pravděpodobné, že podobně jako viscerální tuková tkáň, produkuje také PVT řadu biologicky aktivních mediátorů. Ty mohou lokálně ovlivňovat vývoj aterogeneze. Úloha perivaskulární tukové tkáně není v tomto směru objasněna [19].
Byla provedena řada intervenčních studií zaměřených na studium vlivu PVT na patogenezi aterosklerózy s využitím zvířecích modelů. Studie Takaoka a kol. (2009) využívající transplantační studie podala důležité důkazy o úloze PVT po cévním poranění. V případě transplantačních studií na zvířecích modelech se viscerální nebo perivaskularní tuk donora transplantuje do oblasti abdominální aorty nebo femorální arterie příjemce zbavené perivaskulárního tuku. Tato studie prokázala ochrannou funkci PVT při cévním poranění za bazálních podmínek a vliv dysfunkce PVT vyvolané krátkodobým podáváním vysokotukové diety projevující se zvýšenou tvorbou neointimy po operačním zákroku. Zánětlivá infiltrace PVT má přímou souvislost s endoteliální dysfunkcí [20]. Zánětlivé změny v perivaskulárním tuku mají svou roli v procesu patogeneze aterosklerózy. To je i v souladu s dalšími pracemi naznačujícími úlohu PVT při vzniku aterosklerotického onemocnění tepen [21,22].
Transplantace ledviny
Transplantace ledvin je nejvýhodnější a v současné době rutinní možností terapie chronického selhání ledvin. K transplantaci ledviny je indikován každý nemocný s chronickým selháním ledvin, který nemá žádnou kontraindikaci této léčby. Česká republika patří dlouhodobě k zemím, které jsou v počtu transplantací ledvin na předním místě v Evropě [23]. Je to jednak díky transplantačnímu zákonu, který předpokládá souhlasné stanovisko zemřelého dárce k transplantaci, a hlavně díky zavedenému transplantačnímu programu transplantací od zemřelých dárců a v posledních letech i přibývajícímu počtu transplantací od žijících dárců. Kvůli nedostatku zemřelých dárců se prodlužuje čekací doba a stoupá mortalita pacientů na čekací listině. Jedna z možností, jak zkrátit dobu čekání, je transplantace od žijícího dárce. Poprvé provedl transplantaci od žijícího dárce Joseph Murray a jeho tým před 65 lety v Bostonu [24]. Během této doby se ukázalo, že transplantace ledviny od žijícího dárce je bezesporu nejvhodnější alternativou náhrady ledvin pro pacienty s chronickým selháním s minimálními krátkodobými i dlouhodobými riziky [25]. V České republice se za rok 2017 uskutečnilo 469 transplantací ledvin, z toho 252 v Institutu klinické a experimentální medicíny; včetně 45 případů transplantací od žijícího dárce. To představuje více než 53 % všech transplantací ledvin v ČR [26].
Žijící dárce ledviny
Žijícím dárcem ledviny může být každá osoba starší 18 let, která chce nezištně poskytnout tento orgán svému příbuznému či jinak blízké osobě. S rostoucím nedostatkem orgánů se stále zvyšuje poptávka po dárcích ledvin. Kandidát dárcovské nefrektomie by měl být informován o možnosti rizika selhání ledvin vyžadujícího dialýzu nebo transplantaci. Ovšem tato postnefrektomická rizika jsou velmi nízká v prvních několika desetiletích a jsou jen mírně vyšší nežli rizika v běžné populaci [27,28].
Technika dárcovské nefrektomie
Světovým trendem dárcovské nefrektomie je laparoskopický odběr, který může být transperitoneální nebo retroperitoneoskopický. Obě laparoskopické formy mohou být modifikovány ručně asistovanou technikou. Bylo prokázáno, že metoda HARS (hand-assisted-retroperitoneoscopicnefrectomy) je metodou volby vzhledem k nízkému riziku komplikací a současně kratšímu času teplé ischemie štěpu, celkovému operačnímu času, ale i délce hospitalizačního pobytu [29,30]. HARS dárcovská nefrektomie je standardem i na naší klinice [31].
Zkušenosti chirurga při dárcovské nefrektomii jsou nezbytné. Jedná se o precizní chirurgický výkon, který se provádí na zdravém pacientovi, kdy je důležité eliminovat jakékoliv komplikace [32]. Dle Evropské urologické asociace nejsou věkové hranice pro dárcovství ledvin v současnosti stanoveny, chybí doporučení pro maximální věk pro darování. Mladí dárci ve věku <18 let a ženy v reproduktivním věku nejsou indikováni k dárcovské nefrektomii, s výjimkou vzácných případů, kdy pro příjemce neexistují žádné další možnosti. Body mass index (BMI) >35 kg/m2 se považuje za relativní kontraindikaci pro živé dárce ledvin [33].
Současné kontraindikace dárcovství ledviny
Diabetes mellitus, hypertenze a obezita představují obecné kontraindikace k darování, protože jsou spojeny s pooperačními komplikacemi se zvýšeným rizikem vzniku a progrese kardiovaskulárních onemocnění a poruch renálních funkcí [28]. Pacienti s diabetem mellitem I. typu jsou kontraindikováni k odběru. Dárci s prediabetem nebo diabetem mellitem II. typu by měli být důkladně vyšetřeni a hodnoceni individuálně, nejedná se však o absolutní kontraindikaci k odběru.
Kandidáti s kontrolovanou a medikamentózně léčenou hypertenzí pod 140/90 mmHg s použitím jednoho nebo dvou antihypertenziv, bez orgánového postižení, mohou být akceptováni k dárcovství [34]. Dle Evropské urologické asociace je nekontrolovaná hypertenze absolutní kontraindikací k odběru ledvin [33]. Léčená dyslipidemie nepředstavuje kontraindikaci k odběru v závislosti na celkovém stavu dárce [28]. Tato jednotlivá kritéria jsou dále podrobena důkladnému výzkumu a postupně dochází k jejich rozšíření. Můžeme tedy říci, že obezita, léčená hypertenze či dyslipidemie v současné době nepředstavují absolutní kontraindikaci k dárcovské nefrektomii [35]. Pokud se vyskytnou uvedené morbidity společně a pacient splňuje kritéria pro metabolický syndrom, musí být z dárcovství vyloučen.
Metabolický syndrom
Metabolický syndrom představuje hlavní příčinu vyloučení dárců v některých programech dárcovské nefrektomie [36]. U některých nemocných se často vyskytuje kombinace centrální obezity, dyslipoproteinemie, hypertenze a inzulinové rezistence s poruchou glukózové tolerance či diabetu mellitu 2. typu. Kombinace více těchto faktorů je velmi riziková z hlediska rozvoje a progrese aterosklerózy a s ní spojených komorbidit [37]. Dále vede prokazatelně ke vzniku a progresi chronické renální insuficience [38]. Zhodnocení biopsií parenchymu ledvin od živých dárců ukázalo, že výskyt jednotlivých rizikových faktorů metabolického syndromu je spojen se sníženou hustotou glomerulů [39,40]. Nefrektomie představuje pro dárce ledviny ztrátu asi 30 % normální renální funkce [41], proto se každý dárce musí posuzovat z hlediska těchto rizikových faktorů přísně individuálně.
Vliv nefrektomie na funkci ledvin u živých dárců ledvin
Výsledky studií ukázaly, že přítomnost centrální obezity u živých dárců byla spojena s opožděným nástupem funkce ledviny po nefrektomii [42]. My jsme ve studii negativní vztah mezi vyšším BMI dárců a opožděným rozvojem funkce štěpu u příjemců nepotvrdili [43]. Co se týká samotných dárců ledvin, tak se v první dekádě po dárcovství podle publikovaných studií neprokázalo zvýšené riziko kardiovaskulárních příhod a celkové mortality [44,45]. Při delším sledování se ukazuje možnost zvýšeného rizika chronické renální insuficience u dárců ledvin [46]. Jedním z důvodů může být vznik metabolického syndromu [47] s urychlením aterosklerózy. Jiná studie poukázala na vzájemný vztah mezi sníženou funkcí ledvin současně se zvýšením oxidativního stresu a snížením celkové antioxidační kapacity [48].
Význam odběru tukové tkáně při dárcovské nefrektomii
Jistý vztah kardiovaskulárních nemocí a obezity je dobře znám už z konce 40. let minulého století [49]. Vliv množství tuku na komplikace aterosklerózy zůstává poměrně nejasný. Vedle zprostředkovaného vztahu patofyziologických parametrů „metabolického syndromu“ (jak je v současnosti tento souhrn patologií označen) se ale objevuje v posledních několika letech vztah daleko méně zprostředkovaný, jež souvisí s produkcí molekul tukovou tkání, které mohou přímo ovlivnit aterogenní proces. Dále mohou nepřímo ovlivnit vlastnosti monocytů a jejich vliv na rozvoj aterogeneze [50,51]. Možnost přímého vlivu tukové perivaskulární tkáně a vztah k aterogenezi v přilehlé arterii byl rovněž recentně popsán [52]. Většina nálezů, které dokumentují přímý vztah tukové tkáně a aterosklerózy, je získána z experimentálních studií na zvířecích (většinou transgenních) modelech [52]. Dlouhodobě je známo, že tzv. viscerální tuková tkáň je imunologicky aktivnějším orgánem oproti tkáni podkožní. Cytokiny a adipokiny uvolňované z viscerální tukové tkáně (TNF-α, IL-6, IL-1β, adiponektin aj.) jsou jednoznačně faktory vedoucími k chronickému proinflamačnímu stavu, inzulinové rezistenci a metabolickému syndromu [53]. Přímé lokální ovlivnění přilehlého endotelu vysoce proinflamačními cytokiny uvolňovanými z perivaskulární tukové tkáně může pak zásadně ovlivnit endotelovou dysfunkci a rozvoj aterosklerotické léze [54]. Odběr dárcovské ledviny od zdravých jedinců nabízí možnost pro studium perivaskulárního tuku u lidí. V našich podmínkách se při dárcovské nefrektomii odebírá tuková tkáň z podkoží, z oblasti Gerotovy fascie a perirenální tuková tkáň od arteria renalis. Dále se jako jedinečný materiál odebírá vzorek samotné arteria renalis, která byla mechanicky přerušena staplerem při odběru ledviny. Všechen tento materiál je podrobně vyšetřován s identifikací buněčných markerů proinflamačního stavu a protizánětlivých cytokinů u subjektů s pokročilou aterosklerózou oproti zdravým subjektům (dárcům ledvin).
Transplantační program v IKEM se zvýšeným počtem příbuzenských transplantací ledvin nabízí možnost získání lidské tukové tkáně pro vědecké účely od pacientů s různým stupněm aterosklerózy. Od živých dárců ledvin získaná tuková tkáň z očištěných ledvin je v laboratoři k dispozici během krátké doby, Obr. 1.
Image 1. Ledvina od dárce; odběr tukové tkáně
Fig. 1. Living-donor kidney; removal of adipose tissue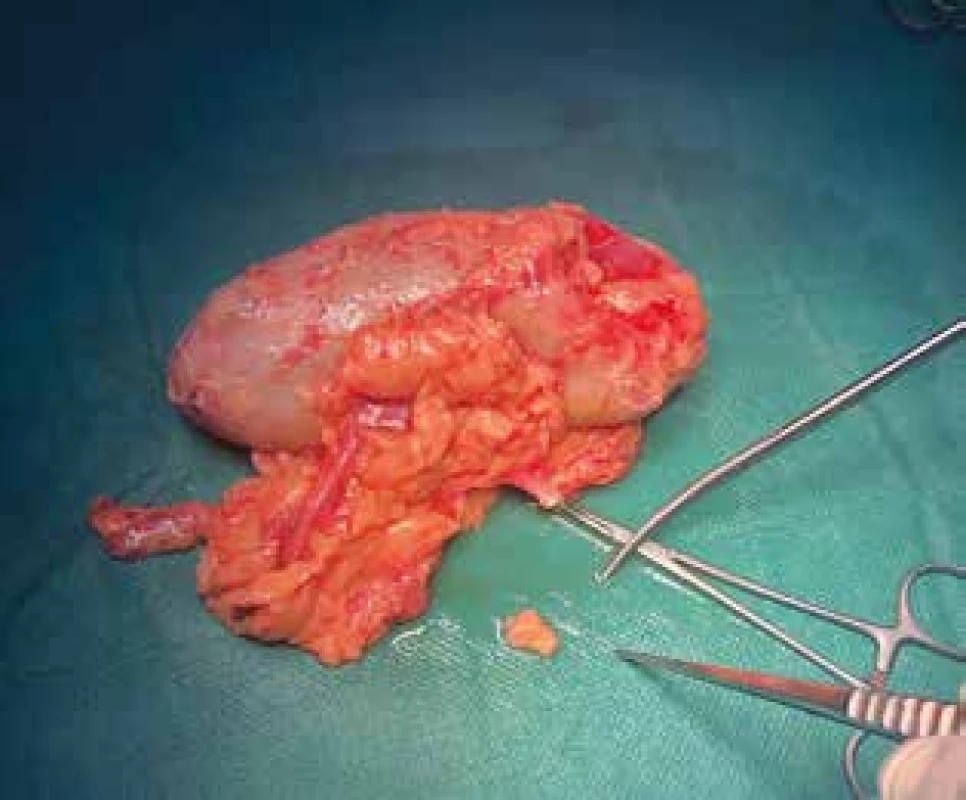
Rezidenční makrofágy, které jsou z této tkáně izolovány, mají v převážné míře proinflamační charakter s výrazně vysokou expresí scavangerového receptoru CD36 [55]. Opačným pólem jsou makrofágy neexprimující CD16 se slabou expresí CD36 receptoru. Tento fenotyp makrofágů v tukové tkáni považujeme za antiinflamační.
Ukázali jsme, že proporce proinflamačních makrofágů vzrůstá s rostoucí BMI [56] jak u mužů, tak u žen. To potvrzují dřívější nálezy v souvislosti s proinflamačním stavem měřeným koncentrací hsCRP se vzrůstajícím podílem tělesného tuku. Překvapivý vztah proporce proinflamačních makrofágů se ukázal při analýze vztahu ke koncentraci aterogenního cholesterolu. Jejich proporce ve viscerální tukové tkáni velmi úzce souvisí s koncentrací non-HDL cholesterolu v celém souboru živých dárců ledvin [57]. Z tohoto výsledku je tedy zřejmé, že negativní vliv zvýšené koncentrace aterogenních lipoproteinů v cirkulaci na rozvoj aterogeneze působí synergně s proinflamačním vlivem makrofágů v tukové tkáni. Platí tedy obecně, že rizikové faktory kardiovaskulárních nemocí – věk, nadbytek tělesného tuku a hypercholesterolemie – souvisejí se zvýšenou proporcí proinflamačních makrofágů v tukové tkáni [58]. Je tedy pravděpodobné, že proinflamační stav organismu stimuluje vznik aterosklerózy synergně s hypercholesterolemií, věkem a sníženou citlivostí k inzulinu.
Závěr
Naše studie v posledních letech byly umožněny rozsáhlým transplantačním programem v IKEM a zvýšeným počtem příbuzenských transplantací ledvin. Získání vzorku tukové tkáně od žijícího dárce ledviny je unikátní situace, kdy získaný vzorek tukové tkáně pochází od obvykle velmi zdravého a současně extenzivně vyšetřeného probanda. Celý projekt má potenciál zvýšit bezpečnost žijícího dárce ledvin a současně více porozumět patogenezi aterosklerózy.
Seznam zkratek
BMI – body mass index
IKEM – Institut klinické a experimentální medicíny
HARS – hand-assisted-retroperitoneoscopicnefrectomy
LDL – lowdensity lipoprotein
PVT – perivaskulární tuková tkáň
Projekt byl schválen etickou komisí G-12-06-11 s jednacím číslem 1041/12.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Filip Thieme
Institut klinické a experimentální medicíny
Vídeňská 1958/9
140 21 Praha 4
e-mail: thif@ikem.cz
Sources
- Kralova Lesna I, Suchanek P, Brabcova E, et al. Effect of different types of dietary fatty acids on subclinical inflammation in humans. Physiol Res. 2013;62 : 145–52.
- Jonasson L, Holm J, Skalli O, et al. Regional accumulations of T cells, macrophages, and smooth muscle cells in the human atherosclerotic plaque. Arteriosclerosis 1986;6 : 131–8. doi: 10.3109/00016347309157091.
- Ross R. Atherosclerosis—an inflammatory disease. N Engl J Med. 1999; 340 : 115–26. doi: 10.1056/NEJM199901143400207.
- Stary HC. Evolution and progression of atherosclerotic lesions in coronary arteries of children and young adults. Arteriosclerosis 1989;9:I19–32.
- Cejkova S, Kralova Lesna I, Fronek J, et al. Pro-inflammatory gene expression in adipose tissue of patients with atherosclerosis. Physiol Res. 2017;66 : 633–40.
- Geissmann F, Auffray C, Palframan R, et al. Blood monocytes: distinct subsets, how they relate to dendritic cells, and their possible roles in the regulation of T-cell responses. Immunol Cell Biol. 2008;86 : 398–408. doi: 10.1038/icb.2008.19.
- Galkina E, Ley K. Leukocyte influx in atherosclerosis. Curr Drug Targets 2007;8 : 1239–48. doi: 10.2174/138945007783220650.
- Stoger JL, Gijbels MJ, van der Velden S, et al. Distribution of macrophage polarization markers in human atherosclerosis. Atherosclerosis 2012;225 : 461–8. doi: 10.1016/j.atherosclerosis.2012.09.013.
- Cho KY, Miyoshi H, Kuroda S, et al. The phenotype of infiltrating macrophages influences arteriosclerotic plaque vulnerability in the carotid artery. J Stroke Cerebrovasc Dis. 2013;22 : 910–8. doi: 10.1016/j.jstrokecerebrovasdis.2012.11.020.
- Kralova A, Kralova Lesna I, Poledne R. Immunological aspects of atherosclerosis. Physiol Res. 2014;63 Suppl 3: S335–42.
- Cinti S. Adipocyte differentiation and transdifferentiation: plasticity of the adipose organ. J Endocrinol Invest. 2002;25 : 823–35. doi: 10.1007/BF03344046.
- Hitsumoto T, Takahashi M, Iizuka T, et al. Relationship between metabolic syndrome and early stage coronary atherosclerosis. J Atheroscler Thromb. 2007;14 : 294–302. doi: 10.5551/jat.e506.
- Cejkova S, Kubatova H, Thieme F, et al. The effect of cytokines produced by human adipose tissue on monocyte adhesion to the endothelium. Cell Adh Migr. 2019;13 : 293–302. doi: 10.1080/19336918.2019.1644856.
- Matsuzawa Y. The metabolic syndrome and adipocytokines. FEBS Lett. 2006;580 : 2917–21. doi: 10.1016/j.febslet.2006.04.028.
- Teramoto T, Sasaki J, Ueshima H, et al. Metabolic syndrome. J Atheroscler Thromb. 2008;15 : 1–5. doi: 10.5551/jat.e580.
- Trayhurn P. Adipose tissue in obesity—an inflammatory issue. Endocrinology 2005;146 : 1003–5. doi: 10.1210/en.2004-1597.
- Gao YJ. Dual modulation of vascular function by perivascular adipose tissue and its potential correlation with adiposity/lipoatrophy-related vascular dysfunction. Curr Pharm Des. 2007;13 : 2185–92. doi: 10.2174/138161207781039634.
- Gao YJ, Lu C, Su LY, et al. Modulation of vascular function by perivascular adipose tissue: the role of endothelium and hydrogen peroxide. Br J Pharmacol. 2007;151 : 323–31. doi: 10.1038/sj.bjp.0707228.
- Fernandez-Alfonso MS, Somoza B, Tsvetkov D, et al. Role of perivascular adipose tissue in health and disease. Compr Physiol. 2017;8 : 23–59. doi: 10.1002/cphy.c170004.
- Horimatsu T, Patel AS, Prasad R, et al. Remote effects of transplanted perivascular adipose tissue on endothelial function and atherosclerosis. Cardiovasc Drugs Ther. 2018;32 : 503–10. doi: 10.1007/s10557-018-6821-y.
- Barandier C, Montani JP, Yang Z. Mature adipocytes and perivascular adipose tissue stimulate vascular smooth muscle cell proliferation: effects of aging and obesity. Am J Physiol Heart Circ Physiol. 2005;289:H1807–13. doi: 10.1152/ajpheart.01259.2004.
- Sacks HS, Fain JN. Human epicardial adipose tissue: a review. Am Heart J. 2007;153 : 907–17. doi: 10.1016/j.ahj.2007.03.019.
- Kuman M. Solid organ transplantation in the Czech Republic. [In Czech]. VnitrLek .2015;61 : 741–46.
- Murray JE, Barnes BA. Human kidney transplantation. J Am Med Womens Assoc. 1968;23 : 985–90.
- Murray JE, Tilney NL, Wilson RE. Renal transplantation: a twenty-five year experience. Ann Surg. 1976;184 : 565–73. doi: 10.1097/00000658-197611000-00006.
- www.ikem.cz (2018) https://www.ikem.cz/cs/darcovstvi-organu/zivot-sup-2-sup/statistika-ikem/a-3129/.
- Kasiske BL. The evaluation of prospective renal transplant recipients and living donors. Surg Clin North Am. 1998;78 : 27–39. doi: 10.1016/s0039-6109(05)70632-0.
- Lentine KL, Kasiske BL, Levey AS, et al. Summary of kidney disease: Improving global outcomes (KDIGO) Clinical practice guideline on the evaluation and care of living kidney donors. Transplantation 2017;101 : 1783–92. doi: 10.1097/TP.0000000000001770.
- Ozdemir-van Brunschot DM, Koning GG, van Laarhoven KC, et al. A comparison of technique modifications in laparoscopic donor nephrectomy: a systematic review and meta-analysis. PLoSOne 2015;10:e0121131. doi: 10.1371/journal.pone.0121131.
- Widmer JD, Schlegel A, Kron P, et al. Hand-assisted living-donor nephrectomy: a retrospective comparison of two techniques. BMC Urol. 2018;18 : 39. doi: 10.1186/s12894-018-0355-2.
- Fronek JP, Chang RW, Morsy MA. Hand-assisted retroperitoneoscopic living donor nephrectomy: first UK experience. Nephrol Dial Transplant. 2006;21 : 2674–5. doi: 10.1093/ndt/gfl107.
- Helantera I, Honkanen E, Huhti J, et al. Living donor kidney transplantation. Duodecim 2017;133 : 937–44.
- Kalble T, Lucan M, Nicita G, et al. EAU guidelines on renal transplantation. Eur Urol. 2005;47 : 156–66. doi: 10.1016/j.eururo.2004.02.009.
- Magden K, Ucar FB, Velioglu A, et al. Donor contraindications to living kidney donation: A single-center experience. Transplant Proc. 2015;47 : 1299–1301. doi: 10.1016/j.transproceed.2015.04.050.
- Textor S, Taler S. Expanding criteria for living kidney donors: what are the limits? Transplant Rev. (Orlando) 2008;22 : 187–91. doi: 10.1016/j.trre.2008.04.005.
- Kasiske BL, Ravenscraft M, Ramos EL, et al. The evaluation of living renal transplant donors: clinical practice guidelines. Ad Hoc Clinical Practice Guidelines Subcommittee of the Patient Care and Education Committee of the American Society of Transplant Physicians. J Am Soc Nephrol. 1996;7 : 2288–313.
- Duvnjak L, Duvnjak M. The metabolic syndrome – an ongoing story. J Physiol Pharmacol. 2009;60 Suppl 7 : 19–24.
- Thomas G, Sehgal AR, Kashyap SR, et al. Metabolic syndrome and kidney disease: a systematic review and meta-analysis. Clin J Am Soc Nephrol. 2011;6 : 2364–73. doi: 10.2215/CJN.02180311.
- Ohashi Y, Thomas G, Nurko S, et al. Association of metabolic syndrome with kidney function and histology in living kidney donors. Am J Transplant. 2013;13 : 2342–51. doi: 10.1111/ajt.12369.
- Rule AD, Semret MH, Amer H, et al. Association of kidney function and metabolic risk factors with density of glomeruli on renal biopsy samples from living donors. Mayo Clin Proc. 2011;86 : 282–90. doi: 10.4065/mcp.2010.0821.
- Jeon HG, Lee SR, Joo DJ, et al. Predictors of kidney volume change and delayed kidney function recovery after donor nephrectomy. J Urol. 2010;184 : 1057–63. doi: 10.1016/j.juro.2010.04.079.
- Yoon YE, Choi KH, Lee KS, et al. Impact of metabolic syndrome on postdonation renal function in living kidney donors. Transplant Proc. 2015;47 : 290–4. doi: 10.1016/j.transproceed.2014.10.051.
- Thieme F, Janousek L, Fronek J, et al. The effect of ectopic fat on graft function after living kidney transplantation. Physiol Res. 2015;64 Suppl 3: S411–7.
- https://www.ikem.cz/cs/darcovstvi-organu/zivot-sup-2-sup/statistika-ikem/a-3129/.
- Ross LF, Thistlethwaite JR, Jr. Long-term consequences of kidney donation. N Engl J Med. 2009;360 : 2371; authorreply 2372.
- Muzaale AD, Massie AB, Wang MC, et al. Risk of end-stage renal disease following live kidney donation. JAMA 2014;311 : 579–86. doi: 10.1001/jama.2013.285141.
- Serrano OK, Sengupta B, Bangdiwala A, et al. Implications of excess weight on kidney donation: Long-term consequences of donor nephrectomy in obese donors. Surgery 2018;164 : 1071–6. doi: 10.1016/j.surg.2018.07.015.
- Yildirim M, Karahan M, Kucuk HF, et al. Increased oxidative stress in living kidney donors: correlation of renal functions with antioxidant capacity. Transplant Proc. 2017;49 : 407–10. doi: 10.1016/j.transproceed.2017.01.028.
- Vague J [Not Available]. Presse Med. 1947;55 : 339.
- Bays HE, Ballantyne CM, Kastelein JJ, et al. Eicosapentaenoic acid ethyl ester (AMR101) therapy in patients with very high triglyceride levels (from the Multi-center, plAcebo-controlled, Randomized, double-blINd, 12-week study with an open-label extension [MARINE] trial). Am J Cardiol. 2011;108 : 682–90. doi: 10.1016/j.amjcard.2011.04.015.
- Chinetti-Gbaguidi G, Baron M, Bouhlel MA, et al. Human atherosclerotic plaque alternative macrophages display low cholesterol handling but high phagocytosis because of distinct activities of the PPARgamma and LXRalpha pathways. Circ Res. 2011;108 : 985–95. doi: 10.1161/CIRCRESAHA.110.233775.
- Szasz T, Webb RC. Perivascular adipose tissue: more than just structural support. ClinSci. (Lond) 2012;122 : 1–12. doi: 10.1042/CS20110151.
- Surmi BK, Hasty AH. The role ofchemokines in recruitment of immune cells to the artery wall and adipose tissue. Vascul Pharmacol. 2010;52 : 27–36. doi: 10.1016/j.vph.2009.12.004.
- Karastergiou K, Mohamed-Ali V. The autocrine and paracrine roles of adipokines. Mol Cell Endocrinol. 2010;318 : 69–78. doi: 10.1016/j.mce.2009.11.011.
- Kralova Lesna I, Kralova A, Cejkova S, et al. Characterisation and comparison of adipose tissue macrophages from human subcutaneous, visceral and perivascular adipose tissue. J Transl Med. 2016;14 : 208. doi: 10.1186/s12967-016-0962-1.
- Lesna IK, Cejkova S, Kralova A, et al. Human adipose tissue accumulation is associated with pro-inflammatory changes in subcutaneous rather than visceral adipose tissue. Nutr Diabetes 2017; 7: e264. doi: 10.1038/nutd.2017.15.
- Poledne R, Kralova Lesna I, Kralova A, et al. The relationship between non-HDL cholesterol and macrophage phenotypes in human adipose tissue. J Lipid Res. 2016;57 : 1899–1905. doi: 10.1194/jlr.P068015.
- Kralova Lesna I, Petras M, Cejkova S, et al. Cardiovascular disease predictors and adipose tissue macrophage polarization: Is there a link? Eur J Prev Cardiol. 2018;25 : 328–34. doi: 10.1177/2047487317743355.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2019 Issue 12-
All articles in this issue
- Odběr tukové tkáně při dárcovské nefrektomii; chirurgický model pro výzkum aterosklerózy
- Přednemocniční aplikace transfuzních přípravků a krevních derivátů
- Léčba poranění jater v traumacentru Fakultní nemocnice Plzeň
- Načasování cholecystektomie v terapii akutní kalkulózní cholecystitidy
- Extraperitoneální fixace sleziny je vhodné řešení pro bloudivou slezinu u dětí a adolescentů – kazuistika
- Cholangioskopie a intraduktální sonografie v diagnostice karcinomu žlučových cest
- United European Gastroenterology Week – UEGW 2019
- Zápis z jednání schůze Redakční rady časopisu Rozhledy v chirurgii, konané dne 6. 11. 2019
- Dva typy autologních buněk v prevenci vytvoření striktury po kompletní cirkulární endoskopické disekci u miniprasete
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Načasování cholecystektomie v terapii akutní kalkulózní cholecystitidy
- Přednemocniční aplikace transfuzních přípravků a krevních derivátů
- Léčba poranění jater v traumacentru Fakultní nemocnice Plzeň
- Cholangioskopie a intraduktální sonografie v diagnostice karcinomu žlučových cest
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

