-
Medical journals
- Career
Světlobuněčný sarkom šlach a aponeuróz s lokalizací v pravé genitofemorální rýze – kazuistika
Authors: R. Adwan 1; P. Prošvic 1; J. Prošvicová 2; V. Straka 3; B. Herzig 4
Authors‘ workplace: Urologické oddělení, Oblastní nemocnice Náchod 1; Oddělení klinické onkologie, Oblastní nemocnice Náchod 2; Oddělení patologické anatomie a cytologie, Oblastní nemocnice Náchod 3; Chirurgické oddělení, Oblastní nemocnice Náchod 4
Published in: Rozhl. Chir., 2018, roč. 97, č. 9, s. 442-445.
Category: Case Report
Overview
Úvod:
Naše kazuistika uvádí dosud nepopsaný výskyt světlobuněčného sarkomu v genitofemorální rýze.
Kazuistika:
Prezentován je 57letý pacient se světlobuněčným sarkomem šlach a aponeuróz. Pacient podstoupil radikální operaci a adjuvantní radioterapii.
Závěr:
Pacient stále žije, je v dobrém stavu, bez reziduální recidivy či generalizace onemocnění.
Klíčová slova:
světlobuněčný sarkom šlach a aponeuróz − genitofemorální rýha
Úvod
Zhoubné nádory měkkých tkání patří všeobecně k méně častým nádorům. Incidence dosahovala v roce 2010 3,5/100 tis. mužů a 3,9/100 tis. žen. Celkově bylo v roce 2010 v ČR hlášeno 405 nových případů [1]. Světlobuněčný sarkom šlach a aponeuróz (SBS) je velmi vzácný tumor tvořící méně než 1 % sarkomů [2]. Poprvé byl popsán a nazván Enzingerem v roce 1965 [3]. V roce 1983 spolu s Chungem jej nazvali maligním melanomem měkkých tkání s ohledem na strukturální a imunohistochemickou podobnost obou nádorů vznikajících z buněk neurální lišty [4,5]. Tento nádor obdobně jako melanom syntetizuje melanin, vykazuje experzi HMB-45, MITF, Melanu A a S-100 proteinu, vykazuje pozitivitu vimentinu [6,7]. Typickým znakem vyskytujícím se u 50–75 % SBS je translokace t (12;22) (q13; q13), která dává vzniknout fúznímu genu EWSR1/ATF1 [8], u gastrointestinálních vzniká fúzní gen EWSR1/CREB1 [10]. SBS postihuje převážně mladé lidi s predilekčním postižením šlach, aponeuróz a fascií nohou a kolen [4]. Často lokálně recidivuje a metastazuje do lymfatických uzlin, plic a kostí.
Kazuistika
V lednu 2011 přišel 57letý muž, který pozoroval v genitofemorální rýze vpravo kaudálně asi 4 měsíce drobnou tuhou rezistenci. K lékaři jej přivedlo náhlé zvětšení rezistence během posledních dvou týdnů. Muž byl zcela zdráv, s ničím se neléčil, neužíval žádné léky, nikdy nebyl operován. Neměl bolesti ani pocity tlaku v místě nádoru a byl zcela bez celkových příznaků. Sonograficky byl v pravé genitofemorální rýze zjištěn nehomogenní útvar 28x18 mm v průměru (Obr. 1), nebyla nalezena patologie na zevním genitálu, lymfadenopatie ani metastázy v dutině břišní a rentgenovém snímku plic. Hladina C-reaktivního proteinu v séru byla 1,5, prostatického specifického antigenu 1,77 ng/ml.Krevní obraz i diferenciální rozpočet byly zcela ve fyziologických mezích. Bylo vysloveno podezření v diferenciální diagnóze na sarkom (dále na lymfadenopatii a obturovanou bulbouretrální žlázu) a pacient byl objednán k operačnímu řešení ve spolupráci s chirurgem. Operace byla provedena 2 týdny od první návštěvy. Nad pravou ilioinguinální rýhou byl proveden podélný řez a tumor postupně radikálně uvolněn až na stopku, která vycházela z vazivových struktur svalů či periostu kosti sedací. Nádor byl makroskopicky celý odstraněn. Redonova drenáž byla odstraněna po 24 hodinách a pacient byl po třech dnech od operace propuštěn do domácího ošetření. Rána se zhojila per primam a celý operační i pooperační průběh byl bez jakýchkoliv komplikací. Na spirální computerové tomografii nebyla prokázána pánevní ani břišní lymfadenopatie ani metastázy v břišní dutině a nitrobřišních orgánech. Histologicky byl nalezen vazivově septovaný nádor s ložiskovými nekrózami. Buňky vřetenitého tvaru se světlou cytoplazmou. V okrajových buňkách nádoru byl zjištěn hnědavý jemně zrnitý pigment. Mitózy byly nalezeny ojediněle. Bylo vysloveno podezření na nádor z perivaskulárních vřetenitých buněk (tzv. PECom) a bloček byl odeslán na vyšší pracoviště ke konzultaci. V definitivním nálezu byl prokázán melanin a absence obrovských mnohojaderných buněk. Imunohistochemicky byla prokázána silná difuzní exprese S-100 proteinu (Obr. 2), fokální silná exprese HMB45 (Obr. 3), ale přítomnost antigenu melan A jen v ojedinělých buňkách. Negativní bylo vyšetření na cytokeratiny, epiteliální membránový antigen, hladkosvalový aktin, calponin, CD10 a RCC antigen. Ki-67 byl prokázán v 15 % buněk (Obr. 4). Nález byl ohodnocen jako světlobuněčný sarkom šlach a aponeuróz(MKN-O ... 9044/32) (Obr. 5 a 6). Pooperačně byl pacient odeslán k adjuvantní radioterapii, která byla provedena ve 30 frakcích s ložiskovou dávkou 60 Gy, byla ukončena v květnu 2011. Radioterapie proběhla bez jakýchkoliv průvodních komplikací. Celotělový PET/SCT z ledna 2012 neprokázal viabilní nádorovou tkáň. Poslední kontrola byla v lednu 2018, kdy byla dle sonografického vyšetření břicha nalezena jen korová cysta na ledvině vpravo a sonografické vyšetření genitofemorální oblasti neprokázalo recidivu tumoru. V současné době pacient žije bez známek onkologického onemocnění, bez průkazu recidivy či generalizace.
Image 1. Ultrasonografie genitofemorální rýhy
Fig. 1: Ultrasonography of the genitofemoral line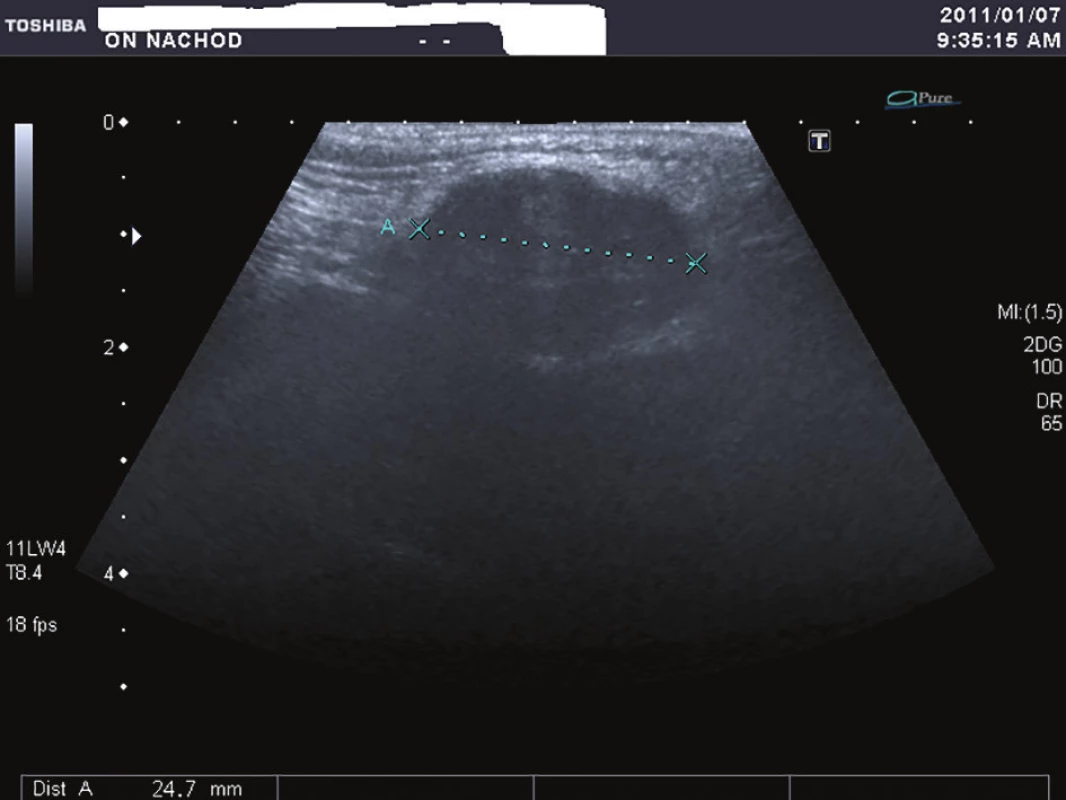
Image 2. Difuzní exprese S-100 proteinu
Fig. 2: Diffused expression of S-100 protein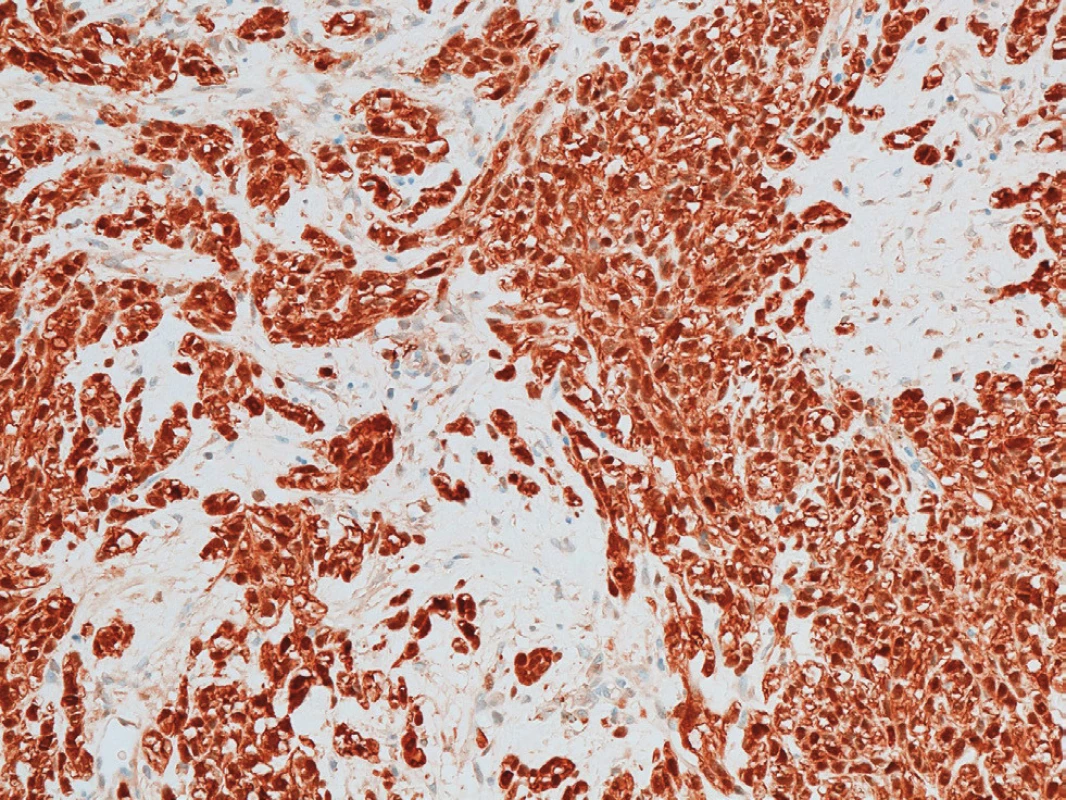
Image 3. Fokální exprese HMB45
Fig. 3: Focal HMB45 expression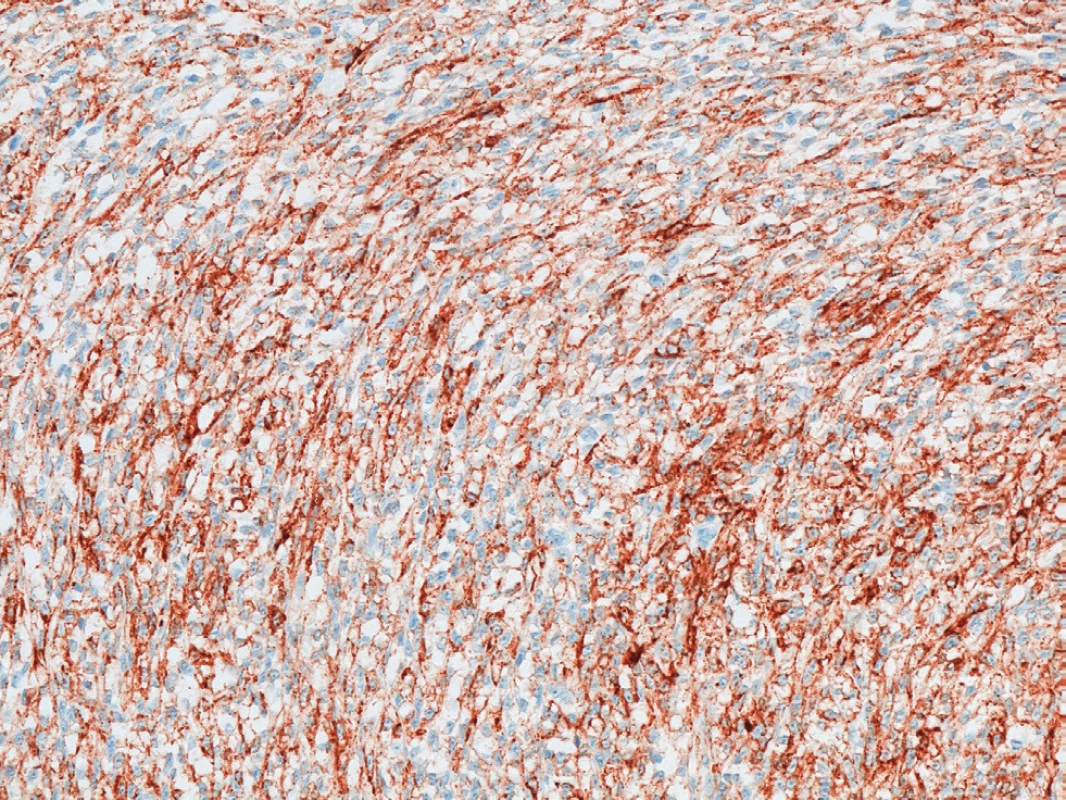
Image 4. Průkaz Ki-67
Fig. 4: Detection of the Ki-67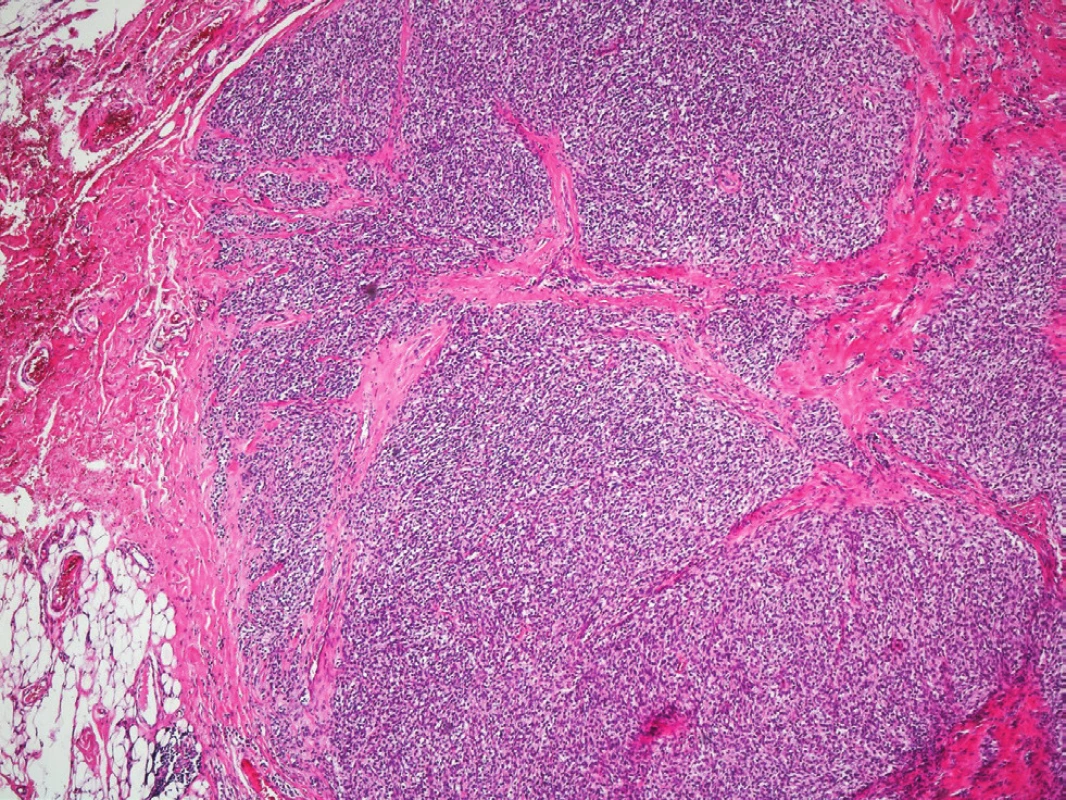
Obr. 5 a 6: Světlobuněčný sarkom šlach a aponeuróz
Fig. 5 and 6: Clear-cell sarcoma of tendons and aponeuroses
Diskuze
V anglické literatuře bylo dosud popsáno kolem 400 případů SBS. V české literatuře zmiňují E. Fedrová a J. Fedra v r. 2010, že tumor výrazně akumuloval 18F-FDG při vyšetření PET/CT. Šlo o ženu vyššího středního věku s postižením Achillovy šlachy, která po radikální operaci a adjuvantní léčbě žila 2 roky bez rekurence onemocnění [9]. Již v roce 1983 Chung et al. popsali soubor 141 případů. V jejich souboru převažovaly ženy a nádor postihoval mladé lidi ve věku od 15 do 35 let [4]. Naopak převahu mužů v souboru s mediánem 30 let (od 13 do 73 let) uvádí v roce 2006 Hisaoka [10]. Další autor udává v souboru 12 případů 10 žen. Věkové zastoupení je opět v širokém rozmezí od 6 do 74 let s mediánem 25 let [11]. Nádor se může vyskytovat v kterémkoliv věku a Lucas 1992 udává medián 29 let [12]. Široké rozmezí v rozpětí 6–81 let, ale s mediánem 33 let a s mírnou převahou mužů (58 %) uvádí Hocar [23]. Nádor se v 78–97 % objevuje na dolních končetinách, predilekčně v oblasti nohou a kotníků, které tvoří asi 33–65 % všech lokalizací. Dále se často objevuje na kolenou, méně často v oblasti stehna a na horních končetinách s klesající incidencí od distálních k proximálním oblastem. Vzácně se vyskytuje v oblasti hlavy, krku a trupu [4,10−16]. Extrémně vzácné jsou pak lokalizace v jiných oblastech – kůže, ledvina, penis, pánev a tenké střevo [13,17−20]. Tumor se zpravidla objeví jako malá, pomalu rostoucí nebolestivá rezistence, která svým růstem postupně může vyvolat tlak, napětí či bolest, které až zpravidla přivedou pacienty k lékaři [4,13,23]. Doba mezi prvním projevem a operací je asi v 1/5 případů až 5 let [4]. Hocar uvádí rozmezí od 6 týdnů do 4 let s mediánem 15 týdnů [23]. Velikost může být velice variabilní, od 0,4 do 15 cm [10,11,13,23]. Histologicky zjištěné nekrózy jsou prognosticky nepříznivé, stejně jako velikost tumoru nad 4–5 cm, pozitivní chirurgické okraje, vysoký grade a vysoký mitotický index. Vysoce prognosticky nepříznivý je výskyt uzlinových či vzdálených metastáz [10,11,13,21−23]. Nekrózy postihující více než polovinu buněk nádoru jsou velmi nepříznivým faktorem [23]. SBS metastazuje především lymfatickou cestou do regionálních lymfatických uzlin. Krevní cestou metastazuje nejčastěji do plic, méně často do jater, kostí, mozku a srdce [10,15,23]. Základem léčby je široká excize nádoru, případně amputace, event. s lymfadenektomií. Jednoznačný přínos následné radioterapie nebo chemoterapie, případně kombinace všech tří postupů, nebyl dosud jednoznačně prokázán. Adjuvantní léčba by měla být podána, přestože se zdá, že multimodalitní léčba nemá lepší výsledky než monoterapie v podobě radikální chirurgické léčby [4,10−13,21]. V roce 2012 však Hocar publikoval práci s úspěšnou neoadjuvantní chemoterapií umožňující následnou radikální chirurgickou léčbu a doporučuje adjuvantní léčbu dle individuálních případů v podobě radioterapie, chemoterapie či kombinace [23]. Údaje o pětiletém, desetiletém celkovém přežití, výskytu recidiv a metastáz se u jednotlivých autorů výrazně liší. Celkově však lze říci, že prognóza onemocnění je všeobecně nepříznivá a vyléčitelnost relativně nízká. Lokální rekurence se objevuje od 5 do 84 %. Vzdálené či uzlinové metastázy se primárně vyskytují u 20–70 %. Celkové 5leté přežití se pohybuje mezi 44–67 %, 10leté mezi 33–41 %. Lokální recidiva se objevuje od 1 měsíce do 20 let po ukončení léčby. V případě lokální recidivy je na místě radikální chirurgická léčba s adjuvantní chemoterapií, event. radioterapií, pokud nebyla použita v léčbě primárního nádoru. Chung popisuje i úspěšnou plicní lobektomii pro metastázu plicní u tří pacientů [4]. V průběhu 6 let se vyvinou vzdálené metastázy u 60–70 % pacientů [3,4,10−15,21−23]. V paliaci se uplatňují chemoterapie a radioterapie. Nejlepší výsledky mají dle Deenika pacienti s tumorem do 2 cm [14]. V roce 2017 Keung et al. sledovali výskyt metastáz lymfatických uzlin u sarkomů měkkých tkání. Z celkového počtu 89 870 pacientů se sarkomem měkkých tkání byly histologicky potvrzeny uzlinové metastázy (pN1) u 1404 pacientů a u dalších 1750 pacientů klinicky suspektní (cN1) bez histologického potvrzení. Z tohoto vzorku 3154 pacientů s pN1 nebo cN1 mělo 1310 synchronní vzdálenou metastázu M1. Metastázy lymfatických uzlin postihly nízký počet pacientů: angiosarkom (6 %), epitelioidní sarkom (13 %), světlobuněčný sarkom (16 %) a sarkom malých buněk (19 %).U onemocnění pN1M0 byl medián celkového přežití 28,2 měsíce v závislosti na primární histologii. Pacienti s pN1M0 u angiosarkomu, světlobuněčného sarkomu, leiomyosarkomu a fibrózního hystiocytomu měli horší medián celkového přežití (19,4; 23,8; 27,1; resp. 29,3 měsíce) v porovnání s epiteloidním sarkomem a liposarkomem (49,6, resp. 56 měsíců, p<0,001) [24]. V roce 2017 Gandhi et al. popsali významnou roli v diagnostice metastaticky postižených uzlin pomocí cytologie aspirační tenkou jehlou u metastáz sarkomů měkkých tkání [25]. V roce 2017 Obiorah et al. popsali neobvyklý případ pacientky se světlobuněčným sarkomem vznikajícím v kůži krku, kde bylo obtížně rozlišit sarkom od maligního melanomu, ale nádorové buňky byly pozitivní na melanocytární markery včetně S100 a HMB-45, které vedly k počáteční diagnóze maligního melanomu. Fluorescenční in situ hybridizace prokázala přeskupení EWSR1 genu na chromozomu 22q12, což vedlo k diagnostice primárního světlobuněčného sarkomu kůže [26].
Závěr
Naše kazuistika popisuje dosud nepopsaný výskyt SBS v oblasti genitofemorální rýhy. Potvrzuje, že malý nádor radikálně chirurgicky odstraněný s následnou radikální adjuvantní radioterapií může být úspěšně léčen, přestože onemocnění má nepříznivou prognózu a jedná se o agresivní typ sarkomu. Vzhledem k tomu, že se jedná o velmi vzácné onemocnění, dosud chybí stanovení optimálního postupu léčby a léčebná schémata. Naše práce upozorňuje na nutnost pomýšlet na neobvyklé nádorové onemocnění v diferenciální rozvaze dlouhotrvajících a zdánlivě benigních lézí. Pacient dosud žije bez známek relapsu onemocnění.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Ramez Adwan
Oblastní nemocnice Náchod
Urologické oddělení
Purkyňova 446
547 01 Náchod
e-mail: adwan.ramez@nemocnicenachod.cz
Sources
-
Novotvary 2010. Praha, ÚZIS 2013.
-
Gelczer RK, Wenger DE, Wold LE. Primary clear cell sarcoma of bone: a unique site of origin. Skeletal Radiol 1999;28 : 240−3.
-
Enzinger FM. Clear-cell sarcoma of tendons and aponeuroses. An analysis of 21 cases. Cancer 1965;18 : 1163−74.
-
Chung EB, Enzinger FM. Malignant melanoma of soft parts. A reassessment of clear cell sarcoma. Am J Surg Pathol 1983;7 : 405−13.
-
Mukai M, Torikata C, Iri H, et al. Histogenesis of clear cell sarcoma of tendons and aponeuroses. An electron-microscopic, biochemical, enzyme histochemical, and immunohistochemical study. Am J Pathol 1984;114 : 264−72.
-
Graadt van Roggen JF, Mooi WJ et al. Clear cell sarcoma of tendons and aponeuroses (malignant melanoma of soft parts) and cutaneous melanoma: exploring the histogenetic relationship between these two clinicopathological entities. J Pathol 1998;186 : 3–7.
-
Mooi WJ, Deenik W, Peterse JL, et al. Keratin immunoreactivity in melanoma of soft parts (clear cell sarcoma). Histopathology 1995;27 : 61–5.
-
Langezaal SM, Graadt van Roggen JF, Cleton-Jansen AM, et al. Malignant melanoma is genetically distinct from clear cell sarcoma of tendons and aponeurosis (malignant melanoma of soft parts). British Journal of Cancer 2001;84 : 535–8.
-
Ferdová E, Ferda J. 18F-FDG-PET/CT muskuloskeletálních nádorů. Ces Radiol 2010;64 : 44–51.
-
Hisaoka M, Ishida T, Kuo TT, et al. Clear cell sarcoma of soft tissue: a clinicopathologic, immunohistochemical, and molecular analysis of 33 cases. Am J Surg Pathol 2008;32 : 452−60.
-
Hantschke M, Mentzel T, Rütten A, et al. Cutaneous clear cell sarcoma: a clinicopathologic, immunohistochemical, and molecular analysis of 12 cases emphasizing its distinction from dermal melanoma. Am J Surg Pathol 2010;34 : 216−22.
-
Lucas DR, Nascimento AG, Sim FH. Clear cell sarcoma of soft tissues: Mayo Clinic experience with 35 cases. Am J Surg Pathol 1992;16 : 1197−1204.
-
Dim DC, Cooley LD, Miranda RN. Clear cell sarcoma of tendons and aponeuroses: A review. Arch Pathol Lab Med 2007;131 : 152–6.
-
Deenik W, Mooi WJ, Rutgers EJ, et al. Clear cell sarcoma (malignant melanoma) of soft parts: A clinicopathological study of 30 cases. Cancer 1999;86 : 969−75.
-
Pavlidis NA, Fisher C, Wiltshaw E. Clear-cell sarcoma of tendons and aponeuroses: a clinicopathologic study. Presentation of six additional cases with review of the literature. Cancer 1984;54 : 1412−7.
-
Marques B, Terrier P, Voigt JJ, et al. Clear cell soft tissue sarcoma. Clinical, histopathological and prognostic study of 36 cases. Ann Pathol 2000;20 : 298−303.
-
Bali A, Roy M, Chikkannaiah P, et al. Cutaneous clear cell sarcoma: a rare aggressive tumor with potential diagnostic challenge. J Lab Physicians 2012;4 : 53−5.
-
Lasithiotakis K, Protonotarios A, Lazarou V, et al. Clear cell sarcoma of the jejunum: a case report. World J Surg Oncol 2013;11 : 17.
-
Comin CE, Novelli L, Tornaboni D, et al. Clear cell sarcoma of the ileum: report of a case and review of literature. Virchows Arch 2007;451 : 839−45.
-
Nakayama S, Yokote T, Iwaki K, et al. A rare case of primary clear cell sarcoma of the pubic bone resembling small round cell tumor: an unusual morphological variant. BMC Cancer 2012;12 : 538.
-
Meis-Kindblom JM. Clear cell sarcoma of tendons and aponeuroses: a historical perspective and tribute to the man behind the entity. Adv Anat Pathol 2006;13 : 286−92.
-
Coindre JM, Hostein I, Terrier P, et al. Diagnosis of clear cell sarcoma by real-time reverse transcriptase-polymerase chain reaction analysis of paraffin embedded tissues: clinicopathologic and molecular analysis of 44 patients from the French sarcoma group. Cancer 2006;107 : 1055−64.
-
O. Hocar, A, Le Cesne, S, Berissi P, et al. Clear cell sarcoma (malignant melanoma) of soft parts: A clinicopathologic study of 52 cases. Dermatol Res Pract 2012. Availeble from: http://dx.doi.org/10.1155/2012/984096
-
Keung EZ, Chiang YJ, Voss RK, et al. The incidence and clinical significance of lymph node metastasis in soft tissue sarcoma. Eur J Surg Oncol 2018;44 : 170−7.
-
Gandhi J, Mehta S, Patel T, et al. Metastasis of soft tissue sarcomas in lymph node: A cytomorphological study. Diagn Cytopathol 2017;45 : 784−8.
-
Obiorah IE, Brenholz P, Özdemirli M. Primary clear cell sarcoma of the dermis mimicking malignant melanoma. Balkan Med J 2017. Available from: 10.4274/balkanmedj.2017.0796.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2018 Issue 9-
All articles in this issue
- Současné poznatky o regeneraci ischemických tkání a zlepšení prokrvení pomocí kmenových buněk – možnosti využití u nerevaskularizovatelné kritické končetinové ischemie
- Preventivní opatření rozvoje hluboké sternální infekce po kardiochirurgických výkonech − přehled
- RFITTH – radiofrekvenčně indukovaná termoterapie hemoroidů, 10 let zkušeností
- Kompresia truncus coeliacus – princípy diagnostiky a chirurgickej liečby
- Asynchronní kvadruplicitní výskyt nádorového onemocnění: adenokarcinomu rektosigmatu, karcinomu ledviny, adenokarcinomu prostaty a neuroendokrinního malobuněčného karcinomu plic – kazuistika
- Fasciitis necrotisans – duplicitas casuum
- Světlobuněčný sarkom šlach a aponeuróz s lokalizací v pravé genitofemorální rýze – kazuistika
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Kompresia truncus coeliacus – princípy diagnostiky a chirurgickej liečby
- RFITTH – radiofrekvenčně indukovaná termoterapie hemoroidů, 10 let zkušeností
- Světlobuněčný sarkom šlach a aponeuróz s lokalizací v pravé genitofemorální rýze – kazuistika
- Preventivní opatření rozvoje hluboké sternální infekce po kardiochirurgických výkonech − přehled
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

