-
Medical journals
- Career
Záchranná pánevní lymfadenektomie po selhání chirurgické léčby karcinomu prostaty – kazuistika
Authors: N. Marečková; M. Staník; D. Macík; J. Doležel
Authors‘ workplace: Oddělení urologické onkologie, Klinika operační onkologie LF Masarykovy univerzity a Masarykova onkologického ústavu Brno přednosta: doc. MUDr. R. Šefr, Ph. D.
Published in: Rozhl. Chir., 2017, roč. 96, č. 6, s. 260-262.
Category: Case Report
Overview
Záchranná lymfadenektomie je alternativou léčby u pacientů po radikální prostatektomii s recidivou onemocnění omezenou na pánevní, případně retroperitoneální uzliny. I když ve většině případů nevede k úplnému vyléčení, u vhodně vybraných pacientů lze pomocí této metody dosáhnout oddálení další progrese a odklad zahájení systémové léčby při relativně malém riziku komplikací.
Autoři popisují kazuistiku muže s radiologicky potvrzenou recidivou karcinomu prostaty po radikální prostatektomii ve vnitřní ilické uzlině bez další vzdálené diseminace. Pacient podstoupil záchrannou pánevní lymfadenektomii s kompletní pooperační biochemickou odpovědí. Třináct měsíců od operace trvá remise, pacient nemá nasazenou hormonální léčbu.Klíčová slova:
záchranná lymfadenektomie − karcinom prostaty − radikální prostatektomie − recidiva nádoruÚvod
Radikální prostatektomie představuje standardní a nejčastější léčbu lokalizovaného karcinomu prostaty u pacientů s předpokládanou délkou života více než 10 let. Přes výborné onkologické výsledky dochází přibližně u třetiny pacientů k biochemické recidivě, která je definována jako elevace prostatického specifického antigenu (PSA) nad 0,2 ng/ml, a později ke klinické progresi. V zásadě se může jednat o lokální recidivu, nebo systémovou progresi. Pacientům s podezřením na lokální recidivu je zpravidla nabídnuta záchranná radioterapie, u podezření na systémovou progresi léčba hormonální. Díky zavedení moderních zobrazovacích metod, jako je např. 18F-cholin-PET/CT, lze u části pacientů s biochemickou recidivou detekovat izolované metastatické postižení v regionálních uzlinách. Těmto pacientům lze nabídnout záchrannou pánevní lymfadenektomii (SLND, salvage lymph node dissection), byť se v současné době považuje za léčbu experimentální. Tato léčba je prováděna s dvěma hlavními cíli: oddálit další progresi nemoci a odložit nutnost nasazení systémové hormonální léčby.
Kazuistika
61letému kuřákovi bez významných komorbidit, alergií, bez trvalé medikace, BMI 26, byl v prosinci 2014 na sektorové urologii diagnostikován karcinom prostaty. Histologicky se jednalo o adenokarcinom v jednom bioptickém vzorku z deseti odebraných, diferenciace nádoru byla vyjádřena Gleasonovým skóre 2+2, vstupní hladina PSA byla 5,9 ng/ml. Klinicky se jednalo o stadium cT1c (negativní palpační nález) a pacient byl zařazen do skupiny s nízkým rizikem bez indikace k provádění dalších stagingových vyšetření. V březnu 2015 byla provedena roboticky-asistovaná radikální prostatektomie, pacient byl propuštěn 5 dní po operaci, pooperační průběh bez komplikací (Clavien 0). Pánevní lymfadenektomie nebyla indikována, jelikož pravděpodobnost uzlinového postižení dle vstupních parametrů byla nižší než 5 %. Přes velmi příznivé vstupní parametry byl ve finálním preparátu po prostatektomii patologem popsaný nádor s Gleasonovým skóre 4+4, což znamená nízký stupeň diferenciace. Karcinom byl oboustranný, bez extraprostatické propagace (kategorie pT2c) a resekční okraje byly negativní. Hodnota PSA již v prvním odběru 2 měsíce po operaci poukazovala na biochemickou recidivu onemocnění (PSA 0,49 ng/ml), která byla potvrzena jejím dalším pozvolným růstem až na hladinu 0,977 ng/ml v září 2015, kdy bylo provedeno 18F-cholin-PET/CT vyšetření, při kterém byla detekována vyšší aktivita radiofarmaka v lymfatické uzlině podél větví levé vnitřní ilické arterie (Obr. 1). Následně byly s pacientem probrány různé možnosti další léčby: záchranná radioterapie, záchranná lymfadenektomie, hormonální léčba a sledování, z nichž si pacient zvolil provedení záchranné lymfadenektomie. V listopadu 2015 byla na našem pracovišti provedena oboustranná rozšířená pánevní lymfadenektomie. Horní hranice byla v oblasti společných ilických cév, laterální okraj tvořil průběh genitofemorálního nervu, distálně femorální kanál a oboustranně byly odstraněny uzliny z vnitřní ilické oblasti, presakrální oblasti a vlevo navíc i pararektálně (Obr. 2). Celkem bylo odstraněno 51 uzlin, z nichž jedna byla patologem hodnocena jako pozitivní s kompletní infiltrací metastatickým adenokarcinomem prostaty, fokálně prorůstajícím přes kapsulu do okolní tukové tkáně. Jednalo se v souladu s PET/CT o uzlinu z levé vnitřní ilické oblasti. Operace si vyžádala šestidenní hospitalizaci, výkon proběhl bez významných pooperačních komplikací – Clavien 1 (singultus). Pooperačně došlo k výraznému poklesu PSA na hladinu 0,029 ng/ml, hladina je v opakovaných odběrech s odstupem 13 měsíců od operace stabilní (0,035 ng/ml) a pacient je sledován, bez hormonální léčby.
Image 1. 18F-cholin-PET/CT: transaxiální fúze PET/CT obrazu zobrazující vyšší aktivitu radiofarmaka v ilické lymfatické uzlině (žlutá šipka) Fig. 1: 18 F-choline PET/CT: transaxial PET/CT fusion image demonstrating focal tracer uptake in iliac node (yellow arrow) 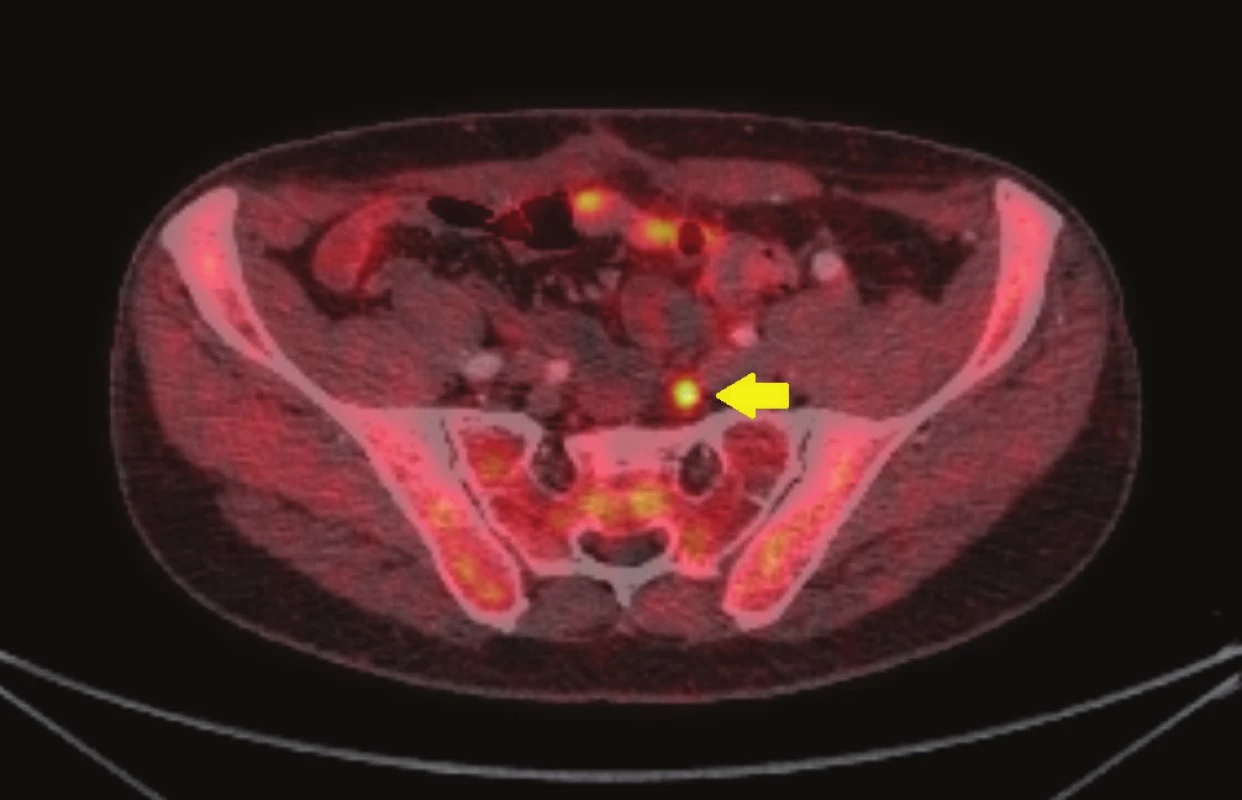
Image 2. Peroperační snímek zobrazující pánevní lymfadenektomii Fig. 2: Intraoperative picture illustrating pelvic lymph node dissection 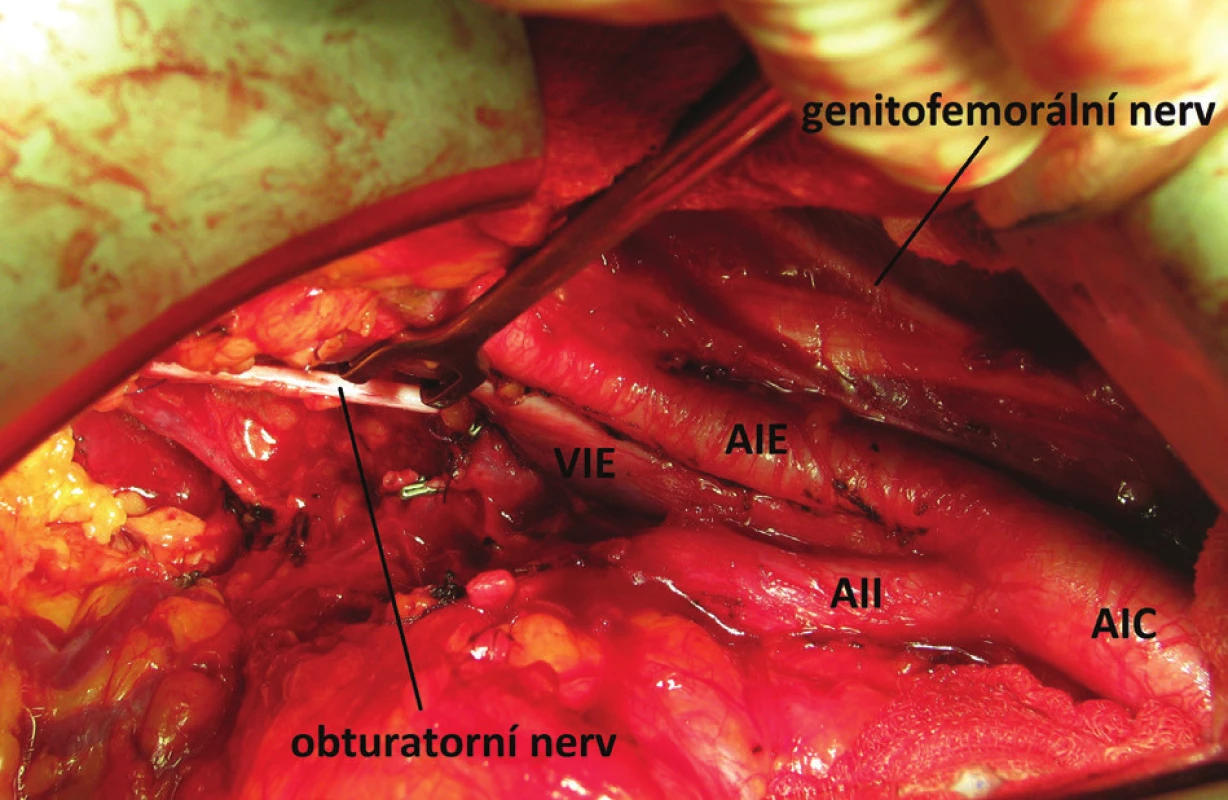
Diskuze
K hodnocení onkologického výsledku radikální prostatektomie se používá sledování hladin markeru PSA. Klinickou recidivu onemocnění předchází tzv. „biochemická recidiva“, definována jako hodnota PSA nad 0,2 ng/ml, potvrzena ve dvou odběrech. Biochemická recidiva může být podmíněna lokální recidivou, nebo systémovým onemocněním. U pacientů se systémovou recidivou onemocnění po radikální prostatektomii se za standard léčby považuje nasazení androgen deprivační terapie bez ohledu na místo a rozsah recidivy. Nicméně skupina těchto pacientů je značně nehomogenní. Pacienti, u kterých je recidiva podmíněna uzlinovým postižením, vykazují ve srovnání s pacienty postiženými kostními nebo viscerálními metastázami mnohem lepší prognózu [1]. Hormonální terapie není kurativní a většina pacientů časem dospěje do kastračně rezistentního stadia onemocnění. Navíc je tato léčba doprovázena vedlejšími účinky snižujícími kvalitu života nemocného.
Neustále se zdokonalující možnosti zobrazovacích modalit podporují snahu ovlivnit onemocnění pomocí lokální léčby v místě recidivy. V současnosti je nejvíce využívána k vyšetření pánevních a retroperitoneálních uzlin cholin-PET/CT [2,3]. Schopnost detekce postižených uzlin je závislá na faktorech, jako jsou hladina PSA, dynamika nárůstu PSA a vliv předchozí hormonální léčby [4]. Při rozhodování o rozsahu lymfadenektomie je nutné si uvědomit, že pouze třetina pacientů s jednou pozitivní uzlinou na PET/CT má při následné lymfadenektomii onemocnění limitováno opravdu pouze na uzlinu, která byla detekována na zobrazovacím vyšetření. Proto, bez ohledu na počet pozitivních uzlin na zobrazovacím vyšetření, musí být provedena lymfadenektomie oboustranná (i při unilaterálním nálezu) a „rozšířená“ – tzn., že musí zahrnout všechny oblasti lymfatické drenáže prostaty [5]. Měla by být odstraněna tukově-lymfatická tkáň kolem zevní ilické vény, distálně po úroveň hluboké cirkumflexní vény a femorální kanál. Proximálně by lymfadenektomie měla zahrnovat tkáně podél společných ilických cév až po bifurkaci aorty. Rovněž by měla být odstraněna tkáň v obturatorní jámě, presakrální uzliny a uzliny nacházející se laterálně a mediálně od vnitřní ilické arterie [4]. U pacientů s podezřením na postižení retroperitoneálních uzlin dle předoperačního zobrazovacího vyšetření nebo u pacientů s pooperačně potvrzenými pozitivními společnými ilickými uzlinami lze výkon doplnit o retroperitoneální lymfadenektomii. Tato by měla zahrnovat oblast od odstupu renálních arterií, kraniálně po bifurkaci aorty kaudálně a laterálně ohraničenou močovody [4].
Přes fakt, že v literatuře přibývá prací popisujících zkušenosti s SLND, počet pacientů, kteří podstoupili tuto léčbu a mají i relativně dlouhou dobu sledování, není příliš velký. Jeden z největších publikovaných souborů je práce italských autorů, která popisuje výsledky u 72 pacientů. Autoři pozorovali pooperační biochemickou odpověď (PSA <0,2 ng/ml) u 41 pacientů (57 %). U třetiny z nich byla ihned zahájena hormonální léčba. Ve zbylé skupině 28 pacientů s kompletní biochemickou odpovědí bez následné hormonální léčby mělo 86 % do pěti let biochemickou progresi. V celé kohortě pacientů bylo zaznamenáno pětileté přežívání bez klinické progrese a nádorově-specifické přežívání v 34 % a 75 % [6].
V souladu s těmito výsledky lze konstatovat, že valná část pacientů po provedení SLND dospěje časem k další biochemické progresi. V odstupu pěti let od operace jen 9–19 % těchto pacientů zůstane bez známek biochemické recidivy a přibližně 26−34 % je bez známek klinické progrese [4]. Z dostupných publikovaných dat tedy vyplývá, že SLND může vést k úplnému vyléčení pouze u malé části nemocných. U podstatné části pacientů ale lze dosáhnout prodloužení přežívání bez progrese a odklad hormonální léčby. Vzhledem k nedostatku dat a porovnávajících studií není v současnosti možné jednoznačně posoudit benefit této léčby nad standardně využívanou hormonální léčbou.
Jako zásadní pro úspěch záchranné lymfadenektomie se jeví výběr vhodných pacientů [7,8]. Mezi nejčastěji uváděné faktory patří nízká hladina PSA (nejčastěji udávána hladina ≤4 ng/ml), vyšší stupeň diferenciace tumoru (Gleasonovo skóre ≤7) a klinická recidiva omezená na pánevní uzliny dle PET/CT.
Záchranná lymfadenektomie není ve většině případů zatížená závažnými komplikacemi. Nejčastěji udávanými jsou protrahovaná lymforea, lymfokéla, pooperačně zvýšená teplota a ileus. Výskyt komplikací vyšších stupňů (dle Claviena 3−4) se v literatuře vyskytuje jen ojediněle, úmrtí po operaci zatím nebylo publikováno [6,10].
Závěr
Záchranná lymfadenektomie je experimentálním postupem léčby u pacientů s recidivou onemocnění po radikální prostatektomii, pokud je recidiva dle zobrazovacích vyšetření (cholin-PET/CT) omezená na pánevní, případně retroperitoneální uzliny. Ve většině případů nevede sice k úplnému vyléčení, ale u vhodně vybraných pacientů lze dosáhnout oddálení další progrese nemoci a umožňuje odložit nasazení systémové léčby při relativně malém riziku komplikací vyplývajících z provedené operační léčby. K upřesnění indikací operace a srovnání výsledku léčby se současným standardem budou nutné další studie.
Podpořeno MZ ČR – RVO (MOÚ, 00209805).
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.MUDr. Natália Marečková
Brněnská 302
664 41 Omice
e-mail: natalia.mareckova@mou.cz
Sources
1. Pond GR, Sonpavde G, de Wit R, et al. The prognostic importance of metastatic site in men with metastatic castration-resistant prostate cancer. Eur Urol 2014;65 : 3–6.
2. Picchio M, Briganti A, Fanti S, et al. The role of choline positron emission tomography/computed tomography in the management of patients with prostate-specific antigen progression after radical treatment of prostate cancer. Eur Urol 2011;59 : 51–60.
3. Scattoni V, Picchio M, Suardi N, et al. Detection of lymph-node metastases with integrated [11C]choline PET/CT in patients with PSA failure after radical retropubic prostatectomy: results con-firmed by open pelvic-retroperitoneal lymphadenectomy. Eur Urol 2007;52 : 423–9.
4. Abdollah F, Briganti A, Montorsi F, et al. Contemporary role of salvage lymphadenectomy in patients with recurrence following radical prostatectomy. Eur Urol 2015;67 : 839−49.
5. Tilki D, Reich O, Graser A, et al. 18F-Fluoroethylcholine PET/CT identifies lymph node metastasis in patients with prostate-specific antigen failure after radical prostatectomy but underestimates its extent. Eur Urol 2013;63 : 792–6.
6. Rigatti P, Suardi N, Briganti A, et al. Pelvic/retroperitoneal salvage lymph node dissection for patients treated with radical prostatec-tomy with biochemical recurrence and nodal recurrence detected by [11C]choline positron emission tomography/computed tomog-raphy. Eur Urol 2011;60 : 935–43.
7. Suardi N, Gandaglia G, Gallina A, et al. Long-term outcomes of salvage lymph node dissection for clinically recurrent prostate cancer: Results of a single-institution series with a minimum follow-up of 5 years. Eur Urol 2015;67 : 299−309.
8. Castellucci P, Fuccio C, Nanni C, et al. Influence of trigger PSA and PSA kinetics on 11C-choline PET/CT detection rate in patients with biochemical relapse after radical prostatectomy. J Nucl Med 2009;50 : 1394–400.
9. 9 Jilg CA, Rischke HC, Reske SN, et al. Salvage lymph node dissection with adjuvant radiotherapy for nodal recurrence of prostate cancer. J Urol 2011;60 : 935–43.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2017 Issue 6-
All articles in this issue
- Chirurgická léčba ovariálního karcinomu
- Totální pánevní exenterace – strategie a rozsah operačního výkonu
- ODS − Obstrukční defekační syndrom – souhrnné sdělení
- Maligní nádory tenkého střeva
- Záchranná pánevní lymfadenektomie po selhání chirurgické léčby karcinomu prostaty – kazuistika
- Kombinovaná léčba měkkotkáňového sarkomu v oblasti pánve
- Carneyho trias
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- ODS − Obstrukční defekační syndrom – souhrnné sdělení
- Maligní nádory tenkého střeva
- Chirurgická léčba ovariálního karcinomu
- Kombinovaná léčba měkkotkáňového sarkomu v oblasti pánve
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

