-
Medical journals
- Career
Carneyho trias
Authors: L. Fiala 1; I. Kocáková 2; R. Šimůnek 1; E. Krejčí 3; I. Babánková 3; R. Šefr 1
Authors‘ workplace: Klinika operační onkologie, Masarykův onkologický ústav a LF Masarykovy univerzity Brno přednosta: doc. MUDr. R. Šefr, Ph. D. 1; Klinika komplexní onkologické péče, Masarykův onkologický ústav a LF Masarykovy univerzity Brno přednosta: prof. MUDr. R. Vyzula, CSc. 2; Oddělení onkologické patologie, Masarykův onkologický ústav Brno primář: MUDr. P. Fabian, Ph. D. 3
Published in: Rozhl. Chir., 2017, roč. 96, č. 6, s. 267-272.
Category: Case Report
Overview
Carneyho triáda je popsána jako synchronní nebo metachronní výskyt gastrointestinálního stromálního tumoru (GIST) žaludku, plicního chondromu a extraadrenálního paragangliomu. U většiny pacientů je vyjádřena pouze jedna nebo dvě komponenty. Současná koincidence všech tří nádorů v době diagnózy byla zaznamenána pouze přibližně ve 2 % případů. Nejčastější je kombinace GIST a plicního chondromu. Tímto sdělením chceme prezentovat případ 57leté pacientky s anamnézou prodělané resekce žaludku pro leiomyosarkom v mládí a nejasným ložiskovým plicním nálezem, který je stacionární minimálně od roku 2003. Pacientka měla v době první návštěvy u nás zjištěn blíže nespecifikovaný nádor žaludku, levého retroperitonea a dvě jaterní metastázy. Během dvou operací byla provedena exstirpace tumoru retroperitonea, klínovitá resekce žaludku, levostranná hemihepatektomie a adrenalektomie. Histologicky byl zjištěn GIST žaludku, jeho metastázy v játrech a feochromocytom/paragangliom levého retroperitonea. Nález svědčil pro diagnózu Carneyho trias nebo syndromu Carney-Stratakis. Provedením mutační analýzy genů kódujících B, C a D podjednotky enzymu sukcinátdehydrogenázy a potvrzením přítomnosti DNA metylace promotoru genu SDHC bylo zjištěno, že u pacientky se jedná o Carneyho trias a plicní nález bylo možné prohlásit za benigní chondrom. Tímto sdělením chceme poukázat na obtížnosti se stanovením diagnózy tohoto extrémně vzácného syndromu a jeho odlišení od syndromu Carney-Stratakis.
Klíčová slova:
Carneyho trias – GIST − plicní chondrom − extraadrenální paragangliom − syndrom Carney-StratakisÚvod
Carneyho trias je extrémně vzácný nefamiliární syndrom neznámé etiologie zahrnující přítomnost žaludečního GIST, plicního chondromu a extraadrenálního paragangliomu.
Poprvé jej popsal americký patolog J. Aiden Carney v roce 1977, kdy publikoval se svými kolegy případy dvou mladých žen s výskytem těchto tří vzácných nádorů a dále výskyt dvou ze tří komponent triády u pěti dalších pacientů [1]. Od té doby jsou celosvětově publikována pouze jednotlivá kazuistická sdělení na toto téma, což dokládá, o jak raritní klinickou jednotku se jedná. Doposud největší ucelený retrospektivní soubor celkem 79 pacientů s Carneyho triadou publikoval Carney et al. v roce 1999 v Mayo Clinic Proceedings . Tímto článkem jsme chtěli dokumentovat naši vlastní zkušenost s raritním syndromem a obtížnou cestu vedoucí ke stanovení správné diagnózy, která by nebyla úspěšná bez dostupnosti moderních imunohistochemických a genetických vyšetření.
Kazuistika
57letá pacientka, která začátkem roku 2014 podstoupila v sektorovém zdravotnickém zařízení sérii standardních vyšetření pro přibližně čtyřdenní anamnézu bolestí v levém podžebří. Na transabdominálním ultrazvuku byla zobrazena blíže nespecifikovaná expanze v okolí žaludku. Bylo doplněno CT břicha odhalující objemnou měkkotkáňovou expanzi levého retroperitonea velikosti 87x76x78 mm ležící před levou ledvinou a obdobnou oválnou expanzi velikosti 50x30x27 mm v oblasti dorzální stěny fundu žaludku. Dále se na CT zobrazila kulovitá expanze levé nadledviny velikosti 21x16 mm, adenom pravé nadledviny velikosti 22x14 mm a dvě hypodenzní léze 27x21 mm a 32x27 mm v levém jaterním laloku. Na bazi plic vpravo v S10 byla zachycena nehomogenní expanze s kalcifikacemi velikosti 38x39 mm, která byla popsána na dohledaném prostém snímku již v roce 2003 (Obr. 1,2,3,4). S uvedenými nálezy se pacientka v květnu 2014 dostavila do Masarykova onkologického ústavu (MOÚ). Z předchorobí byla nejzajímavější informace o resekci žaludku dle Billrotha typ I. pro nádor, kterou pacientka podstoupila v roce 1971. Histologicky byl tumor popsán jako leiomyosarkom. Pooperačně údajně pacientka podstoupila chemoterapii a aplikaci interferonu, ale přesné informace nebylo možné dohledat. K dispozici nebyl ani histologický vzorek z roku 1971 k případnému druhému čtení. Byla doplněna gastrofibroskopie odhalující intramurální submukózní expanzi zadní stěny pahýlu žaludku v oblasti kardie a subkardiálně a biopsie ložiska v levém retroperitoneu pod CT. Punkční biopsií byl odhalen CKAE negativní tumor s expresí chromograninu A, který morfologií a imunoprofilem odpovídal feochromocytomu. K biologické povaze nádoru se z prosté punkční biopsie nebylo možné vyjádřit, ale klinické znaky (velikost, bifokalita, suspektní jaterní metastázy) nasvědčovaly malignitě. Během následující operační revize byly potvrzeny dvě intraparenchymatózně uložené jaterní metastázy v S2 a S3 a ložisko v zadní stěně žaludku. V retroperitoneu vlevo před levou ledvinou byla přítomna tumorózní resistence s bohatou patologickou vaskularizací, odtlačující okolní struktury včetně levého renálního svazku. Byla provedena exstirpace tumoru levého retroperitonea (Obr. 5). Jaterní metastázy a ložisko ve stěně žaludku byly ponechány k řešení v druhé době. Histologické vyšetření resekátu potvrdilo feochromocytom levého retroperitonea, pravděpodobně vycházející z nadledviny, s odpovídajícím imunoprofilem.
Image 1. Jaterní metastázy na CT snímku Fig. 1: Liver metastases on CT scan 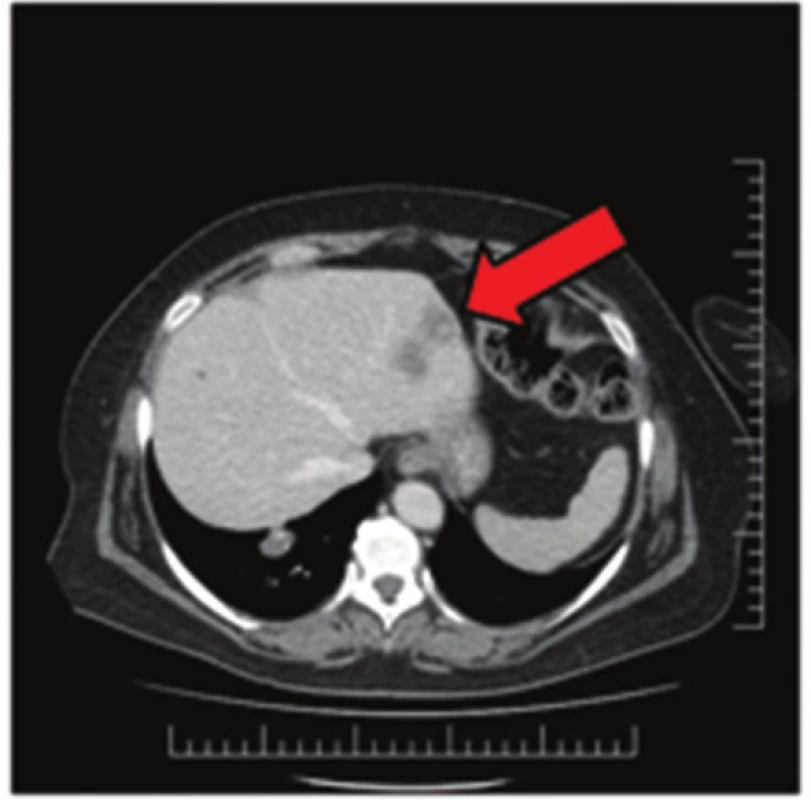
Image 2. GIST žaludku na CT snímku Fig. 2: Gastric GIST on CT scan 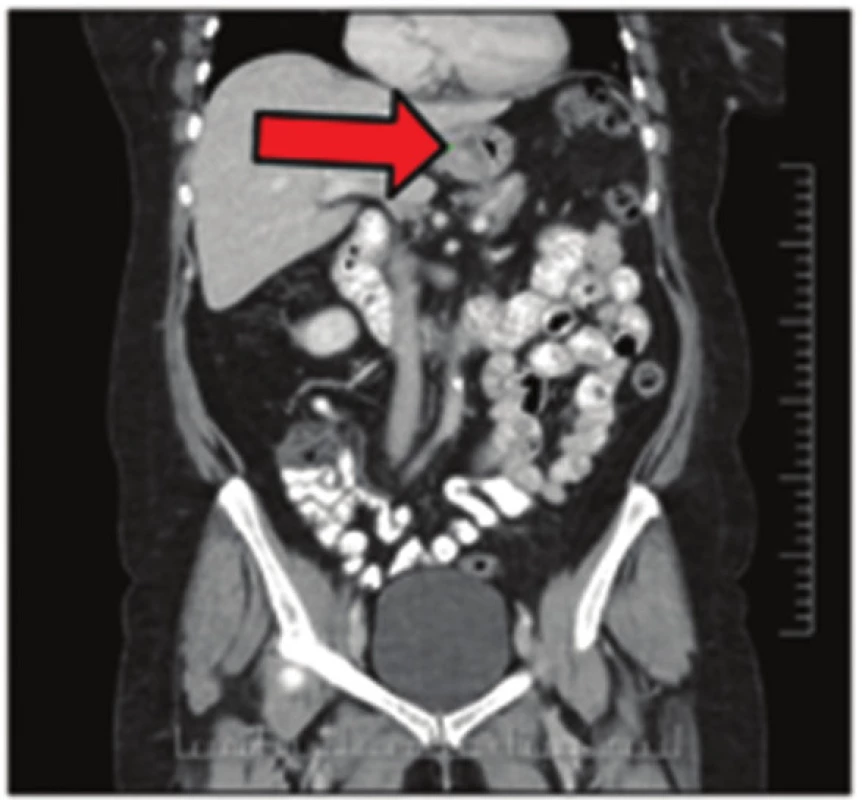
Image 3. Extraadrenální paragangliom na CT snímku Fig. 3: Extraadrenal paraganglioma on CT scan 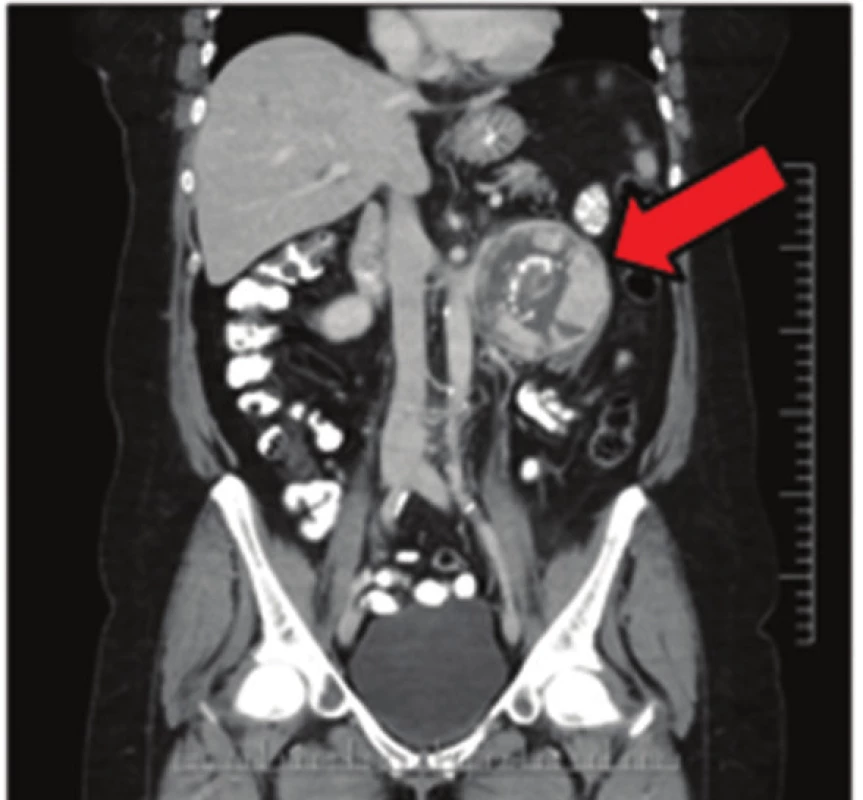
Image 4. Plicní chondrom na CT snímku Fig. 4: Pulmonary chondroma on CT scan 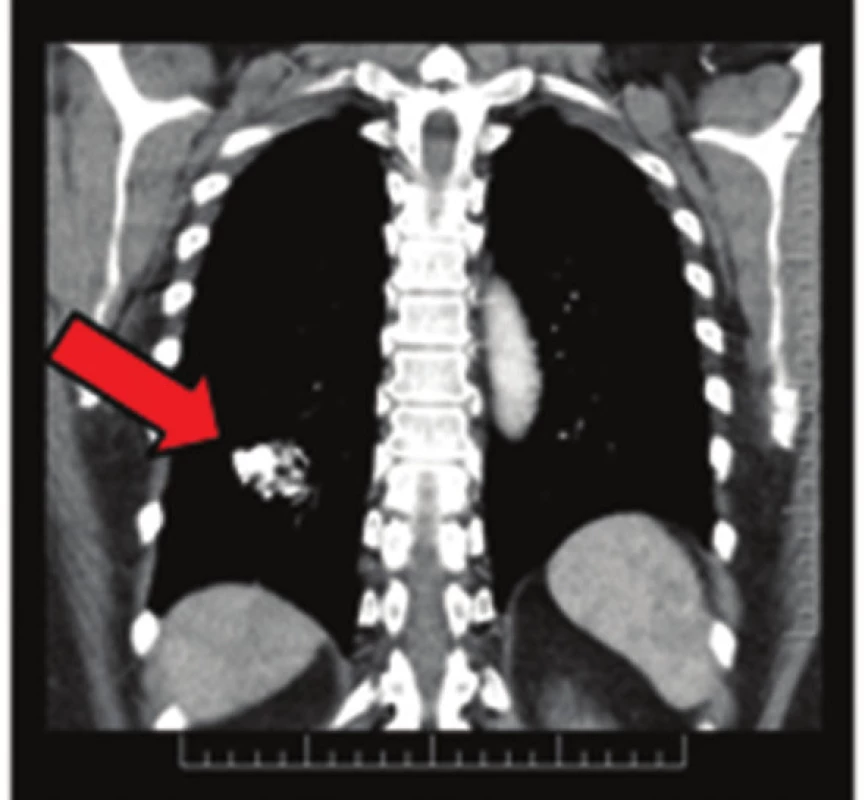
Image 5. Exstirpát extraadrenáního paragangliomu Fig. 5: Extirpated paraganglioma 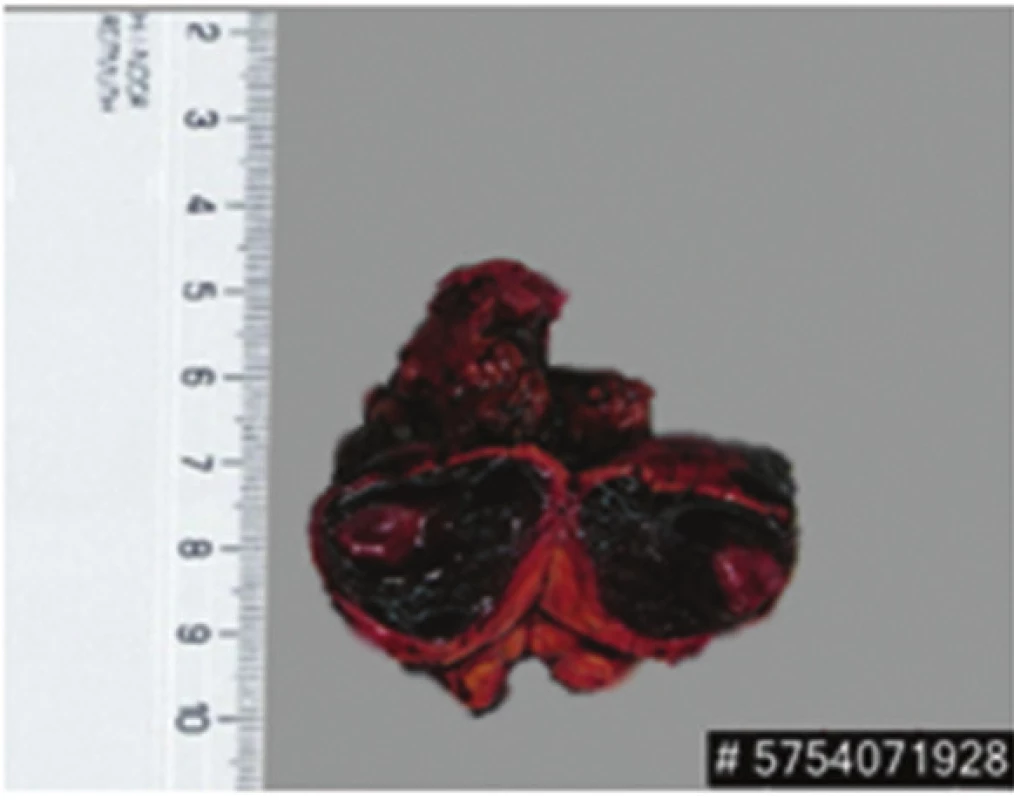
Průběh bez komplikací, pacientka byla 8. pooperační den propuštěna domů.
Onkologická rozvaha: vzhledem k přítomnosti metastáz jde o feochromocytom maligní povahy, hormonálně neaktivní, s nízkou mitotickou aktivitou, bez nálezu extratumorózní angioinvaze, bez infiltrativního růstu. Nález plicního ložiska vpravo je dle dostupné dokumentace stacionární minimálně od roku 2003. Prioritou je tedy chirurgické odstranění reziduální nádorové masy, poté sledování (včetně plicního nálezu) pod dohledem endokrinologa.
Před plánovanou druhou operační revizí bylo provedeno kontrolní CT břicha, které kromě stacionárních jaterních ložisek vzhledu metastáz zobrazilo i expanzi levé nadledviny charakteru metastázy v místě po resekci feochromocytomu a ložisko v zadní stěně žaludku subkardiálně. Při druhé operaci byla provedena levostranná hemihepatektomie, nástěnná resekce žaludku a levostranná adrenalektomie (Obr. 6,7,8). Pooperační průběh opět bez komplikací, 13. den pacientka propuštěna do domácí péče.
Image 6. Resekát jater – levostranná hemihepatektomie s dvěma metastázami Fig. 6: Liver specimen – left hemihepatectomy with two metastases 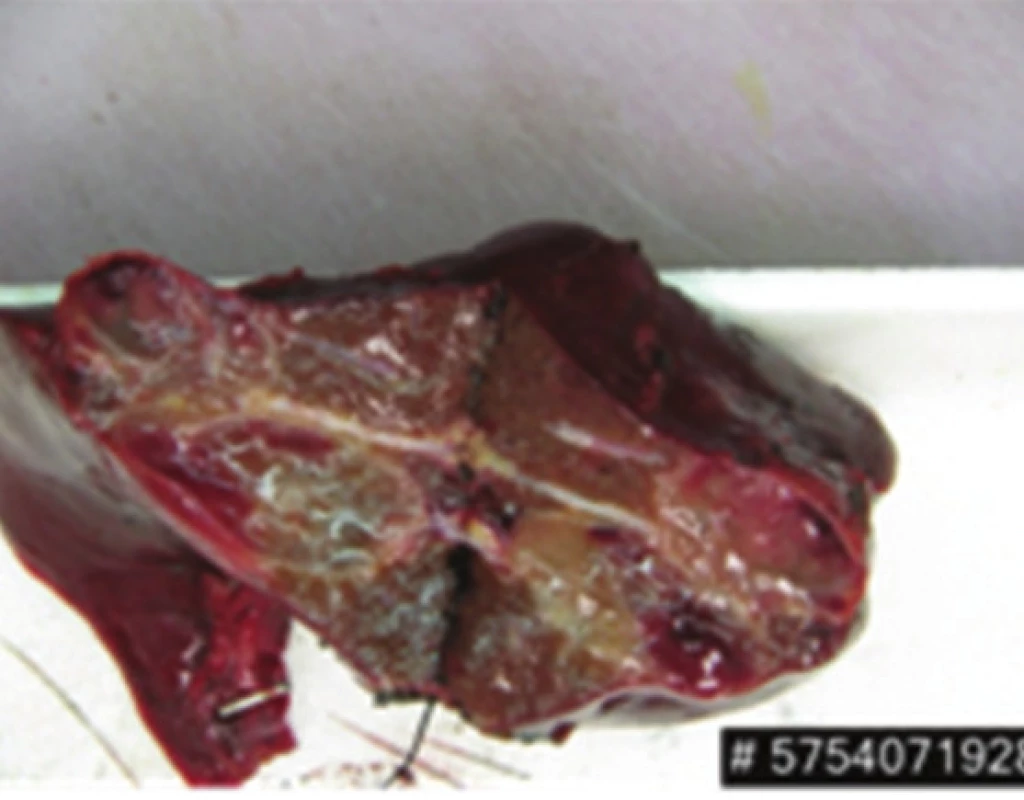
Image 7. Resekát žaludku s GIST Fig. 7: Gastric specimen with GIST 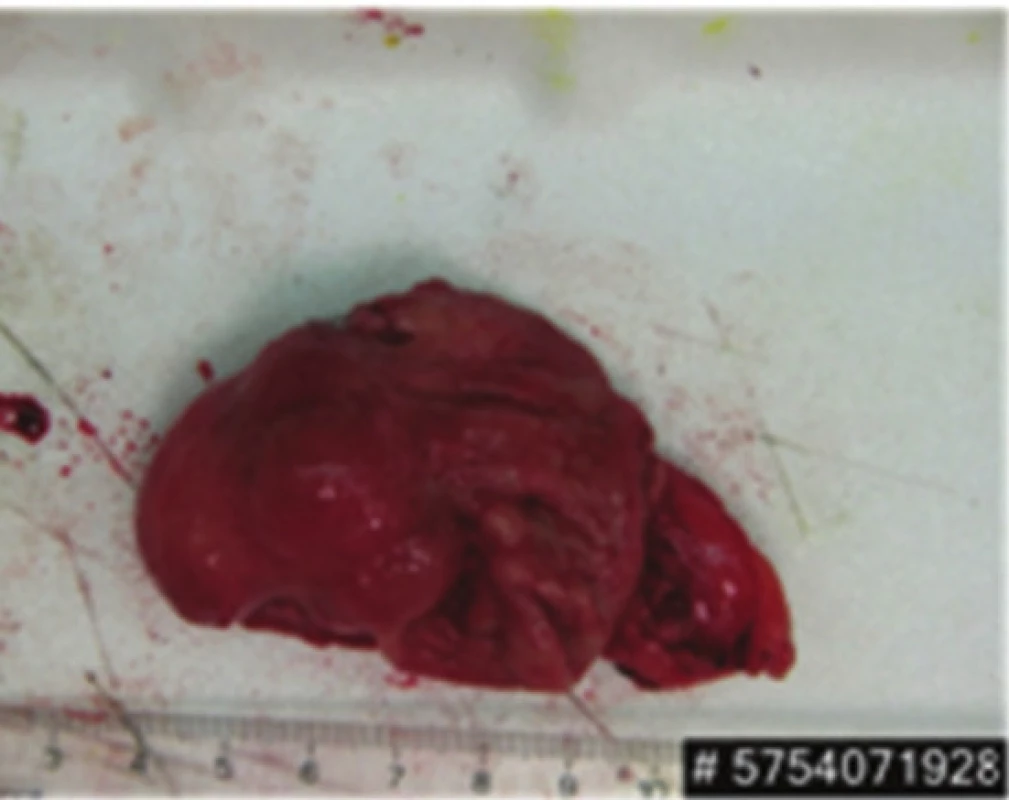
Image 8. Levostranná adrenalektomie Fig. 8: Left adrenalectomy 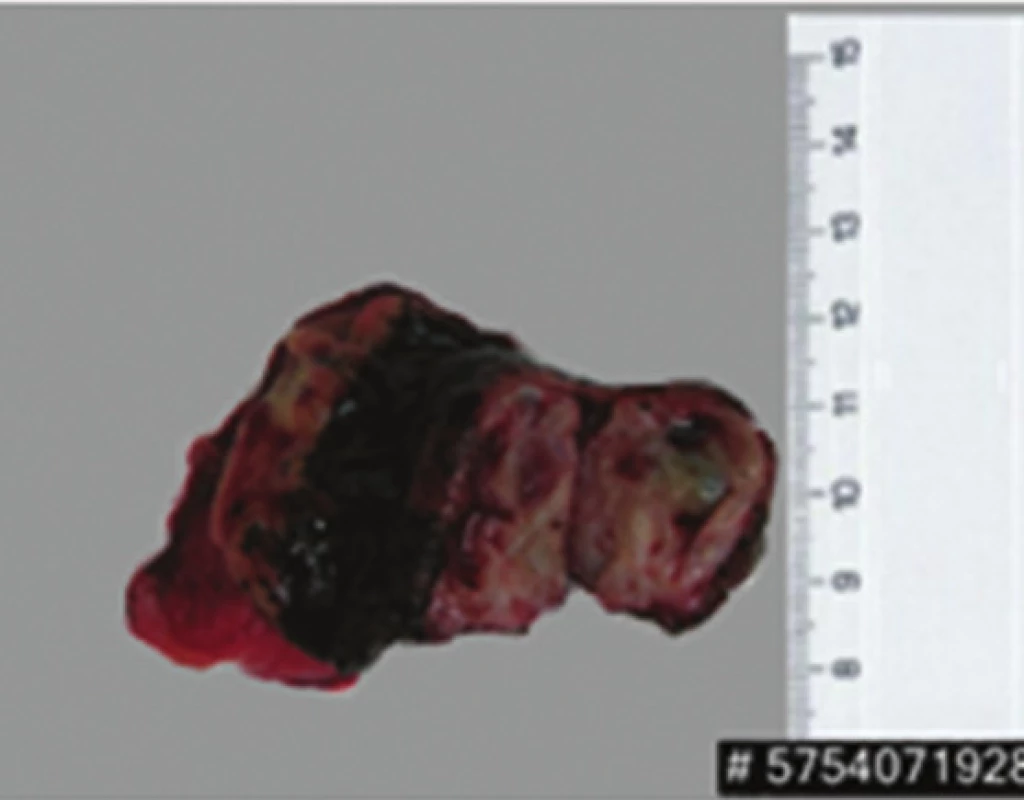
Výsledek histologie byl překvapivý. V resekátu stěny žaludku byl nalezen gastrointestinální stromální tumor, v resekátu jater pak metastázy tohoto tumoru. Při velikosti 38 mm a mitotické aktivitě 4/5 mm2 (4/50HPF) by primární tumor dle ESMO guidelines 2012 spadal do prognostické skupiny 2 – benigní GIST s 1,9% pravděpodobností progrese (viz Tab. 1). Vzhledem k jaterním metastázám bylo ale nutné tumor hodnotit jako maligní. Mutační analýza neprokázala mutaci v genech KIT a PDGFR. V oblasti dřeně levé nadledviny byly nalezeny pouze reparativní změny po předchozí resekci a adenom kůry nadledviny bez nálezu rezidua feochromocytomu. Protože metastáza nepocházela z feochromocytomu, byl tento překlasifikován na nádor nejistých biologických vlastností.
Table 1. Dělení rizika relapsu GIST, volně dle ESMO guidelines 2012 [17] Tab. 1: The risk of GIST recurrence, according to ESMO guidelines 2012 [17] ![Dělení rizika relapsu GIST, volně dle ESMO guidelines 2012 [17]
Tab. 1: The risk of GIST recurrence, according to ESMO guidelines 2012 [17]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/b5019b858fc6dfb4c0700589086fe275.png)
Vysvětlivky: Data získaná z dlouhodobého follow-up studií hodnotících GIST žaludku, tenkého střeva, duodena a rekta. ++ ve studii se nevyskytl tento typ nádoru. Data obtained from long-term follow-up studies evaluating GIST of the stomach, small bowel, duodenum and rectum. ++ in the study occurred this type of tumor. S ohledem na skutečnost, že se u pacientky velmi pravděpodobně jednalo o metachronní výskyt gastrointestinálního stromálního tumoru žaludku (nádor, který byl pacientce dříve odstraněn a klasifikován jako leiomyosarkom, by dnes s vysokou pravděpodobností spadal do skupiny GIST) a paragangliom/feochromocytom v relativně nízkém věku vzniklo podezření, že by se mohlo jednat o familiární syndrom Carney-Stratakis. Pokud by plicní ložisko bylo chondromem, pak by šlo o odlišný syndrom, tzv. Carneyho triádu. Materiál byl odeslán k imunohistochemickému průkazu SDH a vyšetření mutací SDH genů.
Imunohistochemickým vyšetřením nebyla ve tkáních paragangliomu a GIST žaludku zjištěna přítomnost B podjednotky mitochondriálního enzymu sukcinátdehydrogenázy (SDHB) a byla zjištěna přítomnost A podjednotky tohoto enzymu. Tento nález svědčí pro SDHB-deficientní GIST a paragangliom. Pro definitivní rozlišení mezi Carneyho trias a syndromem Carney-Stratakis bylo provedeno molekulárně genetické vyšetření genů SDHB, SDHC a SDHD a analýza metylace promotoru genu SDHC. Mutace v genech prokázána nebyla, ale byla potvrzena metylace promotoru genu SDHC. Uvedený komplex vyšetření svědčí pro diagnózu Carneyho trias.
Kontrolní CT vyšetření plic a mediastina potvrdilo, že předmětné ložisko pravé plíce má stacionární vzhled i velikost v porovnání s dohledanými snímky z roku 2003. Vzhledem k výše uvedeným skutečnostem byl plicní nález definitivně uzavřen jako benigní chondrom a bylo upuštěno od jeho histologické verifikace biopsií. Pacientka je sledována v pravidelných půlročních intervalech a je bez známek recidivy onemocnění.
Diskuze
Carney et al., kteří publikovali doposud největší soubor 79 pacientů s Carneyho triádou, analýzou svého souboru zjistili, že syndrom postihuje nejčastěji ženy v mladém věku (85 % pacientů ze souboru byly ženy, v 82 % byl výskyt syndromu zaznamenán kolem 30. roku života). Pouze v 17 případech (22 %) byl popsán výskyt všech tří komponent triády, a to v různých časových obdobích. Synchronní koincidence všech tří tumorů je ještě raritnější a byla zachycena pouze přibližně ve 2 % případů [2]. Zbylých 78 % pacientů mělo vyjádřenu pouze jednu nebo dvě ze tří komponent, a to nejčastěji kombinaci tumoru žaludku a plic. Co se týče procentuálního zastoupení jednotlivých komponent triády v Carneyho souboru, tak nejčastější byl žaludeční GIST (99 %) a plicní chondrom (76 %). Nejméně často byl zastižen extraadrenální paragangliom, který byl popsán pouze u 47 % pacientů. Nižší procento výskytu plicního chondromu může být dáno chybnou interpretací rentgenologického nálezu plicní léze považované např. za metastázu GIST, hamartom, granulom nebo jinou benigní lézi [3]. Zároveň byl pozorován často velmi dlouhý časový interval mezi výskytem jednotlivých komponent triády (v některých případech i více než 25 let). Dalším typickým znakem pro Carneyho triádu je její nefamiliární výskyt. Ze souboru 79 pacientů, které popsal Carney, byl pouze ve dvou případech zjištěn familiární výskyt bilaterálních karotických paragangliomů u sourozenců [1]. Tyto případy familiárního výskytu paragangliomů a gastrointestinálních stromálních tumorů byly s dalšími obdobnými případy následně podrobně analyzovány a bylo zjištěno, že kromě familiárního výskytu se liší i v dalších znacích. V roce 2002 Carney a Stratakis publikovali práci, ve které tyto odlišnosti přesně definovali. Koincidence GIST a paragangliomu s familiárním výskytem a autosomálně dominantním typem dědičnosti byla nazvána Syndrom Carney-Stratakis [4]. Tento syndrom se od Carneyho triády dále liší nepřítomností převahy postižení mladých žen, absencí výskytu plicního chondromu a vyšším zastoupením paragangliomu [5]. Provedené imunohistochemické a mutační analýzy prokázaly zásadní odlišnosti i na genetické úrovni, které umožňují tyto dva syndromy odlišit. Zároveň byly definovány rozdíly mezi gastrointestinálními stromálními tumory vznikajícími v rámci zmíněných syndromů a mnohem častějšími sporadickými GIST. U 90−95 % sporadických GIST (které představují 98–99 % všech gastrointestinálních stromálních tumorů) je přítomna mutace v genu KIT (c-kit pozitivní GIST), zbylých přibližně 5–10 % sporadických GIST je tzv. c-kit negativních. Často je u nich zachycena mutace v genu PDGFRA (platelet-derived growth fractor receptor alpha) [6]. GIST vzniklé v rámci syndromů Carney a Carney-Stratakis vykazují odlišný molekulárně genetický profil. Hovoříme o tzv. „wild-type“ GIST, které zahrnují všechny GIST, u nichž nejsou přítomny nejběžnější mutace KIT a PDGFRA, ale jsou přítomny jiné raritní mutace (např. v genech SDH, BRAF, NF1) nebo doposud neznámé mutace. Kromě již zmíněných syndromů do rodiny „wild-type“ GIST patří rovněž extrémně vzácný pediatrický GIST nebo sporadický „wild-type“ GIST [7]. U pacientů se syndromem Carney-Stratakis byly v roce 2007 prokázány germinální mutace genů SDHB, SDHC nebo SDHD. Jedná se o geny kódující příslušné podjednotky (B, C, D) mitochondriálního enzymu sukcinátdehydrogenázy a jejich mutace byly nalezeny jak v buňkách GIST, tak v buňkách paragangliomů [8]. Naopak GIST i paragangliomy vyskytující se v rámci Carneyho trias jsou tzv. SDH „wild-type“, tzn., že u nich nebyly prokázány mutace v genech SDH (jsou SDH deficientní) [4,7]. Přehledně viz Tab. 2. Za zmínku stojí i fakt, že v případě SDH deficientních GIST selhávají obecně známá a přijatá prognostická kritéria, která dle velikosti nádoru, jeho lokality a mitotického indexu umožňují odhadnout míru rizika agresivního chování, resp. míru rizika vzniku relapsu. Tuto skutečnost dokládá i námi referovaný případ. V roce 2014 byla v nádorech Carneyho triády detekována aberantní DNA metylace promotoru genu SDHC, která naopak není přítomna v GIST a paragangliomech s prokázanou zárodečnou mutací SDH genů (syndrom Carney-Stratakis) ani u sporadických GIST s KIT/PDGFRA mutací [9]. Tato specifická genetická změna umožňuje odlišit Carneyho trias od syndromu Carney-Stratakis a pomohla i v případě naší pacientky s jistotou potvrdit, že se jedná o Carneyho trias.
Table 2. Srovnání sporadického GIST a GIST u Carneyho triády a syndromu Carney-Stratakis Tab. 2: Comparison of sporadic GIST and GIST in Carney triad and Carney-Stratakis syndrome 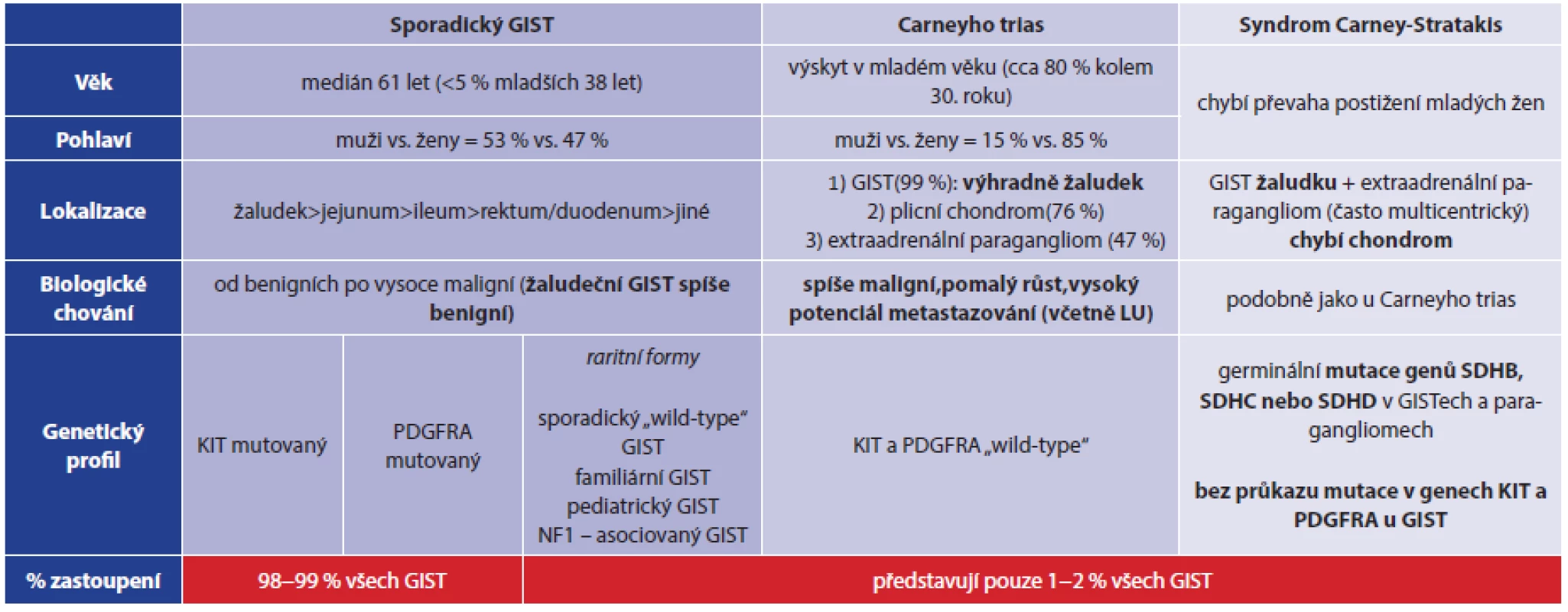
Klinická manifestace Carneyho triády závisí na tom, která složka se jako první či dominantní klinicky projeví. Vzhledem k 99% pravděpodobnosti výskytu GIST nepřekvapí, že nejčastěji se triáda manifestuje právě projevy žaludečního GIST, typicky krvácením s běžnými projevy jako anemizace, hemateméza či melena. Při gastroskopii, eventuálně na CT nacházíme intramurální lézi s nebo bez slizniční ulcerace, typicky lokalizovanou v oblasti antra žaludku nebo malé křiviny. Dále je pro GIST v rámci Carneyho trias typický pomalý růst, ale zároveň i časté metastazování včetně lymfatických uzlin (na rozdíl od sporadického GIST, který lymfaticky prakticky nemetastazuje) [2,10]. Stejně jako u sporadického GIST i zde je jedinou kurativní léčebnou modalitou chirurgická léčba. Ve většině případů jsou dostačující nástěnné resekce s mikroskopicky negativními okraji. Výsledný rozsah výkonu ale závisí na lokalizaci tumoru, jeho velikosti a vztahu k okolí. Někteří autoři připouštějí i endoskopické resekce drobných, zejména incidentálních tumorů. V případě chirurgického výkonu je nezbytné zabránit ruptuře nádoru (riziko peritoneální diseminace). Role laparoskopie v chirurgické léčbě GIST je předmětem diskuzí. Chybí prospektivní studie, četná kazuistická sdělení či malé retrospektivní analýzy ale dokládají, že laparoskopický přístup je možný (zejména u nádorů v příznivých lokalizacích a menších rozměrů) [11,12]. Vzhledem k tomu, že GIST u Carneyho trias vykazuje vysoký potenciál metastazování, je relevantní i otázka chirurgické léčby vzdálených metastáz. Anatomické a extraanatomické resekce nebo užití termoablačních metod v léčbě nejčastějších jaterních metastáz, stejně jako plicní resekce v případě solitárního plicního postižení mají v dnešní době v léčbě metastatického GIST své místo. Naopak cílená léčba inhibitory tyrozin kinázy (imatinib) je v případě metastatického GIST nebo v adjuvantní terapii u Carneyho syndromu většinou neúčinná, protože GIST u Carneyho syndromu je c-kit negativní. Role adjuvantní terapie žaludečního GIST asociovaného s Carneyho syndromem není jednoznačná a vyžaduje další studium [13].
Druhou komponentou Carneyho triády, vyskytující se u 76 % pacientů, je plicní chondrom [2]. Jde o benigní lézi vycházející z peribronchiální mezenchymální tkáně, pro kterou je typický multifokální, bilaterální nebo periferní výskyt a asymptomatický nebo indolentní průběh [14]. Chondrom může být odstraněn z torakotomického nebo torakoskopického přístupu, ale stejně tak je možné ho ponechat in situ a sledovat [15].
Poslední složkou v rámci triády je extraadrenální paragangliom, který se vyskytuje jen u necelých 50 % pacientů. Typická je extraadrenální lokalizace, často multifokální výskyt, v 35 % hormonální aktivita, pozitivita na chromogranin A a ve většině případů benigní chování. Carney ale popsal i metastázy zakládající extraadrenální paragangliomy. S ohledem na povahu, lokalizaci a velikost mohou být paragangliomy buď ponechány a sledovány, nebo resekovány. Důvodem k resekci bývá nejčastěji riziko metastazování a možnost dalšího růstu. Byly publikovány i úspěšné pokusy řešení paragangliomů transarteriální embolizací zejména v oblasti mediastina a karotid [16].
Jak již zaznělo, klinické vyjádření všech tří komponent současně je raritní. U pacientů s manifestací pouze jedné komponenty je žádoucí sledování zaměřené na případný výskyt zbylých složek triády, zejména u žen mladšího věku. S ohledem na skutečnost, že doba mezi manifestací jedné a druhé komponenty může být i více než 25 let, měla by být délka sledování dlouhodobá, respektive doživotní. Jako nejvhodnější zobrazovací metoda využitelná ke sledování pacientů s Carneyho trias se jeví PET/CT, které by mělo být schopno s největší senzitivitou zachytit i okultní léze [4,15].
Závěr
Případem naší pacientky jsme chtěli upozornit na extrémně vzácný syndrom koincidence žaludečního GIST, extraadrenálního paragangliomu a plicního chondromu, známého jako Carneyho triáda. Výskyt kterékoliv jeho komponenty, zejména u žen v mladším věku, by neměl zůstat bez pozornosti a pacienti by měli být bedlivě sledováni s cílem záchytu případné další komponenty trias. Kazuistikou jsme chtěli zároveň demonstrovat, jak obtížné stanovení diagnózy tohoto syndromu může být, zejména s ohledem na existenci podobné klinické jednotky známé jako syndrom Carney-Stratakis. Odlišení těchto dvou syndromů je možné prakticky pouze na základě vyloučení, resp. potvrzení přítomnosti mutací genů kódujících podjednotky B, C a D mitochondriálního enzymu sukcinátdehydrogenáza a detekci případné hypermetylace promotoru genu SDHC.
Práce podpořena MZ ČR – RVO (MOÚ, 00209805).
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.MUDr. Lukáš Fiala
Klinika operační onkologie MOÚ a LF MU Brno
Oddělení onkologické chirurgie
Žlutý kopec 7
656 53 Brno
e-mail: lfiala@mou.cz
Sources
1. Carney JA, Sheps SG, Go VL, et al. The triad of gastric leiomyosarcoma, functioning extra-adrenal paraganglioma and pulmonary chondroma. N Engl J Med 1977;296 : 1517−18.
2. Carney JA. Gastric stromal sarcoma, pulmonary chondroma, and extra-adrenal paraganglioma (Carney Triad): natural history, adrenocortical component, and possible familial occurrence. Mayo Clin Proc 1999;74 : 543−52.
3. Rodriguez FJ, Aubry M, Tazelaar HD, et al. Pulmonary chondroma: a tumor associated with Carney triad and different from pulmonary hamartoma. Am J Surg Pathol 2007;31 : 1844−53.
4. Alrashdi I, Bano G, Maher ER, et al. Carney triad versus Carney Stratakis syndrome: two cases which illustrate the difficulty in distinguishing between these conditions in individual patients. Familial Cancer 2010;9 : 443−7.
5. Carney JA, Stratakis CA. Familial paraganglioma and gastric stromal sarcoma: a new syndrome distinct from the Carney triad. Am J Med Genet 2002; 108 : 132−9.
6. Rubin BP, Heinrich MC, Corless CL. Gastrointestinal stromal tumour. Lancet 2007;369 : 1731–41.
7. Kocáková I, Fiala L, Kocák I. Gastrointestinální stromální nádory. Aktualizovaný pohled na personalizaci léčby. Mol Target Ther News 2016;2 : 16−21.
8. Pasini B, McWhinney SR, Bei T, et al. Clinical and molecular genetics of patients with the Carney-Stratakis syndrome and germline mutations of the genes coding for the succinate dehydrogenase subunits SDHB, SDHC and SDHD. Eur J Hum Genet 2008; 16 : 79−88.
9. Haller F, Moskalev EA, Faucz FR, et al. Aberrant DNA hypermethylation of SDHC: a novel mechanism of tumor development in Carney triad. Endocr Relat Cancer 2014;21 : 567−77.
10. Byrne CM, Daneshjoo R, Wyatt JM, et al. Gastrointestinal hemorrhage as a presentation of Carney’s triad. Anz J Surg 2007;77 : 88−90.
11. Bednarski BK, Pisters PWT, Hunt KK. The role of surgery in the multidisciplinary management of patients with localized gastrointestinal stromal tumors. Expert Rev Anticancer Ther 2012;12 : 1069–78.
12. L. Fiala L, Šefr R, Kocáková I, et al. Léčba gastrointestinálních stromálních tumorů – komplexní pohled chirurga. Rozhl Chir 2015;94 : 189−92.
13. Stratakis CA, Carney JA. The triad of paragangliomas, gastric stromal tumours and pulmonary chondromas (Carney triad), and the dyad of paragangliomas and gastric stromal sarcomas (Carney-Stratakis syndrome): molecular genetics and clinical implications. J Intern Med 2009;266 : 43−52.
14. Murali R, Carney JA. An asymptomatic, incidentally discovered pulmonary tumor in a 41-year-old woman. Arch Pathol Lab Med 2005;129 : 191−4.
15. Chen CF, Chuang CH, Liu MK, et al. Clinical, radiologic and pathologic characteristics of the Carney triad: a case report and literature review. Kaohsiung J Med Sci 2010;26 : 428−34.
16. Vogl TJ, Lehnert T, Wetter A, et al. Interventional radiology in Carney triad. Eur Radiol 2005;15 : 833−7.
17. Gastrointestinal stromal tumors: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2012;23(Suppl 7):vii49–vii55.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2017 Issue 6-
All articles in this issue
- Chirurgická léčba ovariálního karcinomu
- Totální pánevní exenterace – strategie a rozsah operačního výkonu
- ODS − Obstrukční defekační syndrom – souhrnné sdělení
- Maligní nádory tenkého střeva
- Záchranná pánevní lymfadenektomie po selhání chirurgické léčby karcinomu prostaty – kazuistika
- Kombinovaná léčba měkkotkáňového sarkomu v oblasti pánve
- Carneyho trias
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- ODS − Obstrukční defekační syndrom – souhrnné sdělení
- Maligní nádory tenkého střeva
- Chirurgická léčba ovariálního karcinomu
- Kombinovaná léčba měkkotkáňového sarkomu v oblasti pánve
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

