-
Medical journals
- Career
Transfer nádorových buněk mezi pacientem a laboratorním zvířetem jako základní metodický přístup ke studiu kancerogeneze a identifikace biomarkerů
Authors: Dušan Klos 1; M. Stašek 1; M. Loveček 1; P. Skalický 1; R. Vrba 1; R. Aujeský 1; R. Havlík 1; Č. Neoral 1; L. Varanashi 2; M. Hajdúch 2; J. Vrbková 2; P. Džubák 2
Authors‘ workplace: I. chirurgická klinika FN a LF Univerzity Palackého v Olomouci přednosta: prof. MUDr. Č. Neoral, CSc. 1; Ústav molekulární a translační medicíny LF Univerzity Palackého v Olomouci ředitel: doc. MUDr. M. Hajdúch, Ph. D. 2
Published in: Rozhl. Chir., 2016, roč. 95, č. 12, s. 432-438.
Category: Original articles
Overview
Úvod:
Hledání prognostických a prediktivních faktorů pro časnou diagnostiku nádorů, jejich surveillance a sledování vlivu terapeutických modalit s využitím hybridních laboratorních modelů in vitro/in vivo je experimentální přístup s významným potenciálem. Nezbytným předpokladem je ovšem příprava in vivo nádorového modelu, která může narážet na řadu technických úskalí. Hodnocení technické úspěšnosti graftingu a xenotransplantace v závislosti na typu tumoru nebo nádorové linie je důležitou informací pro přípravu těchto modelů a jejich dalšího využití pro proteomické a genomické analýzy.Metody:
Byla zpracována peroperačně/biopticky odebraná nádorová tkáň karcinomů GIT, případně kultivovány stabilní nádorové buněčné linie, proběhlo zhodnocení viability a následně inokulace vzorků tumorózní tkáně či ascitu subkutánně do SCID myší s individuální délkou tumorózního růstu a následným odebráním biologického materiálu.Výsledky:
Bylo analyzováno 140 odběrů nádorové tkáně, které sestávaly ze 17 vzorků tumorů jícnu (viabilita 13/úspěšná inokulace 0), 13 tumorů kardie (11/0), 39 tumorů žaludku (24/4), 47 vzorků tumorů pankreatu (34/1) a 24 vzorků tumorů tlustého střeva a rekta (22/9). Vyřazeny byly 3 vzorky pro histologickou nepřítomnost tumoru (ve 2 případech kompletní remise po neoadjuvantní terapii pro karcinom jícnu, v 1 případě chronická pankreatitis). U nádorových linií byla úspěšnost inokulace v 17 z 28 linií.Závěr:
Mimo stabilní nádorové linie a karcinomy tlustého střeva je u tumorů jícnu, žaludku a pankreatu významně nižší úspěšnost graftingu na myší model. Úspěšnost graftingu je úměrná viabilitě odebrané nádorové tkáně, která je závislá na sekvenci klinických a laboratorních postupů s vysokým stupněm spolupráce obou typů pracovišť.Klíčová slova:
proteomická analýza – xenotransplantace – prognostické a prediktivní faktory – tumory gastrointestinálního traktuÚvod
V posledních dvou dekádách extrémně vzrostly poznatky o molekulárně biologických procesech na buněčné úrovni, což v důsledku vedlo k pochopení klíčových charakteristik a principů řady onemocnění včetně onemocnění nádorového [1]. Celá společnost díky tomu právem očekává od realizovaných klinických a výzkumných studií výstupy do klinické praxe, zejména zlepšení časné diagnostiky a díky personalizované medicíně i úspěšnosti léčby [2]. S rozvojem všeobecného vědeckého poznání došlo také k masivnímu rozvoji nových in vitro a ex vivo metod a technik, které umožňují vyplnit chybějící části poznání genetické, molekulární a holistické podstaty nádorového onemocnění. Nicméně i přes posun v tkáňových in vitro technikách, kdy se stále více využívá relevantnějších 3D modelů, se zatím žádný rozsáhlejší studijní záměr neobejde bez in vivo modelů na zvířeti [3]. Modelování různých patologických stavů na laboratorním zvířeti umožňuje pochopit řadu mechanismů kancerogeneze, stejně jako lze tímto postupem identifikovat biomarkery, které mohou pomoci predikovat odpověď na různé modality léčby. Nádorovou tkáň je možné implantovat do živého příjemce, laboratorního zvířete, kde může dál pokračovat v růstu, a to i se systémovou reakcí zvířete na proliferující nádorovou tkáň. Tento přístup se začíná využívat pro personalizovanou medicínu, kdy se z biopticky/peroperačně odebrané nádorové tkáně vytvoří tzv. od pacienta derivovaný nádorový model (patient derived xenograft – PDX model), který je svým biologickým chováním a odpovědí na léčbu podobný nádorové tkáni u pacienta [4]. Zdokonalené standardy péče o laboratorní zvíře, optimalizace zvířecích modelů, kvalitní zpracování nádorové tkáně a různé suplementy stimulující růst a viabilitu nádorových buněk umožňují maximalizovat výtěžnost a úspěšnost přípravy PDX modelů a i díky tomu racionalizovat využití laboratorních zvířat při dodržení všech etických zásad jejich použití [5].
Cílem naší studie bylo ověřit možnosti a úspěšnost přenosu nádorové tkáně z různých částí zažívacího traktu na laboratorní zvíře, imunodeficitní SCID myš.
Metody
Nádorové linie použité pro přípravu nádorového modelu
Nádorové linie byly zakoupeny od Německé banky mikroorganismů a buněčných kultur (Leibniz-Institut DSMZ-Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH) a od Americké banky buněčných kultur (American Type Culture Collection – ATCC). Jejich charakterizace je uvedena v Tab. 1. Kultivovány byly dle doporučení výrobce, většinou v plném kultivačním médiu (RPMI1640 (Sigma-Aldrich), 15% fetální bovinní sérum (Gibco), L-glutamin 300 mg/l (Sigma-Aldrich), penicilin 25000 I.U./l (Biotika), streptomycin 100 mg/l (Sigma-Aldrich)), v CO2 kultivačním inkubátoru (Thermo Scientific) za standardních podmínek (5 % CO2, 95% vlhkost, 37 °C).
Table 1. Úspěšnost graftingu nádorových linií Tab. 1: Percentage of tumor lines grafting 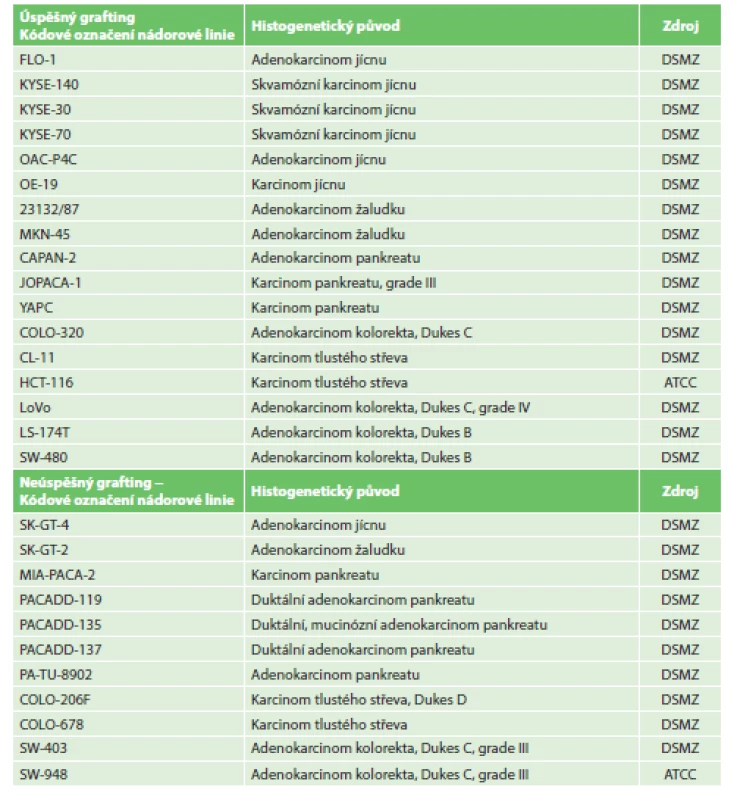
Primární nádorová tkáň použitá pro přípravu nádorového modelu
U pacientů s diagnostikovaným maligním nádorovým onemocněním jícnu, žaludku, pankreatu či kolorekta byl na základě jejich informovaného souhlasu, který byl schválen etickou komisí Fakultní nemocnice Olomouc, proveden peroperační odběr nádorové tkáně o velikosti minimálně 3 mm3. Odběry pacientských vzorků v rámci studie probíhaly na 1. chirurgické klinice Fakultní nemocnice v Olomouci v letech 2009–2015.
Vzorky byly bezprostředně po odběru sterilně umístěny do 20 ml transportního média (Médium RPMI1640 (Sigma-Aldrich), 15% fetální bovinní sérum (Gibco), L-glutamin 300 mg/l (Sigma-Aldrich), penicilin 25000 I.U./l (Biotika), streptomycin 100 mg/l (Sigma-Aldrich), transferin 2,5 µg/l (Sigma-Aldrich), inzulin – Actrapid 120 m.j./l (Novo-Nordisk), heparin 12500 m.j./l (Léčiva ČR) a transportovány do Ústavu molekulární a translační medicíny LF UP, kde probíhalo další zpracování vzorků.
Zvířata
Pro studii byly použity SCID myši (Harlan Laboratories Ltd., AnLab s.r.o.) mezi 6 až 12 týdny věku, které vykazují závažný kombinovaný imunodeficit ovlivňující B i T lymfocyty. Myši mají normální NK buňky, makrofágy a granulocyty.
Všechna zvířata byla chována v individuálně ventilovaných klecích s vinylovým izolátorovým systémem v patogen-free prostředí, při teplotě 22±1 °C s 45±10% vlhkostí a 12hodinovým cyklem světlo/tma. Tato kritéria naplňují mezinárodní podmínky pro práci s laboratorními zvířaty. Projekt pokusu podle § 16a zákona č. 246/1992 Sb., na ochranu zvířat proti týrání, ve znění pozdějších předpisů, byl schválen odbornou komisí LF UP pro zajišťování dobrých životních podmínek pokusných zvířat.
Příprava derivovaných nádorových modelů
Nádorová tkáň byla po transportu do laboratoře ve sterilních podmínkách rozstříhána na drobné kousky a dezintegrována mechanickým protlačením přes kovové sítko (Obr. 1). Izolované buňky byly po podbarvení trypanovou modří spočítány v Bürkerově komůrce, kdy byla současně stanovena jejich viabilita. Pouze vzorky, kdy se podařilo vyizolovat minimálně 1x106 viabilních buněk, byly transplantovány do imunodeficitních SCID myší. Vyizolované primární nádorové buňky/buňky nádorové linie byly v médiu v poměru 1 : 1 smíchány s Corning Matrigel® Matrix® (Corning). Dle množství získaného materiálu bylo transplantováno 1–5x106 buněk subkutánní injekcí o celkovém objemu 200 µl, a to na pravý nebo i na levý bok SCID myši.
Image 1. Nástroje pro zpracování nádorové tkáně Fig. 1: Instruments for tumor tissue treatment 
Následně byla zvířata sledována a v případě, že došlo k růstu implantovaného materiálu, byla po dosažení velikosti 1 cm3 nádorová hmota odebraná. Část nádorové tkáně se následně zamrazila na -80 °C a zpracovala pro další molekulárně genetická vyšetření, část nádorové masy se retransplantovala/pasážovala do dalšího zvířete. Paralelně s odběrem nádorové hmoty proběhlo vykrvení zvířete a izolace séra pro identifikaci cirkulujících nádorových markerů (Schéma 1). Pokud nedošlo do šesti měsíců k růstu implantovaného nádorového materiálu, byla implantace nádoru/nádorové linie hodnocena jako neúspěšná a zvíře bylo utraceno.
Schéma 1: Pracovní postup přípravy nádorových xenograftů Scheme 1: Workflow of preparing the tumor xenografts 
Výsledky
Do studie bylo zařazeno 140 odebraných vzorků biologického, potenciálně nádorového materiálu, které sestávaly ze 17 vzorků tumorů jícnu, 13 tumorů kardie, 39 tumorů žaludku, 47 tumorů pankreatu a 24 tumorů tlustého střeva a rekta. 3 vzorky byly vyřazeny pro histologickou nepřítomnost nádorových buněk (ve 2 případech se jednalo o kompletní remisi po neoadjuvantní terapii pro karcinom jícnu, v jednom případě šlo o chronickou pankreatitis u nemocného s předpokládaným tumorem pankreatu). Podrobný rozbor souborů je uveden v Tab. 2 až 6. Úspěšnost xenotransplantace je spolu se základními klinickými daty tumorů shrnuta v Tab. 7. Podařilo se připravit 4 xenotransplantáty nádorů žaludku, jeden nádor pankreatu a 9 nádorů tlustého střeva. Další hodnocenou skupinou bylo 28 stabilizovaných nádorových linií gastrointestinálního traktu, kde jsme nebyli omezování jako u primárního nádorového materiálu množstvím buněk (Tab. 1). V rámci této skupiny se podařilo připravit 6 xenotransplantátů nádorů jícnu, 2 nádory žaludku, 3 nádory pankreatu a 6 nádorů tlustého střeva.
Table 2. Tumory jícnu Tab. 2: Tumors of the esophageus 
Table 3. Tumory kardie Tab. 3: Tumors of the cardia 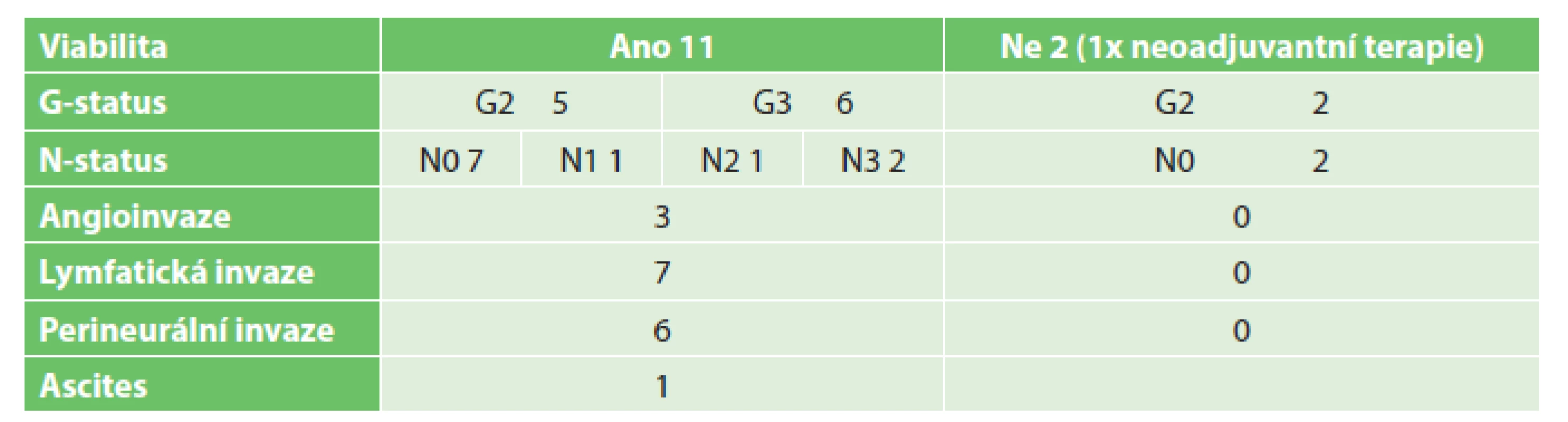
Table 4. Tumory žaludku Tab. 4: Gastric tumors 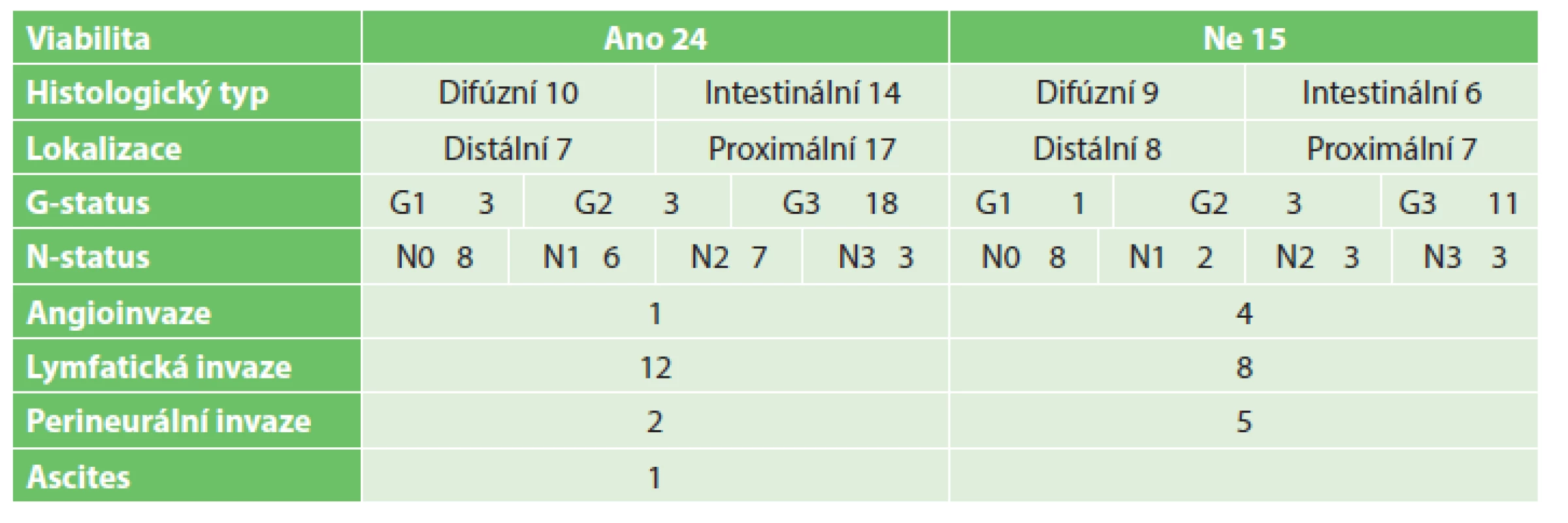
Table 5. Tumory pankreatu Tab. 5: Pancreatic tumors 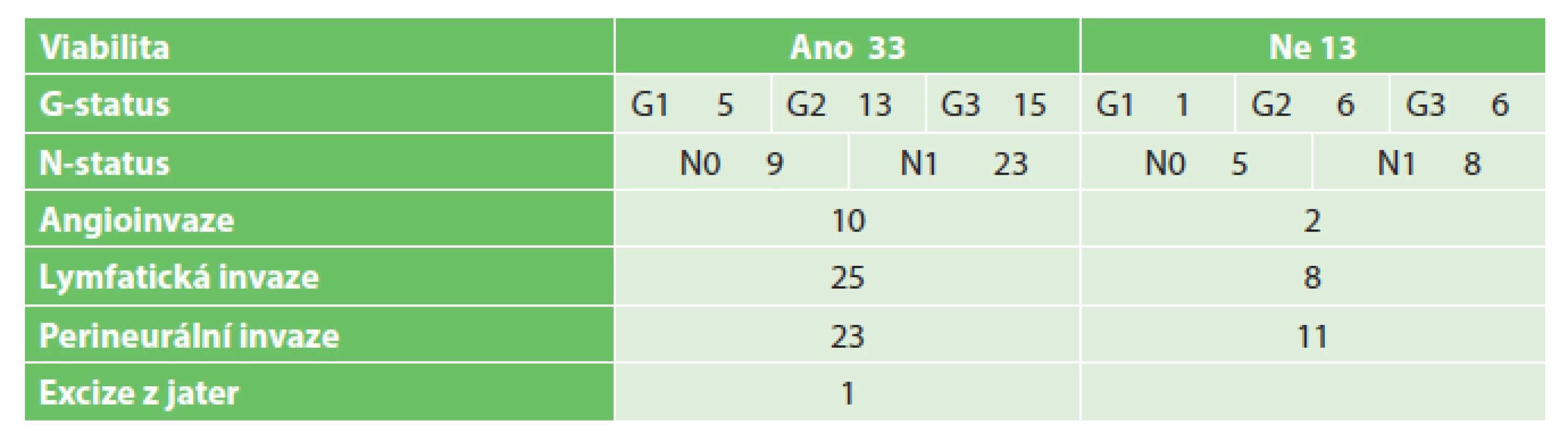
Table 6. Tumory tlustého střeva Tab. 6: Colorectal tumors 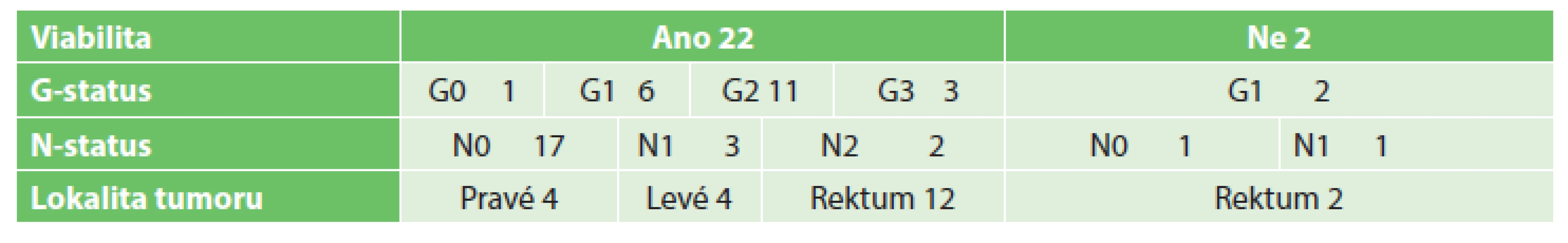
Table 7. Úspěšný grafting – přehled základních klinických charakteristik pacientů Tab. 7: Successful grafting – overview of clinical characteristics of the patients 
Diskuze
Karcinomy horního gastrointestinálního traktu jsou častým a velmi obtížně léčitelným nádorovým onemocněním, prognóza pacientů je nejistá, léčebné možnosti omezené. Hlavní léčebnou modalitou zůstává chirurgická léčba, případně intervenční paliativní terapie, možnosti klinické a radiační onkologie zůstávají pouze na podpůrné úrovni. Základními podmínkami úspěšné léčby jsou tedy možnost radikálního chirurgického řešení díky časnému stanovení diagnózy. Pro indikaci a monitoraci onkologické terapie a surveillance pacientů je nezbytná možnost sledování léčebné odpovědi.
Za tímto účelem byly již v minulosti identifikovány biomarkery/nádorové markery v oblasti tlustého střeva (CEA – karcinoembryonální antigen) [6] či ovariálního karcinomu (Ca125) [7], přesto i zde pokračuje rozsáhlý výzkum a hledání dalších kandidátských proteinů. V oblasti horního zažívacího traktu zůstává jediným spolehlivým tumor markerem Ca19-9 u tumorů pankreatu [8,9,10,11]. Přesto jeho základním nedostatkem zůstává nedostatečná možnost rozlišení časných stadií tumoru a tím velmi omezené využití v nádorovém screeningu. V této souvislosti je zřejmé, že i pro další karcinomy GIT by bylo výhodné mít specifické a senzitivní biomarkery. Jejich identifikace může probíhat na řadě úrovní, a to genomické, transkriptomické, mikroRNA, proteomické, 3D buněčných interakcí, metabolomické či na úrovni buněčné organizace [12,13]. Pro fázi vývoje nových biomarkerů je pro většinu analýz a metod zásadní zisk dostatečného množství nedegradovaného materiálu, čehož může být dosaženo právě díky multiplikaci nádorové tkáně ve zvířecím modelu [7] s možnou identifikací proteinů sekretovaných nádorem do krevního řečiště.
Na druhou stranu úspěšnost tohoto přístupu není stoprocentní a v případně některých nádorových typů téměř nulová. V literatuře se jako problematická nádorová tkáň uvádějí karcinomy prostaty, gliomy a na základě naší studie se zdá, že i xenotransplantace karcinomů horního GIT se nevyznačuje vysokou úspěšností. Naproti tomu procento úspěšnosti graftingu pro kolorektální karcinom se pohybovalo ve výši, která je srovnatelná s obdobnými studiemi v zahraničí (40,9 %) [14]. Klíčovým parametrem pro úspěšný přenos nádorové tkáně do zvířete je viabilita nádorových buněk a jejich počet. Proces tumorgeneze je navíc provázen dalšími procesy (zánětlivá reakce, paraneoplastické metabolické syndromy), které ovlivňují jak grafting materiálu, tak i nespecificky stav séra a materiálu, který se výsledně používá pro hledání biomarkerů.
Mezi základní obtíže při zpracování kandidátních vzorků patří také klinický přístup k danému nádorovému onemocnění [5,15]. U nemocných s tumory jícnu je dle současného stupně poznání [16] ve většině případů doporučena neoadjuvantní chemoradioterapie, která může úspěšně dosáhnout regrese tumoru až do rozsahu kompletní patologické remise. Na druhou stranu je tímto přístupem buněčnost tkáně a vitalita vyizolovaných buněk významně snížena. Také změna v množství a typu stromatu s reaktivní fibrózou je dalším nepříznivým faktorem pro následující xenotransplantace, což negativně ovlivňuje použitelnost odebraných vzorků. Pro tumory žaludku a kardie [17] je nutno brát v úvahu plurigenotypický a plurifenotypický charakter onemocnění [18,19]. Z našich pilotních výsledků vyplývá vyšší úspěšnost zisku viabilních buněk z proximálních částí žaludku a z kardie, nenacházíme však významný rozdíl mezi difuzním a intestinálním typem tumoru žaludku [20]. Zde hraje významnou roli snížená soudržnost a infiltrace stromatu s vysokým podílem vazivové tkáně ve vzorku a možný vliv nekróz a negativního efektu žaludeční šťávy na zachování buněčné viability. U tumorů pankreatu [21,22] je obtížným již samotný odběr tumoru, zejména rozlišení jeho lokalizace i z důvodů časté přítomnosti perifokálních zánětlivých změn. Odběrem vzorku může též dojít k významnému znehodnocení preparátu s narušením radiálního okraje tumoru s dopadem na histologickou klasifikaci pokročilosti tumoru.
Mezi základní problémy při zpracování preparátu [23], které mohou vést k autolýze vzorků a jejich případné devitalizaci, patří nedostatečná zkušenost odebírajícího personálu (odběr nenádorové tkáně a nebo tkáně nekrotické, zjizvené, vaziva), použité nástroje (mechanická degradace vzorku, nevhodný způsob dezinfekce odběrových nástrojů v případě ex vivo odběru), transportní zdržení (způsobené přípravou média, jeho pozdním rozmražením, samotným transportem a s tím související rychlostí zpracování preparátu) a pochopitelně možný vliv zpracování preparátu v laboratoři [24], a to jak v posouzení případné degradace vzorku, viability nádorových buněk, tak i v nekvalitní dezintegraci nádorové tkáně a následné inokulaci buněk do zvířecího modelu [25,26].
Celkové hodnocení viability odebraných nádorových vzorků (137/104) odpovídá předpokládaným možnostem. Na základě testu nezávislosti, popřípadě testu ekvivalence proporcí se liší na 10% hladině významnosti podíl viabilních buněk mezi jednotlivými typy nádorů (největší je u nádorů kolorekta a kardie, nejnižší je u nádorů žaludku) a na 1% hladině významnosti jsme pozorovali závislost na velikosti nádoru (nejvíce u T=0, nejméně u T=4), kde ovšem není žádný jasný trend. Výsledky mohou být také značně ovlivněny malým počtem pozorování v některých podskupinách. U ostatních parametrů (G a N status, angioinvaze, lymfatická invaze, perineurální šíření) nejsou rozdíly ve viabilitě nádorových buněk statisticky významně odlišné.
V další fázi jsme hodnotili úspěšnost inokulace primárních nádorových buněk tumorů zažívacího traktu. Mezi 104 viabilními vzorky bylo 14 nádorových vzorků, které dále rostly na zvířeti a vytvořily PDX model. Pozorovali jsme statisticky významné rozdíly mezi jednotlivými skupinami, kdy nejvyšší úspěšnost byla v případě kolorektálního karcinomu (9 vzorků) a karcinomů žaludku (4 vzorky), přičemž vzorky ze střeva mají vyšší úspěšnost graftingu než nádory žaludku (9/22=41 % vs. 4/24=17 %) [27]. Nejúspěšnější grafting vykazovaly nádory s N = 0 (celkem 11, z toho 9 kolorektum, 1 žaludek) a gradingem 1 nebo 2. Skupinou, kterou jsme významně zvýšili úspěšnost xenotransplantace a rozšířili naše možnosti v další fázi při hledání biomarkerů, byly stabilizované tkáňové kultury karcinomů GIT.
Závěr
Tato studie poskytla základní informace k získávání materiálu z tumorů gastrointestinálního traktu za účelem xenotransplantace primární nádorové tkáně na myší SCID model se zhodnocením její úspěšnosti v závislosti na lokalitě a klinických a patologických vlastnostech tumoru. Pravděpodobnost zachování viability je závislá na komplexní sekvenci úkonů jak z hlediska klinika, tak i z hlediska laboratorního personálu a laboratorních postupů s vysokým stupněm koordinace dílčích kroků, zejména pro inokulaci na myší model. Takto multiplikovaný a připravený materiál je možné použít pro další omické analýzy vhodné k hledání biomarkerů.
Poděkování
Studie byla podpořena grantovým projektem IGA MZ ČR s registračním číslem NT 14282-3/2013.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Dušan Klos, Ph.D.
Dubany 212
798 12 Vrbátky
e-mail: dklos@seznam.cz
Sources
1. Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell 2011;144 : 646−74.
2. Tarazona N, Gambardella V, Huerta M, et al. Personalised treatment in gastric cancer: myth or reality? Curr Oncol Rep 2016;18 : 41.
3. Das V, Bruzzese F, Konečný P, et al. Pathophysiologically relevant in vitro tumor models for drug screening. Drug Discovery Today 2015;20 : 848−55.
4. Cho SY, Kang W, Han JY, et al. An Integrative approach to precision cancer medicine using patient-derived xenografts. Mol Cells 2016;39 : 77−86.
5. Chijiwa T, Kawai K, Noguchi A, et al. Establishment of patient-derived cancer xenografts in immunodeficient NOG mice. International Journal of Oncology 2015;47 : 61–70.
6. Van den Brink GR, Offerhaus GJ. The morphogenetic code and colon cancer development. Cancer Cell 2007;11 : 109–17.
7. Beer LA, Wang H, Tang H-Y, et al. Identification of multiple novel protein biomarkers shed by human serous ovarian tumors into the blood of immunocompromised mice and verified in patient sera. PLoS ONE 2013;8:e60129.
8. Grote T, Logsdon CD. Progress on molecular markers of pancreatic cancer. Curr Opin Gastroenterol 2007;23 : 508−14.
9. Harsha HC, Kandasamy K, Ranganathan P, et al. A compendium of potential biomarkers of pancreatic cancer. PLoS Med 2009; dostupný na: http://journals.plos.org/plosmedicine/article?id=10.1371/journal.pmed.1000046.
10. Koopmann J, Zhang Z, White N, et al. Serum diagnosis of pancreatic adenocarcinoma using surface-enhanced laser desorption and ionization mass spectrometry. Clin Cancer Res 2004;10 : 860−8.
11. Jones S, Zhang X, Parsons DW, et al. Core signaling pathways in human pancreatic cancers revealed by global genomic analyses. Science. Sep 26, 2008;321 : 1801–6.
12. Wilson, CJ, Zhan, H, Swint-Kruse, et al. The lactose repressor system: paradigms for regulation, allosteric behavior and protein folding. Cell Mol Life Sci 2007;64 : 3–16.
13. Vitkup D, Kharchenko P & Wagner A. Influence of metabolic network structure and function on enzyme evolution. Genome Biol 2006;7:R39.1–R39.9.
14. Julien S, Merino-Trigo A, Lacroix L, et al. Characterization of a large panel of patient-derived tumor xenografts representing the clinical heterogeneity of human colorectal cancer. Clin Cancer Res. 2012;18 : 5314−28.
15. Damhofer H, Ebbing EA, Steins A. Establishment of patient-derived xenograft models and cell lines for malignancies of the upper gastrointestinal tract. J Transl Med 2015;13 : 115.
16. Jang R, Darling G, Wong RK. Multimodality approaches for the curative treatment of esophageal cancer. J Nati Compr Canc Netw 2015;13 : 229−38.
17. Zhu Y, Tian T, Li Z, et al. Establishment and characterization of patient-derived tumor xenograft using gastroscopic biopsies in gastric cancer. Sci Rep 2015;5 : 8542.
18. Humphries JM, Penno MA, Weiland F, et al. Identification and validation of novel candidate protein biomarkers for the detection of human gastric cancer. Biochim Biophys Acta 2014;1844 : 1051−8.
19. Van Cutsem E, Sagaert X, Topal B, et al. Gastric cancer. Lancet 2016 dostupné na: http://dx.doi.org/10.1016/S0140-6736(16)30354-3
20. Choi YY,Lee JE, Kim H, et al. Establishment and characterisation of patient-derived xenografts as paraclinical models for gastric cancer. Sci Rep 2016;6, dostupný na: http://www.nature.com/articles/srep22172
21. Delitto D, Pham K, Vlada AC, et al. Patient-derived xenograft models for pancreatic adenocarcinoma demonstrate retention of tumor morphology through incorporation of murine stromal elements. Am J Pathol 2015;185 : 1297–1303.
22. Walters DM, Stokes JB, Adair SJ, et al. Clinical, molecular and genetic validation of a murine orthotopic xenograft model of pancreatic adenocarcinoma using fresh human specimens. PLoS One 2013;8: dostuný na: http://journals.plos.org/plosone/article?id=10.1371/journal.pone.0077065
23. Li J, Kil C, Considine K, et al. Intrinsic indicators for specimen degradation. Lab Invest 2013;93 : 242−53.
24. Ahmed FE. Sample preparation and fractionation for proteome analysis and cancer biomarker discovery by mass spectrometry. J Sep Sci 2009;32 : 771−98.
25. Mollo MR, Antonini D, Cirillo L, et al. Research techniques made simple: skin carcinogenesis models: xenotransplantation techniques. J Invest Dermatol 2016;136:e13−7.
26. Lee HJ, Lee EY, Kwon MS, et al. Biomarker discovery from the plasma proteome using multidimensional fractionation proteomics. Curr Opin Chem Biol 2006;10 : 42−9.
27. Dangles-Marie V, Pocard M, Richon S, et al. Establishment of human colon cancer cell lines from fresh tumors versus xenografts: comparison of success rate and cell line features. Cancer Res 2007;67 : 398−407.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2016 Issue 12-
All articles in this issue
- 10 let sleeve gastrectomy – tubulizace žaludku v České republice z hlediska operačního výkonu
- Transfer nádorových buněk mezi pacientem a laboratorním zvířetem jako základní metodický přístup ke studiu kancerogeneze a identifikace biomarkerů
- Proximální gastrektomie u selektovaných pacientů s adenokarcinomem gastroezofageální junkce, bezprostřední a dlouhodobé výsledky operační terapie
- Purtscher-like retinopatia ako komplikácia akútnej pankreatitídy
- Raritní případ obrovského adenomu příštítného tělíska
- Kvalita života u pacientů s Crohnovou chorobou po střevní resekci – první výsledky
- Castlemanova choroba - chirurgická léčba, kazuistiky
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Raritní případ obrovského adenomu příštítného tělíska
- 10 let sleeve gastrectomy – tubulizace žaludku v České republice z hlediska operačního výkonu
- Purtscher-like retinopatia ako komplikácia akútnej pankreatitídy
- Proximální gastrektomie u selektovaných pacientů s adenokarcinomem gastroezofageální junkce, bezprostřední a dlouhodobé výsledky operační terapie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

