-
Medical journals
- Career
Krvácení z pseudoaneuryzmatu a. hepatica po pankreatoduodenektomii řešené implantací stentgraftu
Authors: J. Pastor 1; R. Pádr 2
Authors‘ workplace: III. chirurgická klinika 1. LF UK a FN Motol, přednosta: prof. MUDr. R. Lischke, PhD. 1; Klinika zobrazovacích metod 2. LF UK a FN Motol, přednosta: doc. MUDr. M. Roček, CSc. 2
Published in: Rozhl. Chir., 2015, roč. 94, č. 6, s. 256-260.
Category: Case Report
Overview
Opožděné krvácení je jednou z možných komplikací pankreatoduodenektomie. Jeho léčba je operační nebo endovaskulární (embolizace, stentgraft). V naší kazuistice uvádíme případ pacienta s krvácením z pseudoaneuryzmatu a. hepatica v odstupu 3 měsíců od pankreatoduodenektomie provedené pro karcinom choledochu, které bylo řešeno zavedením stentgraftu.
Klíčová slova:
pankreatoduodenektomie – pooperační komplikace – krvácení – angiografie – stentgraftÚVOD
Letalita po pankreatoduodenektomii (PD) v průběhu posledních let klesá vlivem koncentrace těchto výkonů do specializovaných center, kde obnáší pod 5 %, nicméně morbidita, resp. % pooperačních komplikací se výrazněji nemění [1]. Jednou z nejzávažnějších komplikací po resekci pankreatu – ať už pro tumor, nebo chronickou pankreatitidu – je krvácení, často podmíněné pseudoaneuryzmatem (PSA) některé z přiléhajících viscerálních tepen. Krvácení po PD se vyskytuje v 3 – 7,6 % případů [2]. Možnosti jeho léčby jsou operační nebo endovaskulární (embolizace či zavedení stentgraftu).
KAZUISTIKA
70letý nemocný byl operován 24. 10. 2012 na naší klinice pro stenozující tumor distálního choledochu s obstrukčním ikterem. Pacient byl vyšetřován pro progredující ikterus, na ERCP popsána 15 mm dlouhá v.s. tumorózní stenóza proximálního choledochu těsně pod místem odstupu ductus cysticus (endosonograficky suspekce na cholangiogenní tumor – provedena biopsie, která byla vyhodnocena jako nízce diferencovaný adenokarcinom). Bylo provedeno PTC a zavedena zevně-vnitřní drenáž. Nemocný byl indikován k cefalické duodenopankreatektomii. Peroperačně byl zjištěn pozitivní resekční okraj choledochu, proto byl tento zkrácen o další 2 cm. V rekonstrukční fázi byla nejprve zaslepena první klička jejuna a byla na ni provedena pankreatiko-jejunoanastomosa end-to-side. Poté ve vzdálenosti cca 40 cm bylo jejunum předěleno, byla zkonstruována end-to-side entero-enteroanastomóza a na takto exkludovanou kličku byla pak napojena gastro-enteroanastomóza end-to-side. Hepatiko-jejunoanastomóza byla poté zkonstruována vzhledem k anatomickým poměrům na přívodnou kličku transponovanou k pankreatu end-to-side. Do podjaterní krajiny byl vložen drén.
Definitivní histologie prokázala adenoskvamózní karcinom choledochu pT2 pN1 M0. Pooperační průběh byl komplikován přechodnou biliózní sekrecí do drénu s pozitivním průkazem amylázy v sekretu (229 µkat/l). Bylo provedeno CT s negativním nálezem, laboratorní analýza neprokázala elevace zánětlivých markerů ani jaterních testů. Byl zvolen konzervativní postup, sekrece spontánně ustala, drén byl extrahován a nemocný byl 17. pooperační den propuštěn do domácího ošetřování.
Od začátku prosince 2012 měl nemocný opakované krvácení charakteru melény s kolapsovými stavy. Byl vyšetřen na spádovém pracovišti – gastroskopie negativní, kolonoskopie odhalila obsah tlustého střeva s tmavou krví, uzavřeno jako krvácení ze zdroje v tenkém střevě. Pacient byl následně přeložen k došetření na interní kliniku FNM. Zde se znovu dostavilo krvácení s koaguly ve stolici, hypotenze, pokles v krevním obraze (hemoglobin 58 g/l), a pacient byl proto přeložen na naši kliniku. Byla provedena CT-angiografie (CT-AG), která ukázala postkontrastně se sytící nejspíše PSA velikosti 27x18 mm pod průběhem hepatické tepny v místě odstupu a. gastroduodenalis (Obr. 1). Nemocný byl indikován k provedení digitální subtrakční angiografie (DSA) s pokusem o endovaskulární ošetření zdroje krvácení.
Image 1. Pseudoaneuryzma a. hepatica v místě odstupu a. gastroduodenalis (3D CT-AG) Fig. 1: Pseudoaneurysm of hepatic artery at the place where gastroduodenal artery arises (3D-CT AG) 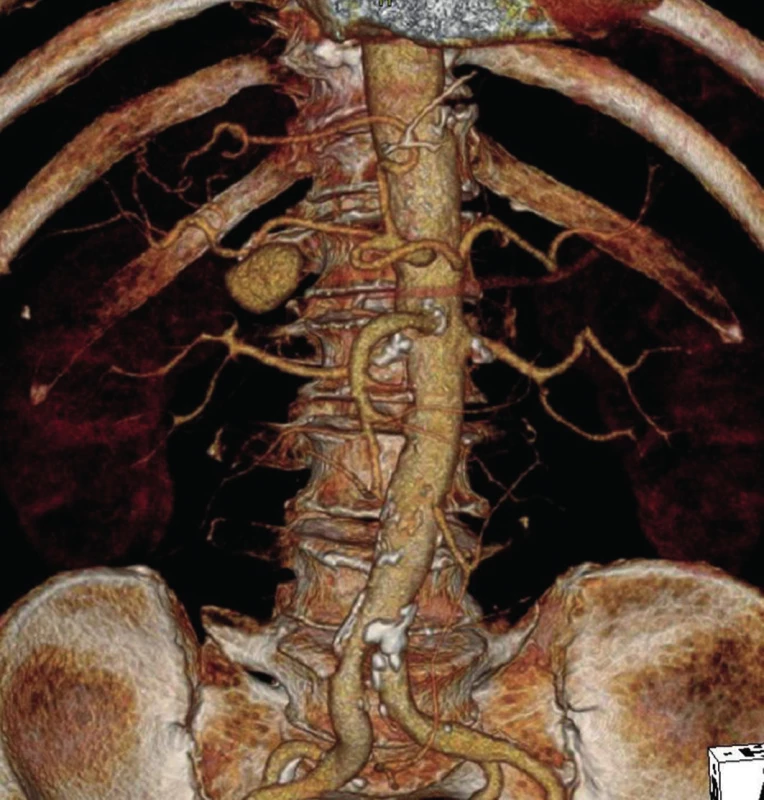
Přístupem přes pravou femorální tepnu byl zaveden 8F sheath typu Arrow do aorty. Následně byla provedena selektivní sondáž truncus coeliacus a angiografie. Ta jasně prokázala nález 3 cm velkého PSA (Obr. 2) v místě odstupu a. gastroduodenalis. Šíře a. hepatica communis i propria byla 4 mm a anatomické aktuální poměry nekomplikované, radiolog se rozhodl pro implantaci balonexpandibilního stentgraftu. Nejprve pronikl diagnostickým katétrem pomocí říditelného Terumo vodiče za odstup PSA do a. hepatica propria. Do této tepny následně přes diagnostický katétr umístil tuhý vodič COOK Superstif, po kterém zavedl 8F Arrow sheath za odstup PSA do a. hepatica propria. Poté implantoval přes odstup PSA balonexpandibilní stentgraft typu Jograft (Abott, Rangendingen, Germany) velikosti 4x28 mm nesený na balonkovém katétru Fox 4x40 mm. Tento stentgraft byl v místě PSA balonkovým katétrem rozvinut tak, že zakryl odstup PSA a přemostil jej (Obr. 3). Kontrolní angiografie po implantaci stentgraftu zobrazila plně průchodnou a. hepatica propria s jejími větvemi a s volně průchodným lumen stentgraftu bez známek plnění PSA (Obr. 4).
Image 2. AG nález pseudoaneuryzmatu a. hepatica Fig. 2: Angiographic finding of pseudoaneurysm of hepatic artery 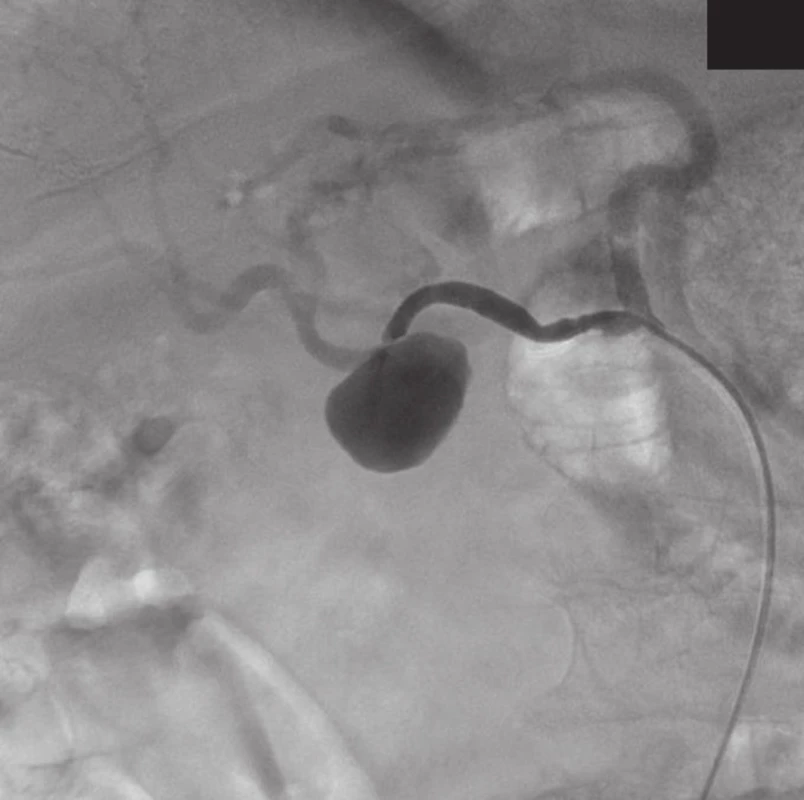
Image 3. Zavádění stentgraftu Fig. 3. Stentgraft introduction 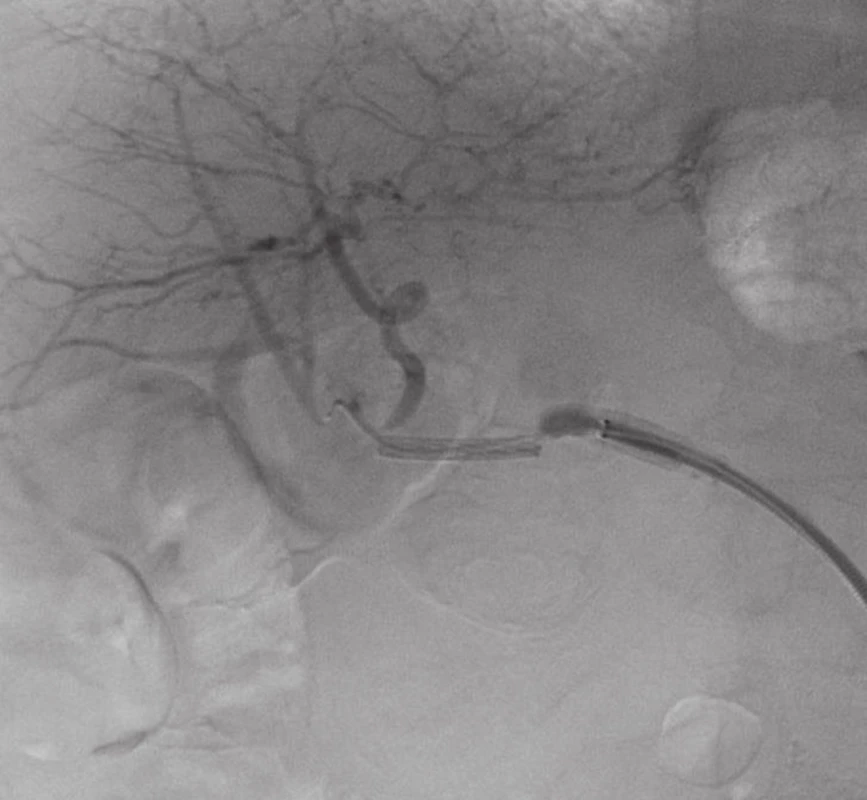
Image 4. AG po zavedení stentgraftu s vymizením leaku a dobrým průtokem skrze a. hepatica Fig. 4: Angiography after stentgrafting without leakage and good blood flow through hepatic artery 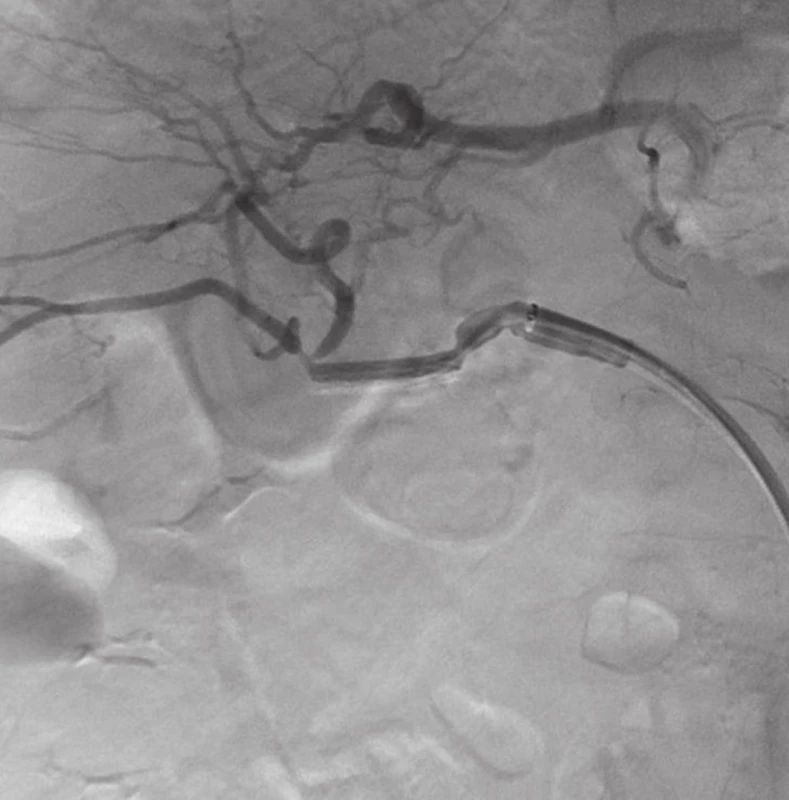
V průběhu příhody bylo podáno 5 jednotek erymasy a 3 jednotky mražené plazmy. Po zákroku byl pacient, bez recidivy krvácení, propuštěn.
V dubnu 2013 bylo při onkologické kontrole u pacienta zjištěno ložisko jater, jiným pracovištěm indikována a provedena perkutánní radiofrekvenční ablace (RFA) ložiska pod CT kontrolou. 5 dní po tomto výkonu se pacient dostavil na naši kliniku pro febrilie, CT ukázalo kolekci v místě RFA ošetřeného ložiska, pod CT byl zaveden drén odvádějící zakalenou tekutinu. Podán Sulperazon (cefoperazon/sulbaktam, Pfizer, Praha, ČR), následně došlo k poklesu teplot a zánětlivých markerů. Další průběh byl bez komplikací, drén byl extrahován a pacient propuštěn. Kontrolní CT s odstupem 6 týdnů od RFA ukázalo novou 13mm metastázu v játrech, pročež byla indikována paliativní chemoterapie Do února 2014 je pacient bez recidivy krvácení.
DISKUZE
Všeobecně akceptovaným dělením krvácení po resekcích pankreatu (PPH – postpancreatectomy hemorrhage) je klasifikace ISGPS (International Study Group of Pancreatic Surgery) – viz Tab. 1 [14]. Tato klasifikace je založena na třech parametrech – době vzniku krvácení, jeho lokalizaci a závažnosti.
Table 1. Klasifikace krvácení po pankreatektomii dle ISGPS [14] Tab. 1: ISGPS classification of postpancreatectomy hemorrhage [14] ![Klasifikace krvácení po pankreatektomii dle ISGPS [14]
Tab. 1: ISGPS classification of postpancreatectomy hemorrhage [14]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/759ddaea5093b7ebd6a934978f6605d6.png)
Četnost krvácení po PD se udává 3–7,6 % [2], na našem pracovišti jsme v roce 2012 provedli 18 cefalických a 8 distálních hemipankreatektomií, četnost krvácivých komplikací byla 3,85 %.
Krvácení jako komplikace po PD může být časné nebo pozdní. Příčinou časného bývá nedokonalá hemostáza v oblasti některé z anastomóz nebo sklouznutí ligatury z cévy. Takové krvácení vyžaduje okamžitou reoperaci s chirurgickým ošetřením zdroje krvácení. Pozdní krvácení bývá výsledkem ruptury PSA viscerální tepny (a. hepatica communis, propria, ramus dexter nebo sinister, a. lienalis, a. mesenterica superior) a za jeho příčinu se považují přímé cévní poranění během disekce a lymfadenektomie, aroze cév při píštěli pankreatické, biliární nebo střevní, tlak drénu na cévu a lokální infekce [3]. Predisponujícím faktorem jsou také předoperační aktinoterapie [4], zvláštní rizikovou skupinou jsou nemocní po transplantaci jater. V etiologii PSA viscerálních tepen se kromě operačních výkonů včetně laparoskopické cholecystektomie [5] uplatňují výkony perkutánní (biopsie jater) a endoskopické (ERCP), traumata a záněty (akutní či chronická pankreatitida). Prokázat přesnou etiologii krvácení nebývá dost dobře možné ani při operační revizi, tím méně pak při endovaskulárním ošetření. V případě námi prezentovaného pacienta svou roli mohla sehrát přechodná pankreatická píštěl, která ale zregredovala spontánně, a nebyl proto u ní indikován jiný léčebný postup než konzervativní (hodnotíme-li zpětně, zda nešlo zabránit vzniku PSA).
Krvácení z PSA může být do volné peritoneální dutiny, do retroperitonea nebo do dutého orgánu (střevo, žlučové cesty), vzácně vzniká arterio-portální píštěl. Klinickým projevem pak může být jak krvácení do GITu (melena), tak do volné břišní dutiny (hemoperitoneum, ev. odvod krve drénem). Většinou se jedná o akutní, život ohrožující stav s oběhovou nestabilitou, nutností objemové resuscitace, úpravou krevního obrazu a koagulace, souběžně probíhá diagnostika (endoskopie, CT-AG) a následně intervence (chirurgická nebo endovaskulární) [6].
Přístup k opožděným krvácením byl donedávna výhradně chirurgický, operace ovšem nese všechna rizika výkonu v křehkých tkáních s adhezemi, kde se zdroj krvácení hledá a ošetřuje velice obtížně. Výhodnou alternativu proto nabízejí metody intervenční radiologie – jde o AG s ošetřením krvácejícího PSA embolizací nebo přemostěním pomocí stentgraftu (první v literatuře publikovaný případ pochází z roku 2006 [4]).
Podstatou embolizace (koilingu) je implantace kovových embolizačních spirál (koilů) do lumen PSA. Je vhodná spíše pro PSA malé velikosti. Další možností je uzávěr přívodné tepny k PSA. To provádíme v případě, že patologický nález je na funkčně terminální tepně. Nalézá-li se patologická extraluminace na tepně, která má funkčně kolaterální zásobení periferie, je možné provést vyřazení PSA pomocí uzávěru – embolizací odvodné části tepny těsně za odstupem do PSA a těsně před dostupem do PSA.
V případě, že je nutné zachovat průtok hlavní funkční tepnou a umožňují-li to anatomické poměry, pak se doporučuje provést implantaci stentgraftu přes odstup poraněné tepny. Stentgraft je endovaskulární protéza kombinující vlastnosti nosného stentu s jeho pokrytím syntetickým nebo jiným nepropustným materiálem. Tak tvoří cévní protézu, která se zavádí endovaskulární cestou. Stentgrafty se dělí na balonexpandibilní (je nutné je rozvinout v místě patologické tepny pomocí balonkového katétru na potřebou šíři) a samoexpandibilní (díky konstrukčnímu materiálu se samy po vysunutí ze zavaděče rozvinou na potřebnou šíři). Indikace k použití těchto typů se částečně překrývají a závisejí hlavně na anatomických poměrech, typu patologie a volbě specialisty provádějícího výkon. Zavedení stentgraftu působí okluzi PSA a přitom zachovává průtok tepnou. Ideální pro implantaci stentgraftu jsou proximální léze s volnými úseky bez větvení v délce 5–10 mm před a za lézí a adekvátní kalibr tepny [3], obecně je zavedení stentu lepší u tepen většího průměru a většího krevního průtoku – a. hepatica má menší průměr, ale relativně vysoký průtok, podobně jako např. koronární tepny [6].
Ani tyto metody nejsou prosty komplikací – v případě embolizace se udává především okluze terminálního cévního řečiště s následnou ischemií a možností infektu infarzované části jater, v případě implantace stentgraftu pak jeho okluze, deformace či kinking a migrace kovového materiálu cévním řečištěm do trávicí trubice či žlučových cest a také riziko recidivy krvácení. Nebyl publikován případ infektu stentgraftu [7], vznik abscesu jater se dává do souvislosti s ischemií části jaterního parenchymu po embolizaci, v literatuře je udáván i případ abscesu levého laloku jater po implantaci stentgraftu, kdy jím bylo nutné přemostit i odstup levé větve a. hepatica propria [4]. V naší kazuistice šlo o absces v místě předchozí RFA jaterní metastázy, na kterou předchozí implantace stentgraftu vzhledem k jeho dobré průchodnosti zřejmě neměla vliv. V každém případě je metodou volby v léčbě pyogenních jaterních abscesů vzniklých po endovaskulárním ošetření PSA CT-navigovaná perkutánní drenáž pod clonou ATB.
Porovnáme-li uvedené možnosti, pak embolizace se ukazuje jako bezpečnější než operace [8], nese ovšem vyšší riziko recidivy krvácení a především ischemie koncového orgánu [9] s možností infekce a rozvoje abscesu. Nejmenší riziko těchto komplikací má zavedení stentgraftu [7, 10], které je rovněž metodou volby při vzniku arteriovenózní píštěle v portální oblasti [11].
Endovaskulární řešení se tak stalo metodou první volby na pracovištích s dostupným vybavením a zkušeným personálem, operační řešení (resekce PSA, ligace nebo resekce orgánu) pak bývá indikováno až při selhání radiointervečních metod. Morbidita i letalita jsou vyšší u operačního řešení, kdy představuje 5–25 %, [12] celková letalita při ruptuře viscerálního arteriálního PSA je udávána mezi 25–70 % [13].
V následném sledování průchodnosti stentgraftu se uplatňuje především duplexní UZ jako metoda neinvazivní a bez radiační zátěže [6], v případě našeho pacienta byly indikovány CT-kontroly vzhledem k onkologické diagnóze a popsanému vývoji základního onemocnění.
ZÁVĚR
Opožděné krvácení z PSA a. hepatica communis/propria je vzácnou, ale závažnou komplikací PD. Manifestuje se krvácením do GITu, případně do volné peritoneální dutiny či retroperitonea. Jeho léčba je možná operačně, nebo endovaskulárně embolizací či zavedením stentgraftu. V porovnání všech tří metod má nejnižší morbiditu a letalitu implantace stentgraftu, kterou lze na pracovištích s adekvátní výbavou považovat za metodu volby. Pacienty s touto komplikací je proto nutné směrovat do center, která disponují jak radiologickým komplementem schopným endovaskulárně ošetřit krvácení z viscerální tepny, tak zkušeným pankreatochirurgem.
Podpořeno projektem (Ministerstva zdravotnictví) koncepčního rozvoje výzkumné organizace 00064203 (FN MOTOL).
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Jan Pastor
III. Chirurgická klinika 1. LF UK a FN Motol
V Úvalu 84
150 00 Praha 5
e-mail: jan.pastor@fnmotol.cz
Sources
1. Jon B, Čečka F, Ferko A, et al. Naše zkušenosti s resekčními výkony na pankreatu. Retrospektivní analýza, Rozhledy v chirurgii 2008;87 : 195–9.
2. Schmidt CM Powell ES, Yiannoutsos CT, et al. Pancreatoduodenectomy. A 20-year experience in 516 patients. Arch Surg 2004;139 : 718−25.
3. Boufi M, Belmir H, Hartung O, et al. Emergency stent graft implantation for ruptured visceral artery pseudoaneurysm. Journal of Vascular Surgery 2011;53 : 1625−31.
4. Kaw LL., Jr, Saeed M, Brunson M, et al. Use of a stent graft for bleeding hepatic artery pseudoaneurysm following pancreatoduodenectomy, Asian Journal of Surgery 2006;29 : 283−6.
5. Schwarzmannová K, Poch T, Šimša J, et al. Pseudoaneurysma arteria hepatica manifestující se hemobilií jako komplikace laparoskopické cholecystektomie. Rozhledy v chirurgii 2008;87 : 360–3.
6. Hylton JR, Pevec WC. Succesful treatment of an iatrogenic right hepatic artery pseudoaneurysm and stenosis with a stent graft. Journal of Vascular Surgery 2009;51 : 1510−3.
7. Miller MT, Comerota AJ, Disalle R, et al. Endoluminal embolisation and revascularisation for complicated mesenteric pseudoaneurysm, a report of two cases and literature review. Journal of Vascular Surgery 2007;45 : 381−6.
8. Negi SS, Sachdev AK, Bhojwani R, et al. Experience of surgical management of pseudo-aneurysms of branches of the coeliac axis in a Norh Indan Hospital. Trop Grastorenterol 2002;23 : 97−100.
9. Salam TA, Lumsden AB, Martin LG, et al. Nonoperative management of visceral aneurysms and pseudoaneurysms, Am J. Surg 1992;164 : 215–9.
10. Larson RA, Solomon J, Carpenter JP. Stent graft repair of visceral artery aneurysms. Journal of Vascular Surgery 2002; 36 : 260−3.
11. Flum AS, Geiger JD, Gemmete JJ, et al. Management of a traumatic hepatic artery pseudoaneurysm and arteriovenous fistula with a combination of a stent graft and coil embolisation using flow control with ballon remodeling, Journal of Pediatric Surgery 2009;44 : 31−6.
12. Stanley JC, Wakefield TW, Graham LM, et al. Clinical importance and management of splanchnic artery aneurysms, Journal of Vascular Surgery 1986;3 : 836–40.
13. Reiter DA, Fischman AM, Shy BD. Hepatic artery pseudoaneurymsm rupture: A case report and review of the literature. The Journal of Emergency Medicine 2013,44 : 100−3.
14. Wente MN, Veit JA, Bassi C, et al. Postpancreatectomy hemorrhage (PPH)–An International Study Group of Pancreatic Surgery (ISGPS) definition. Surgery 2007;142 : 20−5.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2015 Issue 6-
All articles in this issue
- Individualizovaná medicína
- Operace v těhotenství pro náhlé příhody břišní z pohledu chirurga
- Současné standardy v péči o pacienty s břišní sepsí
- Nová metoda endovaskulární výplně výdutě aorty abdominální (endovascular aneurysm sealing − EVAS)
- Ganglioneurom, raritní příčina nádoru měkkých tkání krku v dospělosti
- Synchronní nádorové duplicity pankreatu a žaludku/ledviny a jejich léčba
- Krvácení z pseudoaneuryzmatu a. hepatica po pankreatoduodenektomii řešené implantací stentgraftu
- Polymorfismy NOD2/CARD15 genu a riziko reoperací u Crohnovy nemoci
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Operace v těhotenství pro náhlé příhody břišní z pohledu chirurga
- Současné standardy v péči o pacienty s břišní sepsí
- Ganglioneurom, raritní příčina nádoru měkkých tkání krku v dospělosti
- Nová metoda endovaskulární výplně výdutě aorty abdominální (endovascular aneurysm sealing − EVAS)
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

