-
Medical journals
- Career
Cévní protézy: 50 let vývoje od syntetických k tkáňovému inženýrství a buněčné terapii
Authors: J. Chlupáč 1,2,3; E. Filová 1,2; L. Bačáková 1,2
Authors‘ workplace: Oddělení růstu a diferenciace buněčných populací, Fyziologický ústav, Akademie věd ČR, v. v. i., Praha, Česká republika, přednostka: MUDr. Lucie Bačáková, CSc. 1; Centrum výzkumu chorob srdce a cév, Akademie věd ČR, v. v. i., Praha, Česká republika 2; Klinika transplantační chirurgie, Institut klinické a experimentální medicíny – IKEM, Praha, Česká republika, přednosta: prof. MUDr. Miloš Adamec, CSc. 3
Published in: Rozhl. Chir., 2010, roč. 89, č. 1, s. 85-94.
Category: Monothematic special - Original
Overview
Zlatý standard v syntetických cévních protézách již více než 50 let představují polyetylén tereftalát (PET, Dacron) a expandovaný polytetrafluoroetylén (ePTFE). Tyto polymery fungují dobře jako náhrady velkých cév, avšak jejich dlouhodobá průchodnost při náhradě cév o malém průměru (< 6 mm) je neuspokojivá. Pacientova vlastní tepna nebo žíla zůstává náhradou volby v koronární, bércové nebo obecně mikrovaskulární chirurgii. Příčinami selhávání cévních protéz jsou trombóza a porucha vhojení, spočívající v nedostatečném pokrytí endotelovými buňkami a v intimální hyperplazii, která vzniká díky nepoměru v poddajnosti a hemodynamické nerovnováze. V rámci výzkumu ideální nízkoprůměrové cévní náhrady došlo ke změně některých chirurgických postupů, vývoji nových biomateriálů a zejména k zavedení technologie buněčných a tkáňových kultur. Cévní náhrady připravené částečně nebo i kompletně metodami tkáňového inženýrství již prokázaly slibné výsledky v pokusném i klinickém hodnocení. Cílem tohoto sdělení je podat stručný přehled materiálů současně dostupných a testovaných jako cévní náhrady se zaměřením na buněčné interakce s biomateriály, techniky tkáňového inženýrství a vlastní zkušenosti autorů.
Klíčová slova:
cévní protéza – polyetylén tereftalát – polytetrafluoroetylén – polyuretan – endotelové buňky – tkáňové inženýrstvíÚVOD
Ateroskleróza je příčinou takřka poloviny úmrtí v Evropě. Ačkoli farmakologická a minimálně invazivní perkutánní léčba neustále rozšiřují své možnosti, koronární či periferní chirurgický bypass zůstává metodou volby u značné části pacientů [1] a ukázal se jako více „cost-effective“ než např. primární končetinová amputace. Syntetické cévní náhrady se implantují v případě chybějícího vlastního materiálu pacienta, avšak po více než půl století vývoje nejsou výsledky současně používaných cévních protéz optimální ve smyslu vhojování a tkáňové integrace.
Dlouhodobá průchodnost cévních protéz je uspokojivá při náhradě velkých cév (> 8 mm), kde je trombogenicita umělého materiálu překonána mohutným krevním proudem a pětiletá průchodnost např. aorto-ilických rekonstrukcí dosahuje 90 %. Mezi autologním a syntetickým materiálem není velký klinický rozdíl v případě náhrady kratších cév o středním průměru (6–8 mm) jako je karotická či společná stehenní tepna. Cévní protézy však dosahují horších výsledků při implantaci do oblasti o nízkém průměru nebo průtoku (< 6 mm), jako je tomu v koronárním, infrainguinálním a zejména bércovém řečišti. Pětiletá primární průchodnost proximálního femoro-popliteálního (F-P) bypassu pomocí ePTFE činí pouze 39 %, zatímco při užití autologní žilní náhrady stoupá na 74 %. Cévní náhrady a jejich klinické indikace jsou shrnuty v tabulce 1.
Table 1. Indikace a použití cévních náhrad podle anatomické lokalizace. ePTFE: expandovaný polytetrafluoroetylén, PU: polyuretan, TEBV: totally engineered blood vesel Tab. 1. Indications and use of vascular prostheses based on anatomical location. ePTFE: expanded polytetrafluoroethylene, PU: polyurethane, TEBV: totally engineered blood vessel 
Současně užívané cévní protézy selhávají jednak díky obecné tendenci ke tvorbě krevních sraženin na umělém povrchu a dále díky tzv. intimální hyperplazii (IH) lokalizované zejména v oblasti distální anastomózy. U lidí, na rozdíl od většiny zvířecích experimentálních modelů, zůstává vnitřní (krevní) povrch cévních protéz z velké většiny nepokrytý tkání, resp. endotelem. Etiologie IH, vznikající obvykle 2–24 měsíců po implantaci, je multifaktoriální a zahrnuje nepoměr poddajností (compliance mismatch) mezi relativně rigidní protézou a více elastickou tepnou, nepoměr jejich průměrů (diamater mismatch), chybějící zralé endotelové buňky (EB), chirurgické trauma cévní stěny a turbulence toku krve s následnými adaptačními změnami v subendotelové tkáni jako je proliferace a migrace hladkých svalových buněk (HSB) z médie do intimy a syntéza proteinů extracelulární matrix (ECM).
Výzkum nových biomateriálů a zejména metody tkáňového inženýrství jsou stále více zaváděny a bylo dosaženo slibných klinických výsledků s cévními náhradami, které jsou tzv. biohybridní nebo dokonce kompletně tkáňově konstruované [2]. Ideální cévní náhrada by měla být: mechanicky pevná a současně poddajná; netoxická; neimunogenní; biokompatibilní; komerčně dostupná v různých velikostech i pro akutní výkony; chirurgicky vhodná ve smyslu poddajnosti a retence stehů; netrombogenní; odolná k infekci; schopna tkáňové integrace, kompletního vhojení event. růstu při implantaci dětským pacientům a v neposlední řadě by náklady měly odpovídat užitku. V těchto ohledech byl výzkum v oblasti ideální cévní náhrady o malém průsvitu přirovnán k hledání Sv. Grálu [3].
Cílem tohoto přehledného sdělení je výčet vlastností současně užívaných cévních náhrad se zaměřením na buněčné reakce vůči biomateriálům, přístupy tkáňového inženýrství v cévní chirurgii a nastínění zkušeností autorů v tomto oboru.
HISTORICKÉ POZNÁMKY
Kromě významných pokroků v anestézii, asepsi, transfuzi, antibiotické léčbě, antikoagulaci a radiologii je historie cévní chirurgie úzce spjata s možností šití a náhrady poškozených cév. Ve starověku byly cévní intervence omezeny na zástavu krvácení pomocí komprese a popálení (např. rozžhavenou smůlou). V 15. století zavedl Ambrose Paré cévní podvaz, cévně-chirurgická léčba však začala až r. 1759, kdy Hallowell a Lambert skutečně zašili defekt pažní tepny. První cévní anastomózu provedl Nicholas Eck jako porto-kavální spojku u psa roku 1877. Carrel a Guthrie začátkem 20. století vylepšili techniky cévního stehu, transplantace a dokonce tkáňové kultury pro náhradu orgánů, načež Alexis Carrel obdržel Nobelovu cenu za fyziologii a medicínu v roce 1912.
Goyannes jako první použil autologní (vlastní) žilní štěp (v. poplitea) jako náhradu výdutě (aneuryzmatu) a. poplitea v roce 1906. F-P bypass pomocí reverzní safény poprvé provedl Kunlin v roce 1948, čímž započal úspěšnou éru tohoto štěpu trvající dodnes. Ve stejném období se začaly používat čerstvé tepenné allogenní štěpy (tkáně stejného živočišného druhu) za účelem lidské cévně-rekonstrukční chirurgie. Cévní protéza byla poprvé zavedena roku 1952 jako náhrada aorty u psa pomocí trubice vyrobené z materiálu Vinyon „N” a použití stejného materiálu k náhradě aneuryzmatu břišní aorty u člověka v roce1954 nastartovalo rychlý rozvoj cévní chirurgie a výzkum a použití cévních protéz.
SOUČASNĚ DOSTUPNÉ CÉVNÍ NÁHRADY
Tepenné cévní náhrady
Biologické cévní náhrady
Zlatým standardem cévních náhrad zůstává nativní, pacientova vlastní céva, která má přirozeně nejvíce fyziologických vlastností. V koronárním řečišti je to a. mammaria interna a a. radialis, které jsou nadřazeny také často užívanému štěpu v. saphena magna (VSM, saphenous vein graft, SVG) [4]. V případě periferního bypassu na dolní končetině (DK) je materiálem volby VSM. Po vnitřním odstranění chlopní valvulotomem může být našita in situ způsobem, vyživující vasa vasorum tak zůstanou intaktní a krevní tok je obrácen. Teoreticky tak dojde k zachování žádoucích vlastností endotelu, mnohé studie však neprokázaly nadřazenost tohoto postupu nad častěji užívaným ex vivo reverzním štěpem.
I přes dobré klinické výsledky podléhá SVG ateroskleróze a intimální hyperplazii, která se může vyskytovat po celé délce štěpu. Takřka 30–40 % pacientů nemá vhodnou VSM z důvodu předchozí flebitidy, exstirpace, varixů, hypoplazii nebo jiné anatomické příčině. Každý chirurgický odběr štěpu je také zákonitě spojen s nezanedbatelnou morbiditou v místě odběru.
Alternativní biologické cévní náhrady se používají jen ve vybraných indikacích a mnohdy s omezeným klinickým výsledkem: tepny, jako a. gastroepiploica dx. pro koronární bypass; žíly DK jako v. saphena parva, žíly horních končetin pro koronární či periferní bypass a hluboké žíly dolních končetin k náhradě infikované aortální protézy, viscerální revaskularizaci nebo dokonce k primárnímu bypassu DK.
Čerstvé nebo kryoprezervované lidské štěpy (homografty, lidské allografty ze zemřelých dárců) byly počátkem 60. let opuštěny z důvodu obtížného uchovávání, pozdních komplikací, tvorbě výdutí a také díky začínající éře syntetických cévních protéz. Jejich použití však bylo oživeno v indikacích jako je léčba infekce protézy v aortální pozici, primární bypass DK [5, 6] a současná nebo následná revaskularizace u transplantovaných pacientů. Ačkoli homografty nejsou používány rutinně, většinou v situacích ohrožení končetiny, reoperace nebo infekce, některé studie prokazují lepší průchodnost, např. prezervované pupeční žíly (odebrané z pupečníku novorozenců) ve srovnání s ePTFE [7].
S implantací heterograftů (xenograftů, tkáňových štěpů jiných živočišných druhů) [8] se setkáváme zejména ve studiích alternativních hemodialyzačních zkratů. I když bovinní karotická tepna se neukázala lepší než PTFE a decelularizovaný bovinní ureter byl implantován s neurčitými výsledky, tak např. glutaraldehydem ošetřená bovinní mezenteriální žíla poskytla štěp snižující počet infekcí, trombóz a reintervencí. Je důležité zmínit, že acelulární přirozená tkáň allogenního (lidského) nebo xenogenního (zvířecího) původu slouží jako podpora pro nasazení buněk v rámci cévního tkáňového inženýrství. Souhrn biologických cévních náhrad ukazuje tabulka 2.
Table 2. Klinicky používané biologické cévní náhrady. CABG: coronary artery bypass grafting, IMA: internal mammary artery, VSM: vena saphena magna Tab. 2. Clinically used biological vascular grafts. CABG: coronary artery bypass grafting, IMA: internal mammary artery, VSM: vena saphena magna 
Syntetické cévní náhrady
Již přes 50 let jsou syntetické cévní náhrady zastoupeny dvěma typy polymerů: 1. polyetylén tereftalát (PET), Terylén nebo Dacron, 2. polytetrafluoroetylén (PTFE), Teflon nebo Gore-Tex. Obě molekuly jsou vysoce krystalické a hydrofobní. Zevní povrch může být zpevněn přídatnými kroužky či spirálou jako prevence zalomení nebo komprese u dlouhých bypassů nebo rekonstrukcí překračujících více kloubů či střední čáru těla.
PET/Dacron, polyetylén tereftalát [-O-C=O-C6H4-O-C=O-CH2-CH2-] byl poprvé představen v Anglii v r. 1939, a dále vyvíjen a patentován jako Dacron firmou DuPont v roce 1950. Jedná se o termoplastický polymer z rodiny polyesterů užívaný ve formě syntetických vlákének kruhového průřezu spřadených do tlustších vláken, která mohou být utkána přes sebe (woven) nebo smyčkovitě spletena (knitted) (Obr. 1) jako látka tvořící trubici cévní náhrady. Vrapování (crimping) je technika nařasení povrchu zvyšující roztažitelnost a odolnost vůči zalomení. Porozita tohoto textilního materiálu se vyjadřuje jako propustnost (permeabilita) pro vodu a je vyšší u pletených protéz, které tudíž bývají impregnovány albuminem, kolagenem nebo želatinou, což snižuje propustnost (např. až na 0–5 ml H2O/cm2/min při 13 kPa) a umožňuje se vyhnout dříve používanému tzv. předsrážení krví. Podle typu látky zajišťující příčné vazby (cross-linking), nejčastěji formaldehyd nebo glutaraldehyd, dochází k degradaci albuminu za 2–8 týdnů po implantaci. I když kolagenní impregnace zvyšovala depozici krevních destiček a zpomalovala proces hojení u psů, prospektivní randomizované zkoušky s aorto-ilickou protézou nepotvrdily vyšší stimulaci koagulace než u konvenčního Dacronu. Nebyly prokázány rozdíly v klinické průchodnosti mezi pleteným a tkaným PET v aorto-ilické pozici. Je známa dlouhodobá tendence Dacronu k dilataci, ale přímá souvislost se závažnými komplikacemi a selháním náhrady je vzácná.
Image 1. Obraz PET (polyetylén tetraftalát) cévní protézy ve skenovacím elektronovém mikroskopu. NOVA nanoSEM 200, FEI, USA, měřítko = 300 μm 
Tkáňová reakce na cévní protézu začíná ihned po obnovení krevního průtoku. Rozhraní tkáň/protéza a krev/protéza představují vysoce komplexní mikroprostředí, ve kterém fyzikálně-chemické vlastnosti (povrchová energie, náboj, smáčivost nebo drsnost) mohou ovlivnit finální průchodnost. Prvním krokem typickým pro interakci jakéhokoli materiálu s krví je proces adsorpce a desorpce plazmatických proteinů (Vromanův efekt) s následnou depozicí krevních destiček, bílých a červených krvinek a event. adhezí, migrací a pokrytím buňkami (EB a HSB). Fibrinová depozita obsahující destičky a krevní buňky se tvoří během několika prvních hodin až dnů po implantaci a jsou stabilizována až do doby 18 měsíců do tzv. vnitřní kompaktní fibrinové vrstvy. Fibrin vyplňuje též volné prostory uvnitř protézy. Tato fibrinová pseudointima však zůstává zpravidla acelulární. Příležitostně, po asi 5 měsících, může dojít k prorůstání kapilár a fibroblastů do úzkých prostor intersticia pletené cévní protézy a k dosažení vnitřní fibrinové vrstvy. Na lidských explantátech byly nalezeny i malé ostrůvky endotelizace dále od anastomózy pleteného Dacronu. Fibrinová hmota zevně obklopující protézu je postupně osídlena makrofágy a granulační tkáň obsahující obrovské buňky cizích těles (foreign-body giant cells, FBGC) je obvyklým histologickým nálezem pod zevním pouzdrem pojivové tkáně. V případě pleteného Dacronu mohou být obdobné endotelové ostrůvky u člověka pozorovány jen zřídka. Zralá výstelka EB a dobře vyvinutá vrstva HSB je uvnitř cévní protézy popisována jen u zvířecích studiích a dá se připsat spíše rozsáhlejšímu vrůstání přes anastomózu než skutečnému vhojování přes stěnu protézy. Struktura tkaného a méně i pleteného Dacronu umožňuje jistý stupeň transmurálního vhojení, vnitřní vrstva kompaktního fibrinu však představuje bariéru, která i když je někdy dosažena vrůstajícím pojivem, tak kapiláry nejsou schopny napojení na spoře endotelizovaný krevní povrch cévní protézy [9].
PTFE, polytetrafluoroetylén (-CF2-CF2-) byl patentován v r. 1937 firmou Dupot jako Teflon a v r. 1969 firmou Gore jako Gore-Tex. ePTFE je expandovaný polymer vyrobený procesem zahřívání, natahování a vytlačování (extruze) za vzniku netextilní porézní trubice složené z nepravidelně uspořádaných pevných membrán (uzlů, nodes) a vlákének (fibrils). Molekula je biostabilní, povrch je elektronegativní, omezující reakce s krevními komponenty a porozita je popisována jako internodální vzdálenost (internoval distance, IND), většinou 30–90 μm. Reálně dostupné póry pro vhojování jsou však mnohem menší.
Na modelu primátů byla experimentálně stanovena optimální porozita jako IND = 60 μm (vysoce porézní) s ohledem na vhojování a endotelizaci 4mm ePTFE protéz a klinické zkoušky s vysoce porézním ePTFE sice prokázaly vrůstání kapilár, to ovšem nedosáhlo přes polovinu šíře stěny a už vůbec nevyústilo v endotelizaci. Lidská tkáňová odpověď na standardní nízce porézní ePTFE (IND ≤ 30 μm) je obdobná jako u Dacronu: v lumen nacházíme tenké fibrinové koagulum nebo amorfní materiál s destičkami bez jakékoli výstelky EB. Zevní kolagenní pouzdro se vytváří za 1–6 měsíců a penetruje materiál s minimální buněčnou infiltrací. Systematické hodnocení randomizovaných studií srovnávajících Dacron a ePTFE neprokázalo nadřazenost toho či onoho materiálu.
Polyuretany (PU) jsou velká rodina elastických polymerů obsahujících uretanovou skupinu [-NH-(CO)-O-]. Byly původně vyvinuty v Německu ve 30. letech, komercionalizovány firmou DuPont v r. 1962 a zavedeny do klinické praxe v průběhu 60. let. Jedná se o kopolymery složené ze 3 různých monomerů: krystalický (tvrdý) segment odpovídá za rigiditu a amorfní (měkký) segment naopak za flexibilitu, která tedy může být regulována výrobním procesem. Třetí monomer prodlužuje řetězec. Nevýhodou první generace PU na bázi polyesteru byla hydrolytická degradace vedoucí k přerušení klinického pokusu. Další generace PU na bázi polyéteru, odolná vůči hydrolýze avšak náchylnější k oxidaci, úspěšně prošla klinickým hodnocením jako hemodialyzační cévní přístup a obdržela schválení agenturou Food and Drug Administration (FDA) v r. 2000.
Poslední generace PU na bázi polykarbonátu je hydrolyticky i oxidačně stabilní a jako nízkoprůměrová cévní náhrada v krysím experimentu podporovala rychlejší luminální endotelizaci při snížené tvorbě IH ve srovnání s ePTFE. Po 36 měsících v aorto-ilické pozici u psa odhalila histologická analýza dobře vyvinutou neointimu pouze v distální anastomóze, minimální hydrolýzu amorfního segmentu a hlavně cévní protéza si časem uchovala svou poddajnost, což je jev nepozorovaný u Dacronu či ePTFE. Tato slibná zjištění podpořila zahájení Fáze I klinického pokusu.
Na základě mikrostruktury můžeme PU rozdělit na vláknité a pěnovité, oba typy však spíše postrádají komunikující prostory pro vrůstání kapilár. Po implantaci je krevní povrch vláknitého PU pokryt vrstvou fibrinu, která je tenčí než u Dacronu a vnější povrch je zapouzdřen jizevnatou tkání obsahující FBGC. Mikroporézní pěnovitý PU o velikosti pórů 15 μm dosahuje chudého vrůstání tkáně, zatímco se zvyšující se velikostí pórů až na 157 μm bylo u paviánů dosaženo snížení nežádoucí okolní zánětlivé reakce (FBGC) s prorůstáním kapilárních pupenů. Toto transmurální vhojování však bylo zpomaleno po dosažení denzní vnitřní fibrinové vrstvy, která je vtlačována zevnitř cévní náhrady do jejích pórů [10].
Ačkoli PU cévní náhrady vykazují řadu příznivých jevů, jako je např. přítomnost výstelky EB i při nepříznivých hemodynamických podmínkách, dobré vhojování, příznivé chirurgické vlastnosti a nízké krvácení ze stehů [11], další výzkum a ověření jsou nutné, neboť klinická cévní chirurgie zatím postrádá dostatečné zkušenosti a důkazy. Přehled syntetických cévních náhrad je uveden v tabulce 3.
Table 3. Klinicky používané syntetické cévní náhrady. ePTFE: expandovaný polytetrafluoroetylén, IND: internodal distance, PET: polyetylén tetraftalát Tab. 3. Clinically used synthetic vascular grafts. ePTFE: expanded polytetrafluoroethylene, IND: internodal distance, PET: polyethylene tetraphtalate 
Cévní náhrady s modifikovaným lumen
K potlačení trombogenicity syntetických materiálů bývají v lumen protézy připevněny různé chemické látky a antikoagulancia: časné studie prokázaly sníženou adhezi destiček k ePTFE potaženému uhlíkem, celková průchodnost však zlepšena nebyla. Dacron s navázaným heparinem měl o něco lepší průchodnost než nenavázaný ePTFE a ePTFE s připevněním heparinem prokázal lepší odolnost vůči trombóze i u lidí . Potažení 4mm ePTFE kombinací polyetylén glykol (PEG)-hirudin/iloprost snížilo IH a vedlo ke zlepšení průchodnosti protézy u prasete. Heparin vázaný jak na ePTFE tak i PU významně snižuje trombózu aortální protézy u krys a pokrytí dipyridamolem příznivě ovlivnilo průchodnost 5mm PU protéz ve zvířecích experimentech. Fibroblastový růstový faktor 1 (FGF-1) a heparin prohloubil kapilarizaci a endotelizaci aortální ePTFE protézy bez zvýšení IH u psů. Antitrombotická léčiva jsou samozřejmě rutinně systémově podávána pacientům s cévní chorobou s jednoznačně pozitivním vlivem na průchodnost cévních náhrad a obecně kardiovaskulární mortalitu.
Pro zvýšení odolnosti syntetických cévních protéz k infekci bylo např. antibiotikum rifampicicn navázáno na Dacron, ovšem bez vlivu na výskyt protetických infekcí, nicméně potažení Dacronu stříbrem (Silvergraft) nabízí rozumnou léčebnou alternativu při výměně infikované protézy [13].
Cévní náhrady kompozitní a s žilním interpozitem
V rámci úsilí o zlepšení nepříznivé hemodynamiky v anastomóze byly zavedeny alternativní chirurgické techniky a interpozice autologního žilního segmentu. Anastomóza mezi cévní protézou a výtokovou tepnou koncem ke konci (end-to-end) je teoreticky hemodynamicky příznivější variantou než koncem ke straně (end-to-side), klinické zkoušky však tuto výhodu nepotvrdily a navíc odhalily vyšší výskyt končetinových amputací po anastomóze end-to-end, pravděpodobně díky vyloučení kolaterálních cév [14]. Šicí materiál a technika může snížit nepoměr poddajnosti v anastomóze, např. aplikací jednotlivých stehů, pokračující cévní steh je však nejvíce používaným pro kratší operační čas a lepší hemostázu.
Vmezeření pacientovy žilní tkáně ve formě záplaty nebo manžety mezi protézu a tepnu snižuje rozdíl poddajnosti a zlepšuje průchodnost protézy. Techniky zavedené během 80. a 90. let zahrnují: Miller cuff, Linton patch, Taylor patch a St. Mary‘s boot [15].
Když je autologní žilní štěp příliš krátký, další přijatelné varianty zlepšující průchodnost jsou: kompozitní bypass – napojení protézy a žíly středovou anastomózou, sekvenční bypass – distální žilní bypass jako odbočka proximálního bypassu protézou a přemosťující štěp (bridge graft) – spojení 2 průchodných výtokových tepen krátkým žilním segmentem, na který je napojena přívodná protéza. I když založení přídatné arterio-venózní (AV) spojky a tím pádem zvýšení průtoku femoro-distálním (vedoucím pod kolenní štěrbinu) bypassem může působit jako prevence trombózy, rozličné studie neprokázaly výhody tohoto postupu.
Techniky žilních interpozitů jsou obecně účinné při lokalizaci distální anastomózy pod kolenním kloubem a jsou bezvýznamné v oblasti nad kolenem. Výchozím mechanismem je redukce nepoměru poddajnosti a potlačení IH. Tato zjištění vedla k vývoji speciálně formované ePTFE protézy, schopné lépe ovládat průtokové síly díky rozšíření hlavy anastomózy. Je zajímavé, že průchodnost těchto „manžetovaných“ ePTFE a uhlíkem potažených Distaflo ePTFE protéz je srovnatelná s žilními interpozity.
Biosyntetické / biohybridní cévní náhrady (biografty)
Zavedení biologických součástí do cévní náhrady zlepšuje její biokompatibilitu a živé EB jsou nejlepším antitrombogenním povrchem. Existují 3 způsoby endotelizace lumen cévní protézy in vivo po její implantaci: trans-anastomotická, přerůstáním z tepny, trans-murální, prorůstáním tkáně a kapilár stěnou protézy a hematogenní, osídlením cirkulujícími progenitorovými buňkami. Na rozdíl od zvířecích modelů však člověk stěží dosáhne spontánní endotelizace dále než 1–2 cm od anastomózy a trans-murálnímu vhojení brání nepříznivá struktura současně užívaných protéz [10].
Koncepce osazení (seeding) lumen protézy EB před její implantací byla dosažena v experimentu a následně tato autologní „transplantace” endotelu dokázala zlepšit průchodnost Dacronových protéz u pacientů-nekuřáků. EB mohou být odebrány z krátkého úseku podkožní žíly (např. v. saphena, v. cephalica, v. jugularis ext.) a ihned nasazeny na lumen cévní náhrady v rámci jedné operace. Výsledky prvních klinických zkoušek během 80. let byly neuspokojivé pro malý počet a hustotu buněk. Výkonnější techniky extrakce a retence EB a bohatší buněčné zdroje jako např. mikrovaskulární endotel tukové tkáně či omenta nakonec vylepšily výsledek této jednofázové metody nasazení.
Dvoufázová metoda zahrnuje časový interval (obvykle 2–4 týdny) mezi odběrem buněk a implantací. Navíc, vystavení EB in vitro podmínkám průtoku ještě před jejich zapojením do tepenné cirkulace zlepšuje jejich retenci díky navození strukturálních změn a adaptaci. Mechanické síly, kterým je endotelová výstelka v cévách vystavena zahrnují: hydrostatický tlak vyvinutý tlakem krve, střižné napětí (shear stress) vyvinuté třením krevního sloupce o cévní stěnu a dále cyklické podélné a příčné roztažení vyvinuté opakovanou distenzí cévy pod vlivem srdečního rytmu. Chronické laminární a nebo naopak turbulentní střižné napětí má na funkci EB a HSB největší vliv a reguluje jejich signální transdukci, prostorové uspořádání, sekreci molekul, organizaci cytoskeletu, genovou expresi, migraci, proliferaci a přežívání. Tyto pochody nakonec ovlivňují vznik trombózy či aterosklerózy a co je důležité, podobné jevy a změny buněčného fenotypu mohou být pozorovány i po buněčném osídlení biomateriálů.
První zkoušky dvoufázové metody in vitro endotelizace přinesly slibné výsledky a nedávno publikovaná celková pěti - a desetiletá průchodnost endotelizovaných, fibrinem potažených ePTFE F-P bypassů činí 69 % a 61 %. Již dříve byl tento postup správně považován za výplň mezery mezi protetickým a žilním štěpem. I když se příliš neužívá, prospěšnost osazení protézy ePTFE pomocí EB byla prokázána i v koronárním řečišti.
Další buněčné zdroje a techniky pro zlepšení adheze by samozřejmě zvýraznily zmíněný klinický úspěch. Cévní buňky jsou závislé na „ukotvení“ (anchorage-dependent) a jejich integrinové receptory adherují k povrchům prostřednictvím proteinů extracelulární matrix (ECM), které jsou adsorovány z kultivačního média in vitro nebo z krve in vivo [17]. Buněčná adheze k biomateriálům může tedy být regulována pokrytím proteiny ECM jako je např. kolagen, laminin nebo fibronektin, nebo dokonce kovalentním navázáním krátkých, peptidových adhezních sekvencí, které mohou být i specifické pro určitý buněčný typ, např. sekvence RGD (Arg-Gly-Asp). Fibrin, jako přirozený zprostředkovatel buněčné migrace a hojení ran hraje významnou roli i v tkáňovém inženýrství cévních náhrad. Jsou testovány i méně specifické fyzikální povrchové modifikace, neligandové technologie a nanostrukturované povrchy.
Jiný přístup ke zlepšení buněčného osídlení je použití progenitorových buněk. Buňky kostní dřeně kupř. zajistily kompletní endotelizaci psích aortálních ePTFE náhrad po dobu 6 měsíců. Endotelové progenitorové buňky (endothelial progenitor cells, EPC) byly izolovány z periferní krve i u člověka a na psím modelu bylo prokázáno, že část CD34+ buněk kostní dřeně (bone-marrow cells, BMC) může být mobilizována do cirkulace a osídlit povrch Dacronové protézy, a dále že předchozí nasazení BMC na Dacron urychlí časnou endotelizaci bez zvýšené trombogenicity. Díky vysoké proliferační kapacitě a diferenciačnímu potenciálu mohou být progenitorové a kmenové buňky důležitým buněčným zdrojem příštích let [18].
Ke konstrukci cévních náhrad je zvažováno též použití geneticky modifikovaných EB, které by zajistily lepší buněčné osídlení při eliminaci trombotických komplikací, např. zvýšenou produkcí tkáňového aktivátoru plazminogenu (t-PA), urokinázového aktivátoru (u-PA) nebo BMC transdukovaných k expresi endoteliální varianty syntetázy oxidu dusnatého (eNOS). Tyto postupy genetické modifikace však přirozeně naráží na řadu etických otázek. Konvenčním a eticky přijatelným postupem je použití látek s účinkem antikoagulačním, antiinflamačním nebo regulujícím růst buněk (IH) jako je např. heparin a heparinu podobné molekuly, hirudin, dipyridamol, růstové faktory jako cévní endotelový růstový faktor (VEGF) nebo fibroblastový růst. faktor (FGF), antimigrační či antiproliferační léky paclitaxel, sirolimus a inhibitory cyklin-dependentní kinázy 2 (CDK2 kinase). Takovéto látky mohou být přímo inkorporovány do stěny protézy nebo stentů vylučujících léky (DES), katetrů a perivaskulárních kroužků. Umělé materiály vylučující vazodilatační oxid dusnatý (NO) zahrnují syntetické polymery (např. polyuretan, PTFE) obsahující donory NO jako jsou diazeniumdioláty a S-nitrosothioly.
Živé, tkáňovým-inženýrstvím připravené cévní náhrady (TEBV)
Koncept kompletní, živé, biologické náhrady v sobě zahrnuje schopnosti růstu, remodelace, obnovování a reakce na dané prostředí. Podobně jako tepna, náhrada se skládá z funkční vrstvy EB (tunica intima) spočívající na metabolicky aktivních HSB (tunica media), majících kontraktilní, nikoli syntetický (aterogenní) fenotyp [19]. Štěp má také obsahovat dostatek kolagenu a elastinu pro žádoucí mechanické vlastnosti. Syntetický materiál by měl být vyloučen, neboť bývá náchylný ke chronické zánětlivé odpovědi a k infekci a nebo by měl být alespoň minimálně imunogenní či trombogenní, dostatečně poddajný a v ideálním případě degradabilní, poskytující jen dočasnou oporu pro regeneraci cévní tkáně, která ji časem nahradí vlastní matrix.
Cévní náhrada připravená výhradně tkáňovým inženýrstvím (totally-engineered blood vesel, TEBV) musí obsahovat 3 součásti: oporu (scaffold) poskytující prvotní tvar a pevnost, adhezní matrix a živé cévní buňky. Existují v zásadě 4 přístupy ke scaffoldu: permanentní syntetický (někdy nelze zcela vyloučit), přirozená acelulární tkáň, biodegradabilní polymery, a „non-scaffold“ technologie.
Historicky první pokus spočíval v osazení EB, HSB a fibroblastů do trubiček z kolagenního gelu, vyžadoval však zevní Dacronovou síťku jako mechanickou oporu. Příklady implantace cévních náhrad s použitím přirozené opory zahrnují nasazení lidských buněk na prasečí aortu zbavenou živých buněk (decelularizace) nebo na submukózu tenkého střeva (small intestinal submucosa, SIS). Nejčastěji užívaným biodegradabilním polymerem je kyselina polyglykolová (polyglycolic acid, PGA). EB a HSB nasazené a množené na PGA za podmínek průtoku vykázaly skvělé výsledky po implantaci do psů. Nasazením BMC na biodegradabilní scaffold byla vytvořena živá cévní náhrada, jejíž histologická analýza po implantaci do dolní duté žíly u psů prokázala schopnost BMC diferencovat jak směrem k EB tak i k HSB.
Technologie bez opory (non-scaffold, self-assembly), resp. cévní náhrada složená jenom z živých buněk, byla připravena např. obtočením a kultivací buněčných vrstev HSB a fibroblastů na PTFE mandrénu, po jehož odstranění byly do lumen nasazeny EB. Takový štěp jako první na světě praskl až při tlaku kolem 2 000 mm Hg, což je pevnost srovnatelná s lidskou tepnou, a navíc, krátkodobý pokus s implantací u psů prokázal vyhovující chirurgické vlastnosti. Jiný typ štěpu bez použití opory byl vyvinut vyvoláním zánětlivé reakce: silastiková trubička umístěná do peritoneální dutiny potkanů či králíků je po 2 týdnech pokryta vrstvami myofibroblastů, kolagenní hmotou a jednou zevní vrstvou mezotelových buněk. Po obrácení „na ruby“ se podobá cévě a jako náhrada karotidy nebo aorty udržela průchodnost i po 4 měsících.
Živá, biologická cévní náhrada, složená z BMC nasazených na biodegradabilním substrátu, byla poprvé implantována dětskému pacientovi s vrozenou cyanotickou srdeční vadou jako náhrada plicní tepny [20] a později u skupiny 42 pacientů bez známek komplikací vyplývajících z této náhrady. Dalšího klinického úspěchu bylo dosaženo metodou skládání a průtokové kultivace buněčných vrstev a tyto štěpy byly použity jako hemodialyzační cévní přístup u skupiny 10 pacientů [21]. Nedávná publikace uvádí jedno - a šestiměsíční průchodnosti 78 % a 60 %, které odpovídají uznávaným kritériím u vysoce rizikových pacientů. Souhrn kompozitních, biohybridních a inženýrsky připravených cévních náhrad je uveden v tabulce 4.
Table 4. Kompozitní, biosyntetické a kompletně tkáňově inženýrsky připravené cévní náhrady používané v experimentu i v klinice Tab. 4. Composite, biosynthetic and completely tissue-engineered vascular grafts, in clinical and experimental use 
Žilní cévní náhrady
Na rozdíl od tepen bývá zapotřebí nahrazovat spíš centrální žíly o větším průsvitu, jako je dolní dutá žíla (DDŽ), horní dutá žíla (HDŽ) nebo žíly iliko-femorální [22]. Nejlepších výsledků dosahují autologní štěpy typu v. femoralis superficialis, v. jugularis interna, v. renalis l.sin. a zejména zlatý standard, který představuje kompozitní, spirální žilní štěp z VSM užívaný např. k rekonstrukci HDŽ pro iatrogenní, katétrem vyvolaný trombotický uzávěr. Na druhou stranu, opakovaná perkutánní transluminální angioplastika (PTA) dosahuje podobných výsledků jako operativní rekonstrukce. Žilní allogenní homografty, ať už čerstvé nebo kryoprezervované, byly rovněž použity jako žilní náhrady v experimentu i v klinice. V oblasti žil mají ePTFE cévní protézy se zevní výztuhou lepší průchodnosti nežli bez ní, nicméně použití syntetických náhrad bývá omezeno nízkoprůtokovou trombogenicitou a mikrobiální kontaminací, jako např. při cévních traumatech nebo náhradě v. portae u resekcí pankreatu. Průchodnost žilních rekonstrukcí může být podpořena přídatnou arterio-venózní spojkou.
Hemodialyzační cévní přístupy
Nativní arterio-venózní spojka (AVF) je optimální, nicméně pacienti s vyčerpaným žilním přístupem musí dostat protetickou AVF, která má poskytnout dostatečný průtok a vydržet opakované punkce. Ve spleti biologických a protetických AVF je obtížné najít ideální přístup, randomizované studie však naznačují, že ePTFE s manžetou a „časné“ (early access) PU protézy nabízí bezpečnou alternativu. Biologické a semibiologické štěpy mají v určitých ohledech lepší výsledky, nežli čistě syntetické protézy [23].
ZKUŠENOSTI AUTORŮ
Statické experimenty, tedy bez průtoku kultivačního média, jsou v naší tkáňové laboratoři prováděny za účelem posouzení cílené buněčné kolonizace různých biomateriálů. Klinicky užívané PET cévní protézy (VÚP, Výzkumný ústav pletařský Brno) (Obr. 1) byly např. impregnovány biodegradabilními polyesterovými polymery k vytvoření „pozadí“ pro další modifikaci pomocí multivrstev adhezních proteinů, jako je kolagen, fibronektin, laminin a zejména fibrin, který může být potencionálně získán z pacientovi krve. Za účelem cévního tkáňového inženýrství byla posuzována adheze a růst zvířecích EB a HSB (Obr. 2). Výzkumná práce v oblasti fibrinových povrchů vyústila ve společný patent.
Image 2. Konfluentní vrstva endotelových buněk bovinní linie CPAE 7. den po nasazení na PET cévní protéze (VÚP, Brno, ČR) modifikované vrstvou kolagenu a fibrinu. Zelená: cytoskelet, červená: buněčná jádra. Konfokální mikroskop Leica TCS SP2 AOBS, 60x1 μm, zvětšení 10x, nasazeno 50x10<sup>3</sup> buněk/cm<sup>2</sup>, primární protilátka anti ß-aktin 1:400 (Sigma), sekundární protilátka Alexa Fluor 488 2 mg/ml (Invitrogen), Propidium Iodid 5 μg/mL 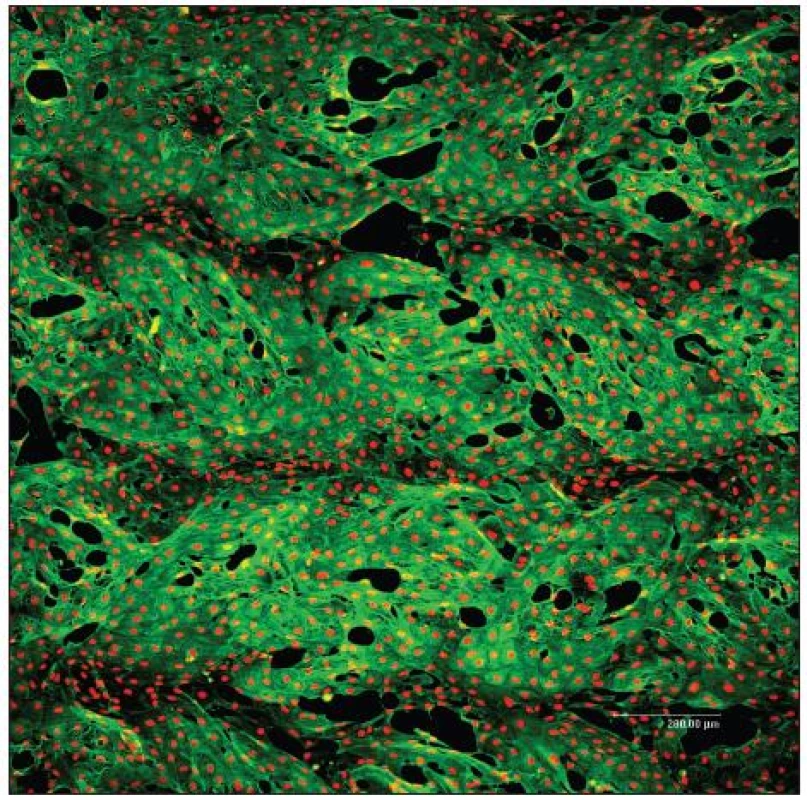
Dynamické experimenty za podmínek definovaného průtoku média lépe napodobují podmínky in vivo. Dacronové cévní protézy byly modifikovány proteiny ECM, kolonizovány lidskými EB odebranými z pacientů a vystaveny průtoku média. Na analogických planárních vzorcích byla rovněž stanovena genová exprese endotelu v závislosti na podkladu. Hybridní cévní konstrukty in vitro osazené autologními EB a připravené podmínkami bioreaktoru (Provitro Comp., Berlín, Německo) jsou v současné době testovány na prasečím modelu.
ZÁVĚR
Cévní chirurgie ve formě bypassu dolních končetin zůstává standardní metodou léčby pokročilé a víceetážové formy aterosklerózy. Za posledních 50 let nebyla vyvinuta syntetická alternativa dosahující dlouhodobé průchodnosti autologních cévních náhrad, které sice představují zlatý standard, avšak jako nativní materiál jsou často nedostupné. K překonání těchto problémů jsou do praxe zaváděny modifikace lumen, interpozice žilních segmentů a zejména metody tkáňového inženýrství cév o malém průsvitu. Pomocí materiálového výzkumu, komplexní tkáňové kultivace a technologie nasazování buněk byly připraveny biohybridní a kompletně inženýrsky konstruované cévní náhrady. Výsledky experimentálního i klinického výzkumu se zdají slibné a buněčná terapie se může stát častou léčebnou možností v cévní a endovaskulární chirurgii příštích desetiletí.
Seznam zkratek
a. arteria AVF arteriovenózní fistula BKD buňky kostní dřeně BMC bone-marrow cells CD cluster of differentiation molecule CDK2 cyklin dependentní kináza 2 DDŽ dolní dutá žíla DES drug eluting stent DK dolní končetina EB endotelové buňky ECM extracelulární matrix eNOS endotelová syntáza NO EPC endothelial progenitor cells ePTFE expandovaný PTFE FBGC foreign body giant cells FGF-1 fibroblast growth factor 1 FDA Food and Drug Administration F-P femoro-popliteální HDŽ horní dutá žíla HSB hladké svalové buňky IH intimální hyperplazie IMA internal mammary artery IND internodal distance NO oxid dusnatý PEG polyethylén glykol PET polyethylene terephtalate PGA polyglycolic acid PTA perkutánní transluminální PTFE polyetylén tereftalát PU polyuretan RGD Arg-Gly-Asp sekvence SIS small intestinal submucosa SVG saphenous vein graft TEBV totally engineered blood vesel t-PA tkáňový aktivátor plazminogenu u-PA urokinázový aktivátor plazminogenu v. vena VEGF vascular endothelial growth factor VSM vena saphena magna VSMC vascular smooth muscle cells MUDr. Jaroslav Chlupáč
Klinika Transplantační Chirurgie
Institut Klinické a Experimentální Medicíny
Vídeňská 1958/9
140 21 Praha 4 - Krč
e-mail: jacu@medicon.cz
Sources
1. Norgren, L., Hiáty, W.R., Normandy, J. A., et al. TASC II Working Group. Inter-Society Consensus for the Management of Peripheral Arterial Disease (TASC II). J. Vasc. Surg., 2007; 45 Suppl S: S5–67.
2. Isenberg, B. C., Williams, C., Tranquillo, R. T. Small-diameter artificial arteries engineered in vitro. Review. Circ. Res., 2006; 98(1): 25–35.
3. Kakisis, J. D., Liapis, C. D., Breuer, C., Sumpio, B. E. Artificial blood vessel: the Holy Grail of peripheral vascular surgery. J. Vasc. Surg., 2005; 41(2): 349–354.
4. Cooper, G. J., Underwood, M. J., Deverall, P. B. Arterial and venous conduits for coronary artery bypass. Eur. J. Cardiothorac. Surg., 1996; 10 : 129–140.
5. Dardik, H., Wengerter, K., Qin, F., et al. Comparative decades of experience with glutaraldehyde-tanned human umbilical cord vein graft for lower limb revascularization: an analysis of 1275 cases. J. Vasc. Surg., 2002; 35(1): 64–71.
6. Fahner, P. J., Idu, M. M., van Gulik, T. M., Legemate, D. A. Systematic review of preservation methods and clinical outcome of infrainguinal vascular allografts. J. Vasc. Surg., 2006; 44(3): 518–524.
7. Johnson, W. C., Lee, K. K. A comparative evaluation of polytetrafluoroethylene, umbilical vein, and saphenous vein bypass grafts for femoral-popliteal above-knee revascularization: a prospective randomized Department of Veterans Affairs cooperative study. J. Vasc. Surg., 2000; 32(2): 268–277.
8. Schmidt, C. E., Baier, J. M. Acellular vascular tissues: natural biomaterials for tissue repair and tissue engineering. Biomaterials, 2000; 21(22): 2215–2231.
9. Xue, L., Greisler, H. P. Biomaterials in the development and future of vascular grafts. J. Vasc. Surg., 2003; 37(2): 472–480.
10. Zilla, P., Bezuidenhout, D., Human, P. Prosthetic vascular grafts: wrong models, wrong questions and no healing. Biomaterials, 2007; 28(34): 5009–5027.
11. Tiwari, A., Salacinski, H., Seifalian, A. M., Hamilton, G. New prostheses for use in bypass grafts with special emphasis on polyurethanes. Cardiovasc. Surg., 2002; 10(3): 191–197.
12. Bosiers, M., Deloose, K., Verbist, J., et al. Heparin-bonded expanded polytetrafluoroethylene vascular graft for femoropopliteal and femorocrural bypass grafting: 1-year results. J. Vasc. Surg., 2006;43(2): 313–318.
13. Mirzaie, M., Schmitto, J. D., Tirilomis, T., et al. Surgical management of vascular graft infection in severely ill patients by partial resection of the infected prosthesis. Eur. J. Vasc. Endovasc. Surg., 2007; 33(5): 610–613.
14. Schouten, O., Hoedt, M. T., Wittens, C. H., et al. VASCAN Study Group. End-to-end versus end-to-side distal anastomosis in femoropopliteal bypasses; results of a randomized multicenter trial. Eur. J. Vasc. Endovasc. Surg., 2005; 29(5): 457–462.
15. Moawad, J., Gagne, P. Adjuncts to improve patency of infrainguinal prosthetic bypass grafts. Vasc. Endovascular Surg., 2003; 37(6): 381–386.
16. Panneton, J. M., Hollier, L. H., Hofer, J. M. Multicenter randomized prospective trial comparing a pre-cuffed polytetrafluoroethylene graft to a vein cuffed polytetrafluoroethylene graft for infragenicular arterial bypass. Ann. Vasc. Surg., 2004; 18(2): 199–206.
17. Bačáková, L., Filová, E., Rypáček, F., Švorčík, V., Starý, V. Cell adhesion on artificial materials for tissue engineering. Physiol Res., 2004; 53 Suppl 1: S35–45.
18. Riha, G. M., Lin, P. H., Lumsden, A. B., et al. Review: application of stem cells for vascular tissue engineering. Tissue Eng., 2005; 11(9–10): 1535–1552.
19. Muto, A., Fitzgerald, T. N., Pimiento, J. M., et al. Smooth muscle cell signal transduction: implications of vascular biology for vascular surgeons. J. Vasc. Surg., 2007; 45 Suppl A: A15–24.
20. Shin’oka, T., Omak, Y., Ikada, Y. Transplantation of a tissue-engineered pulmonary artery. N. Engl. J. Med., 2001; 344(7): 532–533.
21. L’Heureux, N., McAllister, T. N., de la Fuente, L. M. Tissue-engineered blood vessel for adult arterial revascularization. N. Engl. J. Med., 2007; 357(14): 1451–1453.
22. Kalra, M., Gloviczki, P., Andrews, J. C., et al. Open surgical and endovascular treatment of superior vena cava syndrome caused by nonmalignant disease. J. Vasc. Surg., 2003; 38(2): 215–223.
23. Scott, E. C., Glickman, M. H. Conduits for hemodialysis access. Semin. Vasc. Surg., 2007; 20(3): 158–163.
24. Chlupáč, J., Filová, E., Riedel, T., et al. Endothelial Cells on PET Vascular Prostheses Impregnated with Polyester-based Copolymers and Coated with Cell-adhesive Protein Assemblies. Engineering of Biomaterials, 2008; (81–84): 108–111.
25. L’Heureux, N., Dusserre, N., Marini, A., et al. Technology insight: the evolution of tissue-engineered vascular grafts-from research to clinical practice. Nat. Clin. Pract. Cardiovasc. Med., 2007; 4(7): 389–395.
26. Bordenave, L., Menu, P., Baquey. C. Developments towards tissue-engineered, small-diameter arterial substitutes. Expert Rev. Med. Devices, 2008; 5(3): 337–347.
27. Nezić, D. G., Knezević, A. M., Milojević, P. S., et al. The fate of the radial artery conduit in coronary artery bypass grafting surgery. Eur. J. Cardiothorac. Surg., 2006; 30(2): 341–346.
28. Nishibe, T., Kondo, Y., Muto, A., Dardik, A. Optimal prosthetic graft design for small diameter vascular grafts. Vascular., 2007; 15(6): 356–360.
29. Seifalian, A. M., Tiwari, A., Hamilton, G., Salacinski, H. J. Improving the clinical patency of prosthetic vascular and coronary bypass grafts: the role of seeding and tissue engineering. Artif. Organs, 2002; 26(4): 307–320.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2010 Issue 1-
All articles in this issue
- Klinické zkušenosti s použitím chladem konzervovaných žilních a tepenných alloštěpů: dlouhodobé výsledky
- Pedální bypass – desetileté zkušenosti
- Vícenásobná sekvenční revaskularizace infrapopliteálních tepen při záchraně kriticky ischemické končetiny
- Úspešné kombinované riešenie aneuryzmy aberantnej retroezofageálne prebiehajúcej arteria subclavia dextra (arteria lusoria). Kazuistika
- Výsledky kombinované chirurgické a endovaskulární léčby žilního thoracic outlet syndromu v letech 2000 – 2007 na II. chirurgické klinice VFN a 1. LF UK v Praze
- Chronická žilní insuficience a možnosti moderní chirurgické léčby v oblasti povrchního systému
- Infekce av spojky k hemodialýze založené ePTFE interponátem. Léčba na základě zkušeností nebo podle nálezů moderních vyšetřovacích metod?
- Cévní protézy: 50 let vývoje od syntetických k tkáňovému inženýrství a buněčné terapii
- Operace na vnitřních karotidách v lokoregionální anestezii na chirurgické klinice v Plzni za uplynulých 7 let. Diskuse nad AHA a ESVS guidelines
- Hybridní výkony v léčbě torakoabdominálních výdutí typu IV, V
- Prevence endoleaku II. typu pomocí peroperačního coilingu vaku aneuryzmatu abdominální aorty během implantace stentgraftu
- Případ kombinace endoleaku Ib a IIIa typu po zavedení stentgraftu pro subrenální výduť aorty
- Současné možnosti roboticky asistované cévní chirurgie
- Příspěvek k diagnostice infekce cévní protézy
- Autogenní vena femoralis superficialis jako náhrada infikované aorto-iliako-femorální cévní protézy
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Cévní protézy: 50 let vývoje od syntetických k tkáňovému inženýrství a buněčné terapii
- Úspešné kombinované riešenie aneuryzmy aberantnej retroezofageálne prebiehajúcej arteria subclavia dextra (arteria lusoria). Kazuistika
- Chronická žilní insuficience a možnosti moderní chirurgické léčby v oblasti povrchního systému
- Pedální bypass – desetileté zkušenosti
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

