-
Medical journals
- Career
Antimikrobní léčba u komplikované nitrobřišní infekce – současný stav
Authors: F. Vyhnánek
Authors‘ workplace: Chirurgická klinika 3. LF UK, Praha
Published in: Rozhl. Chir., 2009, roč. 88, č. 4, s. 206-213.
Category: Monothematic special - Original
Overview
Nitrobřišní infekce se odlišuje od ostatních infekcí šíří rozmanitosti a závažnosti, etiologií, která je často polymikrobiální, mikrobiologickými výsledky, které lze obtížně interpretovat a esenciální rolí chirurgické intervence. Nitrobřišní infekce jsou často příčinou morbidity a úmrtnosti. Prognóza je významně ovlivněna včasnou a přesnou diagnózou a vhodnou chirurgickou nebo radiologickou intervencí a správně načasovanou účinnou antimikrobní léčbou. Výběr antibiotik je nejen volbou mezi staršími nebo novějšími nebo mezi monoterapií a kombinací antibiotik, ale závisí na klinickém stavu nemocného, spektru účinnosti, načasování a trvání léčby, na dávce a frekvenci aplikace antimikrobních léčiv. Kromě toho antimikrobní léčiva by měla být používána pečlivě s cílem vyvarovat se anebo zabránit rozvoj antimikrobní rezistence. Nevhodný výběr antimkrobních léků při iniciální empirické léčbě vede k recidivě infekce, chirurgické reintervenci a prodloužení doby hospitalizace a dokonce i úmrtnost je závislá na vhodnosti časné empirické léčby.
Klíčová slova:
nitrobřišní infekce – antimikrobní léčba – empirická a cílená léčbaÚVOD
Nitrobřišní infekce je častou příčinou morbidity u chirurgického nemocného. Prognóza značně závisí na stupni intraperitoneální kontaminace, závažnosti vlastního onemocnění, obranyschopnosti nemocného a doprovázející orgánové dysfunkce [1, 2, 3]. Úmrtnost je uváděna v rozmezí < 1 % až > 60 % [1, 4]. Nitrobřišní infekce se odlišuje od jiných infekcí širokou rozmanitostí příčin a závažností, jejichž etiologie je často polymikrobiální, mikrobiologickými výsledky, které lze obtížně interpretovat a esenciální rolí chirurgické intervence [1]. Etiologie těchto infekcí může být velmi variabilní a obvykle zahrnuje mikroby generované z trávicí trubice [2, 5]. U komunitních získaných nitrobřišních infekcí převažují Enterobacteriaceae (většinou Escherichia coli) v kombinaci s anaeroby (většinou s Bacteroides fragilit). K nozokominálním nitrobřišním infekcím, které jsou patogenem zánětlivých komplikací abdominální chirurgie, se řadí Pseudomonas aeruginosa, Acinetobacter baumannii, Staphylococcus aureus, Enterococcus spp. a Candida spp. (Tab. 1). Mikrobiologického vyšetření nitrobřišní infekce je komplexní a má relevantní roli zvláště v některých situacích (výskyt cizích těles, potencionální přítomnost rezistentních nebo neznámých patogenů, nozokomiální infekce u nemocných s rizikovými faktory). Aktuální znalost resistence patogenních bakterií je zásadním požadavkem pro volbu empirické antimikrobní terapie nitrobřišní infekce [1, 4, 6, 7]. Rezistence postihující všechny velké skupiny antimikrobních farmak rezultuje v komplexní rezistenci fenotypů, proti kterým je účinný jen velmi limitovaný počet antimikrobních léků [6, 7, 8]. Z klinického hlediska lze rozlišit dva hlavní typy nitrobřišních infekcí: nekomplikovanou a komplikovanou [1]. U nekomplikované nitrobřišní infekce postihuje infekční proces jen jednotlivý orgán bez známek porušení jeho anatomické struktury. Obecně, u nemocného s touto infekcí může být v léčbě indikována jen chirurgická intervence s perioperační antimikrobní profylaxí. U komplikované nitrobřišní infekce, kde infekční proces postihuje kromě orgánu, který je zdrojem, i okolí se vznikem ohraničení peritonitidy, nebo nitrobřišního abscesu, a nebo difuzní peritonitidy. Zejména komplikované nitrobřišní infekce jsou důležitou příčinou signifikantní morbidity a častěji jsou spojeny se špatnou prognózou. Nicméně časná klinická diagnóza, následovaná adekvátní sanací zdroje infekce se zabráněním pokračující kontaminace a obnovou anatomické struktury a fyziologické funkce, stejně tak i okamžité zahájení vhodné empirické antimikrobní léčby, může limitovat sdruženou úmrtnost. Největší výzvou spojenou s komplikovanou nitrobřišní infekcí je její časné rozpoznání [1, 4]. Antimikrobní postup postihující gram-negativní aerobní a anaerobní střevní patogeny je obecně standardizován a řada režimů, buď v monoterapii nebo v kombinační léčbě, prokázala jejich účinnost [2, 7, 9]. Přesto je důležité pro výběr antimikrobních farmak znát místní epidemiologickou situaci a aktuální citlivost patogenů nitrobřišních infekcí. Iniciální empirická antimikrobní léčba by měla zahrnovat:
- Volbu antibiotika účinného proti polymikrobiální infekci (aerobní gram-negativní, gram-pozitivní koky a anaerobní mikroby).
- Zajištění dostatečné koncentrace antibiotika v místě infekce.
- Podání antibiotika bez nežádoucích vedlejších účinků.
- Výběr antibiotika podle vyhodnocení výsledků aktuální citlivosti v posledním období.
- Znalost famakodynamické a farmakokinetické charakteristiky antibiotika (rozdělení antibiotik podle toho, zda je jejich aktivita závislá na koncentraci nebo době expozice) [6, 9, 10, 11, 12].
Table 1. Častěji izolované patogeny u komplikovaných nitrobřišních infekcí Tab. 1. Commonly isolated pathogens in complicated intraabdominal infections 
Výběr antimikrobních léčiv je založen na očekávaném spektru patogenních bakterií jako kalkulovaná empirická léčba. Není možné stanovit obecné doporučení pokud jde o výběr určitých tříd antimikrobních chemoterapeutik, přestože všechny dostupné klinické studie neprokázaly významné snížení účinku porovnávaných antibiotik [1, 4, 9, 10, 13]. U nemocných s nozokominální nitrobřišní infekcí je pravděpodobnější výskyt multirezistentních patogenů [12]. Inadekvátní empirická antimikrobní léčba je spojena se selháním a následným úmrtím. Proto je u těchto nemocných doporučen širokospektrý antimikrobní režim. Rutinní podání antimikrobních farmak proti enterokokům není doporučováno, ale může být efektní za určitých klinických podmínek jako je septický šok u nemocných s předchozí prolongovanou léčbou cefalosporiny, s imunosupresí a s recidivující nitrobřišní infekcí doprovázenou závažnou sepsí [1, 4, 7]. S výskytem rezistentních patogenů je nutno počítat u nemocných s prolongovanou hospitalizací a i s antimikrobní léčbou. Antimykotická léčba Candida spp. je doporučena při kandidóze – kolonizaci kandidou – nebo u nemocných se specifickými rizikovými faktory invazivní kandidózy jako je imunodeficience a prolongovaná antimikrobní expozice [4, 11]. Doba podání antimikrobní léčby je variabilní a závisí na typu nalezeného zdroje infekce, adekvátnosti intervenční eradikace infekce, stavu obranyschopnosti nemocného a i odpovědi na léčbu. Nemocní s lokalizovanou peritonitidou nebo s nitrobřišním abscesem (jestliže je absces kompletně vydrénován) a bez známek poruchy imunity mohou být léčeni relativně krátkou dobu (7–10 dní) [1, 4, 6]. Polymorbidní nemocní s difuzní peritonitidou vyžadují podání antibiotik delší dobu 10–14 dní parenterální cestou a dále i prolongovanou orální aplikaci. Antimikrobní léčba by měla pokračovat až do doby, kdy jsou jasné známky eradikace infekce. U sepse trvající déle než týden jsou indikovány další diagnostické postupy a pokud je nezbytné i chirurgická reintervence [1]. U vybraných nemocných je prolongovaná antimikrobní léčba nezbytná (infikovaná pankreatická nekróza).
ANTIMIKROBNÍ LÉČBA U PRIMÁRNÍ PERITONITIDY
Primární zánět pobřišnice je vyvolán infekcí z extraperitoneálního zdroje, často hematogenní cestou. Postihuje nemocné se závažným onemocněním, u dětí s nefrotickým syndromem a u dospělých s cirhózou [2]. U nemocných s cirhózou dochází k infekci peritonea translokací mikroorganismů z lumen GIT. Proces je usnadněn přerůstáním bakterií ve střevním lumen a snížením antimikrobní aktivity ascitu. Vznik primární peritonitidy je podmíněn poruchou obranyschopnosti nemocného. Většinou je zánět vyvolán monobakteriální infekcí, u dětí grampozitivními koky (Streptococcus pneumonie), u dospělých koliformními bakteriemi (Escherichia coli) v 70 %), 10 až 20 % grampozitivní koky (streptokoky, Staphylococcus aureus včetně MRSA) a v 10 % anaeroby (Bacteroides species). V empirické antimikrobní léčbě jsou indikována betalaktámová antibiotika (amoxycilin, klavulanová kyselina, ampicilin, sulbaktam), cílená léčba je podle výsledku izolovaného kmene a jeho citlivosti [1, 10].
ANTIMIKROBNÍ LÉČBA U SEKUNDÁRNÍ PERITONITIDY
Infekce v peritoneální dutině vzniká následkem zánětu nebo mechanického porušení integrity GIT, urogenitálního traktu nebo solidních orgánů břišní dutiny a retroperitonea s vystavením účinku většinou bakteriální flóry trávicího ústrojí [2]. Vznik sepse u sekundární peritonitidy je spojen s některými rizikovými faktory. Vedle infekce je to rozsah a stadium peritonitidy, vyšší věk nemocných, orgánová dysfunkce v předchorobí a pooperační infekce.
Pokud je sekundární peritonitida komplikována závažnou sepsí je úmrtnost několikanásobně vyšší. Mezi rizikové faktory spojené s selháním iniciální empirické antimikrobní léčby u sekundární peritonitidy se uvádějí: a) perforace tlustého střeva s průnikem velkého množství bakterií, b) opoždění v zahájení antimikrobní léčby, c) imunosuprese a závažná přidružená onemocnění (diabetes mellitus), d) krevní ztráta při operaci, e) podání antibiotik pouze proti aerobní bakteriím, f) pozitivní kultivace enterokoků (Enterococcus species) z peritoneální dutiny, g) výskyt nozokomiální rezistentní infekce u pooperační peritonitidy. Sekundární peritonititida se dělí na: 1. Akutní peritonitidu s perforací, 2. Pooperační peritonitidu, 3. Poúrazovou peritonitidu.
1. Akutní peritonitida s perforací
Je nečastější akutní nitrobřišní chirurgickou infekci. Téměř 80 % perforačních peritonitid vzniká jako následek nekrózy stěny GIT [2]. Sekundární perforační peritonitida je buď ohraničená nebo při pokračujícím šíření infekce dochází k generalizaci zánětu – difuzní zánět pobřišnice. Příčinou perforace tenkého střeva je zánět a nekróza střeva při poruše perfuze.
Peritonitida následkem zánětu apendixu je nejčastější a u většiny případů se prezentuje jako lokalizovaná. Kolem 22 % peritonitidy vzniká následkem zánětu tlustého střeva (diverticulitis, colitis), méně častá je perforace u karcinomu kolon, u inkarcerované hernie nebo u volvulu a invaginace [2]. Nekrotizující pankreatitida může být doprovázena peritonitidou jestliže jde o infikovanou nekrózu pankreatu se sekundární infekcí exudátu v peritoneu [4]. Příčinou peritonitidy jsou převážně endogenní smíšené bakteriální infekce (aerobní a anaerobní). Incidence bakterií je závislá na anatomické lokalizaci zdroje infekce. Z gramnegativních aerobních bakterií jsou to Enterobacteriaceae (Escherichia coli, Enterobacter species, Klebsiella species), z grampozitivních aerobních bakterií enterokoky (Enterococcus species), výjimečně stafylokoky (Staphylococcus aureus) a z anaerobních bakterií nejčastěji Bacteroides fragilis. Bacteroides species a z anaerobních koků Peptostreptococcus species [2]. Antimikrobní léčba je indikována jako monoterapie tak i kombinace antibiotik a to podle stupně závažnosti a klinických známek komplikací [1, 4, 10] (Tab. 2). Mezi parametry vysokého stupně závažnosti peritonitidy patří: pokročilý věk, malnutrice, nízká hodnota albuminu v séru, závažná onemocnění v předchorobí, vyšší APACHE II skóre (> 15), nedostatečná kontrola zdroje infekce při primární operaci, imunosuprese a výskyt rezistentních nozokomiálních bakterií [2, 3, 4]. Indikace k alternativnímu podání antibiotika zahrnují vedle alergie, farmakokinetiku antibiotika a místní epidemiologickou situaci z hlediska stavu rezistence [6, 10]. Empirické podání aminoglykosidů (gentamicin, netilmicin, tobramycin, amikacin, isepamicin) jako antibiotika první volby je limitováno jejich nefrotoxicitou. Proto účinná kombinace linkosamidu (klindamycinu) s aminoglykosidy je v současné době řazena mezi alternativní léčbu [10]. Další doporučené antimikrobní režimy u vysoce rizikových nemocných s nitrobřišní infekcí mají podstatně srovnatelnou účinnost jak u monoterapie tak i kombinační léčby [4, 10, 14, 15, 16, 17, 18] (Tab. 3). Podání klindamycinu jako antimikrobního léku proti anaerobním gramnegativním bakteriím nebo grampozitivním kokům je v současné době podle aktuálního výsledku citlivosti limitováno narůstající rezistencí u Bacteroides fragilis, Clostridium species i u Peptostreptococus species. Mimoto jeho dlouhodobé podání je spojeno s rizikem vzniku enterokolitidy vyvolané Clostridium difficile.
Table 2. Doporučení pro antimikrobní léčbu u nitrobřišní infekce dospělých Tab. 2. Antimicrobial treatment recommendations in intraabdominal infections in adults 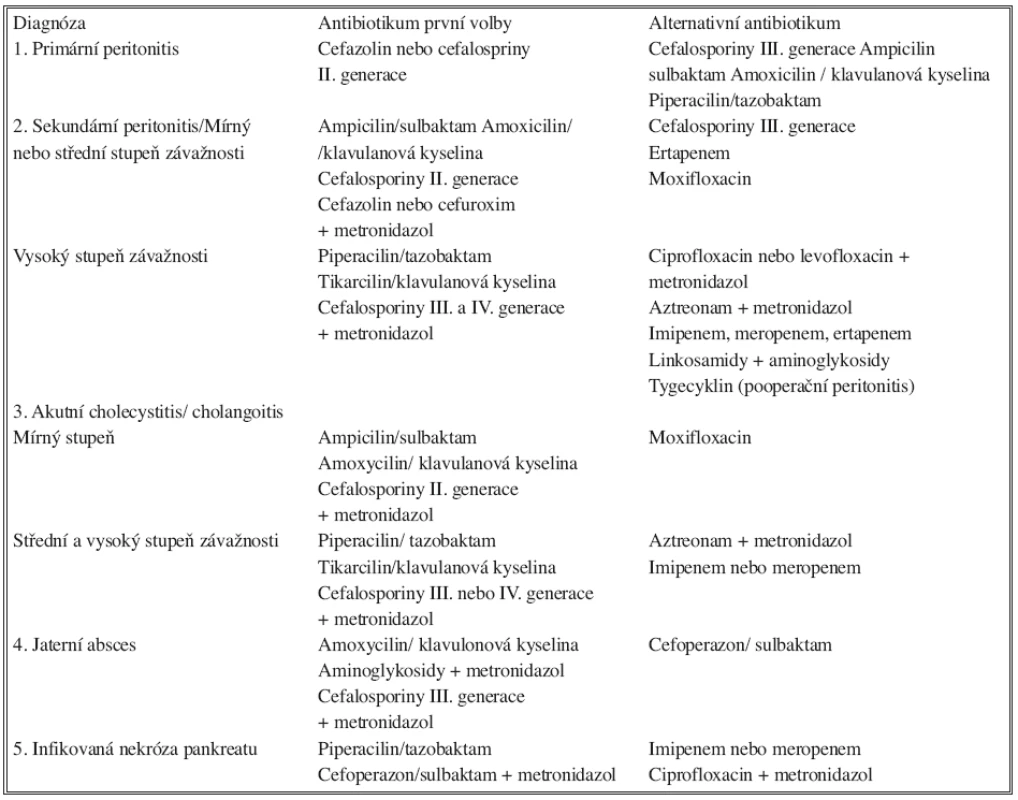
Table 3. Doporučené antimikrobní režimy pro nemocné s vysokým rizikem u nitrobřišních infekcí Tab. 3. Recommended antimicrobial regimens in high-risk patients with intraabdominal infections 
2. Pooperační peritonitida
Výskyt pooperační peritonitidy je udáván u nemocných po provedené laparotomii v rozmezí 1–20 % [2]. Nejčastější příčinou je porucha hojení anastomózy GIT – dehiscence. Pozdní diagnóza je nejčastěji způsobena opožděným rozvojem typických příznaků, které jsou zřejmé mezi 5. až 7. pooperačním dnem. I proto je pooperační peritonitida spojena s vysokou úmrtností (až u 60 % nemocných s difuzní pooperační peritonitidou). Morbidita i úmrtnost jsou také závislé na anatomické lokalizaci a rozsahu dehiscence (vyšší úmrtnost po kolorektálních operacích). Méně častou příčinou pooperační peritonitidy jsou infikované reziduální hematomy a další septické zdroje (nedostatečná drenáž iniciálního zdroje infekce – kontaminované peritoneum střevním obsahem při primární operaci) včetně pooperační infekce chirurgického místa v peritoneální dutině nebo v nitrobřišních orgánech.
Etiologickým agens je většinou smíšená střevní bakteriální flóra a to v závislosti na lokalizaci dehiscence. Při pozdějším vzniku této komplikace mohou být někdy patogenem kolonizující rezistentní bakterie jako jsou enterokoky (zvláště Enterococcus species rezistentní na vankomycin) a dále i Pseudomonas aeruginosa. Mezi další rezistentní patogeny patří Klebsiella species, MRSA a ESBL kmeny Escherichia coli produkující beta-laktamázy s rozšířeným spektrem, které řadíme mezi hospitalizační nozokomiální infekce. Antimikrobní léčba je širokospektrá a to většinou cílená na základě výsledku mikrobiologického vyšetření odebraného materiálu a dále i výsledku lokálního antibiotikogramu. U závažného průběhu při vysokém riziku nozokomiální infekce lze jako iniciální monoterapii podat piperacilin/tazobaktam, nebo karbapenemy (imipenem, meropenem, ertapenem) [10, 11, 13, 14, 16, 17, 18, 19]. Recentně jsou první zkušenosti v léčbě rezistentních patogenů (MRSA – methicilin rezistentní Staphylococcus aureus, VRE – vankomycin rezistentní enterokoky, ESBL produkující gramnegativní bakterie, Acinetobacter species, Stenotrophomonas species) tygecyklinem [20, 21, 22] (Tab. 4).
Table 4. Účinek tygecyklinu na multirezistentní patogeny nozokomiálních infekcí Tab. 4. Effects of tygecycline on multiresistent nosocomial infections 
3. Poúrazová peritonitida
U tupého poranění břicha je nejčastější příčinou poúrazové peritonitidy poranění střeva nebo mesenteria s následnou poruchou perfuze střevní stěny při přerušení větví mesenterické tepny vedoucí k ischemii a následné perforaci střeva [1, 2, 4]. Rozvoj peritonitidy je dán časovou prodlevou při pozdní diagnóze. Tento typ poúrazové peritonitidy je většinou velmi závažný, protože jde o pozdní rozpoznání u zraněného s polytraumatem. U penetrujících poranění je rozvoj nitrobřišní infekce sekundární po kontaminaci peritonea. Závažnost klinického obrazu je závislá na době mezi poraněním a operační revizí s kontrolou pokračující kontaminace peritonea. Stupeň bakteriální kontaminace peritonea je závislý na místě perforace trávicí trubice a zvyšuje se aborálním směrem s narůstajícím rizikem vzniku nitrobřišní infekce. Izolované bakterie lze zařadit mezi smíšené polymikrobiální aerobní a anaerobní infekce. Rozvoj první fáze infekčního procesu (difuzní peritonitidy a bakteremie) je podle současných znalostí u penetrujících střelných poranění aborální části GIT spojen s Enterobacteriacae (především Escherichia coli, Enterococcus species a Bacteroides fragilis). Doba mezi poraněním a operací je kruciální pro aplikaci antimikrobní léčby nebo profylaxe. Jestliže je < 4 hodiny a výsledek skóre APACHE II je nízký, operační výkon je zařazen mezi kontaminované a je indikována antimikrobní profylaxe. U zraněného s delší dobou (> 4 hodiny) od úrazu a se závažnějším stupněm poranění má být zahájena peroperační antimikrobní léčba [23].
ANTIMIKROBNÍ LÉČBA U TERCIÁRNÍ PERITONITIDY
Zahrnuje perzistentní nebo recidivující nitrobřišní infekce, vzniklé po zjevně úspěšné léčbě primární nebo sekundární bakteriální peritonitidy. Jestliže infekce perzistuje nebo recidivuje po 48 hodinách po kompletní přiměřené chirurgické a antibiotické léčbě, lze ji považovat za terciální peritonitidu. Stejně tak lze uvažovat o terciární peritonitidě po třetí reintervenci u sekundární peritonitidy, ošetřenou opakovanou revizí při plánované relaparotomii. Na rozdíl od primární a sekundární peritonitidy je patogenní mikrobiální flóra odlišná, je ve spojení s orgánovou dysfunkcí a signifikantní úmrtností, přes účinnou antibiotickou léčbu a přiměřený postup při sanaci zdroje infekce [2]. V mikrobiální flóře terciární peritonitidy dominují koaguláza – negativní stafylokoky, ESBL – Escherichia coli, ESBL – Klebsillea pneumoniae, Pseudomonas aeruginosa, Enterobacter species, Enterococcus species a Candida species. Přes relativně nízkou virulenci těchto bakterií je úmrtnost u terciární peritonitidy vysoká, dosahující až 50 % u většiny studií [1, 2, 4, 10, 12]. Tyto výsledky léčení jsou přisuzovány méně patologickému procesu samotnému a více poruše imunity u nemocného. Včasné rozhodnutí k podání cílené antibiotické léčby je na základě výsledku hemokultury a odebraného materiálu z peritoneální dutiny. Iniciální volba antimikrobní léčby pro léčbu terciární – většinou nozokomiální nitrobřišní infekce je extrémně důležitá protože bylo prokázáno, že neúčinná empirická antimikrobní léčba je ve spojení s opožděným klinickým zlepšením, prodloužením doby hospitalizace a zvýšením rizika úmrtnosti [1, 2, 4].
Současný přehled volby antimikrobní léčby je cíleně zaměřen na jednotlivé patogeny [1, 4, 14, 18, 19] (Tab. 5). Doba trvání antimikrobní léčby by neměla přesáhnout 14 dní, kromě mykotické infekce.
Table 5. Doporučený antimikrobní režim proti vybraným bakteriím, které jsou příčinou nozokomiální nitrobřišní infekce Tab. 5. Recommended antimicrobial regimens to fight specific bacteria, causing nosocomial intraabdominal infections 
ANTIMIKROBNÍ LÉČBA U NITROBŘIŠNÍHO ABSCESU
Nitrobřišní absces je definován jako extraluminální kolekce tekutiny v oblasti břišní dutiny, která byla prokázána radiograficky s následnou aspirací hnisu nebo chirurgickou intervencí.
Rozdělení na abscesy intraperitoneální a viscerální je většinou vzhledem k etiopatogenezi doplněno o abscesy retroperitoneální, jejichž původ je v souvislosti se zánětlivým onemocněním nitrobřišních orgánů. Jednotlivé příčiny abscesu jsou specifické podle lokalizace a to především u viscerálních abscesů. Mikrobiologické nálezy jsou vyhodnoceny podle lokalizace abscesu [1, 10, 17, 24]. V supramezokolickém prostoru je infekce většinou monobakteriální (60 %), v inframezokolickém prostoru polymikrobiální (89 %). Mezi izolované patogeny patří nejčastěji Escherichia coli, Streptococcus species, Enterococcus species, z anaerobních bakterií Bacteroides species. U orgánových abscesů je infekce polymikrobiální aerobní a anaerobní. Volba antibiotika k empirické antimikrobní léčbě u abscesu vychází z jeho anatomicko-topografické lokalizace, typu operace a znalosti aktuální rezistence u předpokládaných patogenů [1, 3, 4, 7, 24]. Mezi antibiotika volby patří vedle betalaktamových antibiotik chinolony, karbapenemy. Kombinace antibiotik je cílena k účinku na aerobní i anaerobní patogeny. U jaterního abscesu je v monoterapii účinný cefalosporin III. generace, cefoperazon chráněný inhibitorem betalaktamázy sulbaktamem. V taktice antimikrobní léčby je u abscesu častěji indikována již cílená léčba podle izolovaného patogena [10].
ANTIMIKROBNÍ LÉČBA INFIKOVANÉ NEKROTIZUJÍCÍ PANKREATITIDY
Studie zabývající se účinkem antimikrobních farmak u akutní nekrotizující pankreatitidy jsou zaměřeny na profylaktické podání a dále na léčení infekce u infikované nekrózy pankreatu [25, 26, 27]. U nemocných s nekrotizující pankreatitidou postihující více než jednu třetinu žlázy je nejvyšší riziko sekundární infekce. Vyhodnocením jednotlivých antibiotických režimů [27] (Tab. 6) byl prokázán v některých studiích benefit pokud jde o snížení výskytu infikované nekrózy a nepankreatických infekčních komplikací u nekrotizující pankreatitidy. Nicméně řada dalších studií neprokázala žádný efekt profylaxe ve srovnání s kontrolní skupinou. Bakteriální flóra v infikované nekróze pankreatu je většinou smíšená gramnegativní bakterie, grampozitivní koky a anaerobní bakterie. Proto empirická antimikrobní léčba jak monoterapie, tak i kombinace by měla mít účinek proti smíšené bakteriální flóře. V monoterapii jsou indikovány karbapenemy (imipenem, meropenem), betalaktamová antibiotika (piperacilin/tazobaktam, tikarcilin/klavulanová kyselina). Kombinace chinolonů (cipro - floxacin) a nitroimidazolů (metronidazol) by měla být rozšířena o aminopeniciliny (ampicilin) pro možnost výskytu enterokokové infekce. Součástí antimikrobní léčby u infikované nekrózy je i podání antimykotik. Výskyt kandidové infekce u nemocných operovaných pro infikovanou nekrózu je v rozmezí 20–25 %. To opravňuje zahájení empirické antimykotické léčby u nemocných operovaných pro infikovanou nekrózu pankreatu. Nejčastěji je izolována Candida albicans, je proto při prokázané citlivosti přiměřené podání flukonazolu. Při výskytu Candida glabrata je antimykotikem volby caspofungin nebo amphotericin B a to většinou jako cílená léčba.
Table 6. Antimikrobní profylaxe u pankreatické nekrózy Tab. 6. Antimicrobial prophylaxis in pancreatic necrosis 
ENTEROKOKOVÉ NITROBŘIŠNÍ INFEKCE
Klinický význam enterokokové infekce u nitrobřišních zánětů představuje problém pro pokračující diskusi [1, 2, 4, 7, 9, 19, 20, 28]. Ne všichni nemocní s peritonitidou vyžadují podání antimikrobních farmak účinných proti enterokokům, nicméně nevhodná empirická antimikrobní léčba může mít za následek vysoký stupeň jejího selhání způsobené enterokokovou bakteriemií. Řada studií u komunitních získaných peritonitid srovnávalo anti - mikrobní režimy s účinkem na enterokoky a bez aplikace těchto antibiotik. Žádná z těchto studií neprokázala benefit při podání antibiotika účinného proti Enterococcus species. Proto rutinní podání antienterokokových antibiotik u komunitních peritonitid není nezbytné. Na druhé straně některé klinické stavy u nitrobřišních infekcí představují racionální indikaci podání pro krytí enterokokokových patogenů, jako je septický šok u nemocných s předchozí prolongovanou léčbou cefalosporiny, imunokompromitovaní nemocní s rizikem bakteriemie, nebo recidivující nitrobřišní infekce v průběhu závažné sepse [1]. Patogenem těchto infekcí může být i vankomycin rezistentní enterokok (VRE) [28].
NITROBŘIŠNÍ KANDIDÓZA
Výskyt Candida species u nitrobřišní infekce je ve spojení s některými rizikovými faktory jako je imunodeficience nebo prolongované podání antibakteriálních léčiv. Kandidová peritonitida se vyskytuje u nemocných s peritoneální dialýzou nebo po rozsáhlých resekčních výkonech GIT a sdružených nitrobřišních poraněních. Incidence Candida species je závislá na zdroji infekce [1, 4, 6, 7, 11, 29]. Mykotická peritonitida může být vyvolána polymikrobiální infekcí a také může být monoinfekční vyvolaná Candica species; z nich Candida albicans se vyskytuje v 70 %. Aspergillus spp. byl u nitrobřišních infekcí prokázán jen zřídka. U terciární peritonitidy byla Candida species prokázána až i jako druhý nejčastější patogen. U sekundární peritonitidy je její výskyt méně častý (do 12 %). Predominantním patogenem je Candida species u infikované pankreatické nekrózy. Vysoké riziko kandidózy u nemocných s nitrobřišní kontaminací vedlo k zvýšenému použití antimykotické profylaxe. Bylo prokázáno, že profylaxe flukonazolem snižuje výskyt kandidózy u vysoce rizikových chirurgických nemocných s komplikovanou nitrobřišní infekcí (perforační a pooperační peritonitida). V taktice léčby nitrobřišní kandidózy je vedle promptní eradikace zdroje infekce s odstraněním kontaminované peritoneální tekutiny a infikovaných nekróz i časné zahájení antimykotické léčby (flukonazol, amphotericin B). Antimykotická léčba by měla pokračovat 2–3 týdny.
ANTIMIKROBNÍ REZISTENCE U NITROBŘIŠNÍCH INFEKCÍ
Ohrožení očekávaného účinku antimikrobních farmak je dáno významnou narůstající rezistencí mikroorganismů. Selektivní tlak pro narůstaní rezistentních kmenů je podmíněn chybami v antimikrobní terapii (neúčinnost podaného antibiotika, nízké dávky, krátká doba podání, nesprávně volená kombinace) [1, 4, 6, 30]. Pokud jde o komunitní získané infekce, je role rezistentních patogenů minimální. Problém rezistence je u hospitalizačních nozokomiálních nitrobřišních infekcí [1, 4, 11]. Během posledních dvou desetiletí byl zaznamenán dramatický nárůst rezistence u gram-negativních a gram-pozitivních bakterií stejně tak i u Candida spp. Infekce vyvolaná rezistentními patogeny zvyšuje počet zdrojů infekce, komorbiditu nemocných a riziko úmrtnosti. Klinické výsledky ve spojení s touto infekcí jsou podmíněny nekrytím patogenů iniciálním empirickým antimikrobním režimem. Opožděné zahájení vhodné antimikrobní léčby vede k signifikantní úmrtnosti. U nozokomiálních nitrobřišních infekcí je do kalkulace při výběru empirického antimikrobního režimu nutno zahrnout rizikové faktory, které podporují pravděpodobnost výskytu rezistentních patogenů – hospitalizace na jednotce intenzivní péče, kolonizace rezistentními mikroorganismy, prolongované hospitalizace. Znalost místní epidemiologické situace je proto důležitá pro posouzení aktuálního stavu citlivosti mikroorganismů.
ZÁVĚR
Časná diagnóza nitrobřišní infekce u chirurgického nemocného, následovaná adekvátní sanací zdroje infekce vedoucí k zabránění další kontaminace a obnova anatomické struktury a fyziologické funkce stejně tak jako vhodná empirická antimikrobní léčba může limitovat pooperační morbiditu a úmrtnost. Největší výzvou u komplikované nitrobřišní infekce je její časné rozpoznání. Antimikrobní terapie je obecně standardizována a mnoho režimů, monoterapie nebo kombinační léčba, prokázalo jejich účinnost. Rutinní krytí proti enterokokům není doporučováno, ale je platné za určitých klinických podmínek jako je septický šok u nemocných s předchozí prolongovanou léčbou cefalosporiny, u imunokompromitovaných nemocných s rizikem bakteriemie, a u recidivy nitrobřišní infekce doprovázené závažnou sepsí. U nemocných s prolongovanou hospitalizací a antibakteriální léčbou je nezbytné počítat s pravděpodobností postižení rezistentními patogeny. Antimykotické krytí Candida spp. je doporučováno při zjištění postižení kandidózou, nebo u nemocných se specifickými rizikovými faktory invazivní kandidózy jako je imunodeficience a prolongovaná antibakteriální léčba. Obecně antimikrobní léčba má pokračovat do 5.–7. dne. Jestliže sepse pokračuje i po týdnu, je důležité opakovat vyšetření příčiny a pokud je nezbytné indikovat chirurgickou reintervenci.
Doc. MUDr. F. Vyhnánek, CSc.
Chirurgická klinika 3. LF UK
Šrobárova 50
100 34 Praha 10
e-mail: vyhnanek@fnkv.cz
Sources
1. Blot, S., De Waele, J. J. Critical issues in the clinical management of complicated intra-abdominal infections. Drugs, 2006 : 65 : 1611–1620.
2. Ordonez, C. A., Puyana, J. C. Management of peritonitis in the criticaly ill patiens. Surg. Clin. N. Am., 2006 : 86 : 1323–1349.
3. Pieracci, F. M., Barie, P. S. Management of severe sepsis of abdominal origin. Scand. J. Surg., 2007 : 96 : 184–196.
4. Marshall, J. C. Intra-abdominal infections. Microbes and Infection, 2004 : 6: 1015–1025.
5. Monteiro, M. C., Danielou, A., Piemont, Y., Hansmann, Y., Rohr, S. Bacterial cultures and empirical antimicrobial therapy for community-acquired secondary peritonitis. J. Chir., 2007 : 144 : 486–491.
6. Lochmann, O. Základy antimikrobní terapie. Triton, Praha, 1994 : 175.
7. Malangoni, M. A. Contributions to the management of intraabdominal infections. Am. J. Surg, .2005 : 190 : 255–259.
8. Sihler, K. C., Nathens, A. B. Management of severe sepsis in the surgical patient. Surg. Clin. N. Am., 2006 : 86 : 1457–1481.
9. Sganga, G. Antibiotic treatment of intra-abdominal and post-surgical infections. Ifez Med., 2005: Suppl: 18–24.
10. Chan, Y. J., Chang, F. Y., Chang, S. Ch., et al. Guidelines for antimicrobial therapy of intra-abdominal infections in adults. J. Microbiol. Immunol. Infect., 2008 : 41 : 279–281.
11. Kujath, P., Hoffmann, M., Rodloff, A. Antimicrobial and antimycotic therapy of intra-abdominal infections. Chirurg, 2008 : 79 : 295–305.
12. Nicoletti, G., Nicolosi, D., Rossolini, G.M., Stefani, S. Etiology, epidemiology and microbiological diagnosis of intra-abdominal infections. Infez. Med., 2008 : 16: Suppl. 1 : 8–18.
13. Koblihová, H., Suchopár, J. Kabapenemy: přehled a porovnání základních údajů. Remedia, 2008 : 18 : 247–251.
14. Gin, A., Dilay, L., Karlowsky, J., et al. Piperacillin-tazobactam: a beta-lactam/ beta-lactamase inhibitor combination. Expert Rev. Anti Infect. Ther., 2007 : 5: 365–383.
15. Marešová, V., Urbášková, P. Tigecyklin. Remedia, 2008 : 18 : 194–200.
16. Eagye, K .J., Kuti, J. L., Dowzicky, M., Nicolau, D. P. Empiric therapy for secondary peritonitis: a pharmacodynamic analysis of cefepime, ceftazidime, cetriaxone, imipenem, levofloxacin, piperacillin/ tazobactam, and tigecycline using Monte Carlo simulation. Clin. Ther., 2007 : 29 : 889–899.
17. Navarro, N. S. Jr., Campos, M. I., Alvarado, R., et al. Ertapenem versus ceftriaxone nad metronidazole as treatment for complicated inta-abdominal infections. Int. J. Surg., 2005 : 3: 25–34.
18. Falagas, M. E., Peppas, G., Makris, G. C., et al. Meta-analysis: ertapenem for complicated intra-abdominal infections. Aliment Pharmacol. Ther., 2008 : 27 : 919–931.
19. Tellado, J. M., Wilson, S. E. Empiric treatment of nosocomial intra-abdominal infections: a focus on the carbapenems. Surg. Infect., 2005 : 6: 329–343.
20. Menichetti, F. New options for treatment of intraabdominal infections: tigecycline. Infez. Med., 2008 : 16: Suppl. 1 : 53–56.
21. Doan, T. L., Fung, H. B., Mehta, D., Riska, P. F. Tygecycline : a glycylcycline antimicrobial agent. Clin. Ther., 2006 : 28 : 1079–1106.
22. Shakil, S., Akram, M., Khan, A. U. Tygecycline: a critical update. J. Chemother., 2008 : 20 : 411–419.
23. Krov, G., K@oleian, E. Microbiology and treatment of the abdominal gunshot injury. Khirurgiia, 2006 : 3: 47–54.
24. Cerullo, G., Marrelli, D., Roviello, F., et al. Empiric antibiotic therapy in the treatment of postoperative abdominal abscesses. Clinical and microbiological data. Chir. Ital., 2006 : 58 : 477–484.
25. Hart, P. A., Bechtold, M. L., Marshall, J. B., et al. Prophylactic antibiotics in necrotizing pancreatitis: a meta-analysis. South. Med. J., 2008 : 101 : 1126–1131.
26. Dellinger, E. P., Tellado, J. M., Soto, N. E., et al. Early antibotic treatment for severe acute necrotizing pankreatitis: a randomized, double-blind, placebo-controlled study (feature). Ann. Surg., 2007 : 245 : 674–683.
27. Xu, T., Cai, Q. Prophylactic antibiotic treatment in acute necrotizing pancreatitis: results from a meta-analysis. Scand. J. Gastroenterol., 2008 : 43 : 1249–1258.
28. Sood, S., Malhotra, M., Das, B. K., Kapil, A. Enterococcal infections – antimicrobial resistance. Indian J. Med. Res., 2008 : 128 : 111–121.
29. Boos, C., Kujath, P., Bruch, H. P. Intra-abdominal mycoses. Mycoses, 2005 : 48: Suppl. 1 : 22–26.
30. Macgowan, A. P. Clinical implications of antimicrobial resistence for therapy. J. Antimicrob. Chemother., 2008 : 62: Suppl. 2 : 105–114.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2009 Issue 4-
All articles in this issue
- Antitrombotická profylaxe v chirurgických oborech – doporučení American College of Chest Physicians 2008
- Tolerance akcelerované pooperační rehabilitace po střevních resekčních výkonech
- Úloha chirurgického výkonu v liečbe Crohnovej choroby
- Náhodný nález maligního onemocnění při operačním řešení nezvyklé příčiny střevní obstrukce u pacientky po transplantaci ledviny
- Stenóza truncus coeliacus při duodenopankreatektomii
- Nádorový trombus dolní duté žíly u karcinomu ledviny
- Giardiosa, jako málo frekventní onemocnění v diferenciální diagnostice bolestí břicha
- Poranění femorálních cév u trochanterických zlomenin
- Antimikrobní léčba u komplikované nitrobřišní infekce – současný stav
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Stenóza truncus coeliacus při duodenopankreatektomii
- Nádorový trombus dolní duté žíly u karcinomu ledviny
- Antimikrobní léčba u komplikované nitrobřišní infekce – současný stav
- Úloha chirurgického výkonu v liečbe Crohnovej choroby
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

