-
Medical journals
- Career
Náhodný nález maligního onemocnění při operačním řešení nezvyklé příčiny střevní obstrukce u pacientky po transplantaci ledviny
Authors: K. Houdek; R. Šulc; V. Třeška; J. Moláček
Authors‘ workplace: Chirurgická klinika FN v Plzni, přednosta: prof. MUDr. V. Třeška, DrSc.
Published in: Rozhl. Chir., 2009, roč. 88, č. 4, s. 189-191.
Category: Monothematic special - Original
Overview
Pomocí předkládané kazuistiky 62leté nemocné, která byla přijata a operována na Chirurgické klinice FN Plzeň pro známky obstrukce tenkého střeva, bychom chtěli připomenout možnost vzniku maligního onemocnění v souvislosti s používáním imunosupresiv. Příčinou obstrukce byla strangulace tenké kličky v otvoru peritonea po otevřené fenestraci lymfokely, která se vytvořila po transplantaci ledvinného štěpu. Peroperačně však byla nalezena a histologicky ověřena karcinóza peritonea. Před transplantací nebyly u pacientky známy žádné známky maligního onemocnění.
Klíčová slova:
karcinom – transplantace – imunosuprese – kýlaÚVOD
Používání imunosupresiv v klinické praxi výrazně přispělo k rozvoji transplantační medicíny, umožnilo mnoha lidem návrat do běžné práce a prodloužilo jejich život. Přináší však i řadu nežádoucích účinků, jako např. vyšší riziko vzniku maligního onemocnění u dlouhodobě imunosuprimovaných pacientů. Představuje jednu z příčin vyšší morbidity a mortality těchto pacientů [1, 2, 4, 5]. Důvodem je potlačení imunity, která kontroluje vznik malignity, dále věk nemocných, kteří se díky léčbě dožívají vyššího věku. Do souvislosti se dává také role některých virů – především Cytomegaloviru (CMV) a viru Epsteina-Barrové (EBV) [3, 4, 5].
KAZUISTIKA
Pacientka, 62 let, polymorbidní imunosuprimovaná po 2. transplantaci ledviny, warfarinizovaná(recidivující žilní trombózy) byla přijata na Chirurgickou kliniku Fakultní nemocnice v Plzni 20. 10. 2008 pro 3 dny trvající křečovité bolesti břicha, zvracení a obtížnější vyprazdňování. V minulosti byla pacientka po oboustranné nefrektomii pro infikované cysty ledvin, po transplantaci ledviny a následné graftektomii pro selhání štěpu. Druhá transplantace ledviny byla komplikována rekurencí polyomavirové infekce a dále vytvořením lymfatické kolekce v oblasti štěpu s nutností reoperace, kdy byla otevřeně fenestrována lymfokéla do peritoneální dutiny a současně byla provedena adnex - ektomie vpravo pro cystu (histologicky ložiska endometriózy). Z ostatních operací stav po cholecystektomii, a po operaci kýly v jizvě.
Při fyzikálním vyšetření při přijetí byla nemocná afebrilní, kardiopulmonálně kompenzovaná s dobrou funkcí ledvinového štěpu. Břicho nebylo vzedmuté, bez známek kýly, s nebolestivým poklepem. Na pohmat bylo břicho měkké, prohmatné, nebolestivé, v pravé jámě kyčelní byl hmatný nebolestivý štěp jinak bez hmatné patologické rezistence, játra přesahovala žeberní oblouk o 4 cm. Peristaltika byla obleněná, bez překážkových fenomenů. Per rektum vyšetření bylo nebolestivé, bez hmatné stolice a patologické rezistence, bez přítomnosti krve či jiné patologické příměsi na rukavici.
Při přijetí byl laboratorní nález bez leukocytózy, jen s mírnou elevací CRP. Pacientce byla zavedena nazogastrická sonda a močový katétr.
Při přijetí bylo provedeno sonografické vyšetření (USG) a nativní rentgenový snímek břicha. USG vyšetření bylo s nálezem jaterních cyst, dilatovaných tenkých kliček po úroveň pravé jámy kyčelní, kde byl patrný konvolut. Dále dobře perfundovaný štěp bez známek městnání, bez ložisek. Mezi kličkami bylo přítomno malé množství tekutiny.
Nativní rentgenový snímek břicha byl bez známek pneumoperitonea, byly patrné distendované tenké kličky s hladinkami (šíře do 4,5 cm) v epigastriu a mezogastriu, chudá pneumatizace tračníku. Jak klinický nález na břiše, tak rentgenologický nález nenutil k akutní laparotomii.
Indikovali jsme RTG pasáž trávicího ústrojí vodnou kontrastní látkou. Ta prokázala překážku v oblasti aborálního jejuna (Obr. 1, 2 a 3).
Image 1. RTG nativní snímek břicha Fig. 1. Native abdominal x-ray 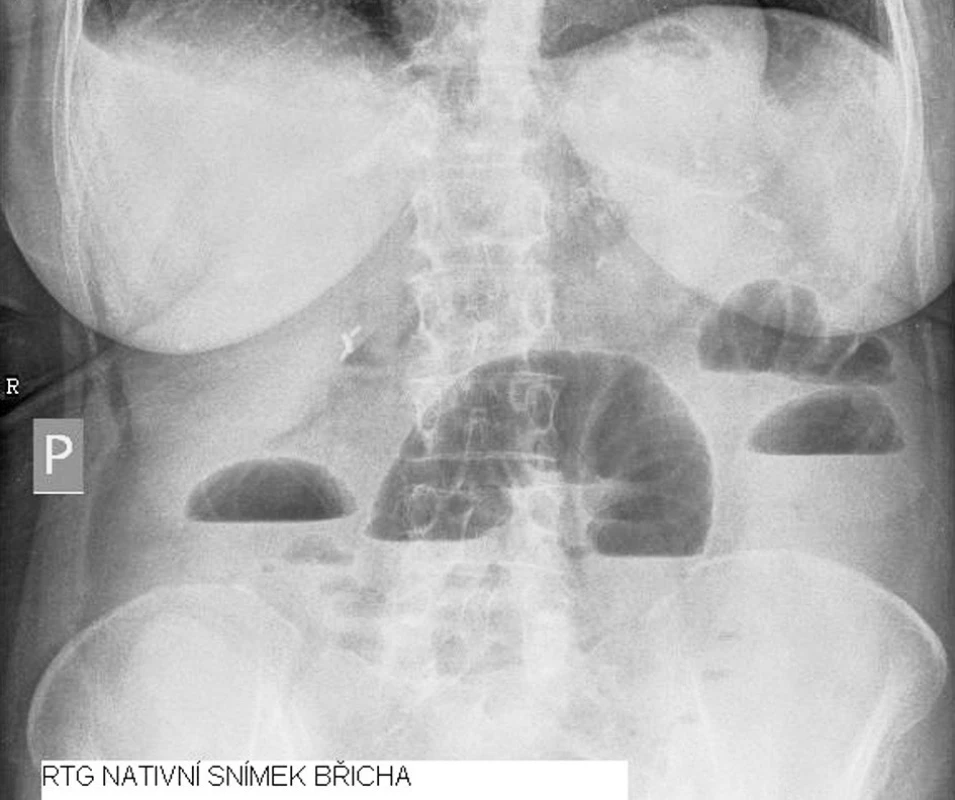
Image 2. Zahájení pasáže GIT kontrastní látkou Fig. 2. Initiation of the contrast’s passage through GIT 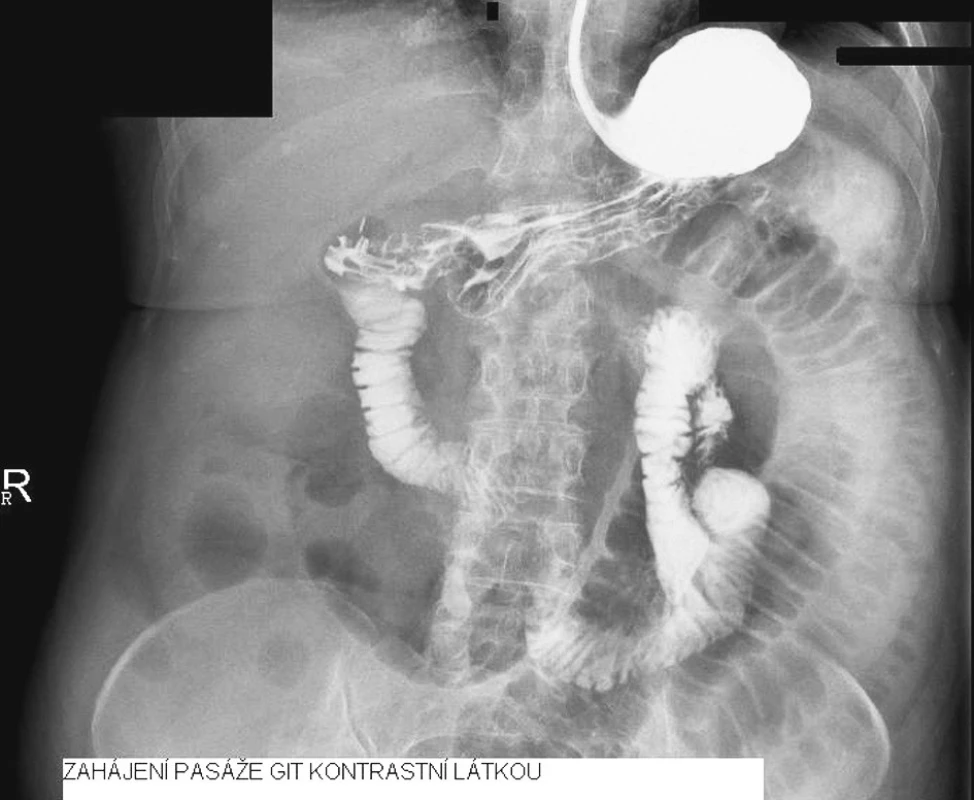
Image 3. RTG snímek 3,5 hodiny po podání kontrastní látky Fig. 3. X-ray view at 3.5 hours following administration of the contrast 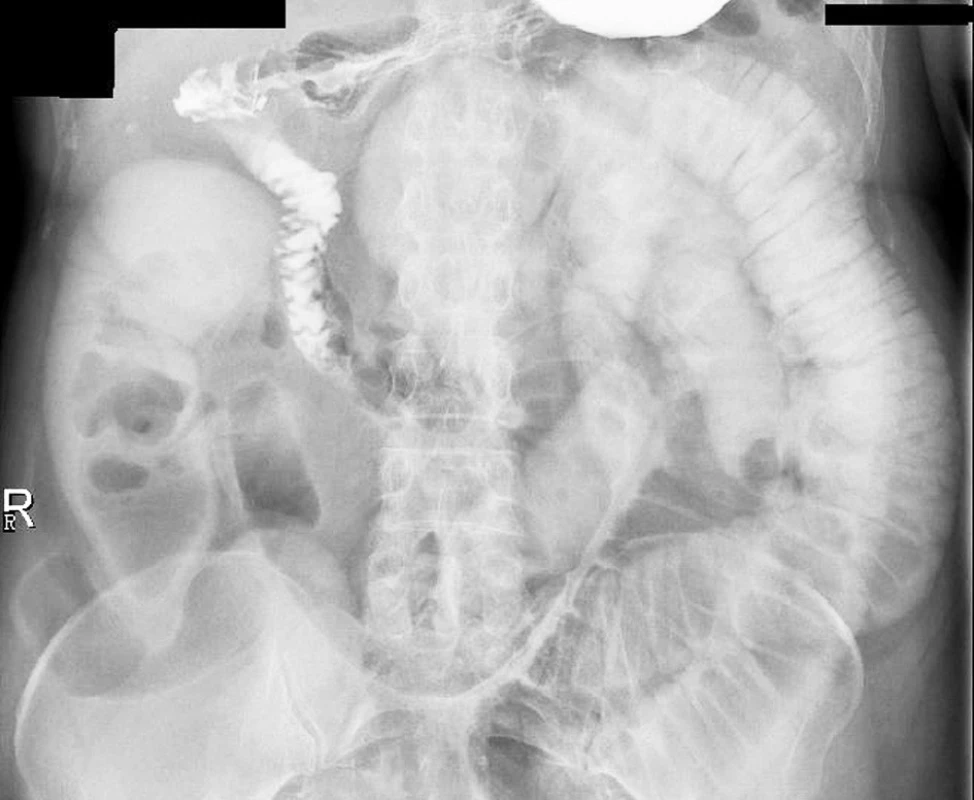
Pro známky rozvíjející se neúplné střevní obstrukce jsme 28 hodin po přijetí indikovali nemocnou k laparotomii. Předoperačně byla nutná korekce patologické hemokoagulace čerstvou mraženou plazmou (warfarinizace).
Při operaci jsme pronikli do břišní dutiny střední laparotomií. V břišní dutině jsme nalezli větší množství serózního lehce zakalenéhovýpotku, kličky jejuna distendované na 4–5cm. Pánev byla pro srůsty nepřehledná, děloha byla velmi omezeně vyšetřitelná bez hrubé patologie, levá adnexa byla viditelná pouze částečně, též bez hrubé patologie. Difuzně po peritoneu byl přítomný rozsev, který budil dojem karcinózy, maximum nálezu bylo v pánvi. V játrech jsme nalezli četné cysty různé velikosti. Příčinou obstrukce byla inkarcerace ilea v otvoru peritonea po předchozí fenestraci lymfokély. Po zvětšení otvoru v peritoneu bylo uvolněno inkarcerované ileum a resekován postižený úsek (asi 25 cm). Kontinuita trávicího ústrojí byla obnovena end to end anastomózou.
Po operaci jsme pozorovali serózní sekreci z dolní třetiny rány, v rozsahu několika kožních stehů byla rána rozpuštěna a ponechána k převazům a hojení per secundam. Jinak byl pooperační průběh nekomplikovaný, pasáž střevní byla obnovena a pacientka byla 6. pooperační den přeložena k další péči na lůžkové oddělení nefrologie I. interní kliniky FN v Plzni. Rána jevila známky dobrého hojení, štěp měl dobrou funkci a pacientka dobře tolerovala perorální příjem. Pro známky rozvíjející se pneumonie byla zahájena příslušná léčba.
V peroperačně odebraných tkáních (omentum, seróza tenkého střeva) byly histologicky prokázány metastázy ovariálního tumoru, buď serózního papilárního tumoru hraniční malignity nebo dobře diferencovaného serózního papilárního adenokarcinomu, který může vznikat primárně na peritoneu. V jedné z vyšetřených lymfatických uzlin byla přítomna metastáza stejného tumoru. Na sliznici a v ostatních vrstvách stěny tenkého střeva nebyla prokázána přítomnost nádorových buněk.
V rámci pátrání po primárním zdroji karcinózy byla laboratorně zjištěna pouze vysoká hladina CA125 – 211,0 IU/ml (laboratorní norma 0–28 IU/ml), která připouštěla možnost diagnózy tumoru ovaria. Provedené CT plic, mediastina, břicha a malé pánve, transvaginální USG a gynekologické vyšetření jasně patrné origo tumoru neprokázaly. Pro epizody enteroragie a k vyloučení tumoru trávicího ústrojí byla provedena kolonoskopie, při které byl elektrokoagulační kličkou snesen prokrvácený polyp (histologicky adenom s ložiskem dysplazie mírného stupně). V souhrnu tedy stav hodnocen jako inoperabilní nález generalizovaného karcinomu s možným původem v levém ovariu. Gynekologem a onkologem byla indikovaná léčba paliativní chemoterapií, vzhledem k polymorbiditě nemocné v monoterapii cyklofosfamidem.
Podle poslední kontroly byla rána prakticky zhojena, pacientka je v celkově dobrém stavu. Chemoterapii zatím nepodstoupila.
DISKUSE
Vnitřní kýla je známou, ale méně častou příčinou střevní obstrukce, na kterou bychom v diferenciální diagnostice neměli zapomínat. Zejména u pacientů, kteří již podstoupili nějaký chirurgický výkon v oblasti břišní dutiny. Existují predisponovaná a fyziologická místa zmiňovaná v literatuře, ve kterých může ke vzniku herniace v dutině břišní dojít. Další vznikají v souvislosti s chirurgickými výkony. Cíleně se snažíme minimalizovat rizika vzniku vnitřní kýly a jejího následného uskřinutí šetrným operováním, uzavíráním otvorů v omentu, uzavíráním otvorů ve střevním závěsu po střevních resekcích nebo resekcí adhezivních pruhů. Symptomatologie strangulace vnitřní kýly nebývá vzhledem k lokalizaci zdaleka tak jasná jako u zevních kýl. To může být i důvodem k pozdějšímu operačnímu řešení (vyhledání lékaře, diagnostické rozpaky). To vede k delší době ischemie orgánů, které jsou obsahem kýly a proto i k časté nutnosti resekce postiženého orgánu. Podobně jako v předkládané kazuistice se však někdy nevyhneme vytvoření pomyslné kýlní branky v rámci řešení jiného chirurgického onemocnění. Strangulace kličky tenkého střeva nám v tomto případě odhalila ještě další nesouvisející onemocnění – postižení orgánů břišní dutiny maligním procesem.
Vznik nových moderních imunosupresiv prodlužuje přežívání pacientů po orgánových transplantacích. Tak jak se prodlužuje přežívání těchto nemocných, setkáváme se i s častějším vznikem maligního onemocnění [1, 2, 4, 5]. Poprvé byla souvislost mezi dlouhodobým podáváním imunosupresiv a vznikem malignity uvedena v literatuře v roce 1968 [2, 5]. Podle dosavadních zkušeností je patrné, že incidence maligního onemocnění je u imunosuprimovaných pacientů vyšší než v běžné populaci [2, 4, 5]. Maligní onemocnění se tak při dlouhodobém sledování stává jednou z příčin morbidity a mortality transplantovaných nemocných.
Nejčastěji se setkáváme se vznikem kožních malignit a lymfoproliferativních onemocnění [3, 5]. Výjimkou však nejsou ani nádory jiných orgánů a tkání. Etiopatogeneze vzniku maligního onemocnění po orgánové transplantaci bude patrně multifaktoriální, není zatím přesně objasněna. Zcela jistě bude hrát svoji úlohu samotná imunosuprese, dále virová infekce, genetické vlivy, věk, pohlaví, geografické poměry a podobně [1, 2, 3, 5].
V důsledku imunosuprese jsou transplantovaní pacienti častěji infikováni viry (nejčastěji CMV, EBV). Infekce těmito viry nebo jejich reaktivace může mít řadu různě závažných projevů. Mezi ně patří nejen rejekce štěpu, ale do souvislosti se dávají i se vznikem nádorových onemocnění. U mnoha nádorů je již virová etiologie prokázána např. Human Papilomaviry nebo viry hepatitidy.
Z dostupných publikovaných výsledků řady studií plyne, že u pacientů, kde je nutné léčit akutní rejekci štěpu, je riziko vzniku malignity vyšší a je u nich i horší prognóza maligního onemocnění [2, 4]. Stejně tak časná virová infekce (CMV, EBV, HBV, HCV …) může být pro vznik maligního onemocnění u imunosuprimovaných pacientů rizikovým faktorem [3, 4, 5].
V uváděné kazuistice byla ve shodě s těmito prezentovanými závěry léčena rekurentní virová infekce (polyomaviry) i rejekce štěpu.
V rámci zlepšení prognózy těchto pacientů je důležitá časná diagnostika a časná léčba nově vzniklých malignit. Pro vedlejší účinky chemoterapeutik (nefrotoxicita, hepatotoxicita) a celkový stav pacientů (omezené či vyčerpané možnosti eliminačních metod) je možnost použití chemoterapie často omezená.
Musí být proto kladen důraz na důkladné a dlouhodobé provádění klinických a screeningových vyšetření (nádorové markery, radiodiagnostické a endoskopické vyšetřovací metody v pravidelných časových intervalech) u pacientů po orgánových transplantacích. To umožní časnou diagnostiku a léčbu komplikací a maligních onemocnění.
MUDr. K. Houdek
Kaznějovská 44
323 00 Plzeň
e-mail: houdekk@fnplzen.cz
Sources
1. Popov, Z., Ivanovski, O., Kolevski, P., Stankov, O., Petrovski, D., Cakalaroski, K., Ivanovski, N. De novo malignancies after renal transplantation – a single-center experience in the Balkans; doi:10.1016/j.transproceed.2007.08.022
2. Fung, J. J., Jain, A., Kwak, E. J., Kusne, S., Dvorchik, I., Eghtesad, B. De novo malignancies after liver transplantation: A major cause of late death. Liver Transplantation, Vol. 1, No. 11, Suppl. 1, 2001.
3. Amado, A. Cancer incidence after immunosuppressive treatment following kidney transplantation. Critical Reviews in Oncology/Hematology, 56, 2005.
4. Baccarani, U., Adani, G. L., Mantanaro, D., Risaliti, A., Lorenzin, D., Avellini, C., Tilissi, P., Groppuzzo, M., Curro, G., Luvisetto, F., Beltrami, A., Bresadola, V., Viale, P. L., Bresadola, F. De novo malignancies after kidney and liver transplantation: Experience on 582 consecutive cases; doi:10.1016/j.transproceed.2006.02.016
5. Adani, G. L., Baccarani, U., Lorenyin, D., Gropuzzo, M., Tulissi, P., Montanaro, D., Curro, G., Sainz, M., Risaliti, A., Bresadola, V., Bresadola, F. De novo gastrointestinal tumours after renal transplantation: Role of CMV and EBV viruses. Clin. Transplant., 2006 : 20.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2009 Issue 4-
All articles in this issue
- Antitrombotická profylaxe v chirurgických oborech – doporučení American College of Chest Physicians 2008
- Tolerance akcelerované pooperační rehabilitace po střevních resekčních výkonech
- Úloha chirurgického výkonu v liečbe Crohnovej choroby
- Náhodný nález maligního onemocnění při operačním řešení nezvyklé příčiny střevní obstrukce u pacientky po transplantaci ledviny
- Stenóza truncus coeliacus při duodenopankreatektomii
- Nádorový trombus dolní duté žíly u karcinomu ledviny
- Giardiosa, jako málo frekventní onemocnění v diferenciální diagnostice bolestí břicha
- Poranění femorálních cév u trochanterických zlomenin
- Antimikrobní léčba u komplikované nitrobřišní infekce – současný stav
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Stenóza truncus coeliacus při duodenopankreatektomii
- Nádorový trombus dolní duté žíly u karcinomu ledviny
- Antimikrobní léčba u komplikované nitrobřišní infekce – současný stav
- Úloha chirurgického výkonu v liečbe Crohnovej choroby
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

