-
Medical journals
- Career
Výsledky chirurgické léčby karcinomu tračníku s uplatněním radikální lymfadenektomie
Authors: L. Lipská; V. Visokai; M. Mráček; M. Levý
Authors‘ workplace: Chirurgická klinika 1. LF UK a Fakultní Thomayerovy nemocnice s poliklinikou, Praha přednosta: doc. MUDr. V. Visokai, Ph. D.
Published in: Rozhl. Chir., 2008, roč. 87, č. 5, s. 242-246.
Category: Monothematic special - Original
Overview
Autoři analyzovali vlastní soubor 1281 nemocných s kolorektálním karcinomem operovaných a sledovaných od I/1992 do VIII/2007 na jednom pracovišti. Vyhodnotili jsme zvlášť pacienty s karcinomem tračníku (C18). Pacienti s nádory rekta a rektosigmoideálního přechodu (C19+20) nejsou předmětem sdělení. Pro karcinom tračníku bylo operováno celkem 846 pacientů. Z nich u 546 bylo dosaženo radikální R0 resekce. Poměr muži/ženy v souboru R0 je 315/231, věk 29–94, průměr 69 let. Rozdělení souboru R0 podle stadií TNM: I 17,8 %, II 49,6 %, III 24,0 %, IV 8,1 %, TNMx 0,5 %. Tříleté přežití nezávisle na stadiu TNM je 80%, 5leté 71%, 10leté 51%. Medián přežití je 9,85 let. Pooperační mortalita dosáhla 5,5 %, morbidita 29,8 %, dehiscence anastomózy 5,7 %. Postupně byla do praxe kliniky zavedena systematická lymfadenektomie do úrovně apikálních uzlin jako integrální součást R0 operace. Cílem práce je rozbor výsledků chirurgické léčby karcinomu tlustého střeva s uplatněním radikální lymfadenektomie a analýza vlivu takto extenzivního výkonu na po-operační morbiditu a mortalitu.
Klíčová slova:
kolorektální karcinom – karcinom tračníku – chirurgická léčba – lymfadenektomie – radikalita – R0 resekce – přežití – morbidita – mortalitaÚVOD
Léčba karcinomu tračníku je v současnosti jedním z nejaktuálnějších problémů chirurgie obecně. V České republice bylo v roce 2005 diagnostikováno 2508 nových onemocnění karcinomem tračníku. Incidence u mužů byla 28,3/100 000, u žen 20,3/100 000 [1]. I přes celou řadu ostatních možných a používaných léčebných modalit zůstává chirurg nadále faktorem klíčovým a nenahraditelným. Již Moynihan ve své práci (1908) zdůrazňoval nutnost odstranění lymfatik s primárním nádorem [2]. Toto tvrzení však bylo po mnoho desetiletí zdrojem diskusí mezi zastánci a odpůrci lymfadenektomií. V současnosti panuje shoda, že adekvátní extenzivita resekce musí splňovat požadavky onkoradikality a současně umožnit stanovení pokročilosti nádorového onemocnění (staging). Uplatnění těchto zásad prokazatelně snižuje výskyt recidiv a zlepšuje přežití nemocných [2, 3, 4, 5, 6, 7, 8]. Cílem naší práce je rozbor výsledků chirurgické léčby karcinomu tlustého střeva s uplatněním radikální lymfadenektomie a analýza vlivu takto extenzivního výkonu na pooperační morbiditu a mortalitu.
METODIKA
Teoretické předpoklady
Jedním ze zásadních faktorů určujících prognózu pacienta s karcinomem tračníku je stadium onemocnění (stage). Mezi zavedené stangingové systémy patří:
- I. TNM (UICC) klasifikace (tumor, nodes, metastases)
- II. JGR (Japanese General Rules for clinical and pathologic studies on cancer of the colon, rectum and anus) [9]
- III. Dukesova klasifikace
V současnosti sílí snahy o přijetí jednotného stagingového systému, přičemž TNM klasifikace se jeví jako nejvhodnější a je všeobecně nejvíc používána. TNM vyhodnocuje vedle hloubky nádorové invaze (T) a přítomnosti vzdálených metastáz (M) též počet pozitivních spádových uzlin, kdy N1 znamená pozitivitu 1–3 uzlin, N2 > 3 uzlin [10]. JGR vyhodnocuje uzliny nejen podle počtu, ale také podle jejich lokalizace (distribuce) v rozsahu N1–N3: N1 uzliny epi - a parakolické ve vzdálenosti do 5 cm od tumoru, N2 uzliny epi - a parakolické do 10 cm od tumoru a uzliny intermediární, N3 vrcholové uzliny při odstupu nutriční tepny tj. uzliny apikální [11]. Podle literárních údajů se nádorová pozitivita apikálních (N3) uzlin v resekátech příslušných úseků tračníku vyskytuje u a. colica dx. cca ve 23 %, u a. colica media a a. colica sin. ve 20 %, a. mesenterica inf. v 9–25 % [12].
Vzdálené metastázy zakládá kolorektální karcinom nejčastěji v játrech a plicích. Výskyt synchronních jaterních metastáz je kolem 20 % [13]. Metachronní metastázy se objeví minimálně u dalších 20 % pacientů, nejčastěji v prvních dvou letech po primární operaci. Izolované plicní metastázy se vyskytují zhruba ve 2 % případů [14].
Strategie léčby
V praxi naší kliniky jsou jednoznačně stanoveny a dodržovány tři základní principy v přístupu k nemocným s karcinomem tlustého střeva:
- 1. dokonalý předoperační staging,
- 2. standardizace chirurgické léčby,
- 3. důsledné pooperační sledování (follow up).
Vlastní chirurgický výkon spočívá v radikálním odstranění postiženého úseku střeva s úplným odstraněním přilehlého mezokolon, ligatuře a protětí nutričních cév v místě jejich odstupu a v systematické lymfadenektomii do úrovně apikálních uzlin (N3 podle JGR).
U tumorů lokalizovaných na rozhraní dvou drenážních oblastí provádíme rozšířené resekce tračníku až subtotální kolektomie s ligaturami a protětím všech nutričních tepen v jejich kořeni a opět s lymfadenektomií do úrovně vrcholových uzlin.
Při podezření na prorůstání tumoru do okolního orgánu jsou nezbytné multiorgánové en bloc resekce [15]. Zda se jedná o adhezi či nádorovou infiltraci odliší pouze patolog mikroskopickým vyšetřením en bloc odstraněného resekátu. Nádorová invaze je prokázaná podle literárních údajů ve 30–80 % případů. Při nedodržení pravidla neoddělovat adherující orgány od nádoru se udává snížení očekávaného pětiletého přežití až o 40 % [6].
Při synchronním metastatickém postižení jater na našem pracovišti vždy zvažujeme možnost simultánní resekce primárního tumoru a jater.
SOUBOR PACIENTŮ, STATISTICKÉ ZPRACOVÁNÍ
Analyzovali jsme databázi 1281 pacientů operovaných a sledovaných pro kolorektální karcinom na chirurgické klinice 1. LF UK a FTNsP v Praze v období od 1/1992 do VIII/2007. Pro karcinom tračníku bylo operováno 846 pacientů. Radikální R0 resekce bylo dosaženo u 546 nemocných a z toho u 370 nemocných jsme provedli kromě R0 resekce taktéž radikální lymfadenektomii do úrovně apikálních N3 uzlin (R0/LE+). Před zavedením extenzivní lymfadenektomie bylo podle tehdejších požadavků radikálně operováno 176 pacientů (R0/LE-).
Poměr muži/ženy v souboru R0 je 315/231, věk 29–94, průměr 69 let. Elektivně bylo operováno 464, akutně 82 pacientů. Struktura souboru R0 podle TNM stadia: I 17,8 %, II 49,6 %, III 24,0 %, IV 8,1 %, TNMx 0,5 %.
Analyzovali jsme vliv vybraných prognostických faktorů (TNM stadium, grading tumoru, předoperační hladina nádorových markerů CEA a Ca19-9, věk, komorbidita, akutní vs. plánovaná operace, lymfadenektomie, pooperační komplikace, krevní ztráta) na celkové přežití a hospitalizační mortalitu. Efekt sledovaného faktoru byl stanoven univariačními testy (log-rank, wilcoxon, mediánový test) na 5% hladině významnosti.
VÝSLEDKY
Celkové přežití pacientů ukazuje tabulka 1 a graf 1. Nejvýznamnějšími faktory negativně ovlivňujícími dlouhodobé přežití v našem souboru jsou podle provedené analýzy pacientova komorbidita a pokročilé stadium onemocnění (TNM III+IV). Následují akutní operace, pooperační komplikace a neprovedení lymfadenektomie, tedy faktory, které může chirurg ve snaze o zlepšení dlouhodobého přežití pacienta do jisté míry aktivně ovlivnit. Neprokázali jsme vliv pohlaví, gradingu či předoperační hladiny nádorových markerů CEA a Ca19-9 na délku přežití (Tab. 2).
Table 1. Celkové přežití nezávisle na TNM stadiu v souboru pacientů R0 (n = 546) Tab. 1. Overall survival following R0 operation irrespective of the TNM stage (n = 546) 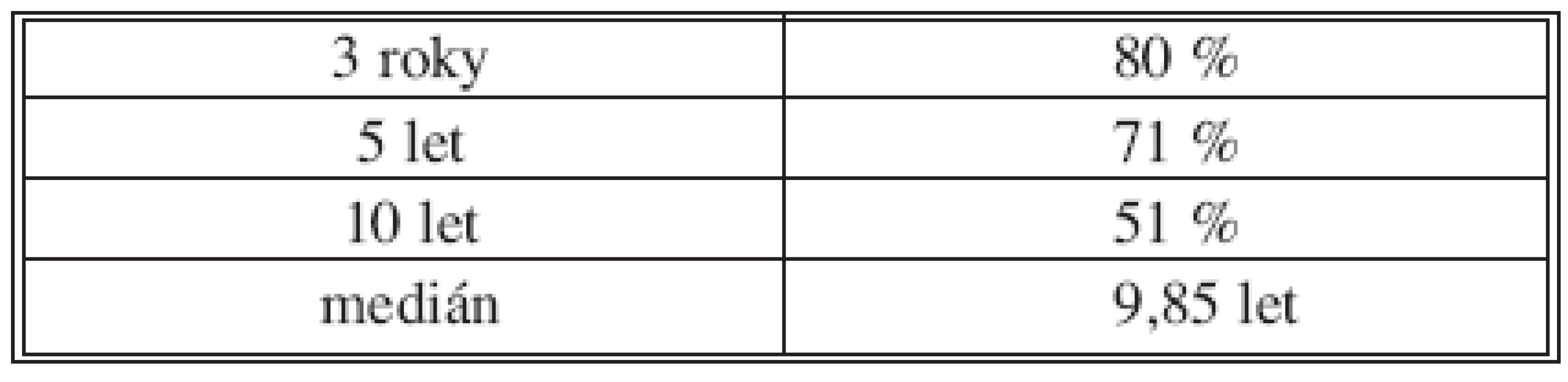
Graph 1. Porovnání celkového přežití pacientů s radikální lymfadenektomií (plná čára) vs. bez radikální lymfadenektomie (přerušovaná čára) Graph 1. Comparison of the overall survival rates in the radical lymphadenectomy group (full line) vs. the group without lymphadenectomy (dashed line) 
Table 2. Univariační analýza vybraných faktorů ve vztahu k celkovému přežití [na 5% hladině významnosti prokazujeme rozdíl v dlouhodobém přežití pacientů s lymfadenektomií a bez lymfadenektomie (p = 0,0021)] Tab. 2. Univariational analysis of the selected factors related to the overall survival rate [at the set 5% significance level, the authors demonstrated a difference in long- term survival rates between the patients with lymphadenectomy and those without lymphadenectomy (p = 0.0021)] ![Univariační analýza vybraných faktorů ve vztahu k celkovému přežití [na 5% hladině významnosti prokazujeme rozdíl v dlouhodobém přežití pacientů s lymfadenektomií a bez lymfadenektomie (p = 0,0021)]
Tab. 2. Univariational analysis of the selected factors related to the overall survival rate [at the set 5% significance level, the authors demonstrated a difference in long- term survival rates between the patients with lymphadenectomy and those without lymphadenectomy (p = 0.0021)]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/83d0e1e729debfa7ed7917cbb5a76cd8.png)
Hospitalizační morbiditu a mortalitu ukazují tabulky 3 a 4. Podle předložené analýzy pooperační komplikace zvyšují riziko úmrtí téměř 17x. Každý rok, o který je pacient starší, zvyšuje riziko smrti 1,1x. S věkem pacienta úzce koreluje jeho komorbidita. Jelikož v našem souboru nezemřel po výkonu žádný pacient bez vedlejší diagnózy, je komorbidita statisticky velmi významným rizikovým faktorem, hazard ratio však nelze hodnotit. Akutní operace zvyšuje pravděpodobnost úmrtí v pooperačním období 2x (hraniční p = 0,08). Neprokázali jsme vliv radikální lymfadenektomie a TNM stadia na pooperační mortalitu. Rovněž rozdíl v průměrné krevní ztrátě u pacientů zemřelých po operaci (EX+) a přeživších (EX-) není statisticky významný (Tab. 5).
Table 3. Pooperační morbidita a mortalita v souboru pacientů R0 vs. R0/LE+ vs. R0/LE- Tab. 3. Postoperative morbidity and mortality rates in the R0 group vs. R0/LE+ vs. R0/LE- 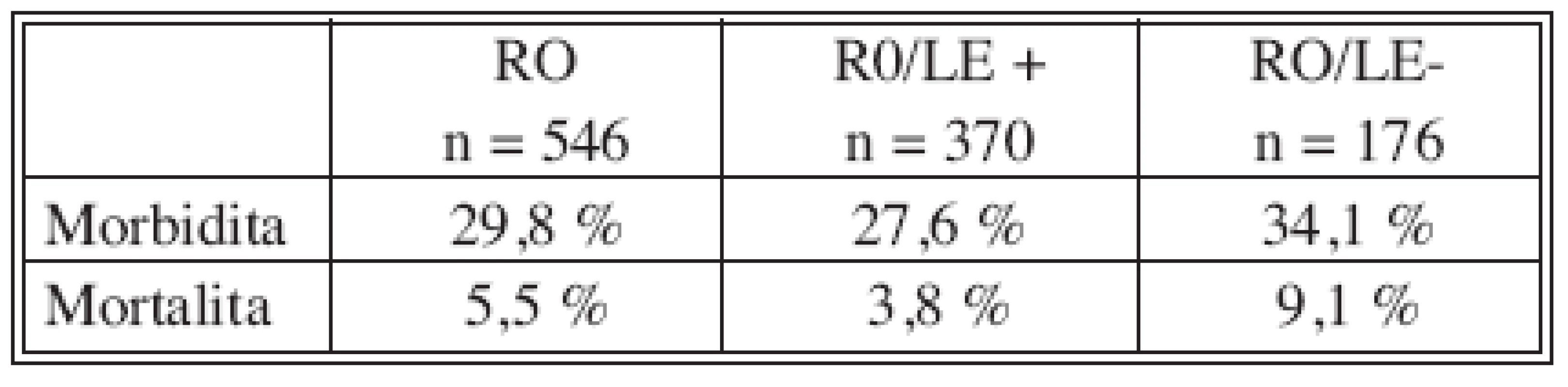
Table 4. Pooperační komplikace v souboru pacientů R0 Tab. 4. Postoperative complications in the R0 patient group 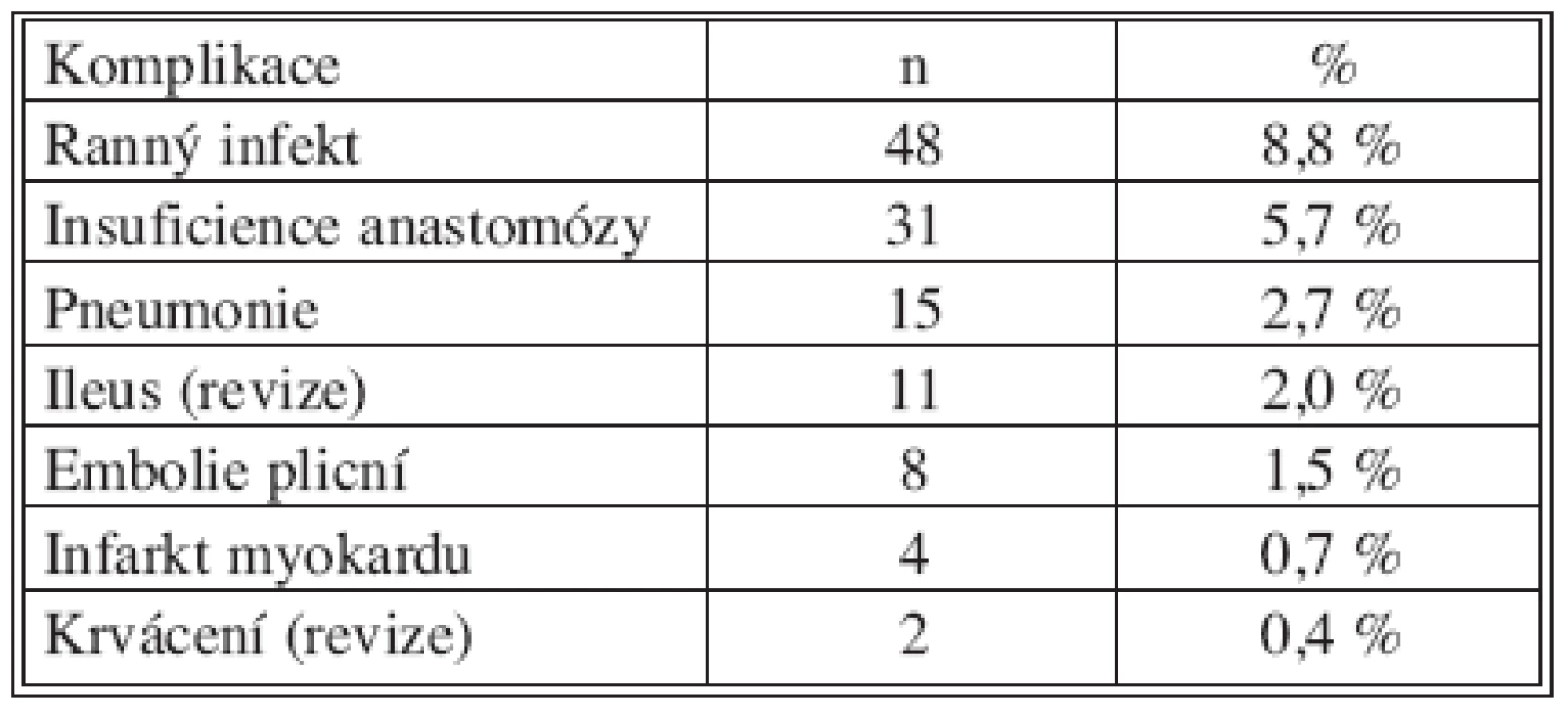
Table 5. Univariační analýza vybraných faktorů ve vztahu k pooperační mortalitě [na 5% hladině významnosti neprokazujeme rozdíl v pooperační mortalitě pacientů s lymfadenektomií a bez lymfadenektomie (p = 0,2580)] Tab. 5. Univariate analysis of the selectied factors related to postoperative mortality rates [at the set 5% significance level, was not demonstrated. A difference in the postoperative mortality between the patients with lymphadenectomy and those without lymphadenectomy (p = 0.2580)] ![Univariační analýza vybraných faktorů ve vztahu k pooperační mortalitě [na 5% hladině významnosti neprokazujeme rozdíl v pooperační mortalitě pacientů s lymfadenektomií a bez lymfadenektomie (p = 0,2580)]
Tab. 5. Univariate analysis of the selectied factors related to postoperative mortality rates [at the set 5% significance level, was not demonstrated. A difference in the postoperative mortality between the patients with lymphadenectomy and those without lymphadenectomy (p = 0.2580)]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/11d28124c842854a5ffd792cbb745fbd.png)
Image 1. Stav po resekci sigmatu s radikální lymfadenektomií Fig. 1. An operation field following sigmoid resection with radical lymphadenectomy 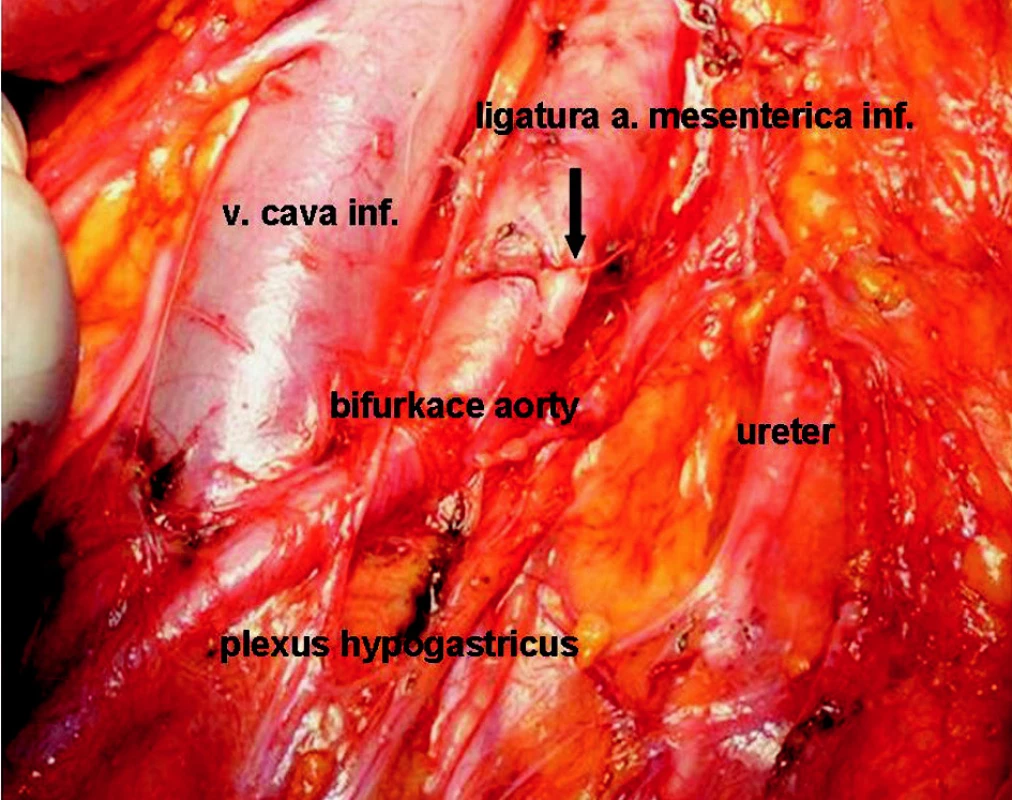
Image 2. Stav po rozšířené levostranné hemikolektomii s radikální lymfadenektomií Fig. 2. An operation field following extensive left-sided hemicolectomy with radical lymphadenectomy 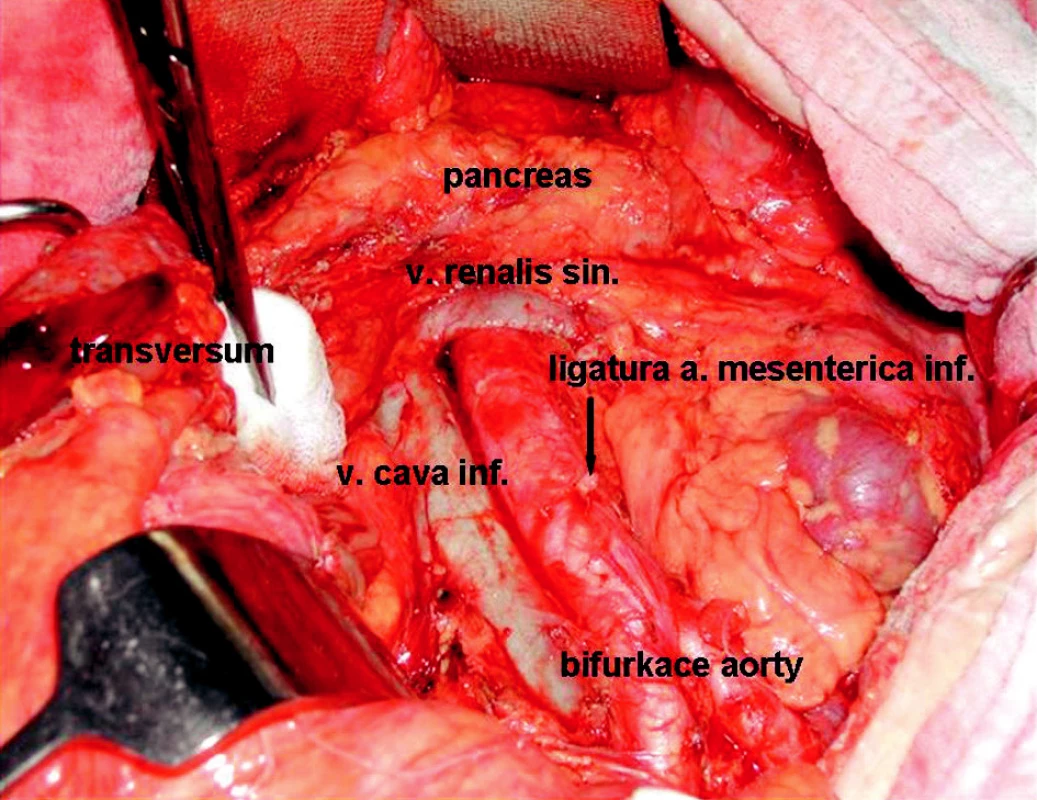
DISKUSE
Jak vyplývá z definice TNM klasifikace, prognózu nemocného ovlivňuje vedle hloubky invaze tumoru a přítomnosti vzdálených metastáz zejména počet nádorově infiltrovaných uzlin [3, 7, 10]. Pouze odstranění všech spádových uzlin s následným histopatologickým vyšetřením může poskytnout objektivní informaci o jejich stavu a tím i stanovení přesného stagingu, který je nezbytný k indikaci adjuvantní chemoterapie. Předoperační vyšetření, včetně zobrazovacích metod, neurčuje vždy spolehlivě rozsah onemocnění. Například před-operační CT vyšetření vykazuje při histologické pozitivitě N1 (JGR) uzlin specificitu pouze 41–68 % [16, 17]. Magnetická rezonance má o něco lepší výtěžnost stran pozitivity uzlin, zvláště pokud jsou použita i jiná diagnostická kritéria než velikost (nepravidelné okraje, rozdíly v intenzitě signálu), její senzitivita je udávána až 85 %, specificita 97 % [18]. PET resp. PET/CT vyšetření je přínosné spíše v diagnostice orgánových metastáz, abdominálních i extraabdominálních, jeho senzitivita pro metastázy v lymfatických uzlinách je nízká (29 %) [19]. Rovněž peroperačně zjištěná velikost uzlin či jejich konzistence nemá žádnou vypovídací hodnotu o jejich stavu. Až 50 % nádorově postižených uzlin je menších než 5 mm [20]. V tomto směru je třeba nadále klást důraz na samotnou techniku operování, tedy provádět zásadně radikální lymfadenektomii a při hraničním umístnění primárního tumoru neváhat s rozšířením rozsahu resekce.Techniky jako vyšetření sentinelové uzliny nebo lymfatické mapování mohou při správném provedení napomoci v určení potřebného rozsahu lymfadenektomie, ale zůstávají nadále předmětem diskusí [21].
Ke stanovení exaktního pN je podle posledního vydání TNM nutné vyšetřit nejméně 12 uzlin, podle aktualizovaných guidelines americké společnosti kolorektálních chirurgů dokonce 15 uzlin [10]. Obecně lze říci, že čím více uzlin je vyšetřeno, tím lépe [22]. Významně prognosticky nepříznivým faktorem je nález pozitivity ve skupině apikálních uzlin (N3 podle JGR), nebo pozitivita ve 4 a více uzlinách (N2 podle TNM) [7]. Problémem histologického vyšetření lymfatických uzlin zůstává přítomnost mikrometastáz. K jejich detekci je třeba speciálních vyšetřovacích technik. Použitím imunohistochemických metod byly prokázány nádorové buňky až ve 26,5 % případů původně označených jako pNO. Následně byla ve skupině pacientů s takto potvrzenými mikrometastázami prokázána recidiva nádoru ve 33 %, při jejich nepotvrzení ve 12 % [23, 24].
Výsledkem nedokonalého odstranění a/nebo histologického zpracování uzlin může být vedle ponechání infiltrovaných uzlin in situ též nepřesné stanovení stagingu onemocnění (understaging). Při chybném zařazení pacienta do TNM stadia II, místo III, není indikována adjuvantní chemoterapie se všemi důsledky. Naopak, při nedostatečném počtu odstraněných a vyšetřených uzlin (pNx), pacient dostane adjuvantní chemoterapii, která by při dostatečném počtu vyšetřených uzlin event. nebyla indikovaná. Obě eventuality pak zhoršují výsledky dlouhodobého přežití v daném souboru.
ZÁVĚR
Přes značné pokroky v chemoterapii karcinomu tlustého střeva zůstává chirurg i nadále klíčovým článkem léčebného procesu. Výše uvedené a doporučované chirurgické postupy jsou ve shodě s našimi zkušenostmi a potvrzují oprávněnost provádění radikální lymfadenektomie. Ta je nezbytná jednak ke stanovení dokonalého stagingu onemocnění a tím i k indikaci adekvátní adjuvantní terapie, zároveň je výkonem léčebným, jelikož snižuje pravděpodobnost lokoregionální rekurence.
Přes rozšířenou extenzivitu operačního výkonu jsme v našem souboru nemocných s radikální lymfadenektomií nezaznamenali vyšší pooperační morbiditu a mortalitu.
Domníváme se, že zdrženlivost a omezení radikality operačních výkonů pro karcinom tračníku rozhodně není na místě. Dodržováním uvedené chirurgické strategie jsou výsledky (dlouhodobé přežití, morbidita, mortalita) v našem souboru srovnatelné s výsledky udávanými ve světové literatuře.
MUDr. L. Lipská, Ph.D.
Chirurgická klinika 1. LF UK a FTNsP
Vídeňská 800
140 59 Praha 4
e-mail: ludmila.lipska@ftn.cz
Sources
1. ÚZIS ČR, Aktuální informace č. 59/2007: Zhoubné nádory v roce 2005.
2. Moynihan, B. G. The surgical treatment of cancer of the sigmoid flexure and rectum: with the special reference to the principles to be observed. Surg. Gynecol. Obstet., 1908; 4(6): 463–466.
3. Le Voyer, T. E., Sigurdson, E. R., Hanlon, A. L., Mayer, R. J., Macdonald, J. S., Catalano, P. J., Haller, D. G. Colon cancer survival is associated with increasing number of lymph nodes analyzed: a secondary survey of intergroup trial INT-0089. J. Clin. Oncol., 2003; 21(15): 2912–2919.
4. Tagliacozzo, S., Tocchi, A. Extended mesenteric excision in right hemicolectomy for carcinoma of the colon. Int. J. Colorectal Dis., 1997; 12(5): 272–275.
5. Herfarth C, Weitz J. Progress in oncological visceral surgery: colon carcinoma, Kongressbd. Dtsch. Ges. Chir. Kongr., 2001; 118 : 95–100.
6. Maurer, C. A., Renzulli, P., Kasparek, M. S., Hager, F., Tabrizi, S. A., Mazzucchelli, L., Buchler, M. W. The role of lymph nodes in colon carcinoma. Zentralbl. Chir., 2000; 125(10): 863–869.
7. Cohen, A. M., Tremiterra, S., Candela, F., Thaler, H. T., Sigurdson, E. R. Prognosis of node-positive colon cancer. Cancor, 1991; 67(7): 1859–1861.
8. Sugarbaker, P. H., Corlew, S. Influence of surgical techniques on survival in patients with colorectal cancer. Dis. Colon Rektum, 1982; 25(6): 545–557.
9. Hida, J., Zasutími, M., Fujimoto, K., Maruyama, T., Kubo, R., Okuno, K., Shindo, K. Comparison between the Japanese generál rules and the TNM system in the regional lymph node classification of carcinoma of the colon. J. Am. Coll. Surg., 1996; 183(6): 611–615.
10. Sobin, L. H., Wittekind, Ch. TNM klasifikace zhoubných novotvarů (UICC) 6. vydání 2002, česká verze 2004, Praha: ÚZIS, 2004, 196 s.
11. Hida, J., Okuno, K., Yasutomi, M., Yoshifuji, T., Matsuzaki, T., Uchida, T., Ishimaru, E., Tokoro, T., Shiozaki, H. Number versus distribution in classifying regional lymph node metastases from colon cancer. J. Am. Coll. Surg., 2005; 201 (2): 21, 7–22.
12. Adachi, Y., Mori, M., Matsushima, T., Kido, A., Shimono, R., Inoue, T., Sugimachi, K. The distribution of lymph node metastases in right-sided colon cancer. J. Clin. Gastroenterol., 1994;19(3): 210–213.
13. Otchy, D., Hyman, N. H., Simmang, C., Antony, T., Buie, W. D., Cataldo, P., Church, J., Cohen, J., Dentsman, F., Ellis, C. N., Kilkenny, J. W. 3rd, Ko, C., Moore, R., Orsay, C., Place, R., Rafferty, J., Rakinic, J., Savoca, P., Tjandra, J., Whiteford, M. Standards Practice Task Force; American Society of Colon and Rectal Surgeons. Practice parameters for colon cancer. Dis. Colon Rektum, 2004; 47(8): 1269–1284.
14. Scheele, J., Altendorf-Hofmann, A., Stangl, R., Gall, F. P. Pulmonary resection for metastatic colon and upper rectum cancer. Is it useful? Dis. Colon Rektum, 1990; 33(9): 745–752.
15. Visokai, V., Lipská, L., Bergmann, P., Levý, M., Trubač, M., Martinu, V., Svobodová, S., Kormunda, S. Multiorgan resections for advanced colorectal cancer. Anticancer Res., 2006; 26(4): 3183–3186.
16. Gomille, T., Aleksic, M., Ulrich, B., Christ, F. Significance of CT in the detection of regional lymph node metastases in colorectal carcinoma. Radiologe, 1998; 38(12): 1077–1082.
17. Hundt, W., Braunschweig, R., Reiser, M. Evaluation of spiral CT in staging of colon and rectum carcinoma. Eur. Radiol., 1999; 9(1 ): 78–84.
18. Brown, G., Richards, C. J., Bourne, M. W., Newcombe, R. G., Radcliffe, A. G., Dallimore, N. S., Williams, G. T. Morphologic predictors of lymph node status in rectal cancer with use of high-spatial-resolution MR imaging with histopathologic comparison. Radiology, 2003; 227(2): 371–377.
19. Kantorová, I., Lipská, L., Bělohlávek, O., Visokai, V., Trubač, M., Schneiderová, M. Routine (18)F-FDG PET preoperative staging of colorectal cancer: comparison with conventional staging and its impact on treatment decision making. J. Nud. Med., 2003; 44(11): 1784–1788.
20. Bruch, H. P., Schwandner, O., Schiedeck, T. H., Roblick, U. J. Actual standards and controversies on operative technique and lymph-node dissection in colorectal cancer. Langenbecks Arch. Surg., 1999; 384(2): 167–175.
21. Duben, J., Gatěk, J., Dudešek, B., Haša, E., Hnátek, L. Pokroky v lymfadenektomii u kolorektálního karcinomu-lymfatické mapování. Rozhl. Chir., 2004; 83(5): 225–230.
22. Joseph, N. E., Sigurdson, E. R., Halon, A. L., Way, H., Mayer, R. J., MacDonald, J. S., Catalano, P. J., Halley, D. G. Accuracy of determining nodal negativity in colorectal cancer on the basis of the number of nodes retrieved on resection. Ann. Surg. Oncol., 2003; 10(3): 203–205.
23. Broll, R., Schauer, V., Schimmelpenning, H., Strik, M., Woltmann, A., Best, R., Bruch, H. P., Duchrow, M. Prognostic relevance of occult tumor cells in lymph nodes of colorectal carcinomas: an immunohistochemical study. Dis. Colon Rektum, 1997; 40(12): 1465–1471.
24. Liefers, G. J., Cleton-Jansen, A. M., van de Velde, C. J., Hermans, J., van Krieken, J. H., Cornelisse, C. J., Tollenaar, R. A. Micrometastases and survival in stage II colorectal cancer. N. Engl. J. Med., 1998; 339(4): 223–228.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2008 Issue 5-
All articles in this issue
- Elektivní videotorakoskopie jako prevence vzniku primárního spontánního pneumotoraxu – ano či ne?
- Spontánní trombóza pseudoaneuryzmatu slezinné tepny
- Funkční změny kardioezofageální oblasti po laparoskopické fundoplikaci
- Výsledky chirurgické léčby karcinomu tračníku s uplatněním radikální lymfadenektomie
- Zevní fixace v léčbě syndromu diabetické nohy
- Léčba erektilní dysfunkce mužů po poranění míchy inhibitory fosfodiesterázy 5
- Syndróm AMS a jeho riešenia
- Cystadenom jater s ovariálním stromatem – kazuistika
- Primární retroperitoneální tumor – extraadrenální paragangliom – kazuistika
- Liečba trombotických komplikácií chirurgických infrainguinálnych revaskularizačných výkonov
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Syndróm AMS a jeho riešenia
- Primární retroperitoneální tumor – extraadrenální paragangliom – kazuistika
- Funkční změny kardioezofageální oblasti po laparoskopické fundoplikaci
- Léčba erektilní dysfunkce mužů po poranění míchy inhibitory fosfodiesterázy 5
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

