-
Medical journals
- Career
Netuberkulózní mykobakteriální infekce v dětském věku
Authors: Nicol Koblásová 1; Jan Mejzlík 1,2; Lukáš Školoudík 1,2; Hubert Vaníček 2,3; Jana Dědková 4; Jan Laco 2,5; Petra Kašparová 2,5; Lenka Ryšková 2,6; Viktor Chrobok 1,2
Authors‘ workplace: Univerzita Karlova, LF v Hradci Králové 2; Dětská klinika, FN Hradec Králové 3; Radiologická klinika, FN Hradec Králové 4; Fingerlandův ústav patologie, FN Hradec Králové 5; Ústav klinické mikrobio logie, FN Hradec Králové 6
Published in: Otorinolaryngol Foniatr, 73, 2024, No. 1, pp. 8-15.
Category: Original Article
doi: https://doi.org/10.48095/ccorl20248Overview
Úvod: Infekce krčních uzlin netuberkulózními mykobakteriemi (NTM), dříve označované i jako atypické mykobakteriální infekce, se u dětí v České republice řadí ke vzácným onemocněním. V současnosti je patrna narůstající incidence, zřejmě vlivem ukončení celoplošné kalmetizace v listopadu 2010. Cíl studie: Podat přehled klinického obrazu, diagnostických možností a terapeutického přístupu u dětí s postižením krčních uzlin netuberkulózními mykobakteriemi. Metodika: Retrospektivně zpracovaný soubor dětí s potvrzenou infekcí léčených na Klinice otorinolaryngologie a chirurgie hlavy a krku FN Hradec Králové od 2010 do 2021. Zařazovacím kritériem byl průkaz původce onemocnění (netuberkulózní mykobakterie) kultivačním vyšetřením nebo molekulárně biologickou metodou (PCR). Výsledky: Celkem bylo zařazeno 19 dětí s průměrným věkem 26 měsíců (rozmezí 12–42 měsíců; SD 7,27). Nejčastějším prokázaným patogenem bylo Mycobacterium avium (n = 16). Kultivační vyšetření bylo pozitivní v 84 % (n = 16) případů, PCR testování bylo pozitivní u 47 % pacientů (n = 9). Všechny děti ze souboru podstoupily jak chirurgickou, tak antibiotickou léčbu. Nejčastěji užívanými antibiotiky byla kombinace makrolidového antibiotika (klaritromycin) s antituberkulotikem (rifampicin). U šesti dětí byla provedena incize spolu s drenáží ložiska a pro trvání zánětu následovala kompletní exstirpace patologické tkáně v celkové anestezii. Celkem 15 dětí podstoupilo probatorní exstirpaci patologické krční uzliny. Blokové disekce infikované tkáně jsme provedli u sedmi dětí pro reziduální zánět. Závěr: Optimální léčbou netuberkulózní mykobakteriální lymfonoditidy je exstirpace postižené uzliny a okolních zánětlivě změněných tkání společně s antibiotickou terapii klaritromycinem a rifampicinem.
Klíčová slova:
deti – mykobakteriální infekce – netuberkulózní mykobakterie – zánět krčních uzlin
Úvod
Mykobakterie se řadí mezi nepohyblivé, aerobní a sporulující mikroorganizmy. Obsahují ve stěně vosky a lipidy, které zabezpečují odolnost vůči okolnímu prostředí a způsobují odolnost k obarvení kyselinami, zásadami a alkoholem. Mykobakterie se in vivo rozmnožují a přetrvávají v makrofázích, proto jsou považovány za intracelulární patogeny. Běžné barvení dle Grama používané pro většinu jiných bakterií mykobakterie neobarvuje, proto se používá barvení dle Ziehla-Neelsena anebo fluorescenční. Vzhledem k dlouhé generační době je nutná pro mikrobiologický průkaz speciální půda, na které se mykobakterie kultivují dny až týdny. Mykobakterie se dělí do dvou skupin na tuberkulózní a netuberkulózní. Etiologicky se vyskytuje velký počet druhů netuberkulózních mykobakterií, kolem 200 druhů, a z toho je 120 patogenních pro člověka [1]. Nejčastějšími jsou M. avium complex (zahrnuje M. intracellulare a M. avium), M. kansasii, M. xenopii, M. gordonae, M. chelonae, M. abscessus, M. scrofulaceum, M. heamophilum, M. malmoensae a M. ulcerans. Celosvětově je 80–90 % kultivačně prokázaných případů netuberkulózních mykobakterióz (NTM) krčních uzlin způsobeno druhem M. avium. Netuberkulózní typy bakterií můžeme najít ve volné přírodě, v půdě, ve vodě, na povrchu rostlin, častější je výskyt u některých druhů zvířat. V minulosti byl u nakažených dětí často udáván kontakt se zvířecím trusem, a to konkrétně se slepičím [2]. Dle nových prací však nebyl uvedený vztah k nákaze prokázán [3]. Interhumánní přenos uzlinové formy mykobakteriózy nebyl také prokázán. V dnešní době je za zdroj infekce považována environmentální nákaza. Možné je i nakažení dítěte při vkládání kontaminovaných předmětů do dutiny ústní. Nejohroženější skupinou obyvatelstva jsou předškolní děti v období prořezávání dočasné dentice. Největší výskyt onemocnění byl zaznamenán mezi 1. a 5. rokem věku dítěte, vzácně po 12. roce [4]. Průnik mikroorganizmů do krevního oběhu se nejprve manifestuje jako běžná respirační infekce s reaktivně zvětšenými uzlinami nejčastěji v submandibulární oblasti, následuje postižení okolních tkání v podobě jednostranného nebolestivého zduření. Postižená uzlina může být lokalizována také v parotické krajině, vzácněji v jiných krčních lokalitách [5]. V době stanovení diagnózy bývá onemocnění přítomno po dobu týdnů až měsíců a typicky nebývá provázeno celkovou zánětlivou odezvou organizmu. Při kolikvaci uzliny se postupně objevuje fluktuace, později barevné změny na kůži a píštěle s hnisavým výtokem.
Cíl práce
Cílem práce je podat přehled klinického obrazu a diagnostických možností společně s terapeutickým přístupem u dětí léčených na Klinice otorinolaryngologie a chirurgie hlavy a krku FN Hradec Králové v letech 2010–2021 v případě postižení krčních uzlin netuberkulózními mykobakteriemi. Konzervativní a chirurgický přístup k léčbě je porovnán se zahraniční literaturou.
Metodika
V práci je retrospektivně zpracován soubor 19 dětí, které byly léčeny na Klinice otorinolaryngologie a chirurgie hlavy a krku v Hradci Králové v letech 2010–2021 s potvrzenou netuberkulózní mykobakteriální infekcí v krčních uzlinách. Zařazovacím kritériem byl průkaz infekce pomocí kultivačního vyšetření nebo molekulárně biologickou metodou polymerázové řetězová reakce (PCR). Sledovanými parametry byly pohlaví, věk, výsledky krevních odběrů a zobrazovacích vyšetření. Pro lokalizaci postižených uzlin byla použita Robbinsova klasifikace krčních oblastí (tab. 1) a klinický obraz byl hodnocen pomocí čtyřstupňové Georgetownovy klasifikace (tab. 2). Dalšími hodnocenými faktory byly výsledky mikrobiologických vyšetření a histologických nálezů, výsledky chirurgické terapie, výskyt pooperačních komplikací, typ a délka antibiotické léčby. Data ze souboru byla zpracována pomocí statistického programu Jamovi Project (Version 1.6). Hodnota p < 0,05 byla považována za statisticky významnou.
Table 1. Lokalizace uzlin v jednotlivých krčních oblastech dle Robbinsovy klasifi kace (společně s parotickou oblastí). 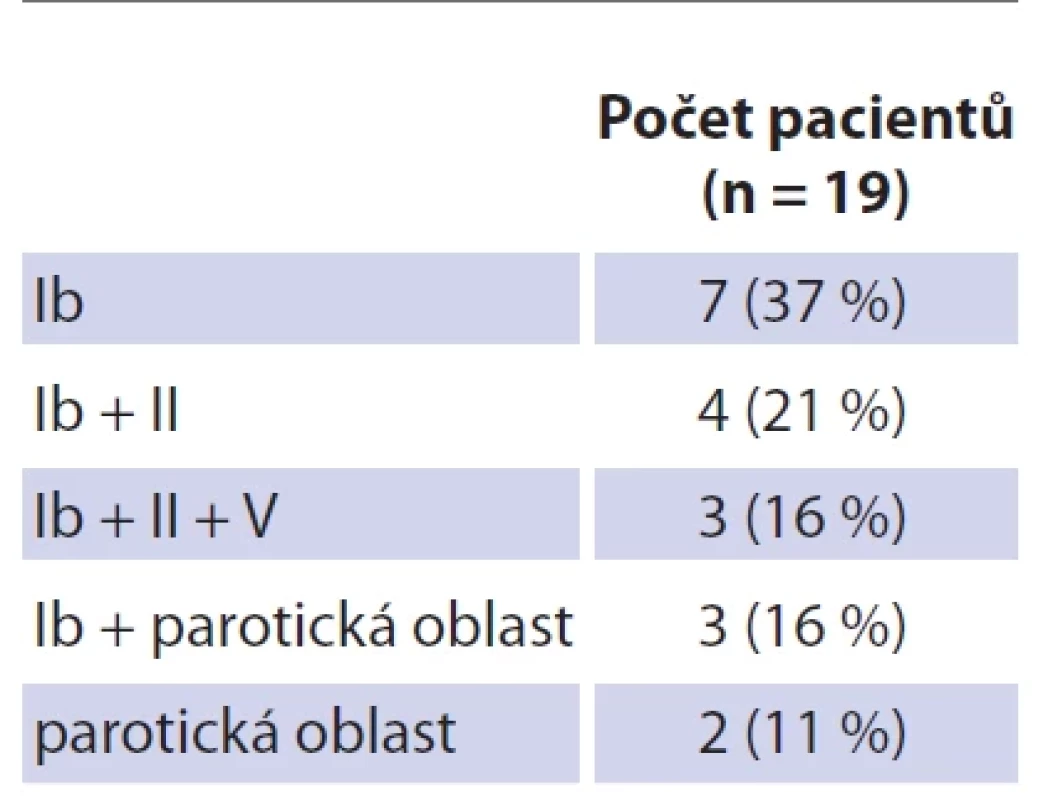
Tab. 1. Localization of lymph nodes in individual neck regions according to Robbin´s classifi cation (together with a parotid region). Table 2. Klasifikace uzlin pomocí Georgetownova klasifi kačního systému. 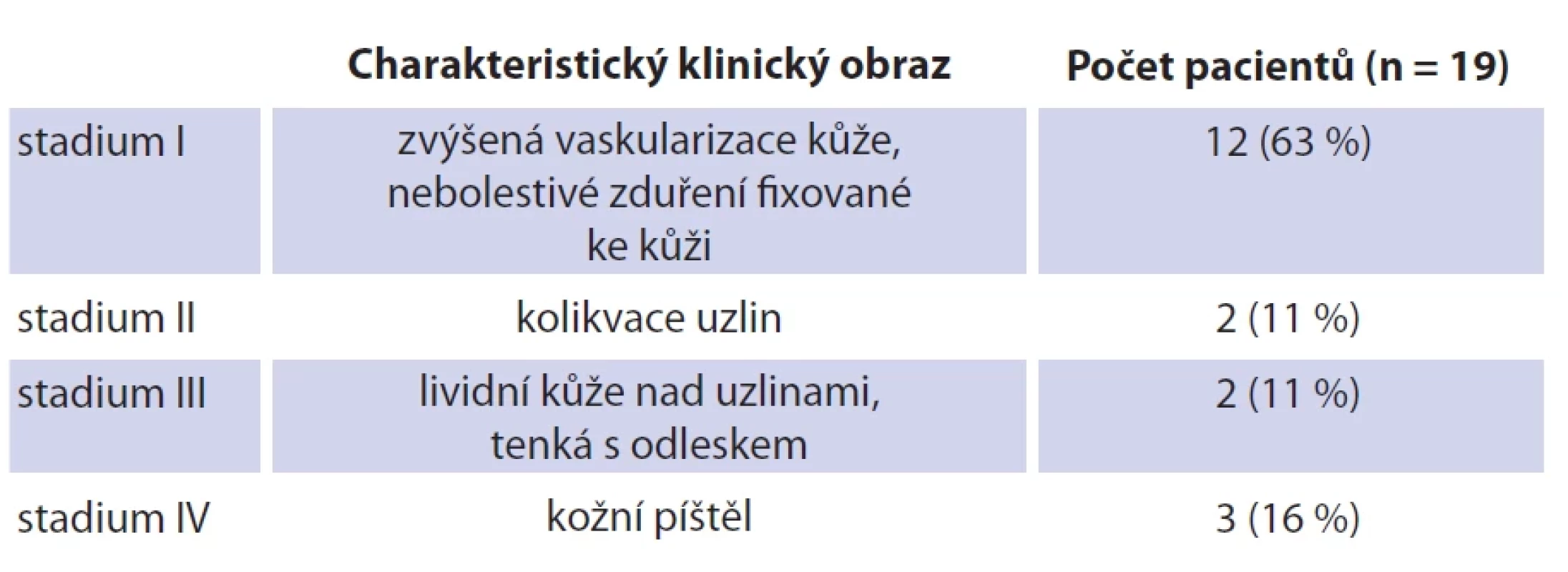
Tab. 2. Classification of lymph nodes using Georgetown classification
system.Table 3. Soubor pacientů a věková struktura. 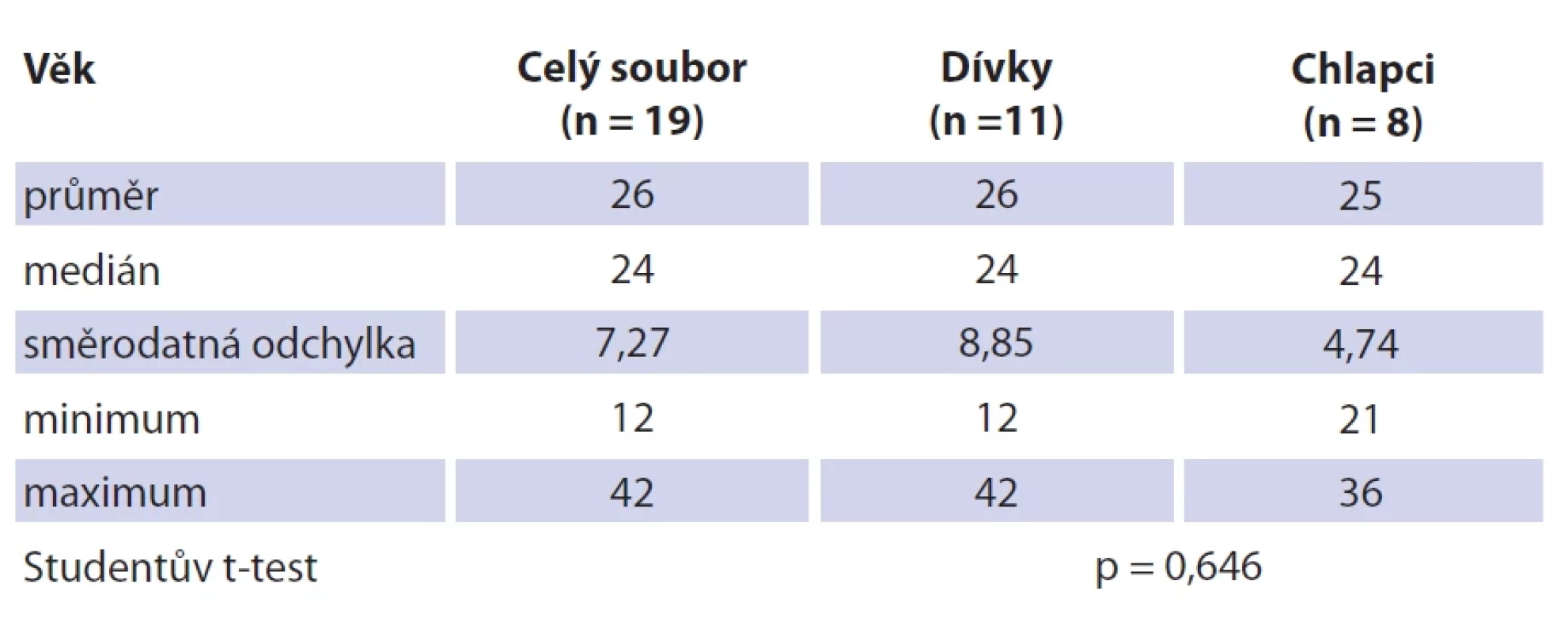
Tab. 3. Patient group and age structure. Table 4. Výsledky provedených mikrobiologických vyšetření. 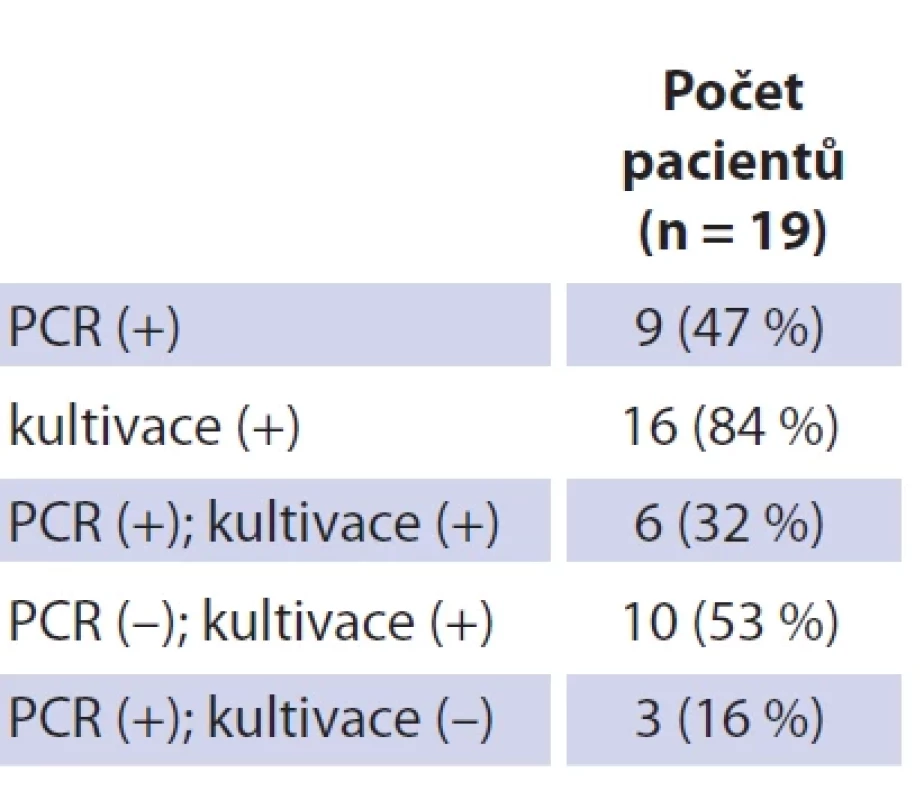
Tab. 4. Results of microbiological examinations. Image 1. Přehled lymfatické uzliny postižené netuberkulózním zánětem rozsáhlými nekrózami (hematoxylin-eozin). 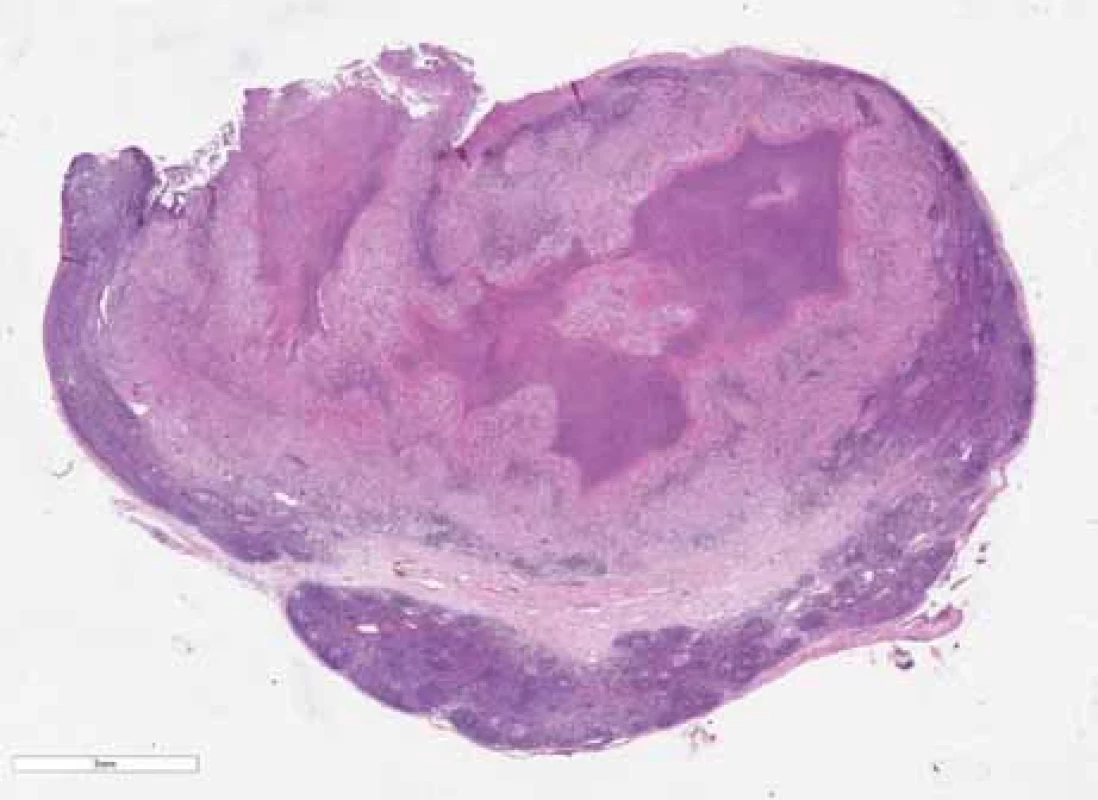
Fig. 1. Overview of a lymph node with nontuberculous infl ammation with extensive necrosis (hematoxylin-eosin). Výsledky
Soubor tvoří 19 dětských pacientů s průměrným věkem 26 měsíců (rozmezí 12–42 měsíců; SD 7,27). Dívek bylo 11 (průměrný věk 26 měsíců, rozmezí 12–42; SD 8,85), chlapců osm (průměrný věk 25 měsíců, rozmezí 21–36; SD 4,74). Jedná se o věkově homogenní soubor bez statisticky významného věkového rozdílu mezi pohlavím (p = 0,646) (tab. 3). Průměrná hodnota C-reaktivního proteinu (CRP) v souboru činila 1,80 mg/l (SD 2,75), v krevním obraze byla průměrná hodnota počtu leukocytů 9,53 × 109/l (SD 2,89). Neprokázali jsme statisticky významný rozdíl mezi hodnotou CRP (p = 0,395) a celkovým počtem leukocytů (p = 0,528) mezi pohlavími. U všech dětí bylo provedeno ultrazvukové vyšetření krku, kolikvace byla popsána u sedmi dětí a kožní píštěl u dvou dětí. Nejčastěji byla patologická uzlina nalezena v regiu I, méně často v parotické (preaurikulární) oblasti, u některých dětí bylo postiženo více lokalit na krku (tab. 3). Všechny děti ze souboru měly pomocí RTG snímku hrudníku vyloučeno postižení plic. Magnetickou rezonanci (MR) v úvodu před naší léčbou měly čtyřo děti, výpočetní tomografie (CT) byla provedena u jednoho dítěte. Jako původce infekce bylo v 16 případech prokázáno M. avium. Jednou bylo nalezeno M. lentiflavum, jednou M. mantenii a M. colombiense (součást komplexu M. avium). Kultivace byla pozitivní u 16 (84 %) dětí, pozitivní PCR u devíti (47 %) dětí. Přítomnost pozitivity při vyšetření metodou PCR a negativní kultivace byla u tří dětí. Negativní PCR vyšetření a pozitivní kultivace byla u 10 dětí, pozitivní výsledek obou mikrobiologických metod byl u šesti dětí (tab. 4). V histologickém obraze nacházíme granulomy s epiteloidními buňkami, které byly přítomny u všech dětí. Obrovskobuněčné multinukleární buňky Langhansova typu byly nalezeny u 16 dětí (obr. 1, 2). Kaseózní nekróza byla pozorována u 10 dětí, u čtyř dětí byla drobná a nedeskriptivní nekróza. Formování mikroabscesů s hnisáním v centru uzliny bylo nalezlo v 11 vzorcích. Pozitivní Ziehlovo-Neelsenovo barvení bylo u 10 vzorků. Tab. 5 uvádí typ chirurgického výkonu, antibiotické terapie a počty dětí s perzistencí zánětu. U všech dětí před selektivní blokovou krční disekcí bylo indikováno MR vyšetření pro určení rozsahu postižení. Pooperační parézu marginální větve lícního nervu jsme pozorovali u šesti dětí. Trvalé postižení funkce nervu po dobu delší než 1 rok bylo ve dvou případech. Nebylo pozorováno postižení jiných kraniálních nervů či další vážnější komplikace chirurgického výkonu. Délka antibiotické terapie byla určována podle klinického stavu dítěte a výsledků zobrazovacích vyšetření. Nejkratší doba užívání byla 14 dní u dvou dětí, nejdelší 4 měsíce u čtyř dětí. Medián užívání antibiotik byl 3 měsíce. Následné pooperační sledování s pravidelnými ultrazvukovými kontrolami po dobu 2 let probíhalo u všech dětí ze souboru.
Image 2. Lymfatická uzlina s nekrózou uvnitř, kde jsou patrny rozpadlé neutrofily a vícejaderné buňky (hematoxylin-eozin, původní zvětšení 10×). 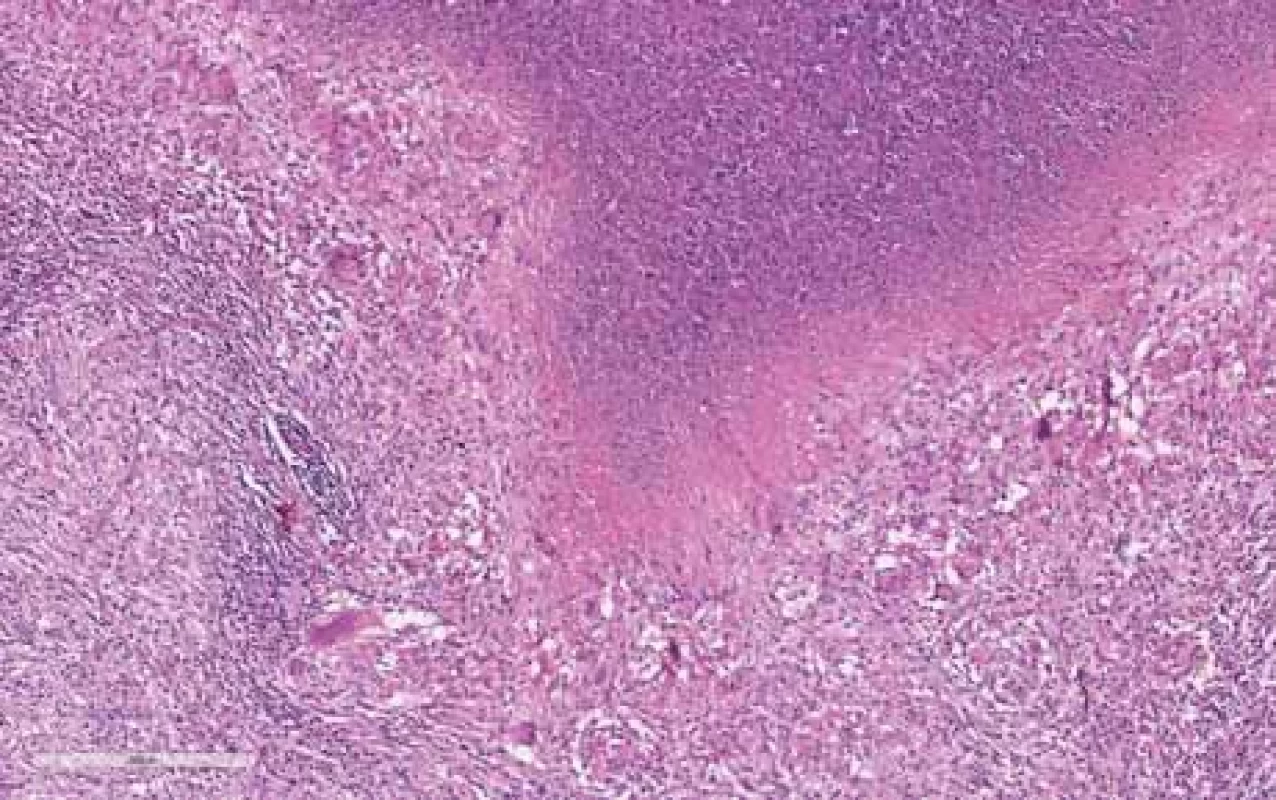
Fig. 2. Lymph node with necrosis inside, showing disintegrated neutrophils and multinuclear cells (hematoxylin-eosin, original magnification 10×). Table 5. Přehled provedeného chirugického výkonu, antibiotické terapie a perzistencí zánětu. 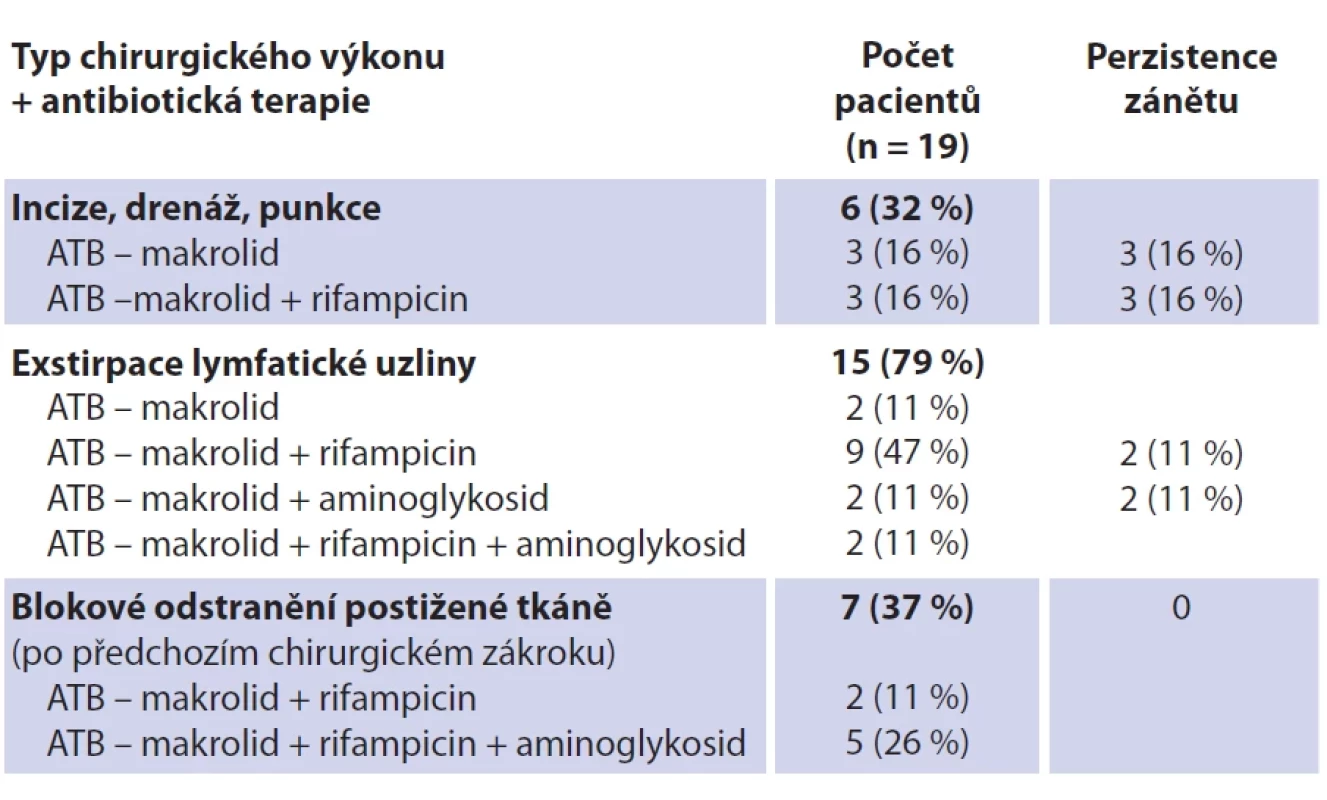
Tab. 5. Overview of performed surgical procedure, antibiotic therapy and persistence of inflammation. Diskuze
Infekcí NTM jsou ve většině případů postiženy zdravé děti bez prokázané poruchy imunitní funkce organizmu. Jsou však popisovány i kazuistické případy dětí, u nichž bylo přítomno postižení uzlin a následně zjištěn deficit IL-12 [6]. V rámci predispozice k onemocnění jsou známé některé rizikové skupiny dětí. Mezi dané skupiny patří například imunokompromitované děti s hematologickým onemocněním, s těžkým imunitním deficitem, chronickou granulomatózní nemocí nebo nemocí štěpu proti hostiteli po transplantaci. Iatrogenně způsobený imunodeficitní stav při léčbě kortikoidy (systémovými nebo inhalačními), TNFa inhibitory nebo léky užívanými po transplantacích činí jedince náchylnějšími k infekci. Jiný popisovaný stav spojovaný s infekcí je deficit vitaminu D nebo polymorfizmy receptoru pro vitamin D [7]. Když se však blíže zaměříme výlučně na postižení krčních uzlin, téměř vždy se jedná o imunokompetentní jedince. Nárůst případů infekce je pozorován v České republice po ukončení celoplošného kalmetizačního programu v roce 2010. Danou skutečnost pozorovali i Doležalová et al., kteří porovnávali z národního tuberkulózního registru incidenci NTM ve stejném časovém období u dvou skupin před ukončením kalmetizace a po jejím ukončení [1]. V jejich souboru pacientů v období let 2003–2010 pozorovali NTM jen u sedmi dětí, avšak v období 2011–2018 bylo prokázáno 89 případů. V literatuře je možné najít práci, která prokazuje částečný protektivní efekt BCG (Bacillus Calmette-Guerin) vakcinace proti netuberkulózní infekci na myším modelu [8].
Klinicky se NTM lymfonoditida manifestuje obvykle jako jednostranné, nebolestivé a pomalu rostoucí zduření na krku. Na rozdíl od zánětlivé lymfonoditidy jiné etiologie obvykle nemají děti s NTM celkové známky infekce (febrilie, únava, schvácenost), elevaci zánětlivých markerů ani bolestivost krčních uzlin. Oproti tomu běžná bakteriální abscedující lymfadenitida se projevuje typicky bolestivým, zarudlým a fluktuujícím zduřením na krku. Diagnostika NTM je prováděna nejčastěji při velikosti uzlin 2–3 cm, méně často vídáme paket uzlin s velikostí až 6 cm. Pediatr bývá většinou prvním lékařem, který dítě pro zduření vyšetřuje. Léčbu obvykle zahajuje nasazením celkové antibiotické terapie preparátem s širokým spektrem účinku po dobu týdne. Tato terapie obvykle nemívá efekt na velikost zduření. Část dětí je následně na doporučení pediatra vyšetřována hematologem. V našem souboru bylo šest dětí vyšetřeno hematologem před chirurgickou léčbou. Zduření přetrvává a postupem času dochází k šíření infekce z uzliny do okolní tkáně a kůže. Klinický obraz se v čase mění. Typickým projevem, který nás upozorňuje na specifický proces v uzlinách, je fixace ke kůži a změna vaskularizace kůže. Kůže začíná být lividně zbarvená, ztenčuje se (obr. 3–5). V tomto terénu se následně může utvořit kožní píštěl. V rámci diferenciální diagnostiky je nutné vždy vyloučit postižení tuberkulózními mykobakteriemi, popř. jinou etiologii krční lymfonoditidy u dětí, jako je např. nemoc kočičího škrábnutí, toxoplazmóza a další infekce [2, 9, 10].
Image 3. Netuberkulózní zánět v submandibulární oblasti s píštělí, další ložisko v oblasti kaudy parotis vpravo a prearikulárně se změnami kožního krytu. 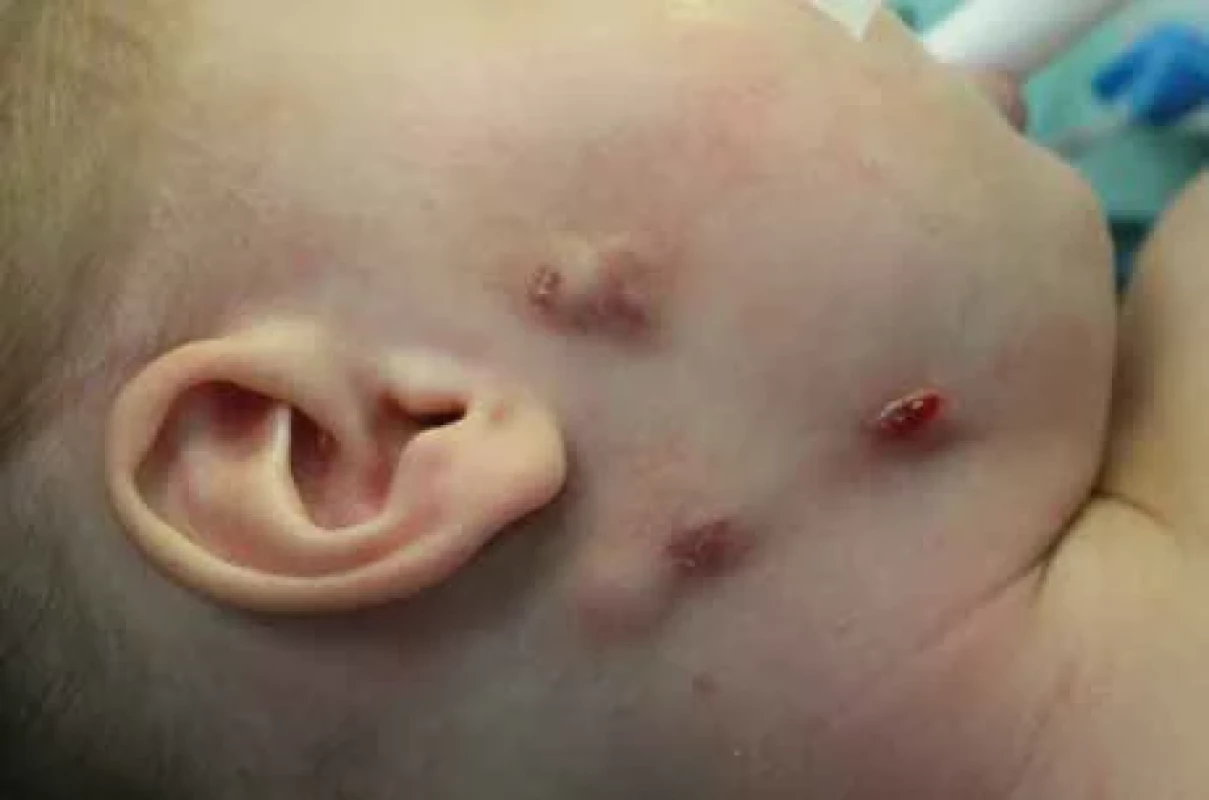
Fig. 3. Nontuberculous infl ammation in the submandibular area with a fi stula, another focus in cauda parotid region on the right and preauricular region with changes in the skin cover. Image 4. Netuberkulózní zánět v submandibulární oblasti vpravo se změnami kožního krytu. 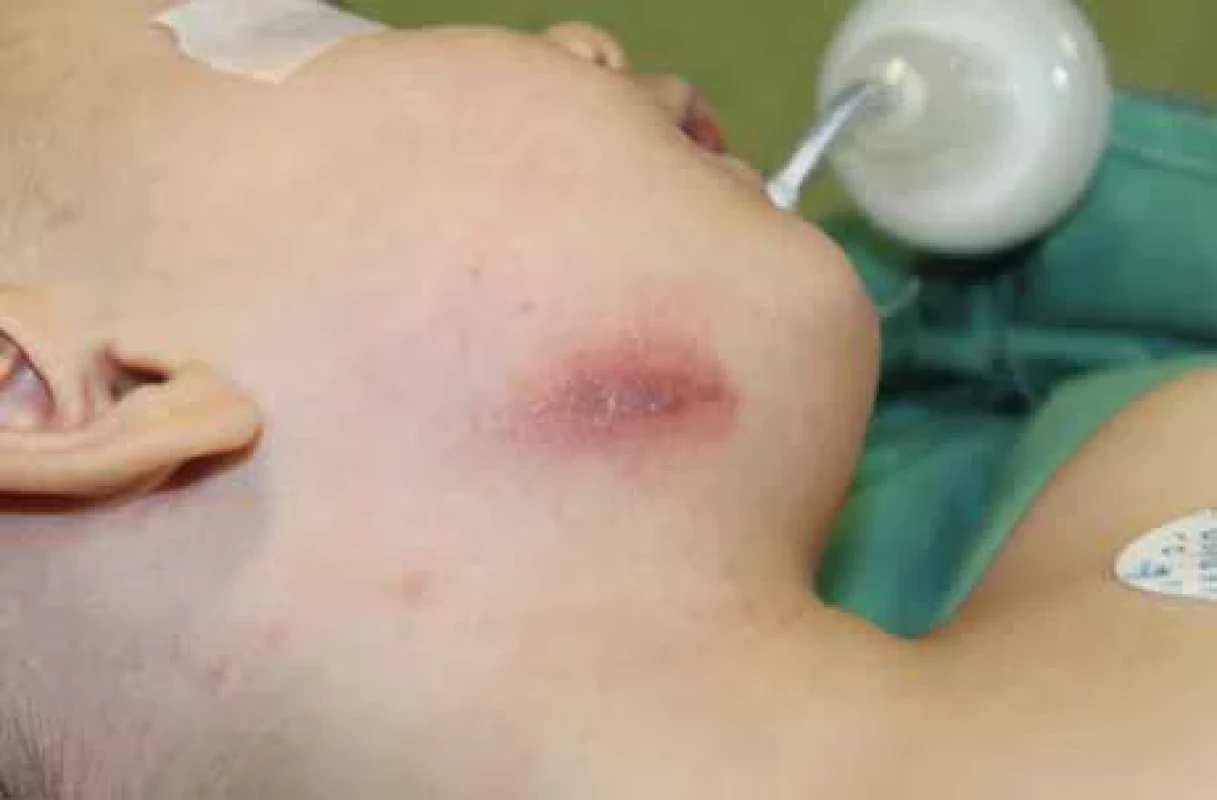
Fig. 4. Nontuberculous infl ammation in submandibular region on the right with changes in the skin cover. Image 5. MR obraz netuberkulózního zánětu v submandibulární oblasti vlevo (šipka): T1 sekvence s kontrastem, koronární rovina. 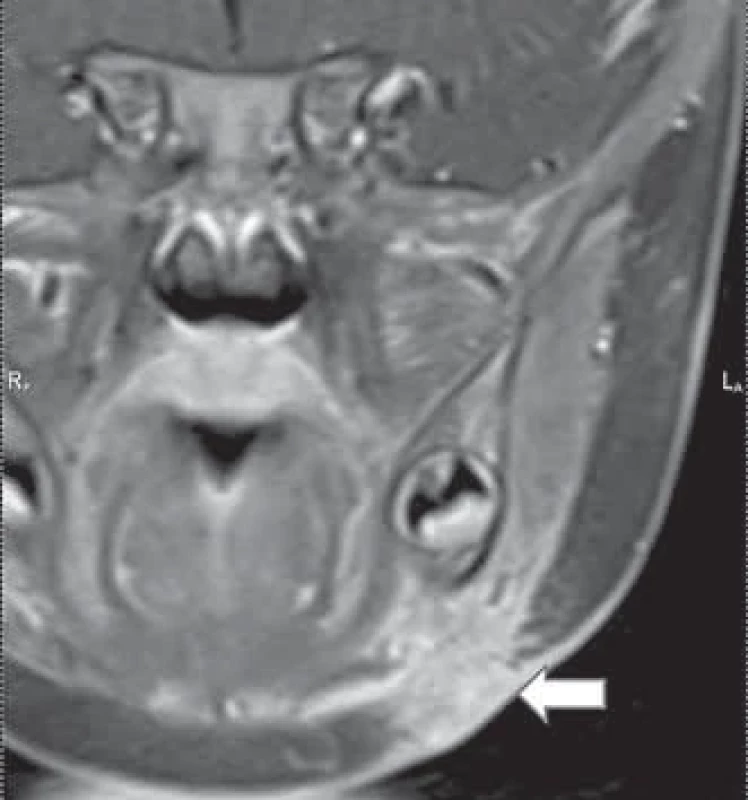
Fig. 5. MRI of nontuberculous infl ammation in the submandibular region on the left (arrow): T1 sequence with contrast, coronal plane. Primární zobrazovací metodou je ultrazvukové vyšetření (UZ). UZ obraz uzliny suspektní z NTM zahrnuje nekrotickou uzlinu se zahuštěným hypoechogenním obsahem. Zpravidla je popisován široký cirkulární lem infiltrace přilehlé tukové tkáně korespondující se šířením zánětu do okolí uzliny. Kalcifikace v uzlině určitou mírou také budí podezření z netuberkulózní infekce [11]. Neméně důležité je topické uložení léze ve vztahu k důležitým strukturám na krku (podčelistní a příušní žláza, velké cévy, mandibula, spodina dutiny ústní, hluboké krční prostory). Reaktivně zvětšené uzliny v okolí hlavního patologického ložiska nejsou vzácností. Tyto uzliny mohou být ponechány bez chirurgické intervence ke konzervativní léčbě [12]. Před samotným chirurgickým zákrokem se často doplňuje další zobrazovací vyšetření, zejména v případě uložení ložiska v parotické oblasti [10]. V našem souboru bylo pět dětí s ložiskem v parotické oblasti a MR bylo provedeno u dvou dětí. Je důležité určit vztah zduření k struktuře příušní žlázy před plánovaným chirurgickým výkonem. Lepší přehled o stavu měkkých tkání v okolí uzliny s absencí ionizujícího záření poskytuje MR vyšetření, které je však časově náročnější a menší děti jej podstupují v sedaci nebo celkové anestezii. Obr. 5 ukazuje typické ložisko v submandibulární oblasti. CT vyšetření je rychlejší varianta vyšetření, často odpadá nutnost sedace, je však spojeno s radiační zátěží. U dětí se proto kloníme k provádění MR vyšetření. Popis charakteristických znaků uzliny při podezření na netuberkulózní zánět (UZ, CT, MR) má značný přínos v diferenciální diagnostice a umožňuje v případě podezření na tuto infekci zahájení včasné a adekvátní terapie. Určitou diagnostickou možností je použití tuberkulinového testu, které je však bráno jako méně užitečné a má svá úskalí. Tuberkulinový kožní test vykazuje zkříženou reakci mezi tuberkulózními mykobakteriemi, BCG imunizací a některými NTM, což vede k falešně pozitivním výsledkům u 30–60 % pacientů [13]. V našem souboru byl test prováděn jen u prvních dvou pacientů ze souboru z indikace dětského pneumologa. U dalších dětí se testování již neprovádělo.
Mikrobiologické vyšetření vzorku je stěžejní při průkazu infekce. Jedná se o klasické metody k průkazu patogenu pomocí mikroskopického a kultivačního vyšetření. Standardem je také testování vzorku použitím molekulárně biologických metod (PCR). Odebraný vzorek z tkáně uzliny a stěr z patologického sekretu v uzlině mají být po odebrání pro zabránění kontaminace jinými patogeny co nejrychleji transportovány do příslušné laboratoře. Provádíme vždy odběr sekretu a odesíláme část tkáně (uzliny) k dalšímu vyšetření. Mikroskopické vyšetření nám umožňuje prokázat přítomnost acidorezistentních tyček v barvených preparátech dle Ziehla-Neelsena či fluorescenčního barvení již během několika málo hodin. Jedná se o nejrychlejší metodu k průkazu mykobakterií, je však provázeno nízkou specificitou i senzitivitou. Vyšetření také nerozlišuje jednotlivé druhy mykobakterií a pro pozitivní záchyt je nutná přítomnost bakterií v řádu 105 bacilů/ml vzorku [14]. Testování na přítomnosti DNA původce (PCR) nám poskytuje výsledek relativně rychle, a to v rozmezí 1–4 dnů. Umožňuje průkaz specifických sekvencí nukleových kyselin rodu Mycobakterium a vyloučení mykobakterií TBC komplexu (M. tuberculosis, M. bovis, M. bovis BCG) a může cíleně prokázat specifické agens jako například M. avium. Senzitivita se uvádí od 70 do 90 % a záleží na kvalitě vzorku. V našem souboru byla PCR metoda pozitivní pouze u 47 % pacientů. Kultivace bakterií na speciálních kultivačních půdách trvá minimálně 6 týdnů. Senzitivita kultivačního vyšetření závisí na koncentraci mykobakterií ve vzorku a pohybuje se kolem 50–80 % [14]. V našem souboru byl kultivační průkaz mykobakterií pozitivní u 84 % dětí. V případě, že se nedaří patogen potvrdit pomocí kultivace nebo PCR, je možno stanovit diagnózu čistě na podkladě klinického obrazu, výsledku paraklinických vyšetření a výsledku histologického vyšetření [15]. V zahraniční literatuře je dále popisováno vyšetření pomocí aplikace netuberkulózního mykobakteriálního antigenu do kůže, které však není v České republice k dispozici.
Odebrání samotného vzorku je možno provádět formou prosté excize, punkce z uzliny nebo provedením diagnostiko-terapeutické exstirpace uzliny. První dva zákroky je možno provést i ambulantně v lokálním znecitlivění. Exstirpaci uzliny provádíme v celkové anestezii za hospitalizace dítěte. Na našem pracovišti jsme neprovedli aspiraci tenkou jehlou z uzliny u žádného z dětí ani incizi (excizi). Důvodem pro toto rozhodnutí byla jednak možná bolestivost při odběru a nespolupráce dítěte, jednak riziko nedostatku materiálu ke stanovení diagnózy. Dle práce Kvaernera et al. byla aspirace tenkou jehlou neúspěšná ke stanovení diagnózy NTM u 27 % odběrů [16]. V případě zjevného podezření z infekce jsme proto preferovali rovnou diagnosticko-terapeutický přístup. Léčba netuberkulózního zánětu je v zásadě dvojího typu. Na jedné straně máme možnost nasazení antibiotické terapie a na druhé provedení chirurgického výkonu. V neposlední řadě je kombinace obou léčebných přístupů. V literatuře se udává průměrná doba 12 týdnů od prvních projevů onemocnění do začátku léčby [17]. V našem souboru byla průměrná doba 6 týdnů do začátku chirurgické léčby. Klasifikace uzlin pomocí Georgetownova klasifikačního systému nám může pomoci při rozhodování a plánování následného terapeutického postupu, jak navrhuje Penn et al. [2]. Ve stadiu I je autory doporučována antibiotická terapie, ve stadiu II a III antibiotika s provedením buď odběru tenkou jehlou (FNAC), nebo exkochleace či chirurgická exstirpace. Pro stadium IV je léčebnou volbou úplné chirurgické odstranění patologické tkáně spolu s antibiotickou terapií. Na základě výše zmíněného systému bylo v souboru autorů Kvaernera et al. zastoupeno 31 případů ve stadiu I (n = 42; 73 %), 4 případy ve stadiu III (n = 42; 9 %), 8 případů ve stadiu IV (n = 42; 19 %). Frekvence stadia II nebyla danými autory popisována [16]. Podobné zastoupení jednotlivých stadií udávají i Rahal et al., kdy se vyskytovalo 25 dětí ve stadiu I (n = 50; 50 %), 15 případů ve stadiu III (n = 50; 35 %) a 10 případů v stadiu IV (n = 50; 20 %). Taktéž v této práci nebylo uvedeno stadium II [18]. Zastoupení dětí v našem souboru v době vyšetření na našem pracovišti bylo obdobné (tab. 2).
Konzervativní způsob léčby výhradně za pomoci antibiotické terapie předpokládá delší dobu užívání preparátů s rizikem vzniku nežádoucích účinků a ani tak nemusí vést ke kompletnímu vyhojení zánětu [19]. Zvolení chirurgického zákroku v podobě incize s drenáží je rychlé a relativně jednoduché, avšak tato intervence může být provázena tvorbou perzistující kožní píštěle [12]. Jizva vzniklá po vyhojení píštěle je méně kosmeticky přijatelná než jizva po kompletní chirurgické exstirpaci uzliny. Nevhodnost incize ložiska bez následné chirurgické exstirpace postižené uzliny je dokládána pracemi vícero autorů [9, 20]. Tato skutečnost je v kontrastu s léčbou běžné abscedující lymfadenitidy, kdy dochází po incizi s drenáží ke zhojení zánětu. Dle většiny autorů je popisována jako nejúčinnější kompletní exstirpace patologické tkáně, která vede u 90 % pacientů k vyléčení infekce [2, 10, 12, 15, 20, 21]. Lindeboom et al. porovnávali výsledky léčby v prospektivní studii, ve které bylo zařazeno 50 dětí léčených čistě chirurgickou metodou a 50 dětí léčených konzervativní terapií antibiotikem (klaritromycin) v kombinaci s antituberkulotikem (rifampicin) po dobu 3 měsíců. Preparáty byly zvoleny na základě předchozích úspěšných kazuistických sdělení. Chirurgická terapie byla prokázána jako účinnější než čistě antibiotická léčba nezávisle na stadiu onemocnění. Procento vyléčených pacientů pomocí chirurgické terapie bylo 96 % ve srovnání s 66 % pacienty léčenými antibiotickými preparáty [19]. Optimálně je vhodné zahájit terapii před tvorbou kožní píštěle. V případě již vyskytující se píštěle před chirurgickým výkonem je k docílení dobrého terapeutického výsledku nutné její odstranění spolu s patologickou uzlinou. Chirurgická exstirpace je zatížena rizikem iatrogenního poškození lícního nervu. Při uložení uzliny v parotické oblasti je v ohrožení vícero větví lícního nervu, při submandibulárně lokalizované uzlině je v ohrožení ramus marginalis lícního nervu. Na základě našeho pozorování doporučujeme nasazení antibiotické terapie již v případě klinického podezření na netuberkulózní zánět v krčních uzlinách před samotnou chirurgickou intervencí po dobu 2 týdnů. Opíráme se o doporučení z literatury [22]. Penn et al. doporučují terapii makrolidovým antibiotikem ve všech stadiích nemoci [2]. Nejvhodnější se jeví preparát z makrolidové skupiny (klaritromycin), který dosahuje vysoké koncentrace v intracelulárním prostoru a hromadí se v makrofázích. Byla prokázána větší citlivost mikroorganizmů k fagocytární aktivitě při terapii makrolidovým preparátem [23]. Podávaná dávka antibiotika je 15 mg/kg/den. Antibiotický preparát ohraničuje zánět před operačním výkonem, a chirurgická intervence má tak šanci na lepší celkový výsledek. Následně po výkonu v případě reziduálního prosáknutí tkání funguje jako podpůrná terapie a užíváním se má docílit kompletní vyhojení zánětu. Pokračování v antibiotické terapii po výkonu je dle našeho názoru vhodné, zejména při nálezu reziduálního zánětu tkání na základě ultrazvukového vyšetření nebo při přítomnosti dalších reaktivně zvětšených uzlin na krku. Společně s nárůstem našich zkušeností a terapeutickými výsledky při léčbě dětí s netuberkulózní infekcí se upravovala i doba užívání jednotlivých preparátů a jejich kombinace. Prvních pět dětí z našeho souboru bylo léčeno čistě monoterapií makrolidovým antibiotikem s následnou chirurgickou intervencí. V případě dvou dětí však i navzdory dané terapii zánět přetrvával, a proto následovalo na doporučení dětského pneumologa přidání preparátu ze skupiny antituberkulotik. Nasazení rifampicinu v dávce 10–20 mg/kg/den bylo provázeno dobrou klinickou odpovědí. Tato konkrétní kombinace léčiv se opírá o terapeutické výsledky a zkušenosti při léčbě netuberkulózní infekce plic. Kombinace makrolidového antibiotika s antituberkulotikem je optimálně užívána do kompletní regrese patologického nálezu. Na základě retrospektivní studie z Austrálie měla výše zmíněná kombinace za výsledek menší opětovné vzplanutí infekce ve srovnání s užíváním makrolidového preparátu samostatně či při neužívání žádné antimikrobiální terapie u dětí po chirurgickém výkonu [24]. Terapie antibiotiky pokračuje v průměru po dobu 4–8 týdnů od chirurgické intervence. Některé děti s rozsáhlejším postižením ve vícero krčních oblastech a při přetrvávání zánětu i navzdory dvojkombinační terapii užívaly na doporučení dětského pneumologa trojkombinaci preparátů. Jednalo se o makrolidové a aminoglykosidové antibiotikum společně v kombinaci s antituberkulotikem. Aminoglykosidový preparát (amikacin) je podáván v dávce 15 mg/kg jednou denně. Forma aplikace je intravenózní s nutností hospitalizace dítěte. Pro riziko postižení ledvin a sluchového nervu je nutno provádět laboratorní kontroly funkce ledvin a monitorace stavu sluchu (audiologické vyšetření nebo výbavnost otoakustických emisí). Riziko vzniku nežádoucích účinků je spojeno s dlouhodobou terapií a nadměrně vysokými dávkami léčiva, proto terapie preparátem v našem souboru byla maximálně po dobu 21 dní. Nejčastěji po 2 týdnech trojkombinační terapie byla provedena chirurgická intervence. Následně se pokračovalo ve dvojkombinaci makrolidovým preparátem s antituberkulotikem. Deichmueller et al. zaznamenali recidivu zánětu u 17 % dětí v jejich souboru po proběhlé léčbě. Doporučují proto ultrazvukové kontroly optimálně 2 roky po terapii [15].
Naše práce má své limity. Jedním z nich je skutečnost, že se jednalo o retrospektivně zpracovaný soubor z jednoho pracoviště. Další práce porovnávající terapeutický přístup s větším souborem pacientů budou nezbytné k určení nejvhodnějšího léčebného postupu.
Závěr
V případě neúspěchu běžné antibiotické terapie u dětí s jednostranným dlouhodobě trvajícím zduřením na krku je nutno pomýšlet na netuberkulózní mykobakteriální zánět. Vždy však musíme vyloučit tuberkulózní zánět či jiné další infekce. Provedení PCR testování, kultivačního a histologického vyšetření nám pomůže stanovit správnou diagnózu. Před chirurgickou intervencí je preferováno provádět ultrazvukové vyšetření krku. V nejasných případech, při rozsáhlejším postižení a při podezření na postižení v oblasti příušní žlázy provádíme i MR vyšetření. Antibiotická terapie makrolidovým preparátem před chirurgickým výkonem zabezpečuje ohraničení zánětu a dává šanci lepšímu celkovému výsledku chirurgické intervence. Optimální je načasování chirurgického výkonu po 2 týdnech antibiotické terapie. V případě reziduálního nálezu po chirurgickém výkonu nebo v případě postižení více oblastí na krku volíme kombinovanou terapii preparáty z řady makrolidových antibiotik s antituberkulotikem do úplné regrese nálezu. Kompletní chirurgické odstranění postižených tkání na krku je preferováno u všech pacientů s netuberkulózním mykobakteriálním zánětem v oblasti krčních uzlin.
Prohlášení o střetu zájmu
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Sources
1. Doležalová K, Malá M, Wallenfels J et al. Nontuberculous mycobacterial infections in children in the Czech Republic in the period 2003–2018. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2020; 164 (3): 1–6. Doi: 10.5507/bp.2020.025.
2. Penn R, Steehler MK, Sokohl A et al. Nontuberculous mycobacterial cervicofacial lympadenitis – a review and proposed classification system. Int J Pediatr Otorhinolaryngol 2011; 75 (12): 1599–1603. Doi: 10.1016/j.ijporl.2011.09.018.
3. Bruijnesteijn van Coppenraet LE, de Haas PE, Lindeboom, JA et al. Lymphadenitis in children is caused by Mycobacterium avium hominissuis and not related to ‘bird tuberculosis’. Eur J Clin Microbiol Infect 2008; 27 (4): 293–299. Doi: 10.1007/s10096-007-0440-z.
4. Fraser L, Moore P, Kubba H. Atypical mycobacterial infection of the head and neck in children: A 5-year retrospective review. Otolaryngol Head Neck Surg 2008; 138 (3): 311–314. Doi: 10.1016/ j.otohns.2007.11.032.
5. Kuchynková Z, Davidová R, Campr V. Mykobakteriální infekce v ORL oblasti. Otorinolaryngol Foniatr 2004; 53 (4): 171–176.
6. Albar RF, Selati SA, Alghamdi AA et al. Atypical mycobacterial infection in pediatric age group: Case report and literature review. Curr Pediatr Res 2017; 21 (1): 186–189.
7. Mortaz E, Moloudizargari M, Varahram M et al. What Immunological Defects Predispose to Non-tuberculosis Mycobacterial Infections? Iran J Allergy Asthma Immunol 2018; 17 (2): 100–109.
8. Orme IM, Collins FM. Prophylactic effect in mice of BCG vaccination against non-tuberculous mycobacterial infection. Tubercle 1985; 66 : 117–120.
9. Mandell LD, Wald ER, Michaels MG. Management of Nontuberculous Mycobacterial Cervical Lymphadenitis. Arch Otolaryngol Head and Neck Surg 2003; 129 (3): 341–344. Doi: 10.1001/archotol.129.3.341.
10. Suskind DL, Handler SD, Tom LWC et al. Nontuberculous Mycobacterial Cervical Adenitis. Clin Pediatr 1997; 36 (7): 403–409. Doi: 10.1177/000992289703600705.
11. Robson CD, Hazra R, Barnes PD et al. Nontuberculous Mycobacterial Infection of Head and Neck in Immunonocompetent Children: CT and MR Finfings. AJNR Am J Neuroradiol 1999; 20 : 1829–1835.
12. Saggese D, Compadretti GC, Burnelli R. Nontuberculous Mycobacterial Adenitis in Children: Diagnostic and Therapeutic Management. AM J Otolaryngol 2003; 24 (2): 79–84. Doi: 10.1053/ajot.2003.21.
13. Meoli A, Deolmi M, Iannarella R et al. Non-Tuberculous Mycobacterial Diseases in Children. Pathogens 2020; 553 (9): 1–12.
14. Školoudík L, Ryšková L, Hornychová H et al. Netuberkulózní mykobakterióza krčních uzlin. Pediatr praxi 2017; 17 (1): 28–30. Doi: 10.36290/ped.2018.048.
15. Deichmueller CM, Emmanouil K, Welkoborsky HJ. Atypical mycobacteriosis in children: a diagnostic and therapeutic challenge. Eur Arch Otorhinolaryngol 2015; 272 (9): 2425–2431. Doi: 10.1007/s00405-014-3160-x.
16. Kvaerner KJ, Kvestad E, Orth M. Surgery required to verify atypical mycobacterial infections. Int J Pediatr Otorhinolaryngol 2001; 61 : 121–128. Doi: 10.1016/s0165-5876 (01) 00558-4.
17. Kennedy TL. Curettage of Nontuberculous Mycobacterial Cervical Lymphadenitis. Arch Otolaryngol Head Neck Surg 1992; 118 (7): 759–762.
18. Rahal A, Abela A, Arcand PH et al. Nontuberculous mycobacterial adenitis of the head and neck in children: experience from a tertiary care pediatric center. Laryngoscope 2001; 111 : 1791–1797. Doi: 10.1097/00005537-200110000-00024.
19. Lindeboom JA, Kuijper EJ, Bruijnesteijn van Coppenraet ES et al. Surgical excision versus antibiotic treatment for nontuberculous mycobacterial cervicofacial lymphadenitis in children: a controlled trial. Clin Infect 2007; 44 (8): 1057–1064. Doi: 10.1086/512675.
20. Margileth AM, Chandra R, Altman P. Chronic Lymphadenopathy due to Mycobacterial Infection. Am J Dis Child 1984; 138 (10): 917–922. Doi: 10.1001/archpedi.1984.02140480019007.
21. Flint D, Mahadevan M, Barber C et al. Cervical lymphadenitis due to non-tuberculous mycobacteria: surgical treatment and review. Int J Pediatr Otorhinolaryngol 2000; 53 : 187–194.
22. Havlík J. Makrolidová antibiotika v pediatrické praxi. Pediatr praxi 2009; 10 (2): 76–79.
23. Rapp RP, McCreaney SA, Goodman NL et al. New macrolide antibiotics: Usefulness in infections caused by Mycobacteria other than Mycobacterium tuberculosis. Ann Pharmacother 1994; 28 : 1255–1264.
24. Tebruegge M, Pantazidou A, MacGregor D et al. Nontuberculous Mycobacterial Disease in Children – Epidemiology, Diagnosis and Management at a Terciary Center. PLoS ONE 2016; 11 (1): 1–14. Doi: 10.1371/journal.pone.0147513.
ORCID autorů
N. Koblásová 0000-0002-6305-7261,J. Mejzlík 0000-0002-7165-2896,L. Školoudík 0000-0003-4054-8719,V. Chrobok 0000-0001-7537-139X,J. Laco 0000-0002-9602-7501,P. Kašparová 0000-0001-5930-1922,L. Ryšková 0000-0002-5826-6376.Přijato k recenzi: 14. 12. 2022
Přijato k tisku: 29. 12. 2022MUDr. Nicol Koblásová
Klinika otorinolaryngologie a chirurgie hlavy a krku
FN Hradec Králové
Sokolská 581
500 05 Hradec Králové
nicol.koblasova@fnhk.czLabels
Audiology Paediatric ENT ENT (Otorhinolaryngology)
Article was published inOtorhinolaryngology and Phoniatrics
2024 Issue 1-
All articles in this issue
- Editorial
- Netuberkulózní mykobakteriální infekce v dětském věku
- Přínos tenkojehlové aspirační biopsie a klasifikace Bethesda v diagnostice tumorů štítné žlázy – retrospektivní studie
- Jsou naše vyšetřovací metody dostatečně citlivé vzhledem k poškození sluchu hlukem?
- Peroperační využití potencované kontaktní endoskopie k hodnocení maligního potenciálu slizničních lézí hrtanu, validace ELS klasifikace
- PFAPA syndróm u detí, naša skúsenosť s chirurgickou liečbou – prehľadový článok s kazuistikou
- Prvá skúsenosť s použitím silikónového stentu pri riešení posteriórnej glotickej stenózy – kazuistika
- Kavernózní hemangiom temporálního svalu – kazuistika
- Primář MUDr. Pavol Jablonický sedmdesátiletý
- Kurz „Chirurgie kůže hlavy a krku pro pokročilé“ 25. 1. 2024, Hradec Králové
- Otorhinolaryngology and Phoniatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Přínos tenkojehlové aspirační biopsie a klasifikace Bethesda v diagnostice tumorů štítné žlázy – retrospektivní studie
- PFAPA syndróm u detí, naša skúsenosť s chirurgickou liečbou – prehľadový článok s kazuistikou
- Kavernózní hemangiom temporálního svalu – kazuistika
- Netuberkulózní mykobakteriální infekce v dětském věku
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

