-
Medical journals
- Career
Biologický význam a vývoj mikrobiomu horních cest dýchacích
Authors: E. Konečná 1; P. Vídeňská 1; M. Urík 2
Authors‘ workplace: RECETOX, Přírodovědecká fakulta, Masarykova univerzita, Brno 1; Klinika dětské otorinolaryngologie Fakultní nemocnice Brno a Lékařské fakulty Masarykovy univerzity v Brně 2
Published in: Otorinolaryngol Foniatr, 69, 2020, No. 3, pp. 135-138.
Category: Review Article
Overview
Mikroorganismy přítomné v horním respiračním traktu hrají důležitou roli nejen jako původci akutních nebo chronických onemocnění, ale také jako přirozená bariéra před kolonizací dýchacích cest patogenem. Článek shrnuje poznatky o struktuře a významu mikrobiomu horních cest dýchacích a faktorech, které ho ovlivňují.
Klíčová slova:
mikrobiom – horní cesty dýchací – kolonizace
ÚVOD
Přirozenou součástí lidského těla jsou různé mikroorganismy zahrnující bakterie, houby, prvoky a viry, jejichž soubor v daném místě se označuje pojmem mikrobiom. Nástup nových technologií umožnil rozvoj výzkumu mikrobiomu, který, jak se ukazuje, má velký vliv na lidské zdraví. Nejvíce je prozkoumán střevní mikrobiom, ale významným se jeví také mikrobiom dýchacích cest.
PŘIROZENÝ MIKROBIOM HORNÍHO RESPIRAČNÍHO TRAKTU
Mikroorganismy, které jsou v dýchacích cestách běžně přítomny, se označují jako přirozený mikrobiom. Hlavní funkcí přirozeného mikrobiomu je poskytnout svému hostiteli ochranu před kolonizací respiračního traktu patogeny a zároveň stimulovat jeho imunitní systém. Pokud je přirozené složení mikrobiálních komunit narušeno, dochází k nerovnováze (např. dojde k přemnožení určitého bakteriálního druhu) nebo dysbióze (poklesu diverzity), které mohou být příčinnou vyšší náchylnosti k různým onemocněním (1).
Jednotlivé části horního respiračního traktu se od sebe odlišují nejen svou anatomickou stavbou, ale také přítomnými mikroorganismy (obr. 1) (15). Tyto rozdíly jsou dány zejména odlišným mikroprostředím (15).
Image 1. Schéma výskytu bakterií v jednotlivých částech respiračního traktu (upraveno podle Man et al., (15)) 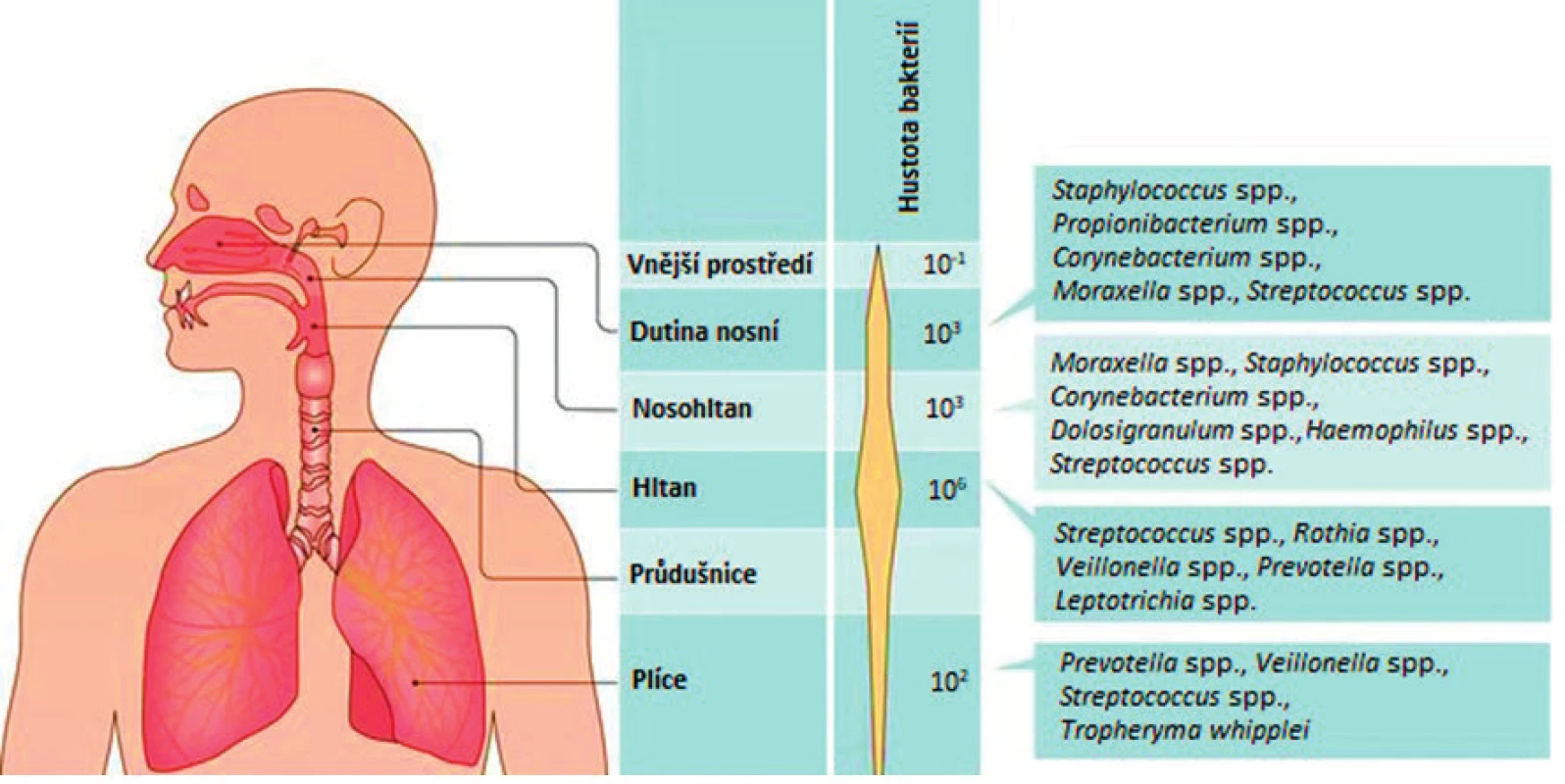
Dutina nosní představuje otevřený ekosystém, který je v kontaktu s vnějším prostředím prostřednictvím vdechovaného vzduchu. Zároveň je hlavní vstupní bránou pro mikroorganismy včetně patogenů, prach, pyl a jiné částice. Obecně bývají v dutině nosní nejčastěji detekovány bakterie rodů Staphylococcus, Propionibacterium a Corynebacterium, které jsou běžnou součástí mikrobiomu kůže člověka (17). Za dutinou nosní se nachází nosohltan. Některé bakterie, jako například Haemophilus, Streptococcus nebo Fusobacterium, jsou specifické pro nosohltan a v nosu se téměř nevyskytují. Pro nosohltan je také typická přítomnost více potenciálně patogenních bakterií než v nosu (9). Na základě nejvíce dominantních rodů De Boeck a kol. (9) navrhli rozdělení mikrobiomu nosohltanu zdravých dospělých jedinců do 4 hlavních skupin:
- typ Moraxella,
- typ Fusobacterium,
- typ Streptococcus,
- smíšený typ, ve kterém dominují rody Corynebacterium, Staphylococcus a Dolosigranulum.
Bakteriální profil typu Streptococcus je spojován s méně stabilním mikrobiomem nosohltanu a potenciálně zvýšeným rizikem infekcí horních cest dýchacích. Smíšený typ, ve kterém dominuje Dolosigranulum nebo Corynebacterium, je považován za stabilní a prospěšný pro zdraví dýchacího traktu (5). Oproti tomu větší výskyt rodu Moraxella v nosohltanu, zejména u dětí, je asociován s akutní sinusitidou (19).
POZITIVNÍ VLIV MIKROBIÁLNÍ KOLONIZACE DÝCHACÍCH CEST
Některé bakterie v respiračním traktu mohou snižovat pravděpodobnost kolonizace dýchacích cest patogenem, a mohly by tak být použity pro vývoj přípravků sloužících k prevenci onemocnění (25). Například Propionibacterium granulosum potlačuje kolonizaci respiračního traktu bakterií Staphylococcus aureus (14). Komenzální bakterie Dolosigranulum pigrum bývá přítomna ve vysokém počtu u dětí, které nemají dutinu nosní kolonizovanou Streptococcus pneumoniae. U dospělých jedinců je pak výskyt D. pigrum spojován se sníženým rizikem kolonizace dýchacích cest bakterií S. aureus.
Další antagonistické interakce jsou pozorovány například u Corynebacterium spp. a S. pneumoniae (8). Existují také bakterie, které riziko kolonizace dýchacích cest patogenem zvyšují. Například výskyt bakterie Streptococcus epidermidis v dýchacích cestách je korelován s přítomností S. aureus v dýchacích cestách (14).
Složení mikrobiomu dýchacích cest hraje významnou roli nejen při respiračních onemocněních, ale může se podílet i na samotné morfogenezi respiračního traktu. Důkazem jsou studie bezmikrobních hlodavců, u kterých byly pozorovány menší plíce a snížený počet zralých alveol oproti hlodavcům s mikrobiomem (27), pokud byla nosní dutina bezmikrobních hlodavců kolonizována Lactobacillus spp. a následně se počet zralých alveolů normalizoval (28).
NEGATIVNÍ VLIV KOLONIZACE DÝCHACÍCH CEST BAKTERIEMI
Akutní infekce
Infekce respiračního traktu jsou celosvětově nejčastější příčinnou onemocnění člověka. Převážná většina těchto infekcí je virového původu, avšak některá onemocnění, například akutní sinusitidu, mohou vyvolávat bakterie, jako jsou Streptococcus pneumoniae, Haemophilus influenzae nebo Moraxella catarrhalis (13).
K rozvoji akutních infekcí respiračního traktu může dojít také v důsledku kolonizace dýchacích cest oportunními patogeny. V nosu je přítomna mikrobiální komunita, která může sloužit jako rezervoár pro oportunní patogeny. Tyto oportunní patogeny mohou v případě oslabení imunitního systému vyvolat infekce v různých částech respiračního traktu. Patří sem zástupci rodů Staphylococcus, Moraxella, Corynebacterium a Propionibacterium, které jsou běžně detekované v nosu zdravých dospělých jedinců. Pouhá přítomnost těchto mikroorganismů je spojována se zvýšeným rizikem akutních respiračních onemocnění horních i dolních cest dýchacích, infekcí kůže a měkkých tkání (6).
Chronická onemocnění
Chronický zánět bývá vyvolán dlouhodobými a perzistentními změnami ve složení nebo struktuře mikrobiálních komunit (17). Chronické záněty dutiny nosní a paranazálních dutin jsou častá a problematická onemocnění s dosud ne zcela objasněnou etiologií. Patří mezi ně například chronická rinosinusitida (24). Chronická rinitida postihuje až 20 % celosvětové populace a vyvolává ji řada různorodých etiologických agens. Pokud jsou kromě nosní dutiny postiženy i paranazální dutiny, pak hovoříme o rinosinusitidě (18). Nedávné studie založené na sekvenačních technologiích prokázaly změny ve složení mikrobiomu v paranazálních dutinách u jedinců s chronickou rinosinusitidou v porovnání se zdravými jedinci. U nemocných dochází k nárůstu mikrobiální diverzity, a to zejména zástupců rodu Moraxella. Současně byl zjištěn zvýšený relativní výskyt zástupců z kmene Actinobacteria (18).
FAKTORY OVLIVŇUJÍCÍ MIKROBIOM HORNÍCH CEST DÝCHACÍCH
Věk
Struktura mikrobiomu horního respiračního traktu se dynamicky mění s věkem člověka. Po narození dítěte jsou jeho horní cesty dýchací kolonizovány bakteriemi z vaginálního (Dolosigranulum, Staphylococcus, Streptococcus) a kožního (Staphylococcus spp., Corynebacterium) mikrobiomu matky (22). Utvořený mikrobiom je udržován kojením z prsu matky, které přispívá k zachování stabilního složení mikrobiomového profilu a zároveň k obohacení mikrobiomu o nové bakteriální rody, zejména rody Moraxella a Haemophillus (4). Kojenci krmení umělou výživou vykazují odlišnou strukturu mikrobiomu se zvýšeným výskytem S. aureus. V prvních 2 letech života dětí se jako stabilní mikrobiom nosu a nosohltanu jeví profily s dominujícími rody Corynebacterium a Dolosigranulum nebo Moraxella. Mikrobiom nosohltanu dětí, ve kterém převažují rody Streptococcus a Haemophilus (konkrétně S. pneumoniae a H. influenza) jsou asociovány se zvýšeným rizikem respiračních infekcí a bronchiolitidy (5).
U dospělých je mikrobiom horních cest dýchacích odlišný a je u nich pozorována vyšší bakteriální diverzita (více druhů bakterií, zejména anaerobních Bacteroidetes), ale naopak menší počet bakteriálních buněk v porovnání s dětmi.
Ve stáří (> 65 let) dochází k nahrazení mikroorganismů v nosu mikroorganismy z orofarynxu, což má za následek výrazné zvýšení počtu zástupců z rodu Streptococcus. Pravděpodobně také dochází k zvýšení výskytu patogenních zástupců, jako je S. pneumoniae, který je spojen s vysokou mírou pneumokokových infekcí u starších osob (26).
Infekce dýchacích cest
Akutní a chronické infekce způsobené viry nebo bakteriemi vyvolávají kaskádu zánětlivých reakcí, které mohou dramaticky změnit mikroprostředí dýchacího traktu, a tím i podmínky pro růst mikrobiálních komunit. Například v důsledku napadení lidského organismu viry často dochází k přemnožení S. aureus. Během zánětlivého onemocnění dochází k zvýšené produkci protizánětlivých cytokinů, které mohou vytvářet vhodné podmínky pro růst potenciálních patogenů, jako jsou např. Pseudomonas aeruginosa, S. pneumoniae, S. aureus nebo Burkholderia cepacia (12).
Kouření
Cigaretový kouř podporuje kolonizaci patogenními mikroorganismy několika způsoby, a to zvýšením účinnosti adherence bakterií k buňkám epitelu (10), narušením čistící funkce řasinek na sliznici (23) nebo oslabením imunitní odpovědi hostitele (2). Dokonce i v samotných cigaretách bývají často přítomny různé potenciální patogeny, jako například Burkholderia, Klebsiella nebo Pseudomonas (20). V nosohltanu kuřáků jsou oproti nekuřákům přítomny ve větším počtu bakterie S. pneumoniae, H. influenzae a Moraxella catarrhalis které se mohou podílet na rozvoji akutních i chronických onemocnění respiračního traktu (7).
Okolní prostředí
Významným faktorem ovlivňujícím strukturu mikrobiomu horních cest dýchacích je prostředí, které člověka obklopuje. Ve vnějším prostředí je koncentrace mikroorganismů obvykle nižší než uvnitř budov, ve kterých člověk tráví přibližně 90 % svého času, čímž se studium mikroorganismů uvnitř budov stává pro výzkumníky zajímavější (3).
Složení a diverzita mikroorganismů uvnitř budov jsou dány dynamickou interakcí mezi vzduchem z venku, obyvateli budovy a samotnou budovou zahrnující způsoby ventilace, vlhkost vzduchu nebo použité materiály v budově (16).
Nedílnou součástí vnitřních prostor je prach a s ním asociované různé mikroorganismy, které mohou být s prachem vdechnuty a podílet se na rozvoji akutních nebo chronických respiračních onemocnění (11). Studiem vlivu prostředí na mikrobiom horních cest dýchacích se na území ČR věnují vědci z centra RECETOX na Přírodovědecké fakultě Masarykovy univerzity Brno.
ZÁVĚR
Mikrobiom horních cest dýchacích má jednak ochranou funkci, ale zároveň může hrát významnou roli při rozvoji onemocnění. Struktura mikrobiomu se dynamicky vyvíjí s věkem jedince, ale vliv mají také vnější faktory jako je kouření nebo mikroorganismy v okolním prostředí. Předpokládá se, že významný vliv na mikrobiom dýchacích cest má pracovní prostřední člověka.
Prohlášení o střetu zájmů
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Do redakce došlo dne: 9. 12. 2019
Přijato k publikaci dne: 16. 1. 2020
Adresa ke korespondenci:
MUDr. Milan Urík, Ph.D.
Klinika dětské otorinolaryngologie
Fakultní nemocnice Brno a Lékařské fakulty Masarykovy univerzity v Brně
Černopolní 9, Brno
e-mail: urik.milan@fnbrno.cz
Sources
1. Adar, S. D., Huffnagle, G. B., Curtis, J. L.: The respiratory microbiome: an underappreciated player in the human response to inhaled pollutants? Ann Epidemiol, 26, 2016, 5, s. 355–359.
2. Arcavi, L., Benowitz, N. L.: Cigarette smoking and infection. Arch Intern Med, 164, 2004, 20, s. 2206–2216.
3. Barberán, A., Dunn, R. R., Reich, B. J., et al.: The ecology of microscopic life in household dust. Proc Biol Sci, 282, 2015, 1814, 212–220.
4. Biesbroek, G., Bosch, A. A., Wang, X., et al.: The impact of breastfeeding on nasopharyngeal microbial communities in infants. Am J Respir Crit Care Med, 190, 2014, 3, s. 298–308.
5. Biesbroek, G., Tsivtsivadze, E., Sanders, E. A., et al.: Early respiratory microbiota composition determines bacterial succession patterns and respiratory health in children. Am J Respir Crit Care Med, 190, 2014, 11, s. 1283–1292.
6. Bosch, A. A., Biesbroek, G., Trzcinski, K., et al.: Viral and bacterial interactions in the upper respiratory tract. PLoS Pathog, 9, 2013, 1, e1003057.
7. Brook, I., Gober, A. E.: Recovery of potential pathogens and interfering bacteria in the nasopharynx of smokers and nonsmokers. Chest, 127, 2005, 6, s. 2072–2075.
8. Brugger, S. D., Bomar, L., Lemon, K. P.: Commensal-pathogen interactions along the human nasal passages. PLoS Pathog, 12, 2016, 7, e1005633.
9. De Boeck, I., Wittouck, S., Wuyts, S., et al.: Comparing the healthy nose and nasopharynx microbiota reveals continuity as well as niche-specificity. Front Microbiol, 8, 2017, s. 2372.
10. El Ahmer, O. R., Essery, S. D., Saadi, A. T., et al.: The effect of cigarette smoke on adherence of respiratory pathogens to buccal epithelial cells. FEMS Immunol Med Microbiol, 23, 1999, 1, s. 27–36.
11. Gutarowska, B., Szulc, J., Nowak, A., et al.: Dust at various workplaces-microbiological and toxicological threats. Int J Environ Res Public Health, 15, 2018, s. 877.
12. Huffnagle, G. B., Dickson, R. P., Lukacs, N. W.: The respiratory tract microbiome and lung inflammation: a two-way street. Mucosal Immunol, 10, 2017, 2, s. 299–306.
13. Jain, N., Lodha, R., Kabra, S. K.: Upper respiratory tract infections. Indian J Pediatr, 68, 2001, 12, s. 1135–1138.
14. Liu, C. M., Price, L. B., Hungate, B. A., et al.: Staphylococcus aureus and the ecology of the nasal microbiome. Sci Adv, 1, 2015, 5, e1400216.
15. Man, W. H., de Steenhuijsen Piters, W. A., Bogaert, D.: The microbiota of the respiratory tract: gatekeeper to respiratory health. Nat Rev Microbiol, 15, 2017, 5, s. 259–270.
16. Meadow, J. F., Altrichter, A. E., Kembel, S. W., et al.: Indoor airborne bacterial communities are influenced by ventilation, occupancy, and outdoor air source. Indoor Air, 24, 2014, 1, s. 41–48.
17. Proctor, D. M., Relman, D. A.: The Landscape Ecology and Microbiota of the Human Nose, Mouth, and Throat. Cell Host Microbe, 21, 2017, 4, s. 421–432.
18. Ramakrishnan, V. R., Holt, J., Nelson, L. F., et al.: Determinants of the nasal microbiome: pilot study of effects of intranasal medication use. Allergy Rhinol (Providence), 9, 2018, 2152656718789519.
19. Santee, C. A., Nagalingam, N. A., Faruqi, A. A., et al.: Nasopharyngeal microbiota composition of children is related to the frequency of upper respiratory infection and acute sinusitis. Microbiome, 4, 2016, 34.
20. Sapkota, A. R., Berger, S., Vogel, T. M.: Human Pathogens Abundant in the Bacterial Metagenome of Cigarettes. Environ Health Perspect, 118, 2010, 3, s. 351–356.
21. Sender, R., Fuchs, S., Milo, R.: Revised estimates for the number of human and bacteria cells in the body. PLoS Biol, 14, 2016, 8, e1002533.
22. Shilts, M. H., Rosas-Salazar, C., Tovchigrechko, A., et al.: Minimally invasive sampling method identifies differences in taxonomic richness of nasal microbiomes in young infants associated with mode of delivery. Microb Ecol, 71, 2016, 1, s. 233–242.
23. Tamashiro, E., Xiong, G., Anselmo-Lima, W. T., et al.: Cigarette smoke exposure impairs respiratory epithelial ciliogenesis. Am J Rhinol Allergy, 23, 2009, 2, s. 117–122.
24. Tran, N. P., Vickery, J., Blaiss, M. S.: Management of rhinitis: allergic and non-allergic. Allergy Asthma Immunol Res, 3, 2011, 3, s. 148–156.
25. Wang, Y., Li, X., Ge, T., et al.: Probiotics for prevention and treatment of respiratory tract infections in children: A systematic review and meta-analysis of randomized controlled trials. Medicine, 95, 2016, 31, e4509.
26. Whelan, F. J., Verschoor, C. P., Stearns, J. C., et al.: The loss of topography in the microbial communities of the upper respiratory tract in the elderly. Ann Am Thorac Soc, 11, 2014, 4, s. 513–521.
27. Wostmann B. S.: The germfree animal in nutritional studies. Annu Rev Nutr, 1, 1981, s. 257–279.
28. Yun, Y., Srinivas, G., Kuenzel, S., et al.: Environmentally Determined Differences in the Murine Lung Microbiota and Their Relation to Alveolar Architecture. PloS One, 9, 2014, 12, e113466.
Labels
Audiology Paediatric ENT ENT (Otorhinolaryngology)
Article was published inOtorhinolaryngology and Phoniatrics

2020 Issue 3-
All articles in this issue
- Hodnocení symptomů vyskytujících se u maligních nádorů hlavy a krku u pacientů ve Velké Británii
- Přínos magnetické rezonance v diagnostice Ménièrovy choroby
- Tracheostomie u dětí – sedmileté zkušenosti z Kliniky otorinolaryngologie a chirurgie hlavy a krku ve Fakultní nemocnici Hradec Králové
- Novorozenecký screening sluchu v Olomouckém kraji: analýza nedostatků
- Belloc(q)ova rourka
- Biologický význam a vývoj mikrobiomu horních cest dýchacích
- Onemocnění COVID-19 probíhající u 16letého chlapce pod obrazem akutní tonzilitidy
- Profesor MUDr. Juraj Klačanský, CSc. – 70ročný
- Prednosta Kliniky otorinolaryngológie a chirurgie hlavy a krku ÚVN a SZU v Ružomberku, MUDr. Marian Sičák, PhD. – 60ročný
- Orální probiotika
- Otorhinolaryngology and Phoniatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Orální probiotika
- Biologický význam a vývoj mikrobiomu horních cest dýchacích
- Přínos magnetické rezonance v diagnostice Ménièrovy choroby
- Tracheostomie u dětí – sedmileté zkušenosti z Kliniky otorinolaryngologie a chirurgie hlavy a krku ve Fakultní nemocnici Hradec Králové
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

